抗白细胞介素6单克隆抗体治疗延长小鼠同种心脏移植物存活时间的实验研究*
雷 钧 何 凡 吴 敏 郑 翔 李舒媛 陈知水
华中科技大学同济医学院附属同济医院器官移植研究所,器官移植教育部重点实验室,器官移植卫生部重点实验室,武汉 430030
近年来,Th17细胞及其分泌的细胞因子白细胞介素17(IL-17)在急性移植排斥反应的发生和发展过程中所发挥的作用逐渐受到重视[1-4]。白细胞介素6(IL-6)作为一种促炎症细胞因子被认为在促进人和小鼠Th17细胞分化过程中发挥了重要的作用,提示中和或清除受体体内的IL-6可能是抑制Th17细胞产生的一种有效的方法[5-6]。研究发现IL-6还可以抑制具有免疫抑制功能的CD4+CD25+调节性T细胞(Treg)的分化,并促进效应性T细胞的增殖[5]。Korn等[7]发现IL-6基因敲除小鼠对实验性自身免疫性脑脊髓炎产生抵抗,中枢神经系统中Th17细胞明显受到抑制,而T reg细胞数量则显著增加。Moller等[8]在IL-6基因敲除的关节炎小鼠模型中亦得出相似的结果。然而,IL-6在移植排斥反应中是否能发挥上述作用却未见详细报道。本实验中,我们通过构建小鼠异位心脏移植模型,应用抗IL-6 mAb抑制受鼠体内细胞因子IL-6的表达,观察其对同种异体移植心脏存活时间的影响,并探讨可能的作用机制。
1 材料和方法
1.1 材料
1.1.1 实验动物 近交系BALB/c小鼠32只,作为供体,近交系C57小鼠64只,作为供体或受体。动物均为雄性,约8周龄,15~20 g,由武汉市同济医院器官移植研究所提供。供、受体体重差异无显著性意义,手术前后不禁饮食。
1.1.2 实验试剂 T rizol试剂盒购自Invitrogen公司;引物合成由上海生物工程公司完成;逆转录-聚合酶链反应(RT-PCR)试剂盒为Fermentas公司产品;抗小鼠IL-6单克隆抗体(anti-IL-6 mAb)、FITC标记的抗小鼠CD4 mAb和PE标记的抗CD25 mAb均购自Ebioscience公司;小鼠IL-6酶免定量检测试剂盒购于华美生物工程公司。
1.2 实验方法
1.2.1 移植模型制作及实验分组 动物模型参考Chen式小鼠颈部心脏移植术式,将供体心脏的无名动脉和肺动脉分别与受体颈总动脉和颈外静脉行端端吻合。供心血液循环途径为:受体颈总动脉→供心主动脉→冠状动脉→心肌冠状静脉→右心房→右心室→供心肺动脉→受体颈外静脉。实验动物随机分为同系移植组、移植治疗组和移植模型组,每组各16对。治疗组自手术之日起至术后第6天,每日经小鼠尾静脉注射3 g/L anti-IL-6 mAb 0.1 mL;模型组同时点注入等量生理盐水。
1.2.2 各组受鼠移植心脏平均存活时间观测 移植当天为术后第0天,术后每日通过视诊和触诊受鼠颈部移植心脏,观察各组小鼠移植心脏存活时间,供心不再搏动即视为排斥终点。
1.2.3 受鼠移植心脏、外周血收集及组织学检查于移植术后第3、6天分别从各组中随机挑选受鼠5只,小鼠经眼眶静脉取血约0.5 mL,4℃下2 000 r/min离心10 min,取血清,采用IL-6酶免定量检测试剂盒行外周血IL-6浓度测定。受鼠移植心脏切割成2份,一份放入冻存管内,置入-80℃深低温冰箱中备用,以供生物学分析;一份以中性甲醛固定,石蜡包埋制成切片(厚4 μ m),采用苏木精-伊红染色于光学显微镜下观察。病理学检查排斥反应分级采用Stanford标准,1级:个别或散在少量的淋巴细胞浸润;2级:小灶性侵袭性淋巴细胞浸润或伴有灶性心肌细胞损害;3级:心肌可见多灶性或弥漫性淋巴细胞浸润伴心肌细胞坏死;4级:弥漫性多类型细胞浸润伴有出血、水肿和坏死。
1.2.4 RT-PCR检测移植术后第3、6天各组移植心脏中细 胞因子 IL-6、IFN-γ、IL-17、RORγ t和Foxp3 mRNA的表达水平 移植心脏组织总RNA的提取:取冻存心脏组织100 mg加1 mL Trizol研磨,按试剂盒说明步骤提取总RNA,紫外分光光度仪测定A260/A280值并计算RNA浓度。RT-PCR过程 :取备用总 RNA 1 μ g,分别加 Oligo(dT)15 、MMLV、dNTPs、RNA酶抑制剂,并最终补足去离子水至总体积为25 μ L。42℃反应 1 h,70℃15 min终止反应,置于冰上,得到的cDNA于-20℃保存或直接行PCR扩增。PCR反应总体积为25 μ L。引物序列和产物大小见表1。反应条件为变性94℃65 s,退火55℃45 s,延伸72℃60 s,35次循环。

表1 引物序列及产物大小Table 1 Sequence of sense and anti-sense cytokine primers for each PCR
PCR反应在 T3 Thermocycler型PCR仪上进行。扩增产物在1.5%琼脂糖凝胶稳压电泳30 min,用Gelreader分析软件系统分析电泳带的灰度,以每个细胞因子电泳带与β肌动蛋白(β-actin)电泳带灰度的比值(相对灰度值)作为各个细胞因子mRNA表达水平的参数,β-actin作为内参照。
1.2.5 流式细胞术检测移植术后第6天受鼠脾脏及移植心脏中CD4+CD25+调节性T细胞的比例变化 取移植术后第6天受鼠脾脏及移植心脏,剪碎碾磨,细胞悬液分别置于 RPMI 1640培养液,37℃、5%CO2孵育4 h。取各组细胞悬液100 μ L(1×106个)加入FITC标记的抗小鼠CD4 mAb(0.25 μ g/106细胞)和 PE 标记的抗 CD25 mAb(0.125 μ g/106细胞),4℃避光孵育30 min,用冷0.01 mol/L PBS缓冲液(pH 7.4)洗涤3 次,最后悬浮在400 μ L PBS缓冲液中,上FACScan流式细胞仪进行分析。
1.3 统计学处理
采用SPSS 12.0统计分析软件,Kaplan-Meier计算生存率,Logrank法进行显著性检验,其余数据采用非配对性t检验,实验数据采用±s表示,以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠移植心脏平均存活时间
同系移植组所有供心在观察终点30 d时均存活,移植模型组供心平均存活时间为(7.7±0.8)d,anti-IL-6 mAb治疗组移植心脏平均存活时间为(22.0±2.3)d,生存分析(Kaplan-Meier)结果显示治疗组供心术后存活时间明显比模型组长,两组间差异有统计学意义(P<0.01)。见图1。

图1 各组心脏移植物存活时间Fig.1 Cardiac allograft survival time in each group
2.2 移植术后血清IL-6水平
同系移植组受鼠术后第3、6天血清中均未检测出IL-6表达,与此相比,移植模型组受鼠术后第3、6天血清中 IL-6浓度明显上升,而应用 anti-IL-6 mAb能明显抑制血清中IL-6浓度的升高,与移植模型组比较差异有统计学意义(P<0.01)。见表2。
表2 小鼠心脏移植术后血清中IL-6浓度的变化(±s,n=5)Table 2 Serum level of IL-6 in each group(±s,n=5)
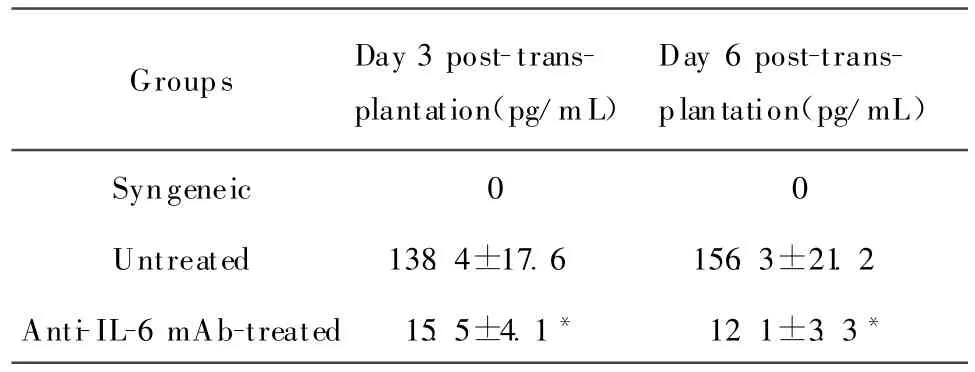
表2 小鼠心脏移植术后血清中IL-6浓度的变化(±s,n=5)Table 2 Serum level of IL-6 in each group(±s,n=5)
*P<0.01 as compared with untreated mice
Groups Day 3 post-transplantation(pg/mL)Day 6 post-transplantation(pg/mL)Syngeneic 0 0 Untreated 138.4±17.6 156.3±21.2 Anti-IL-6 mAb-treated 15.5±4.1* 12.1±3.3*
2.3 移植心脏病理组织学改变
在移植术后第6天获取移植心脏组织,肉眼观:移植模型组供心有不同程度的肿大,质地变硬,呈暗红色或黑色,与周围粘连严重,呈急性排斥表现;anti-IL-6 mAb治疗组供心颜色深红,有少量炎性渗出液,与周围轻度粘连。苏木精-伊红染色组织切片镜下观察:移植模型组心肌组织内有大量炎性细胞浸润,心肌细胞明显变性坏死,属于Stanford标准4级;anti-IL-6 mAb治疗组可见炎性细胞浸润明显减少,间质少量细胞浸润,伴有灶性心肌细胞损害,Stanford标准2级,表明心脏移植急性排斥反应受到抑制。见图2。

图2 移植术后第6天移植心脏病理组织学改变(苏木精-伊红染色,×200)Fig.2 Pathohistological changes of cardiac allografts after transplantation(HE staining,×200)
2.4 移植心脏心肌组织中细胞因子mRNA的表达情况
在RNA模板量相同、反应条件一致的情况下,anti-IL-6 mAb治疗组移植术后第3、6天移植心脏中 IL-6、IFN-γ、IL-17 和 RORγ t mRNA 的表达均受抑制,移植模型组移植心脏中细胞因子的表达水平明显高于治疗组(P<0.05)。而治疗组移植心脏中Foxp3 mRNA的表达水平较模型组明显升高(P<0.05)。见图3。
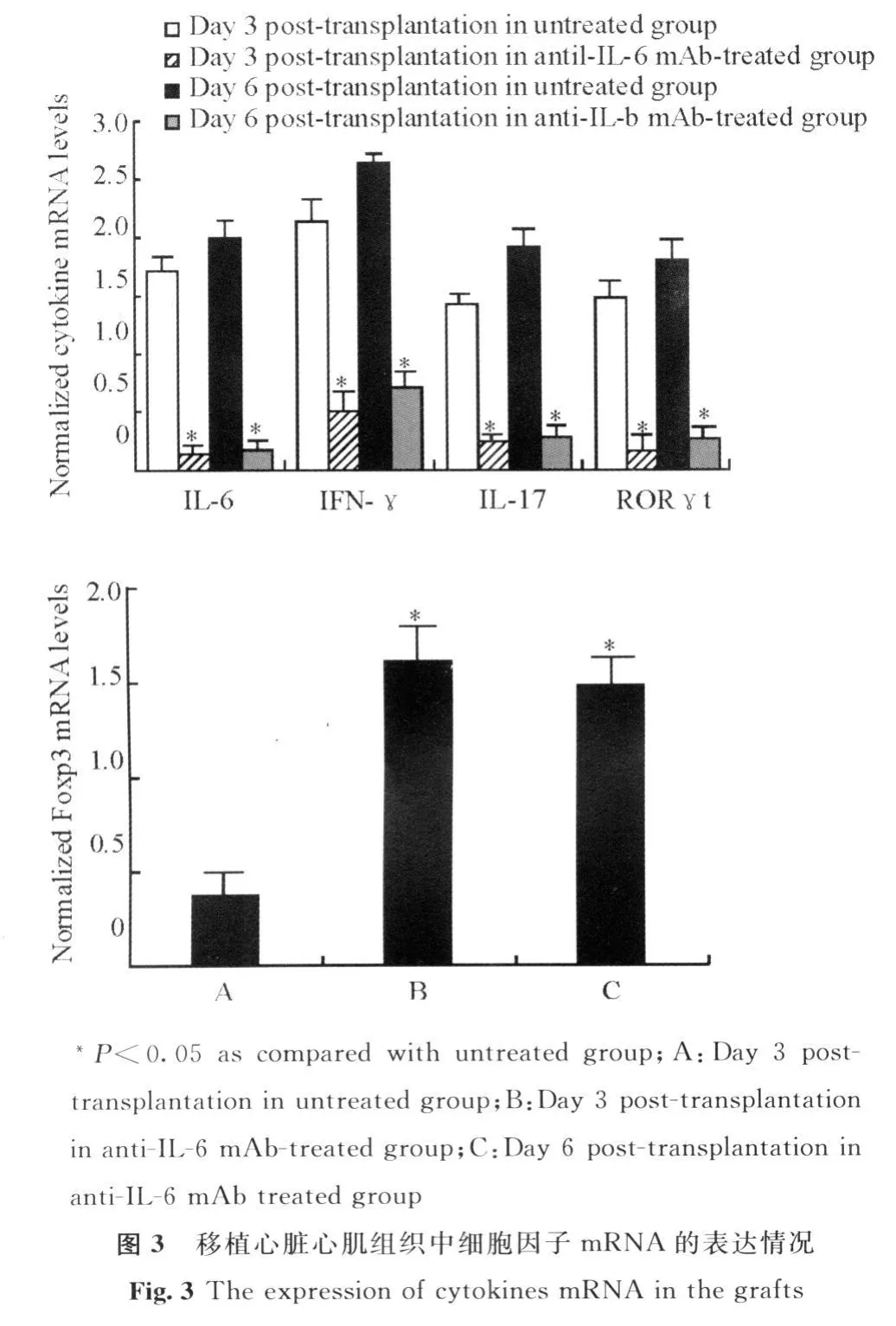
2.5 受鼠脾脏及移植心脏中调节性T细胞比例变化情况
移植术后第6天,流式细胞术分析受鼠脾脏及移植心脏中浸润的CD4+CD25+调节性T细胞,结果显示:anti-IL-6 mAb治疗组脾脏及移植心脏中CD4+CD25+调节性T细胞比例明显升高,而模型组CD4+CD25+调节性 T细胞未见明显升高(图4),各组Foxp3 mRNA表达水平也有类似变化。
3 讨论

图4 受鼠脾脏及移植心脏中调节性 T细胞比例检测Fig.4 The proportion of T reg cells in the grafts and splenocytes of recipients
大多数情况下,移植急性排斥反应被认为主要是Th1型细胞介导的免疫应答,但研究发现在一些动物排斥反应模型中清除干扰素-γ(IFN-γ)、IL-2或信号传导及转录激活子4(STAT4)缺失的小鼠仍可以发生排斥反应[9]。另一方面,一些Th2型细胞分泌的细胞因子也被发现在移植免疫中介导了排斥反应[10]。近年来,在对自身免疫性疾病的研究中发现机体的免疫系统中存在着一种新的CD4+T细胞亚群——Th17细胞亚群,它以高水平分泌IL-17,特异性表达转录因子核孤独受体γ t(RORγ t)为主要特征[11]。研究发现,IL-17的转录水平和蛋白表达水平在多种急性排斥反应动物模型和临床发生急性排斥反应的患者活检组织中明显升高[1-2]。Yuan等[3]研究发现,T-bet基因敲除的小鼠虽然抑制了体内IFN-γ的表达水平及Th1型细胞的分化,但移植心脏仍能发生急性排斥反应,而IL-17被认为在这一过程中起主要作用。这些研究结果均提示Th17/IL-17在移植急性排斥反应的发生和发展中发挥了重要的作用。
本研究发现,anti-IL-6 mAb治疗能有效保护同种异体移植心脏,推迟急性排斥反应的发生,延长移植心脏的存活时间。ELISA结果显示anti-IL-6 mAb可以有效抑制受鼠血清中IL-6的表达水平,RT-PCR结果亦证实移植心脏中IL-6 mRNA的表达水平显著下降,提示anti-IL-6 mAb能有效中和同种异体移植小鼠体内产生的细胞因子IL-6。Liang等[12]研究发现,发生急性排斥反应的小鼠体内高水平表达的IL-6主要由供体的移植心脏产生,接受同种心脏移植的IL-6基因敲除小鼠体内的IL-6表达水平未见显著下降,移植心脏的存活时间亦无明显延长。这种结果可能是由于基因敲除的小鼠体内造血功能的破坏,受鼠体内内环境与应用单克隆抗体中和炎性因子的小鼠体内内环境存在差异,同时单克隆抗体的治疗剂量以及作用时间也可能是造成研究结果不同的原因之一。
我们构建小鼠心脏移植急性排斥模型,治疗组自手术之日起至术后第6天,每日经小鼠尾静脉注射3 g/L anti-IL-6 mAb 0.1 mL,模型组同时点注入等量生理盐水。研究发现,模型组中Th17细胞相关因子IL-17及转录因子RORγ t mRNA的转录水平明显升高,这一结果亦为 Th17/IL-17参与移植排斥反应的发生提供了新的有力证据[13]。Antonysamy等[4]报道,向异位心脏移植的大鼠腹腔输注anti-IL-17的融合蛋白,可使移植心脏存活时间明显延长,提示中和IL-17可以抑制移植排斥反应的发生。我们的研究结果显示,anti-IL-6 mAb治疗组受鼠移植心脏中浸润的炎性细胞明显减少,移植心脏中IL-17及RORγ t mRNA的转录水平明显降低,移植心脏存活时间由(7.7±0.8)d延长至(22.0±2.3)d,从而从另一个角度证实了 Antonysamy等的研究结果。此外,文献报道TGF-β和IL-6的协同作用可诱导小鼠初始T细胞向Th17细胞分化[5],我们的研究结果显示中和小鼠体内的IL-6可以抑制T h17细胞的分化,小鼠体内IL-17及RORγ t表达水平明显降低,从而进一步证实了IL-6在Th17细胞分化过程中所发挥的关键作用。
同时,我们发现anti-IL-6 mAb治疗组移植心脏中Th1型细胞因子IFN-γmRNA的转录水平明显下降,而转录因子Foxp3 mRNA的表达水平明显上升,FCM结果显示治疗组受鼠脾脏及移植心脏中CD4+CD25+调节性 T细胞比例较模型组明显升高。目前仍不清楚anti-IL-6 mAb在此过程中是否直接抑制了小鼠体内IFN-γ的表达,但体内和体外研究均已证实IL-6可以直接抑制由TGF-β介导的T regs细胞的分化[5]。大量动物实验和临床研究显示T regs细胞在移植免疫耐受中发挥重要作用,它可以抑制CD4+、CD8+T细胞的活化和增殖,也可以通过抑制抗原提呈细胞(APC)而间接发挥免疫抑制功能[14],因此,我们认为治疗组移植心脏中IFN-γmRNA表达水平的下降可能是由anti-IL-6 mAb治疗所介导的受鼠体内T regs细胞比例上升的结果。
综上所述,我们的研究结果初步说明了应用anti-IL-6 mAb可以有效延缓小鼠心脏移植排斥反应的发生,延长小鼠同种移植心脏的存活时间,其可能的机制是:抑制Th1、Th17型细胞因子分泌,促进调节性T细胞分化与扩增,阻止单个核细胞浸润移植物。我们的研究结果为制订干预移植排斥反应的策略提供了新的实验依据,抑制同种异体移植小鼠体内IL-6的表达可能是一种有效的治疗移植排斥反应的措施,同时IL-6与其它效应因子以及免疫抑制剂之间在抑制移植排斥反应中是否存在协同效应仍有待进一步研究。
[1] Loong C C,Hsieh H G,Lui W Y,et al.Evidence for the early involvement of interleukin 17 in human and experimental renal allog raft rejection[J].Pathol,2002,19(7):322-332.
[2] Yoshida S,Haque A,Mizobuchi T,et al.Anti-type V collagen lymphocytes that ex press IL-17 and IL-23 induce rejection pathology in fresh and well-healed lung transplants[J].Am T ransplant,2006,6(4):724-735.
[3] Yuan X,Paezcortez J,Schmitt I,et al.A novel role of CD4 T h17 cells in mediating cardiac allograft rejection and vasculopathy[J].J Exp Med,2008,205(13):3133-3144.
[4] Antonysamy M A,Fanslow W C,Fu F,et al.Evidence for a role of IL-17 in organ allograft rejection:IL-17 promotes the functional differentiation of dendritic cell progenitors[J].Immunol,1999,162(1):577-584.
[5] Bettelli E,Carrier Y,Gao W,et al.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulato ry T cells[J].Nature,2006,441(7090):235-238.
[6] Acosta E V,Napolitani G,Lanzavecchia A,et al.Interleukins 1beta and 6 but not transforming growth facto r-beta are essential for the differentiation of interleukin 17-producing human T helper cells[J].Nat Immunol,2007,8(9):942-949.
[7] Korn T,Bettelli E,Gao W,et al.IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells[J].Nature,2007,448(7152):484-487.
[8] Moller B,Villiger P M.Inhibition of IL-1,IL-6,and TNF-alpha in immune-mediated inflammatory diseases[J].Springer Semin Immunopathol,2006,27(4):391-408.
[9] Saleem S,Konieczny B T,Low ry R P,et al.Acute rejection of vascularized heart allografts in the absence of IFNgamma[J].Transplantation,2006,62(12):1908-1911.
[10] Nickerson P,Zheng X X,Teiger J,et al.Prolonged islet allograft acceptance in the absence of interleukin 4 expression[J].Transpl Immunol,2006,4(1):81-85.
[11] Park H,Li Z,Yang X O,et al.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005,6(11):1133-1141.
[12] Liang Y,Christopher K,Finn P W,et al.Graft produced interleukin-6 functions as a danger signal and promotes rejection after transplantation[J].Transplantation,2007,84(6):771-777.
[13] 雷钧,何凡,吴敏,等.IL-17参与小鼠心脏移植排斥反应的实验研究[J].华中科技大学学报:医学版,2009,38(5):581-584.
[14] Ermann J,Szanya V.CD4+CD25+T cells facilitate the induction of T cell anergy[J].Immunol,2001,167(8):4271-4275.

