超声及超声造影与增强 CT对小肾癌诊断的对照研究
任俊红, 郭发金, 王向阳, 蒋文莉, 马 娜, 王川予 (北京医院超声科, 北京 00730; 北京医院放射科; 通讯作者,E-mail:guofajinbh@yahoo.com.cn)
临床上将直径≤4 cm的肾癌称为小肾癌[1],小肾癌约占肾癌发病率的 8.7%-25.4%[2],小肾癌早期症状不典型,多为偶然发现,一旦出现临床症状即属中晚期,预后较差,因此小肾癌的早期确诊尤为重要。作者回顾性分析了 2005-07~2009-12间北京医院收治的 55例直径≤4 cm肾占位患者的临床资料及所有患者 B超、增强 CT结果,并收集其中 20例术前高度怀疑小肾癌患者的超声造影检查结果,结合病理资料进行对比,现报道如下。
1 资料与方法
1.1 研究对象 本组肾占位患者 55例,男 39例,女 16例。年龄 26-79岁,平均年龄 53.3岁。常规超声检查测得肿瘤直径 1.2-4.0 cm,平均(2.9±1.2)cm,所有病灶均经手术病理证实,肾透明细胞癌 44例,肾嫌色细胞型肾细胞癌 3例,乳头状肾细胞癌有 5例。45例(86.5%)有假包膜。有 7例肾包膜受累及但未穿透肾包膜。55例中接受超声造影的患者 20例,男 16例,女 4例。年龄 20-76岁,平均年龄 55.3岁。肿瘤直径 1.4-3.9 cm,平均(2.8±1.3)cm,经手术病理证实:肾透明细胞癌 15例,肾嫌色细胞型肾细胞癌 1例,乳头状肾细胞癌有1例,3例错构瘤。
1.2 仪器与方法 超声检查:采用 GE LOGIQ-9型和 SIEMENS SEQUIA-512型彩色多普勒超声诊断仪,3-5MHz变频探头,在肾区进行各种切面扫描,记录病灶部位、大小、形态及回声特征,检测病灶内血流状态及频谱分析。
超声造影:在超声基础上应用反向脉冲谐波成像模式(power pulse inversion,PPI)和对比脉冲序列谐波成像模式(contrast pulse sequence,CPS),机械指数(MI)范围为 0.08-0.1。Sono Vue(Bracco,Milan,Italy)超声造影剂使用前注入生理盐水 5 m l,充分震荡至乳白色液体,抽出 0.4-1.2 ml,经患者肘部浅静脉团注。选择合适切面固定探头位置行超声造影成像。团注照影剂同时启动超声仪器内置计时器,整个造影过程观察 3 min左右,存贮超声造影的全过程。超声造影依据造影剂进入和退出肿块的快慢(与肾皮质作对比)分为快进快退、快进慢退、慢进快退和慢进慢退型。快进是指照影剂进入肿瘤时间早于肾皮质,快退是指造影剂退出肿瘤时间早于肾皮质,反之亦然。
CT检查:采用美国 GE公司 VCT64排螺旋 CT扫描机,扫描常规横断面 2.5/5mm层厚,2.5/5 mm层距,采用高压注射器(选用离子型对比剂碘海醇80-100 ml)静脉团注,三期动态扫描时间分别为25-30 s,45-50 s,2 min。
1.3 统计学分析 采用 SPSS 11.0统计软件,两者比较采用 χ2检验及 Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
B超检查主要根据肿瘤形态、内部血流分布、有无假包膜等特征进行诊断(见图 1),其中假包膜对B超诊断意义较大。55例肾占位患者中高度怀疑肾癌者 43例,误诊为肾囊肿者 3例(5.4%),错构瘤 9例(16.4%)。
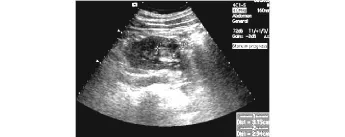
图1 B超示小肾癌边界光滑有假包膜Fig 1 B-mode u ltrasound shows the smooth border of the small renal cancer and pseudo-capsule
20例超声造影患者中,16例(肿瘤直径 1.2-3.7 cm)表现为造影剂快进慢退(见图 2),1例(肿瘤直径在 3.5-4 cm)表现为快进快退,3例(肿瘤直径 3.5-3.8 cm)表现为无明显强化。该 20例患者最后经病理检查证实有 17例为肾癌,3例为错构瘤。

图2 超声造影示增强回声包绕在瘤体周边Fig 2 Ultrasonic contrast shows the tumor is circulated by enhanced echo
55例患者增强 CT表现:51例表现为皮髓质期肿块明显强化,于实质期强化减低的“快进快退”表现(见图 3),有 4例表现不典型,考虑肾癌和错构瘤均有可能。20例超声造影患者增强 CT表现为:16例“快进快退”,2例“快进慢退”,2例无明显强化。
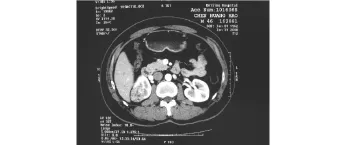
图3 增强 CT示肿瘤强化期Fig 3 The contrast enhanced CT shows enrichment of the tumor
本研究所涉及的影像学检查手段诊断小肾癌的准确率分别为:B超 78.18%,增强 CT为 92.73%。超声造影诊断小肾癌与术后病理诊断对比,其灵敏度 94.12%(19/20),特异度 66.67%(2/3),阳性预测值 94.12%(19/20),阴性预测值 66.67%(2/3),诊断准确率 90.00%。螺旋 CT诊断小肾癌与术后病理诊断对比,其灵敏度 96.23%(51/53),特异度50.00%(1/2),阳性预测值 98.08%(51/52),阴性预测值 33.33%(1/3),诊断准确率 94.55%。超声造影、螺旋增强 CT对小肾癌的诊断准确率差异无统计学意义(P>0.05,见表1,2)。

表1 超声造影诊断小肾癌与术后病理诊断对比 (例)Tab 1 Com parison of diagnosis accuracy between u ltrasonic contrast features and patho logic findings(cases)

表2 螺旋CT诊断小肾癌与术后病理诊断对比 (例)Tab 2 Com parison o f diagnosis accuracy betw een enhanced contrast CT features and pathologic findings (cases)
3 讨论
B超是简便无创伤的检查方法,通过灰阶超声与彩色多普勒检查,肾脏内超过 1 cm肿块即可被超声扫描发现。本组资料中 78.18%的小肾癌是通过体检 B超发现的,小肾癌的 B超特点:病灶处肾结构不清,边界较清晰,有假包膜,内部常呈较高回声区,如肿块内部出血、坏死、液化,可呈不均匀回声,部分其内可见彩色血流。B超简便、价廉、可重复、对肾肿瘤敏感性高,可作为筛选小肾癌的首选方法,但小肾癌的 B超声像图无特异性,对声像图表现不典型者或肿瘤直径 <2 cm的病例,诊断有一定困难。
超声造影对肾良恶性肿瘤的鉴别诊断具有重要的临床价值[3,4],近来许多动物实验研究证明,大鼠或狗的肾脏内各级血管乃至微小血管在超声造影检查时能够很好显示,和其他影像学检查方法比较,超声造影能够增强肾脏和肿瘤微血管血流灌注显示[5,6]。在欧洲的多中心研究发现:大多数病人的多普勒信号在造影后得到明显增强(75%-100%,认为达到最佳增强)[7]。Filippone等[8]报道 30例肾占位性病变,造影前常规彩色多普勒超声仅有43%见瘤内或瘤周血流。在应用造影剂增强造影后86%血流信号显著增强。本研究 20例小肾癌中超声灌注特点 16例表现为造影剂早充填、高增强、慢消退(80%)。相对于肾皮质,超声造影时造影剂在病灶中的“快进慢退”这一特征性表现,对肾癌的诊断有较大应用价值。另有 1例表现为快进快退,考虑和肿瘤的动脉血流速度、瘤体内血管的迂曲程度及超声造影剂的稳定性等因素有关。在良性病变中,肾囊肿表现为无造影剂进入肿块,错构瘤表现为造影剂周边强化明显,逐渐向中心充填的“缓进缓出”的现象。超声造影能弥补常规彩超对肿瘤内低速血流或部位较深或较小肿瘤内血流显示不充分的缺点,增强血流显示,更完整描绘肿瘤血供状况。本组 1例肾细胞癌,二维超声为典型均质强回声,边界清楚,与错构瘤相似,CT扫描也提示肾错构瘤。基础彩超仅见少量点状血流,超声造影后瘤内见丰富的分布紊乱的动静脉血流,符合肾癌特点,据此诊断为肾癌并经手术证实。
增强 CT对小肾癌的诊断准确率高,可以显示直径 0.5-1 cm的肿瘤,可发现未引起肾盂、肾盏改变和无症状的肿瘤。本组增强 CT显示 52例小肾癌多血供的占大多数,均表现不同程度强化,其中86.3%(38/44)肾透明细胞癌的增强方式以“快进快退”为主,这与 Kim等[9]的研究结果相近,位于髓质中心的少血供小肾癌,在皮质期 CT增强强化不明显,在实质期强化稍明显,此时的图像就存在被误诊的可能。故本组 4例误诊为良性肿瘤。肾皮期、实质期和肾盂期的多期增强扫描,小肾癌“快进快退”的强化形成有助于小肾癌的定性诊断。
本研究结果提示,B超由于检查方便、快捷、无创伤、检出率较高,因而适宜大量健康人群肾癌筛查。进一步明确良恶性需要结合超声造影和增强CT,两者在鉴别诊断肾脏肿瘤(病灶直径 <4 cm)的良恶性方面差异无统计学意义。超声造影在临床诊断小肾癌时并不能完全取代增强 CT。但是,由于恶性肿瘤绝大多数在肿瘤外周和内部有大量侵袭性毛细血管形成,从周围组织弥散和渗透氧气和营养物质来维持其增生、进展、转移[10]。超声造影恰恰能够增强对肿瘤微循环的血管显示,结合各种肾脏肿瘤血管分布及丰富程度反映在超声造影图像上的差别,以及造影剂出现和消退时间的不同,与增强 CT相比较,超声造影提高了小肾癌临床诊断的准确性和敏感性。且造影剂的成分为不含碘的微泡气体,具有无创、无过敏的特点,是一种较好的诊断方法,但仍需大样本研究、统计学分析后才能明确其在多大程度上具有优势。随着超声造影剂不断更新和造影技术的进一步完善,超声造影在肾癌尤其是小肾癌的诊断中将发挥越来越重要的作用。
[1] Reddan DN,Raj GV,Polascik TJ.Management of small renal tumors:an overview[J].Am JMed,2001,110(7):558-562.
[2] 王文成,马腾骧.312例肾癌的诊治现状[J].中华泌尿外科杂志,1989,10(4):210.
[3] kawata N,Igarashi T,Ichinose T,et al.Usefulness of contrast-enhanced ultrasound for the diagnosisof recurrent renal cell carcinoma in contralateral kidney[J].Int JUrol,2006,13:325-328.
[4] 杨斌,傅宁华,沈德娟,等.肾肿瘤的超声造影研究[J].中华超声影像学杂志,2007,16(7):599-600.
[5] Silverman SG,Lee BY,Seltzer SE,et al.Small(<3 cm)renal masses:correlation of spiral CT features and pathologic findings[J].Am JRoentgenol,1994,163(3):597-605.
[6] Rybicki FJ,Shu KM,Cibas ES,et al.Percutaneousbiopsy of renal masses:sensitivity and negative predictive value stratified by clinical setting and size ofmasses[J].Am J Roentgenol,2003,180(5):1281-1287.
[7] Gram iak R,Shah PM.Echocardiography of the aortic root[J].Invest Radiol,1968,3:356-366.
[8] Filippone A,MuziM,Basilico R,et al.Color Doppler flow imaging of renal disease.Value of a new intravenous contrast agent:SH U 508A(Levovist)[J].Radiol Med(Torino),1994,87(Suppl1):50-58.
[9] Kim JK,Kim TK,Ahn HJ,et al.Differentiation of subtypes of renal cell carcinoma on helical CT scans[J].Am J Roentgenol,2002,178:1499-1506.
[10] Dekel Y,Koren R,Kugel V,et al.Significanceofangiogenesisand m icrovasc-ular invasion in renal cell car-cinoma[J].Pathol Oncol Res,2002,8(2):129-132.

