SAMP8鼠背海马 synaptotagm inⅣ的年龄效应与分布
王龙海, 陈贵海, 杨启纲, 张 琼 (安徽中医学院解剖学教研室, 合肥 30038; 安徽医科大学第一附属医院神经内科)
突触结合蛋白 synaptotagmin(Syt)属于突触前囊泡蛋白,是涉及神经递质释放过程和脑的学习记忆等生理功能的关键蛋白之一[1]。该蛋白家族在啮齿类和人类中已经发现 16种亚型[2],其中在脑组织内表达的 Syt有 SytⅠ -Ⅶ、Ⅸ -Ⅺ、Ⅷ。由于 Syt不同亚型在组织分布、与二价金属离子的结合、钙离子诱导的与磷脂及 t-SNARE结合的动力学等方面有所不同,所以 Syt不同亚型在生物学功能上也存在差异[3-5]。目前有资料表明,基因突变小鼠脑内海马 SytⅣ的水平与脑衰老的进程以及年龄相关的学习记忆功能等相关[6],但正常衰老的小鼠海马内SytⅣ的水平如何变化,以及 SytⅣ在 SAMP8鼠海马亚区的分布状况均未见报道。
1 材料与方法
1.1 实验动物 本实验小鼠为 SAMP8鼠,购自北京大学医学部实验动物中心(普通级),常规条件下喂养。SAMP8鼠分为 3个年龄组:①青年组:4.5月龄,22只;②中年组:9月龄,23只;③老年组:13月龄,19只。在实验开始前对小鼠进行筛选,有运动障碍、白内障、脱毛及体表可见明显肿块的小鼠被排除。所有小鼠接受标准啮齿类食物,自由饮水。实验开始前 4周,将小鼠饲养于检测室里,每天接触一次(拎尾、抚摸)。整个实验期间,动物可得到足够的食物和水。
1.2 主要实验试剂 一抗为兔抗小鼠 SytⅣ蛋白单克隆抗体,购于美国 Sigma公司。二抗为 SP超敏试剂盒(SP-9001,生物素标记羊抗兔/小鼠 IgG),购于北京中杉金桥生物科技有限公司。DAB显色试剂盒也为北京中杉金桥生物技术有限公司。
1.3 主要实验仪器装置 石蜡切片机(RM2235型),德国 Leica公司。组织芯片点样仪及配套点样针(内径 1.0 mm),朝阳恒泰科技发展有限公司。光学显微镜(Nikon ECLIPSE 80i)及彩色数码 CCD摄像头照相机,日本 Nikon公司。图像分析系统(Image-Pro Plus6.0),美国 Media Cygernetics公司 。
1.4 制备脑组织芯片小鼠引颈脱臼处死,冰上迅速开颅取脑,置于 4%的多聚甲醛溶液中固定、流水冲洗、修块、脱水、透明与浸蜡、HE染色定位海马,以组织点样针套取含海马的适合脑组织芯、二次包埋制作组织芯片。
1.5 免疫组化染色、摄片及图像分析 采用超敏SP法免疫组化染色,镜下摄片。空白对照以 PBS代替一抗 SytⅣ;阳性对照以已知 SytⅣ的阳性切片作阳性对照。摄片以光学显微镜拍摄 SAMP8鼠海马CA3和 DG区图像,以图像分析系统 Image-Pro Plus 6.0对 CA3和 DG区进行光密度值测定和分析。由于测定框选取区域的大小形状不同,故以平均光密度值(mean optical density,MOD)作为分析指标,并以此平均光密度值作为 SytⅣ的相对水平指标。
2 结果
2.1 SytⅣ蛋白在 SAMP8小鼠海马内的表达 空白对照结果为阴性;阳性对照显示 SytⅣ蛋白免疫反应为阳性,镜下阳性染色呈棕黄色至棕褐色不等,背景为淡黄色或无色。光镜下观察组织芯片背海马区结构,SytⅣ在不同年龄组小鼠背海马的各亚区均有表达(图 1),其中 CA3、CA1区的起层、辐射层或透明层 SytⅣ的表达较弱,分子层表达稍强,而整个背海马的 CA3、CA1区锥体细胞和 DG区颗粒细胞的胞膜呈高表达;青年组 SAMP8小鼠 CA 3区、CA1和 DG区 SytⅣ较老年组小鼠呈较高表达(图2,见第 578页)。

图1 SytⅣ蛋白在小鼠背海马的表达(SP,×40)Fig 1 The expression of SytⅣin the dorsal hippocampus of themice(SP,×40)
2.2 SytⅣ表达结果的图像分析 三组 SAMP8小鼠在背海马 DG、CA1和 CA3区突触蛋白 SytⅣ相对含量的年龄效应见图 3。4.5月龄青年 SAMP8小鼠背海马 DG、CA1和 CA3区的 SytⅣ相对含量高于13月龄老年和 9月龄中年 SAMP8小鼠(P<0.05)。9月龄 SAMP8小鼠背海马 SytⅣ的相对含量也高于13月龄鼠,但差异无统计学意义(P>0.05)。
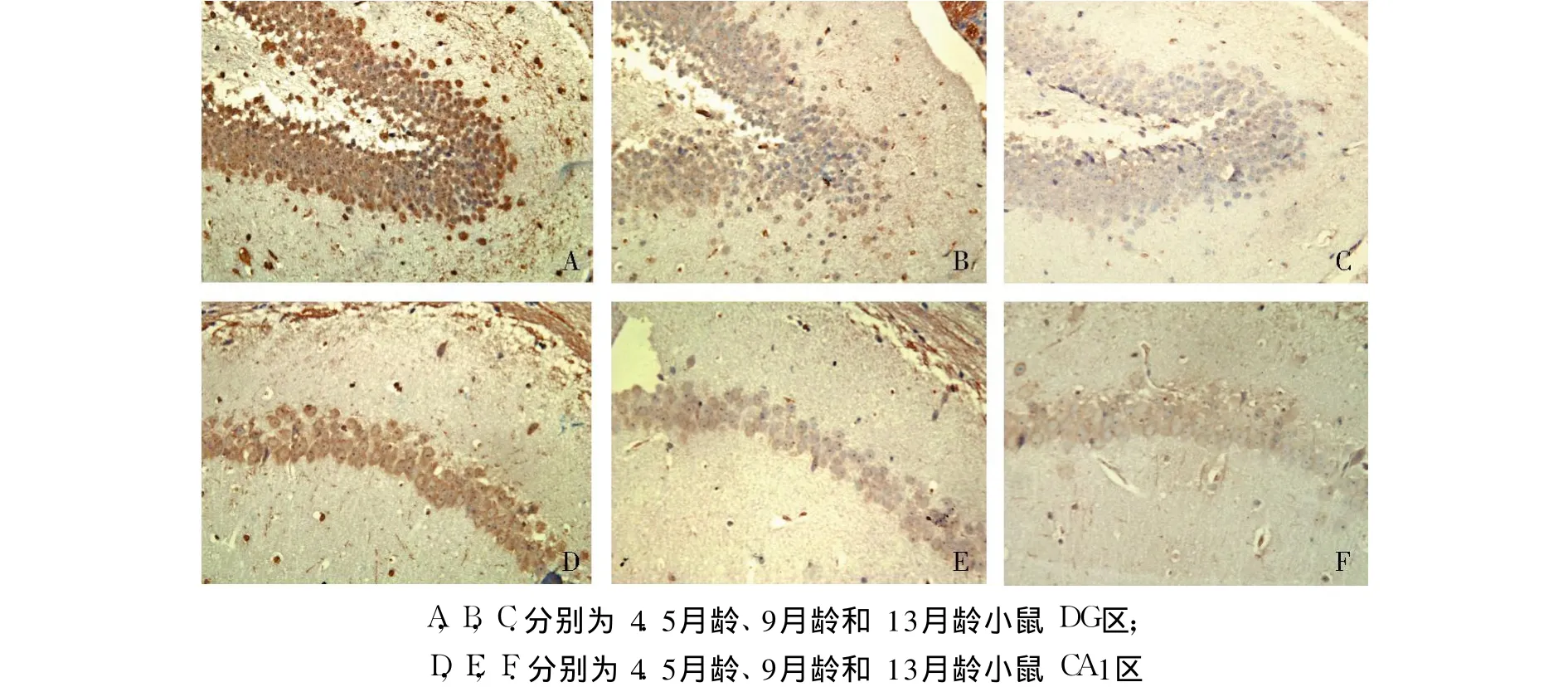
图2 不同年龄小鼠背海马 DG和CA 1区SytⅣ的免疫组化表达(×400)Fig 2 The immunohistochemical stainingof SytⅣ in the DG and CA 1 in the dorsal hippocampus for differentagem ice(×400)

图3 不同年龄 SAMP8鼠在背海马不同亚区SytⅣ的相对含量Fig 3 The relative amount of SytⅣin the DG,CA3 and CA1 of dorsal hippocampus for different-agemice
3 讨论
脑内各区域的衰老改变并不一致。其中,海马和额叶是衰老过程中的易损区域,海马主要参与空间记忆和事件记忆的形成。海马内不同亚区的纤维联系有所不同。因此,了解 SytⅣ在小鼠背海马不同亚区分布情况,对于探讨 SytⅣ的生物学功能有重要价值。Dean等发现SytⅣ集中在海马神经元中包含小囊泡的脑源性神经营养因子(BDNF),位于胞体突触和胞树突触[7]。也有研究者证实在未分化的嗜铬细胞瘤(pheochromocytoma,PC12)细胞中,SytⅣ定位于高尔基体上,用神经生长因子刺激细胞分化后,SytⅣ定位于致密核心大囊泡上[8],在果蝇的突触囊泡上也发现了 SytⅣ的同源体。杨帆等运用全内反射荧光显微系统,发现 SytⅣ与 SytⅠ在LβT2细胞中与致密核心大囊泡(large dense-cored vesicles,LDCVs)有共存现象,且共存比例很大[9]。
本研究发现,SytⅣ在 SAMP8鼠背海马的 CA3、CA1区锥体细胞和 DG区颗粒细胞中均有表达,其中在小鼠背海马的CA3、CA1区的起层、辐射层或透明层表达较弱,分子层表达稍强,背海马的 CA3、CA1区锥体细胞和 DG区颗粒细胞的胞膜呈高表达。这提示 SytⅣ可能在海马锥体细胞和颗粒细胞的神经元细胞体与轴突或树突之间的突触中含量较高,即 SytⅣ是树 -体式突触和轴 -体式突触内主要的突触囊泡蛋白。另外,本研究还发现 SytⅣ在背海马的分布部位未随年龄变化而变化,由此可以推测 SytⅣ在背海马的分布部位可能相对稳定。
SytⅣ,是 Syt家族的第四个成员,也是一种膜转运蛋白[7]。它的氨基酸序列是现已发现的 Syt家族中最简单的一个,仅有 4个外显子编码,C2A保守的 Asp残基 D3为 Ser所取代,该变异改变了 SytⅣ中 C2A结构域和 Ca2+结合的性质,因而,可能只能结合一个或两个 Ca2+。究其生理学功能,Ferguson等认为 SytⅣ在 CA1区,是海马依赖性记忆形成相关的短时程突触可塑性的突触前负调节蛋白[10];Ferguson等运用基因突变小鼠证实 SytⅣ与精细运动以及海马依赖的记忆有关,而且干扰 SytⅣ的水平可导致小鼠的记忆功能丧失[11]。Liu等发现BALB/c小鼠 Syt蛋白的表达水平与被动回避测试成绩正相关[12];Zhang等发现 SytⅣ定位于星形胶质细胞的突起,通过调节神经胶质细胞的谷氨酸释放促成海马为基础的记忆[13]。可见,SytⅣ是涉及神经递质释放过程和脑的学习记忆等生理功能的关键蛋白之一[14]。
有关 SytⅣ年龄效应的探讨,Südhof报道 SytⅣ在出生后发育早期的水平最高,以后逐渐降低[15],并认为与神经系统的发育有关。本研究发现老年SAMP8鼠(13月龄)在背海马 CA1、CA3和 DG中SytⅣ的相对含量显著低于 4.5月龄青年鼠和 9月龄中年小鼠。这与 Südhof报道相一致,也与我们之前发现的老年昆明小鼠背海马 CA1、CA 3和 DG中SytⅣ的相对含量显著低于青年鼠相似。究其原因,我们推测老年小鼠背海马中 SytⅣ的相对含量降低可能与 Syt家族代谢紊乱有关,可能是 SytⅠ或其他亚型表达增加的代偿。
总之,本实验结果提示 SAMP8鼠背海马 DG、CA1和CA3区 SytⅣ的相对含量出现年龄相关性显著降低。SytⅣ在小鼠背海马分布部位不随年龄增加而改变,分布部位相对稳定。SytⅣ在海马 DG、CA1和 CA3区的锥体细胞和颗粒细胞神经元的胞 -树突触和胞 -轴突触内有较高分布,SytⅣ可能是树 -体式突触和轴 -体式突触内主要的突触囊泡蛋白。
[1] Yoshiharz M,Montana ES.The synaptotagmins:calcium sensors for vesicular trafficking[J].Neuroscientist,2004,10:566-574.
[2] Bhalla A,Chicka MC,Chapman ER.Analysis of the synaptotagmin fam ily during reconstituted membrane fusion.Uncovering a classof inhibitory isoforms[J].JBiol Chem,2008,283:21799-21807.
[3] Bhalla A,TuckerWC,Chapman ER.Synaptotagm in isoforms couple distinct ranges of Ca2+,Ba2+,and Sr2+concentration to SNARE-mediated membrane fusion[J].Mol Biol Cell,2005,16:4755-4764.
[4] Connell E,Giniatullina A,Lai-Kee-Him J,et al.Cross-linking of phospholipid membranes isa conserved property of calcium-sensitive synaptotagm ins[J].JMol Biol,2008,380:42-50.
[5] Li C,Ullrich B,Zhang JZ,et al.Ca2+-dependent and-independent activities of neural and non-neural synaptotagmins[J].Nature,1995,375:594-599.
[6] Ferguson GD,Anagnostaras SG,Silva AJ,et al.Deficits inmemory and motor performance in synaptotagminⅣmutantm ice[J].Proc Natl Acad Sci U S A,2000,97:5598-5603.
[7] Dean C,Liu H,Dunning FM,et al.Synaptotagmin-Ⅳmodulates synaptic function and long-term potentiation by regulating BDNF release[J].Nat Neurosci,2009,12:767-776.
[8] Fukuda M,Kanno E,Ogata Y,et al.Nerve growth factor-dependent sorting ofsynaptotagm inⅣprotein tomature dense-core vesicles that undergo calcium-dependent exocytosis in PC12 cells[J].JBiol Chem,2003,278:3220-3226.
[9] 杨帆,赵平.SynaptotagminⅠ和Ⅳ在在 LβT2细胞中的定位和shRNA基因干扰研究[J].现代生物医学进展,2009,9:355-357.
[10] Ferguson GD,Wang H,Herschman HR,et al.Altered hippocampal short-term plasticity and associativememory in synaptotagm inⅣ(-/-)m ice[J].Hippocampus,2004,14:964-974.
[11] Ferguson GD,Vician L,Herschman HR.Biochem istry,genetics,behavior,and possible links to human psychiatric disease[J].Mol Neurobiol,2001,23:173-185.
[12] Liu YF,Chen HI,Yu L,et al.Upregulation of hippocampal TrkB and synaptotagm in is involved in treadm ill exercise-enhanced aversivememory in m ice[J].Neurobiol Learn Mem,2008,90:81-89.
[13] Zhang Q,Fukuda M,Van Bockstaele E,et al.SynaptotagminⅣregulates glial glutamate release[J].Proc Natl Acad Sci U S A,2004,22:9441-9446.
[14] Yoshiharz M,Montana ES.The synaptotagmins:calcium sensors for vesicular trafficking[J].Neuroscientist,2004,10:566-574.
[15] Südhof TC.Synaptotagmins:Why somany[J]?Biol Chem,2002,277:7629-7632.

