大鼠脑海马神经元原代培养方法的建立及其纯度的鉴定
任玥,苏秋香,张勇,张庭深*
(1.沈阳医学院教务处,辽宁 沈阳 110034;2.基础医学院组织与胚胎学教研室)
1977 年,Banker and Cowan[1-3]首次在体外成功的分离并培养了大鼠胚胎海马神经元。此后随着研究的深入,胎鼠海马神经元的体外分离培养技术被不断的改进和提高。但在原代培养中神经元的纯度和产量方面还存在一些急待解决的问题。本研究采用了木瓜酶和胰酶消化的方法来比较神经元产量上的差异,并采用血清培养基加入阿糖胞苷和无血清培养基的培养方法比较其对胎鼠海马神经元纯度的影响。旨在探讨一种高效、稳定的胎鼠神经元的原代培养方法,为中枢神经系统的研究提供理想的细胞模型。
1 材料方法
1.1 实验动物 孕18 d的SPF级Wista大鼠,由沈阳医学院实验动物中心提供。
1.2 主要化学试剂 DMEM/F12(Invitrogen),Neurobasalmedium、B27 supplement(Gibco),多聚赖氨酸 (Sigma),阿糖胞苷 (Ara-C,Invitrogen),L-谷氨酰胺 (L-Gin,Sigma)、庆大霉素(Gibco),胎牛血清 FBS(Gibco),马血清 HOS(Gibco),其他试剂均为国产分析纯。
1.3 主要试剂配制
1.3.1 D'hanks液 1 000ml DDW中含NaCl 8 g,KCl0.4 g,Na2HPO4·12H2O 0.134 g,KH2PO40.06 g,NaHCO30.35 g,调pH值7.2~7.4,高压除菌待用。
1.3.2 1.25%胰酶 取胰酶粉末0.125 g加入10 ml D'hanks液,滤器过滤备用。
1.3.3 种植液 DMEM/F12 85%+FBS 10%+HOS 5%。
1.3.4 神经元培养基配制 neurobasal:B27为50∶1,加入L-Gin和庆大霉素 (L-Gin相当于2 mM)。
1.3.5 HBS液 1 000 ml miniQ中含NaCl 8.4825 g,KCl1.639 g,HEPES2.3831 g,Glucose 0.9 g,调pH值7.3,高压除菌待用。
1.3.6 0.2%木瓜酶 取木瓜酶粉末25 mg加入HBS液12.5 ml中,滤器过滤除菌备用。
1.4 方法
1.4.1 海马神经元分离培养的方法 用乙醚麻醉孕18 d的大鼠,无菌条件下取胚胎,断头、分离海马;将海马置于预冷的D'hanks液中,将其剪成碎片;分别加入胰蛋白酶和木瓜蛋白酶,37℃消化10~20 min,不断震摇,加入胎牛血清(终浓度为10%)终止消化,离心弃上清,再加适量含胎牛血清的D'hanks洗涤2次后,用吸管轻轻吹打,200目不锈钢网过筛,收集滤液离心弃上清;分别用种植液配制成3×105/L细胞悬液加入预先用10 mg/L多聚赖氨酸包被的6孔培养板中,置CO2培养箱(5%CO2,37℃)培养,每周半量换液2次。并在培养3 d后分别加入终浓度为10μmol/L阿糖胞苷,24 h后全量换液,以抑制非神经细胞的生长。在培养6 d时于倒置显微镜下观察细胞生长状况并照像分析。
1.4.2 无血清培养的方法 按照以上方法收集到细胞后用种植液重悬种植培养后4 h换成神经元培养基,置CO2培养箱 (5%CO2,37℃)培养,每周半量换液2次,不同时间段于倒置显微镜下观察细胞生长状况并照像分析。
2 结果
2.1 神经元细胞的形态学观察 在采取了相同的培养方法 (即种植液培养3 d后加入阿糖胞苷)后,通过倒置显微镜观察。胰蛋白酶和木瓜蛋白酶消化后接种的两组神经元细胞均于第4h左右贴壁,圆而透明,折光性好,分布较均匀。培养18~24 h后,少数胞体较大的细胞有突起生成;培养第72 h,神经元胞体增大,饱满;培养第6 d,神经细胞胞体不再继续增大,突起长度稳定,光晕明显,形成完整神经网络。在观察过程中,两组神经元均无较明显的差别,在两组中分别选取10个高倍镜视野进行细胞计数并做统计学处理(P>0.05),差异无统计学意义 (图1)。在采用相同的无血清培养方法中也得到相同结论,图略。

图1 不同消化酶处理后海马神经元原代培养6 d倒置显微镜结果 (×40)A.胰蛋白酶消化后接种培养 B.木瓜蛋白酶消化后接种培养
2.2 神经元的纯度鉴定 基于结果2.1中两种酶的消化对神经元产量无显著影响的结论,本实验在相同胰蛋白酶消化的条件下,比较血清培养3 d后加阿糖胞苷和无血清培养方法对改进神经元培养纯度的影响。在两种培养基培养后5 d后,倒置显微镜下选取10个高倍视野,无血清培养组神经元胞体饱满,突起较长数量明显多于血清培养组,且神经胶质细胞数量少于血清培养组。分别计数两组神经胶质细胞和神经元,计算神经元纯度,结果见图2。
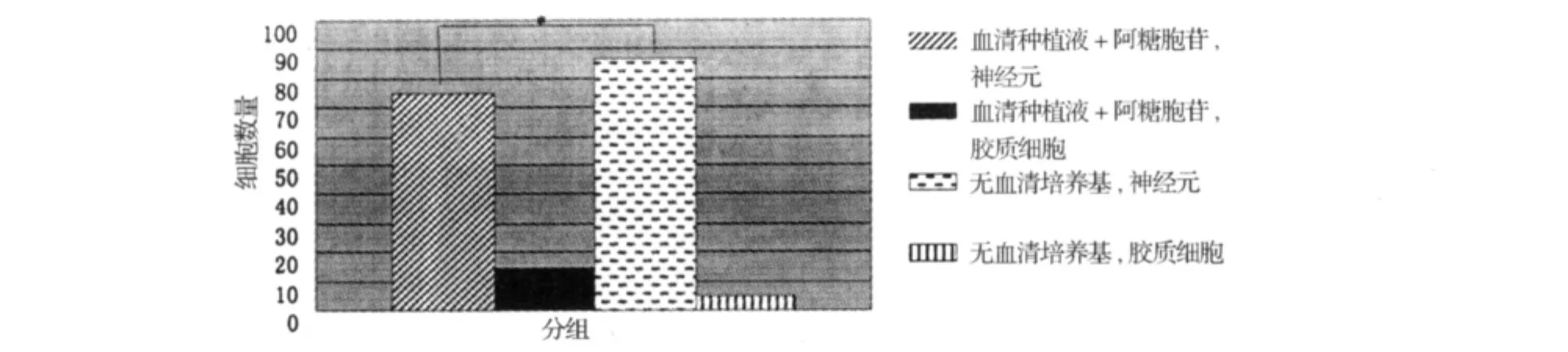
图2 不同培养方法神经元与神经胶质细胞数量统计图 (*P<0.05)
2.3 木瓜酶消化和无血清培养基培养的胎鼠海马神经元形态观察 选用了温和的木瓜酶消化和无血清培养基培养的方法接种后第4 h,细胞已贴壁,圆而透明,折光性好,分布较均匀。培养第2 d,少数胞体较大的细胞有突起生成;培养第6 d,神经细胞胞体增大,突起粗而长,有单极、双极、多极突起,细胞胞体饱满,光晕明显,形成完整神经网络,如图3。

图3 木瓜酶消化后无血清培养不同时间的海马神经细胞的光学显微镜结果 (×40)A.培养第2 d;B.培养第6d;
3 讨论
海马神经细胞原代培养是研究神经系统结构及功能的重要途径和手段之一。大鼠胎鼠脑海马是神经元培养比较理想的取材部位,如何提高培养大脑海马神经元的活性和产率是培养成功与否的关键[4]。传统的培养方法是在取材中应用胰蛋白酶消化并将神经元和神经胶质细胞共同培养一段时间后,通过加入阿糖胞苷抑制神经胶质细胞的生长,达到神经元的纯化。这种培养方法由于酶消化的时间不易控制,而且应用了有丝分裂抑制剂,其加入阿糖胞苷的时间剂量的把握均对神经元原代培养的产量和成活率造成很大影响[5,6]。
本实验在传统培养方法的基础上加以改良。通过对消化酶和培养基的筛选,结果表明:(1)木瓜酶相对胰蛋白酶比较,其消化效力温和,时间容易控制且消化的结果与胰蛋白酶无统计学差异,所以木瓜酶可以作为胎鼠海马神经元培养的优选酶,极大的改进了原代培养中酶消化环节所造成的困扰。(2)本研究对比了传统去除神经胶质细胞的方法和无血清培养方法中神经元的纯度,优化了培养过程中的操作步骤并提高了神经元的纯度。无血清培养能显著抑制神经胶质细胞等干扰细胞的生长,因为B27添加剂的配方中加入了选择性抑制胶质细胞生长的成分因而倒置显微镜下细胞背景非常干净。与传统培养方法相比,B27添加剂中含30多种促进神经元生长和存活的微量元素,其种类和数量都比血清中丰富。
由于本实验方法优化了胎鼠海马神经元原代培养中取材步骤和酶消化的条件,能够获得产量、纯度均较高,且神经元形态好,可以作为神经系统研究的理想模型的胎鼠海马神经元。因此,海马神经元无血清原代培养技术是一项值得推广的技术。
[1] Banker GA,Cowan WM.Rat hippocampal neurons in dispersed cell culture[J].Brain Res,1977,126:397 -425.
[2] Banker GA,Cowan WM.Further observations on hippocampal neurons in dispersed cell culture [J].J Comp Neurol,1979,187:469-493.
[3] Banker GA.Trophic interactions between astroglial cells andhippocampal neurons in culture[J].Science,1980,209:809 -810.
[4]宋岳涛,洪庆涛,唐一鹏.阿糖胞苷对原代培养的大鼠大脑皮质神经元的影响[J].解剖学杂志,2004,27(6):696-699.
[5] Müller HW,Seifert W.Aneurotrophic factor(NTF)released from primary glial cultures supports survival and fiber outgrowth of cultured hippocampal neurons [J].J Neurosci Res,1982,8:195-204.
[6]Muller HW,Beckh S,Seifer TW.Neurotrophic factor for central neurons[J].Proc Natl Acad Sci USA,1984,81:1244 -1252.

