转化生长因子 β1在肺癌中的表达和意义
何欣蓉,刘 馨,黄一凡
(川北医学院附属医院病理科,四川 南充 637000)
转化生长因子 -β1(transforming growth factorβ1,TGF-β1)为具有多功能的细胞因子,能促进细胞外基质的形成,抑制免疫功能,调节细胞的生长分化,并对多种肿瘤细胞具有抑制增殖及激活凋亡作用。而近年已经在胆管癌,胃癌,胰腺癌,结直肠癌等多种恶性肿瘤中发现 TGF-β1的表达异常[1-4]。本文应用免疫组织化学技术检测 TGF-β1蛋白在肺癌及肺良性疾病组织中的表达情况,探讨其在肺癌发生发展过程中的作用。
1 材料与方法
1.1 材料
1.1.1 病例:选取 2007年至 2008年川北医学院第一附属医院例肺癌根治术标本 77例为实验组,另选取 20例良性肺疾病组织为对照组。全部病例均经病理诊断证实。其中男性 58例,女性 19例。年龄为 39-73岁,平均年龄 64.7岁。组织学分类腺癌16例,鳞癌 54例,腺鳞癌 2例,肉瘤样癌 3例,小细胞神经内分泌癌 2例。高分化 10例,中分化 14例,低分化 46例。其中有淋巴转移 42例,无转移 28例。同时收集肺大疱 10例,肺结核 6例,肺脓肿 4例,共计 20例作为对照。
1.1.2 试剂:兔抗人 TGF-β1多克隆抗体购自Santa cruz公司,使用浓度为 1:100。二抗、即用型二步法检测试剂盒 PV-9000和 DAB染色试剂盒购自北京中山公司。
1.2 方法:以 TGF-β1蛋白表达为阳性的乳腺癌组织为阳性对照,PBS代替一抗为阴性对照,采用SP法进行染色。具体步骤如下:石蜡标本行 4μm厚连续切片,脱蜡,对切片进行预处理。3%过氧化氢去离子水孵育 10分钟,阻断内源性过氧化物酶。PBS冲洗,2分钟 ×3次。滴加一抗,4℃湿盒过夜。PBS冲洗 3次,2分钟 ×3次。滴加 PV-9000工作液,37℃湿盒内孵育 30分钟,PBS冲洗,2分钟 ×3次。选用 DAB显色,自来水充分冲洗,复染,脱水,透明,封片。
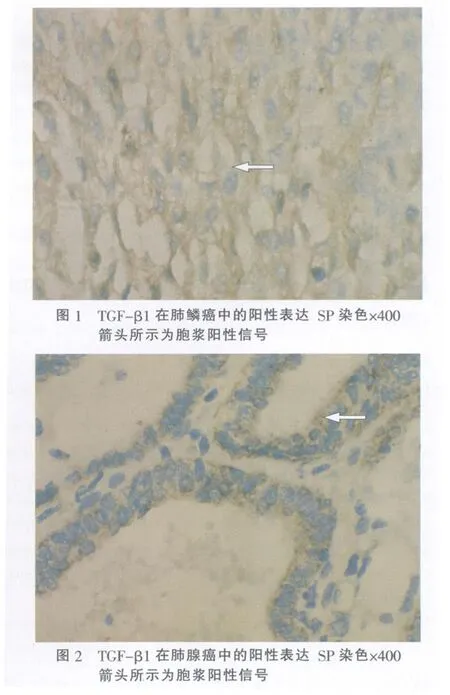
1.3 结果判断:DAB显色法阳性染色为棕黄色颗粒,TGF-β1蛋白主要表达于细胞质中,细胞核中偶见散在阳性物质表达。参照 1996年 5月北京“全国免疫组织化学技术与诊断标准化专题研讨会”标准[5],每张切片随机观察 5个高倍视野(×400),计数每个视野中染色阳性细胞数,阳性细胞 <20%为(-),>20%为(+)。
1.4 统计学方法:应用 SPSS11.5统计软件进行卡方检验。p<0.05为统计学意义。
2 结 果
2.1 肺癌中 TGF-β1蛋白的表达:本组 77例肺癌标本中,TGF-β1的阳性率分为 44.2%,明显高于良性肺疾病组(15%),两者之间存在显著性差异(p<0.05),见图 1、图 2。
2.2 TGF-β1蛋白表达与肺癌癌主要病理特征的关系:77例肺癌标本中,腺癌 16例,鳞癌 54例,腺鳞癌 2例,小细胞神经内分泌癌 2例,肉瘤样癌 3例。因腺鳞癌、小细胞神经内分泌癌、肉瘤样癌例数过少,没有统计学意义。腺癌中有 9例 TGF-β1阳性,鳞癌中有 22例阳性,腺癌的阳性率(56.25%)和鳞癌的 TGF-β1阳性率(40.74%)之间相互比较,差异无显著性意义(p>0.05);组织学分级高分化 10例(其中阳性 1例,阳性率为 10%),中分化 14例(阳性 2例,阳性率为 14.3%),低分化 46例(阳性 28例,阳性率为 60.9%),低分化组的阳性率与高、中分化之间有显著性差异(p<0.05);淋巴结无转移的 28例(阳性 7例,阳性率为 25%),淋巴结有转移 42例(阳性 24例,阳性率为 57.1%),两者之间 TGF-β1表达差异有显著性意义(p<0.05),见表1。
3 讨 论
TGF-β1是 TGF-β家族的主要成员,广泛参与细胞的分化、增殖及凋亡等多种病理生理过程,在不同的器官组织中有不同的功能。在胚胎时期,TGF-β1的表达比较高,与正常肺的形态发生密切相关,而在成熟肺的支气管上皮细胞中表达水平低。现许多研究表明,在多种肿瘤细胞中 TGF-β1水平明显增高,并与肿瘤的生长、浸润和转移关系密切。
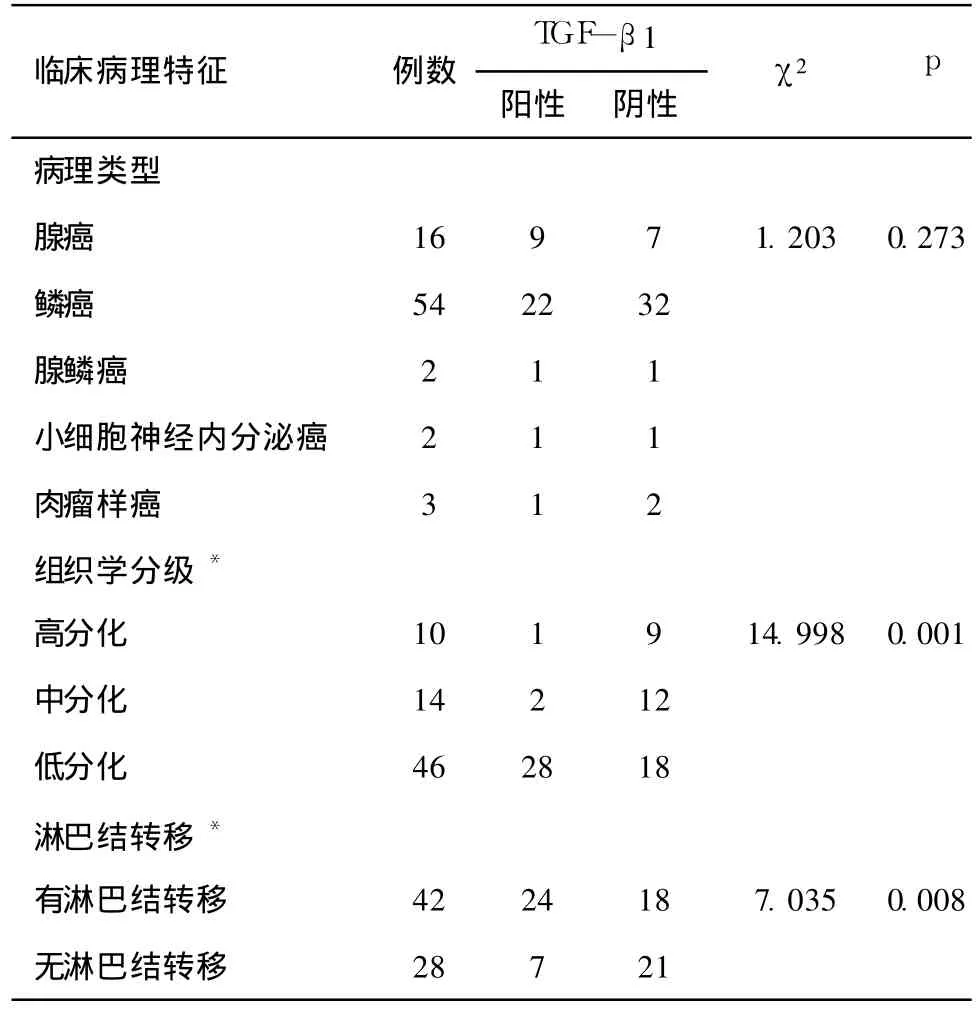
表1 TGF-β1蛋白表达与肺癌主要临床病理特征的关系
TGF-β1信号转导机制非常复杂,目前研究表明其主要介导两个效应相反的信号转导通路:Smad和 MAPK通路,经典的 MAPK通路是 ERK通路。TGF-β1/Smad通路被激活后,对上皮细胞而言,起抑制增殖作用。而 TGF-β1/ERK通路效应是促使细胞增生。因此在肿瘤发生发展过程中,高表达的TGF-β1可能激活 ERK通路。Iglesias[6]等研究证实,TGF-β1能激活 Ras/ERK通路,使肿瘤细胞表型从高分化向低分化过渡。
由于 TGF-β1作用的双向性,其与肿瘤生物学行为间的关系,文献报道不一。朱红[7]等通过对TGF-β1mRNA水平的检测表明,TGF-β1在肺腺癌组织中的表达明显高于非肿瘤肺组织,并且随着肿瘤分期的升高其表达也增加,淋巴结转移组的TGF-β1表达水平高于无转移组。马进安[8]等研究表明 TGF-β1的阳性表达在腺癌中的表达高于鳞癌和小细胞癌,与淋巴结转移和临床分期明显相关。HasegaWa[9]等研究中有淋巴结转移的非小细胞肺癌患者,其 TGF-β1蛋白水平显著高于无淋巴结转移的患者。
我们从蛋白水平检测了 TGF-β1,结果表明肺癌组织中 TGF-β1表达水平明显高于良性疾病组织,TGF-β1蛋白的高表达与临床常见的肺癌组织类型无关,而与组织分化及淋巴结转移密切相关,分化越低的阳性率越高,有淋巴结转移的肺癌标本中TGF-β1蛋白的阳性率高于无淋巴结转移的。由此提示 TGF-β1可能与肺癌的发生及进展有关,有可能作为判断人肺癌细胞恶性程度的指标之一。
肺癌的发生发展是一个极其复杂的过程,涉及诸多因素,但可以看出,TGF-β1在其中起着非常重要的作用。至于高表达的 TGF-β1在细胞恶性转化中所起的作用还有待于进一步研究。
[1] 朱卫东,汤恢焕,欧阳迪平,等 .Smad4蛋白和 TGF-β1及TβR II在胆管癌中表达的研究[J].中国普通外科杂志,2004,13(7):502-505
[2] 许春进,刘 华,陈玉龙,等.转化生长因子 β1基因和细胞外信号调节激酶在胃癌中的表达和意义[J].胃肠病学和肝病学杂志,2002,11(3):245-248
[3] 董春燕,刘铁夫,李兆申,等.TGF-β1和 ERK/ERK 2的相互作用及对人胰腺癌细胞生长的影响[J].第二军医大学学报,2005,26(3):314-318
[4] Tsushima H,Kawata S.High levels of transforming growth factor beta-1 in patients with colorectal cancer:association with disease progression.Gastroenterology[J].1996,110(2):375-382
[5] 中华病理学会杂志编辑委员会.《全国免疫组织化学技术与诊断标准化专题研讨会》会议纪要[J].中华病理学杂志,1996,25(6):326-328
[6] Iglesias M,Frontelo P,Gamallo C,et a1.Blockade of smad-4 in transformed keratinocytes containing a Ras oncogene leads to hyperactivation of the Ras-dependentErk signaling pathway associated witll progression to undiferentiated carcinomas[J].Oncogene,2000,19(36):4134-4145
[7] 朱 红,项锋钢.TGF-β1 mRNA在肺腺癌组织中的表达[J].青岛大学医学院学报,2007,43(5):419-423
[8] 马进安,张连部.肺癌转化生长因子 β1的表达与预后的相关性研究[J].肿瘤研究与临床,2000,12(2):75-77
[9] Hasegawa Y,Takanashi S,Kanehira Y,et a1.Transforming growth factor-β1 level corelates with angiogenesis,tumor progression,and prognosis in patientswith nonsmall cell lung carcinoma[J].Cancer,2001,91(5):964

