肝癌介入治疗后发生肝脓肿的危险因素分析
周 波 王建华 颜志平
(复旦大学附属中山医院介入放射科,上海 200032)
肝动脉化疗栓塞术(transhepatic arterial chemotherapy and embolization,TACE)和经皮穿肝胆道引流术(percutaneous transhepatic cholangiodrainage,PTCD)常用于治疗肝脏肿瘤,关于此类介入治疗后形成肝脓肿的诊疗鲜有报道,分析其成因缺乏数据支持。本文就我院近年收治的病例作一总结,分析脓肿可能成因,为临床治疗和预防介入术后肝脓肿提供依据。
1 资料与方法
1.1 一般资料 2004年9月—2008年3月我院因肝肿瘤行介入治疗后发生肝脓肿患者15例作为研究组,其中男性9例,女性6例。其中,TACE治疗12例,PTCD治疗7例。随机抽取这期间住院介入治疗无肝脓肿肝癌患者17例作为对照组1。其中女性患者占17.6%。另选4例非肿瘤性肝脓肿患者(男性2例,女性2例)作为对照组2。
1.2 方法 收集所有患者脓肿发生前或介入手术前血常规(红细胞、血红蛋白、白细胞、中性粒细胞比例、血小板)、肝肾功能(总胆红素、结合胆红素、白蛋白、谷草转氨酶、谷丙转氨酶)血碱性磷酸酶、γ-谷氨酰转肽酶、乳酸脱氢酶、空腹血糖、前白蛋白及凝血功能(凝血酶原时间、部分凝血酶原时间、纤维蛋白原)的实验室数据,介入治疗病史(包括栓塞剂类型、手术方式)及有无外科手术病史、有无肝移植病史。
1.3 统计学处理 所有数据资料用SPSS 13.0软件处理,参数数据用t检验,非参数数据用卡方检验和Mann-Whitney检验。检验水准α=0.05。
2 结 果
2.1 研究组和对照组1比较 在2004年9月—2008年3月共对4 143例肝肿瘤患者行11784次介入治疗术,其中女性患者17.5%,肝癌介入术治疗后肝脓肿发生率为15/4 134(0.363%)。
两组患者性别,有无PTCD史,是否患原发性肝癌,及血红细胞计数、血红蛋白、白蛋白、碱性磷酸酶、尿酸水平均有显著差异(表1)。而白细胞,中性粒细胞比例,血总胆红素,结合胆红素,谷草转氨酶,谷丙转氨酶,γ-谷氨酰转肽酶,乳酸脱氢酶,尿素氮,肌酐,空腹血糖,前白蛋白,凝血酶原时间,部分凝血酶原时间,纤维蛋白原以及使用栓塞剂(碘油或微球),介入治疗次数,门静脉有无癌栓,有无外科手术史,有无肝移植病史,有无糖尿病史均无显著差异。

表1 研究组和对照组1肝脓肿危险因素比较
2.2 研究组和对照组2的比较 两组患者有无糖尿病史、年龄、血红细胞计数、血红蛋白、白蛋白和碱性磷酸酶水平均有显著差异(表2)。而血白细胞,中性粒细胞比例,血小板,总胆红素,结合胆红素,谷草转氨酶,谷丙转氨酶,γ-谷氨酰转肽酶,乳酸脱氢酶,尿素氮,肌酐,尿酸,空腹血糖,前白蛋白,凝血酶原时间,部分凝血酶原时间,纤维蛋白原及发热时间,有无外科手术史,有无肝移植史均无显著差异。
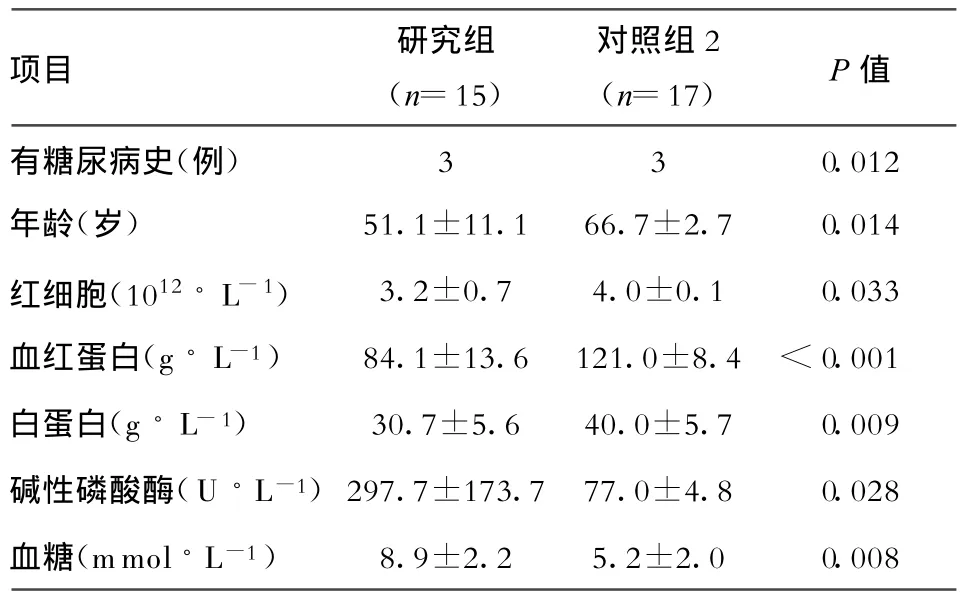
表2 研究组和对照组2肝脓肿发生危险因素比较
3 讨 论
肝癌患者介入术后形成肝脓肿是一种严重并发症,Baere等[1]报道其发生率为 4/561(0.71%),Huang等[2]报道为0.51%(7/1374)。本研究肝癌介入术后肝脓肿发生率为15/4134(0.363%),低于国内外报道。综合分析本研究资料后,发现以下一些因素可能是肝癌肝脓肿形成的高危因素。
3.1 性别 本研究发现女性肝癌患者相对男性患者更易发生肝脓肿,这可能与女性患者肝内血管尤其是胆道周围血管丛较细,更容易被完全栓塞,引起局部血供减少,降低了周围肝组织抗感染能力,导致局部脓肿的形成[3-4]。也可能与中老年妇女激素水平改变引起免疫力下降有关。目前国内外未见该方面的报道,性别是否是肝癌介入术后脓肿发生的高危因素还有待进一步证实。
3.2 胆道损伤和梗阻 本组研究中脓肿组有PTCD手术史达7/15,7例中3例有2次以上PTCD治疗史,4例行内外引流术(包括1例肝移植患者),3例行胆道支架术,而对照组仅 3/17有PTCD手术史,1例为内外引流术,1例行胆道支架术,两组间差异有统计学意义。而反映胆汁淤积的碱性磷酸酶在肝癌脓肿组要明显高于对照组。部分肝癌患者肝内胆汁淤积引起胆管炎症,而PTCD及胆道支架术均对十二指肠乳头括约肌及胆道有不同程度损伤,尤其是内外引流管开口直接位于肠道中,使肠道内细菌经胆道逆行入肝脏,形成肝内胆管炎症,都会导致肝脓肿的发生[1,5-7]。此外,PTCD术中损伤肝内胆管上皮引起肝内胆汁淤积或胆道内血肿,以及长期留置引流管使皮肤穿刺处感染向内播散也是导致肝内脓肿高危因素。本研究发现有9例肝癌肝脓肿患者脓腔和胆管有明显交通,脓肿引流液中有胆汁成分。
3.3 营养状况 本研究发现肝癌肝脓肿患者相对于其他肝癌患者或普通肝脓肿患者都处于贫血和低蛋白血症的状况,这提示营养状况低下可能是介入后肝内脓肿发生的高危因素。大部分肝癌患者都有肝硬化病史或存在恶液质,贫血和低蛋白血症最为常见。本研究发现介入后肝脓肿患者平均血红蛋白低于85 g◦L-1,白蛋白低于30 g◦L-1,明显低于其他肝癌患者,这反映了当患者营养状况极差和免疫力低下时更易发生严重感染,临床上特别需要引起重视,介入手术前应当改善患者一般情况,做好充分的术前准备。
3.4 原发性肝肿瘤和转移性肝肿瘤 本组研究发现转移性肝肿瘤介入治疗后发生肝脓肿的比例要明显高于原发性肝肿瘤,国外学者[7-8]也有相同发现,推测其原因可能有:(1)与肿瘤细胞类型有关。胃肠道肿瘤以腺癌常见,介入治疗肿瘤坏死形成液性坏死区继发感染形成肝脓肿。(2)与肿瘤血供有关。原发性肝癌血供丰富,且部分由门静脉供血,介入治疗往往不能彻底栓塞其血供,而转移性肿瘤血供明显差于原发性肿瘤,肿瘤内部易发生坏死,介入治疗后液化坏死更为明显,容易继发脓肿。(3)与肿瘤位置和数量有关。转移性肿瘤多发生于肝脏边缘,血供稀少细菌容易滋生,且常为多发,坏死后融合成大片坏死区不易吸收,继而发生脓肿。
3.5 糖尿病史和血糖水平 本研究中发现研究组患者中血糖高于对照组1,但无显著统计学差异,糖尿病比例未明显高于对照组(P=0.314);而对照组2患者中糖尿病比例和血糖水平均明显较高(表2),这说明糖尿病史并不一定是肝脓肿发生的原因,而高血糖可能才是真正危险因素,这也提示我们临床上对肝癌患者尤其是有糖尿病史的患者要重视控制血糖以减少发生肝脓肿的机会。
3.6 门静脉癌栓 国内外学者认为[7]门静脉癌栓是肝脓肿形成的原因。理论依据是正常肝组织75%血供来自门脉,仅有25%血供来自肝动脉。同时经试验证实:肝动脉内血流的减少会引起门脉血流代偿性的增加,以确保局部肝组织的血供。因此当门脉有癌栓的患者,其肝组织门脉血供较差;门脉内压力增高后导致局部形成离肝血流;TACE术后门脉血流未能及时地随肝动脉血流减少而增加,这些原因导致局部组织缺血、缺氧,造成了有利于细菌生长繁殖的环境,使脓肿得以形成。本组研究并未得出相同的结果,脓肿组和对照组之间比较无显著统计学差异,这可能是由于抽样误差造成,但同时也说明就本组研究中发现胆道感染所导致肝脓肿的危险因素可能要高于门脉癌栓。
3.7 其他发现 本组研究还发现原发肝癌肝脓肿患者血小板和尿酸水平与其他肝癌患者有显著差异,但和普通肝脓肿患者比较无显著差异。这可能因为大部分原发性肝癌患者有肝硬化,伴有门脉高压和脾肿大,血小板水平较低,而转移性肿瘤患者大多无血小板降低,从而造成统计学差异。而尿酸水平在肿瘤患者之间个体差异较大,其临床意义尚有待进一步研究。还有学者认为使用微球一类的栓塞剂引起肝脓肿的机会较大,本研究并无相同的发现。
4 结 论
肝癌经介入治疗后形成肝脓肿是少见的严重并发症。因此了解其危险因素,对于临床上预防和诊断及选择有效方法治疗肝脓肿都有着重要意义。本研究提示女性、胆道损伤、营养状况低下、转移性肿瘤是介入后肝脓肿发生的危险因素,临床医师可以采取积极的措施,尤其在胆道引流方式的选择、营养状况的判断、血糖的控制方面来避免肝脓肿的发生。
1 Baere TD,Roche A,Amenabar JM,et al.Liver abscessformation after local treatment liver tumors[J].Hepatology,1996,23:1436-1440.
2 Huang SF,Ko CW,Chang CS,et al.Liver abscess formation after transarterial chemoembolization for malignant hepatic tumor[J].Hepatogastroenterology,2003,50(52):1115-1118.
3 ChenC,Chen PJ,Yang PM,et al.Clinical and microbiological featuresof liver abscess after transaterial immobilization for hepatocellular carcinoma[J].Am J Gastroenterol,1997,92:2257-2259.
4 Ishikawa H,Kanai T,Ono T,et al.Analysis of cases with liver abscess following transcatheter arterial chemoembolization(TAE)for malignant hepatic tumors[J].Ganto Kagaku Ryoho,1994,21:2233-2236.
5 Chung JW,Park JH,Han JK,et al.Hepatic tumors:predisposing factors for complications of transcatheter oily chemoemblization[J].Radiology,1996,198:33-40.
6 Okarima H,Kohne S,Tamaki M,et al.Bilo-enteric anastomosis as a risk factor for postembolic hepatic abscess[J].Cardiovasc Intervent Radiol,1989,12:128-130.
7 Song SY,Chung JW,Han JK,et al.Liver abscess after transcatheter oily chemoembolization for hepatic tumors:incidence,predisposing factors,and clinical outcome[J].J Vasc Interv Radiol.2001,12(3):313-320.
8 Kim W,Clark TW,Baum RA,et al.Risk factors for liver abscess formation after hepatic chemoembolization[J].J Vasc Interv Radiol,2001 Aug,12(8):965-968.

