福莫特罗对过敏性哮喘大鼠嗜酸性粒细胞炎症的作用
朱建波 赵铭山
(1.山东省滨州市人民医院,山东滨州 256603;2.滨州医学院,山东滨州 256603)
支气管哮喘是由多种炎症细胞,包括嗜酸性粒细胞(eosinophil,EOS)、肥大细胞、淋巴细胞、上皮细胞等多种细胞及其细胞组分参与的慢性气道炎症,其中EOS起着尤为关键的作用[1-2]。骨髓释放EOS向肺组织内趋化、黏附及EOS凋亡障碍是哮喘EOS增多的主要机制。聚集活化的EOS不但可以分泌多种炎性物质破坏气道黏膜,影响肺脏正常的生理功能,而且活化的EOS能够合成、分泌转化生长因子β2(TGF-β2),参与气道重塑;通过表达过氧化物酶体增生物激活受体(PPAR gamma)抑制气道的免疫反应[3]。
长效 β2受体激动剂(long-actingβ2-agonist,LABA)因其起效快、作用时间长而倍受临床医师青睐。沙美特罗和福莫特罗(formoterol,FMT)是LABA的代表药物,然而近年来有报道[4]β2受体激动剂在体外能够抑制EOS凋亡,可能加重气道炎症。而糖皮质激素能够抑制EOS向肺内迁移,快速诱导外周血中EOS及组织中EOS凋亡;能够减少肺组织中嗜酸性粒细胞趋化活化因子(eotaxin)的表达,抑制包括嗜酸性粒细胞阳离子蛋白(ECP)在内的多种炎性介质的释放,已被证实为抑制哮喘气道EOS炎症方面最有效的药物。本实验通过复制哮喘大鼠模型,以地塞米松为对照,研究福莫特罗在体内对EOS浸润气道的作用,为临床治疗哮喘提供参考。
1 资料与方法
1.1 实验动物 雄性Wistar大鼠(SPF级,购于山东大学实验动物中心)。
1.2 实验试剂和实验仪器 富马酸福莫特罗(沈阳山之内制药有限公司生产);地塞米松磷酸钠注射液(济南利民制药有限责任公司生产);卵蛋白(Ⅲ级)(Sigma公司提供,编号A5378);大鼠 eotaxin酶联免疫吸附(ELISA)试剂盒(上海森雄科技实业有限公司生产);大鼠ECP酶联免疫吸附(ELISA)试剂盒(上海轩昊科技有限公司生产);原位细胞凋亡检测试剂盒(TUNEL)、DAB显色试剂(武汉博士德生物工程有限公司生产)。
1.3 实验方法
1.3.1 哮喘模型的制备及给药方法 48只雄性Wistar大鼠,鼠龄 6~ 8周,体质量 180~220 g,随机分为6组,每组8只。A组为正常对照组;B组为哮喘模型组;C组为小剂量福莫特罗组(0.08 mg◦kg-1);D中等剂量福莫特罗组(0.12 mg◦kg-1);E组为大剂量福莫特罗组(0.16 mg◦kg-1);F组为地塞米松组(0.5 mg◦kg-1)。模型复制参照文献[5]并加以改进,正常对照组给予等量的0.9%氯化钠液(NS)对照操作。各实验组第1、8天注射卵蛋白(albumin,OVA)混悬液(OVA 1 mg,0.9%氯化钠液1 mL,氢氧化铝 200 mg,四肢内侧皮下、腹腔内各注射0.2 mL)。第15天起将大鼠放入自制密闭容器内,2%卵蛋白混悬液雾化吸入30 min,大鼠出现咳嗽、呼吸急促、点头呼吸、打喷嚏、烦躁不安、大小便失禁等过敏反应症状。对照组给予0.9%氯化钠液雾化吸入相同时间。按照以上方法每天雾化吸入1次,连用10 d。
给药方法:从第18天(即第4次诱发哮喘日)开始,每次诱发前1 h,激素组给予地塞米松腹腔注射,0.9%氯化钠液灌胃;福莫特罗组给予相应剂量的0.9%氯化钠液腹腔注射,福莫特罗灌胃;对照组分别给予0.9%氯化钠液腹腔注射,0.9%氯化钠液灌胃。连用7 d。
1.3.2 取材及标本制备 最后1次诱发哮喘后48 h(中性粒细胞<1%,淋巴细胞<9%),2%戊巴比妥钠(46 mg◦kg-1)腹腔注射麻醉大鼠,将其仰面固定在解剖台上,打开腹腔,从腹主动脉抽血5~10 mL,剪断腹主动脉。打开胸腔,剪开左心耳,充分放血。切取右肺,称体质量后-80℃冻存。左肺切成厚度约4 mm组织块,4%多聚甲醛固定。切取右侧肺组织,称质量后-80℃冰冻30 min。30 min后将冰冻肺组织放入匀浆器内,加入少量冰0.9%氯化钠液(0.5 mL◦g-1,以 20 000 r◦min-1离心 10 min将组织搅碎。匀浆液以3 000 r◦min-1离心10 min,留取上清液-80℃冻存备用。切取左侧肺组织,4%多聚甲醛内固定4~5 h,经过水洗、梯度乙醇脱水、浸蜡、包埋。采用连续切片的方法行HE染色及原位凋亡测定,观察组织炎症变化、EOS浸润及凋亡情况。
1.3.3 嗜酸性粒细胞趋化活化因子(eotaxin)及ECP测定 用酶联免疫吸附的方法测定(按照说明书操作)。
1.3.4 EOS凋亡率的测定 用原位凋亡的方法(TUNEL)测定肺组织切片中凋亡的 EOS(按照说明书操作)。
1.4 统计学分析 采用SPSS 11.5统计软件处理。实验数据用(¯x±s)表示。各组数据均行正态检验(Q-Q图)和方差齐性检验(Levene法)。各指标比较均采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著差法(LSD)检验;指标间相关比较采用Pearson相关分析;P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肺组织病理改变 HE染色的EOS在镜下表现为胞浆呈鲜红色,细胞核为杆状或呈分叶状。正常大鼠肺组织中EOS数量少,哮喘组肺组织内有大量EOS浸润,福莫特罗组浸润EOS数量明显减少,并且随福莫特罗剂量增加,EOS数量递减。糖皮质激素组多种炎症细胞减少(图1)。
2.2 各组大鼠肺组织切片EOS原位凋亡(图2);各组大鼠肺组织中浸润EOS数量及其凋亡指数(表
1) 苏木素复染后的组织切片中凋亡细胞的细胞核为棕黄色。每张切片由同一名观察者在高倍镜(×400)下随机选择10个视野,分别计算支气管、血管周围EOS浸润的数量及凋亡指数(凋亡细胞占相应EOS的百分比),平均值作为该片的代表值。哮喘模型组可见大量未凋亡的EOS,凋亡明显延迟,凋亡指数下降;福莫特罗组EOS凋亡抑制,凋亡指数降低;地塞米松组EOS凋亡延迟几乎能够完全纠正,凋亡指数提高。
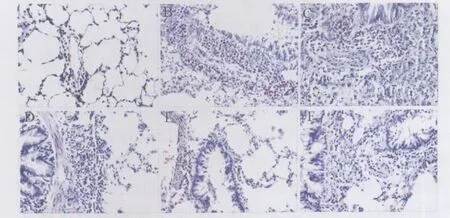
图1 各组大鼠肺组织病理改变(HE染色×400)

图2 各组大鼠肺组织原位凋亡图(苏木素复染×400)
A.正常对照组 气管周围浸润炎症细胞较少,但凋亡细胞较多,其中可见分叶核的EOS,亦可见凋亡的上皮细胞,淋巴细胞。B.哮喘模型组气管周围可见大量的炎症细胞浸润,主要为EOS和淋巴细胞。凋亡的EOS为分叶或杆状核,而凋亡的淋巴细胞核多为圆形,胞核均黄染。C.小剂量福莫特罗组 气管周围浸润EOS较哮喘模型组减少,凋亡细胞比例也有所减少。D.中等剂量福莫特罗组气管周围浸润EOS较小剂量福莫特罗组减少,凋亡细胞的比例也降低。E.大剂量福莫特罗组气管周围浸润EOS减少,凋亡细胞的比例进一步下降。F.地塞米松组气管周围浸润炎症细胞较少,但是凋亡细胞较多,可见凋亡的EOS和淋巴细胞。
2.3 各组大鼠肺组织匀浆中eotaxin及ECP的含量(表2),福莫特罗干预下浸润EOS数量与eotaxin直线相关分析 哮喘大鼠肺组织中eotaxin及ECP的含量明显增加,而福莫特罗各组含量明显减少;肺组织中EOS浸润数量与eotaxin的含量呈直线正相关(图3)。
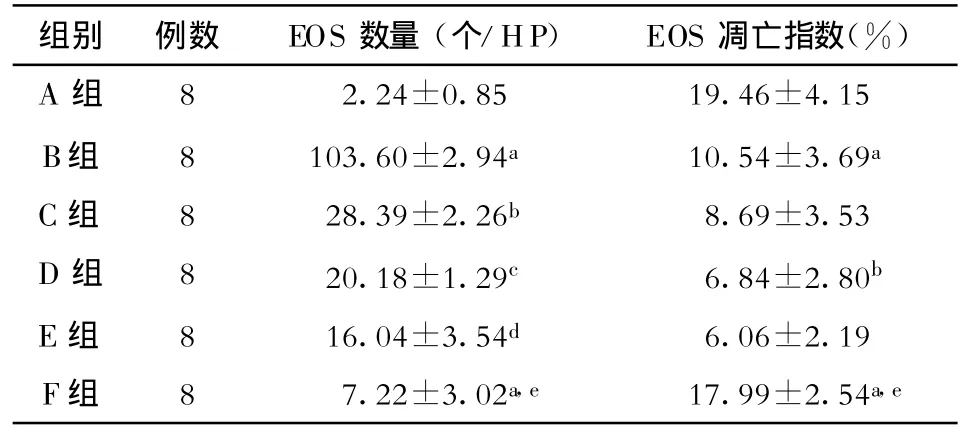
表1 各组大鼠肺组织中浸润EOS数量及其凋亡指数(¯x±s)

表2 各组大鼠肺组织匀浆中eotaxin及ECP的含量(¯x±s)
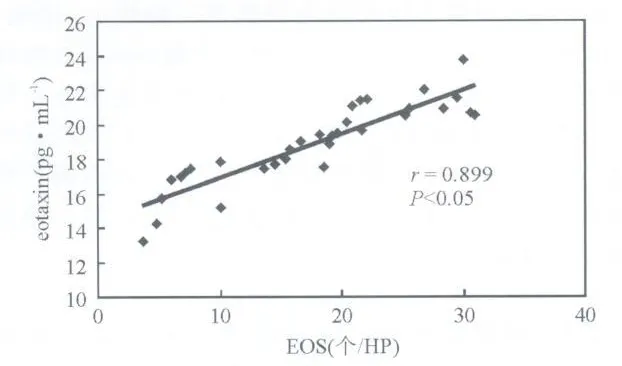
图3 福莫特罗干预下EOS数量与eotaxin含量相关分析
3 讨 论
哮喘的本质是气道炎症,多种炎症细胞长期浸润气道是支气管哮喘的一个突出特征。对基因缺失(如表达IL-5,IL-4的基因)大鼠模型的研究[6]表明了EOS在哮喘病理改变和气道高反应性中的重要作用。无论是哮喘的急性发作期还是缓解期,气道内都有大量的EOS浸润,对气道造成持续性破坏,这被认为是哮喘经久不愈,慢性迁延的原因之一,而减少肺内EOS的浸润则促进哮喘气道炎症的消退。
本实验结果显示福莫特罗组大鼠肺组织内EOS凋亡指数下降,说明福莫特罗在体内能够抑制EOS凋亡,但福莫特罗抑制EOS凋亡的作用无明显的剂量依赖性。Machida等[4]在体外发现福莫特罗抑制EOS凋亡的作用随浓度增高范围内逐渐增强。体内实验尚需增加福莫特罗剂量差距,观察其抑制作用是否具有剂量依赖性。
除了EOS凋亡障碍,骨髓释放的EOS向肺组织内趋化、黏附也是影响哮喘EOS增多的机制,为此我们做了相应的研究。影响EOS向肺组织内迁移的主要细胞因子是IL-5和eotaxin,有研究[7]表明福莫特罗不能通过IL-5影响EOS在肺组织内的浸润,而可能通过影响eotaxin的表达来影响EOS的浸润。eotaxin是由呼吸道上皮细胞、平滑肌、纤维母细胞及多种炎症细胞,如淋巴细胞、单核细胞、巨噬细胞、上皮细胞和EOS等分泌的,属于C-C化学性趋化因子超家族中的β亚群。本实验发现福莫特罗能减少肺组织匀浆中eotaxin的含量,且福莫特罗干预后气道中浸润的EOS数量与肺组织匀浆中eotaxin呈直线正相关,说明福莫特罗可能通过抑制eotaxin的表达减少肺组织内浸润的EOS数量。体外实验有研究表明福莫特罗能够通过抑制平滑肌细胞组蛋白H4乙酰化从而抑制eotaxin基因转录减少其表达。
活化的EOS能够分泌多种毒性蛋白,痰液中的ECP较血清中的含量更能反映患者病情的严重程度,是抗炎疗效的观测指标之一。本实验测定了肺组织匀浆中ECP的含量,结果证明福莫特罗能够减少肺组织内ECP的含量。一些研究表明在体外福莫特罗能够通过抑制血小板或纤维母细胞等多种途径抑制EOS的活化,减少炎症介质的释放,推测在体内亦有相同的作用。尽管本实验观察到ECP含量降低了,但是尚不能排除EOS数量变化对ECP含量的影响。
尽管福莫特罗抑制EOS的凋亡,但是本研究结果表明肺组织内EOS的数量是减少的,与哮喘模型组有显著性差异。因此我们认为福莫特罗对EOS数量的影响主要是通过eotaxin发挥作用的而不是抑制细胞凋亡,至少在短期内是这样的。Wallin等[8]对轻度哮喘患者的研究表明,吸入福莫特罗24μg,每天2次,2个月后气管黏膜下EOS明显较对照组减少。但有研究[9]得出相反的结论,长期规律应用β2受体激动剂患者气道中EOS数量增加,但是否与抑制EOS凋亡有关,尚缺乏证据,毕竟影响EOS数量的因素很多。近年来的研究表明在过敏原的刺激下,肺组织中也有CD34+细胞存在。Sergejeva等[10]研究哮喘豚鼠肺泡灌洗液中分离的CD34+细胞,发现气道中的CD34+细胞能够表达IL-5R,不但能够分化为成熟的EOS,而且自身有增殖的能力,提示CD34+细胞与IL-5R+细胞的分化增殖也可能是哮喘肺组织EOS浸润的一个重要来源。
1 Shen HH.Eosinophil:central mediator of allergic asthma[J]?Chin Med J,2005,118(1):4-5.
2 黄 龙,张 驰.哮喘患者诱导痰中嗜酸细胞IL-4和IL-5 mRNA表达[J].中国临床医学,2004,11(6):966-967.
3 Torrego A,Hew M,Oates T,et al.Exp ression and activation of TGF-βisoforms in acute allergen-in-duced remodeling in asthma[J].Thorax,2007,62(4):307-313.
4 Machida K,Inoue H.Activation of PI3K-Akt pathway mediates antiapoptotic effects of beta-adrenergic agonist in airway eosinophils[J].Am J Physiol Lung Cell Mol Physiol,2005,288(5):860-867.
5 Lloyd CM,Gonzalo JA,Nguyen T,et al.Resolution of bronchial hyperresponsiven-ess and pulmonary inflammation isassociated with IL-3 and tissue leukocyte apoptosis[J].J Immunol,2001,166(3):2033-2040.
6 Leigh R,Ellis R,Wattie JN,et al.Type 2 cytokines in the pathogenesis of sustained airway dysfunction and airway remodeling in mice[J].Am J Respir Crit Care Med,2004,169(7):860-867.
7 Wallin A,Sandstrom T.The effects of regular inhaled formoterol and budesonide on preformed Th-2 cytokines in mild asthmatics[J].Respir Med,2002,96(12):1021-1025.
8 Wallin AT,Cioppa GD,Holgate S,et al.The effects of regular inhaled formoterol and budesonide on preformed Th-2 cy tokines in mild asthmatics[J].Respir Med,2002,96(12):1021-1025.
9 Aldridge RE,Hancox RJ,Robin TD,et al.Effectsof terbutaline and budeso-nide on sputum cells and bronchial hyper responsivenessin asthma[J].Am J Respir Crit Care Med,2000,161(5):1459-1464.
10 Sergejeva S,Johansson AK,Malmhall C,et al.Allergen exposure-induced differences in CD34+cell phenotype:relationship to eosinophilopoietic responses in different compartments[J].Blood,2004,103(4):1270-1277.

