慢性乙型肝炎肝脏微循环障碍发生发展机制的研究
李志群 张 丰 祝 扬 赵景民 潘 登 杨建法 赵雨来
慢性乙型肝炎(CHB)患者肝组织可出现不同程度的微循环障碍。迄今为止,有关CHB肝内微循环障碍的分子机制尚未明确。为此,我们选择CHB和肝硬化患者的穿刺肝组织,进行α-SMA、环氧化酶(COX1)、COX2、AngII及 AT1 蛋白分子的表达状况研究,以探讨其与肝内微循环障碍发生的关系。
材料与方法
一、材料来源 选取2000年~2004年期间解放军302医院收治的经临床和病理诊断的慢性乙型肝炎和肝硬化患者肝穿刺标本120例,排除合并其他病毒感染者。肝穿活组织经10%甲醛溶液固定后,常规石蜡包埋,连续切片。以肝移植健康供肝肝组织标本作为对照组(n=10)。
二、主要试剂 鼠抗人α-SMA、鼠抗人COX1、鼠抗人COX2和EliVisionTM System检测试剂盒为Dako公司产品,DAB显色剂购自北京中杉生物技术有限公司;兔抗人血管紧张素II(AngII)I型受体购自武汉博士德生物工程有限公司。
三、免疫组织化学检测 主要步骤如下:石蜡切片脱蜡至水,3%H2O2-蒸馏水37℃孵箱去除内源酶;以抗原热修复法进行抗原热修复,微波炉煮沸持续15min;室温自然冷却;PBS冲洗5min×3次,分别滴加兔抗人AT1单克隆抗体(稀释浓度1:100)、鼠抗人α-SMA单克隆抗体(稀释浓度1:150)、鼠抗人COX1单克隆抗体(稀释浓度1:150)、鼠抗人COX2单克隆抗体(稀释浓度 1:100),4℃冰箱过夜;PBS 冲洗 5min×3次;滴加适当比例稀释的辣根酶标记二抗,室温40min;PBS冲洗 5min×3次;DAB 显色;苏木素衬染细胞核、封片。阳性染色呈棕黄色。磷酸盐缓冲液替代一抗作为阴性对照。显微镜下观察阳性细胞在CHB患者肝组织内的分布,每张切片选取5个以上典型汇管区和肝小叶,于200倍视野下计数阳性细胞数。
四、病理形态学观察 常规HE染色观察肝组织形态学变化。
五、统计学分析 采用SAS 8.0统计学软件,进行单向有序的R×C表的logistic回归分析。
结 果
一、肝组织α-SMA的表达 肝小叶内窦周纤维化区域、纤维增生明显,汇管区内及其小血管周围、血窦壁及边缘区可见α-SMA阳性细胞浸润。在S4期肝组织内,小叶结构紊乱,纤维间隔内及周围窦壁细胞内有强阳性表达(图1)。

图1 S4期肝组织α-SMA的表达 小血管周围呈强阳性(EliVisionTM System 法,×200)
二、肝组织COX1的表达 COX1蛋白表达于细胞浆,在S3期肝组织,小叶结构紊乱,残留的汇管区、肝细胞及窦壁细胞COX1呈高表达,纤维间隔周围部分少数炎细胞也有表达(图2)。

图2 S3期肝组织COX1的表达 肝细胞浆呈高表达(EliVisionTM System 法,×100)
三、肝组织COX2的表达 COX2蛋白表达于细胞浆,在S2期肝组织内残留的汇管区及纤维间隔周边部的间质细胞、炎细胞内COX2呈高表达,周围肝细胞、窦壁细胞呈弱表达(图3)。

图3 S2期肝组织COX2的表达 在间质细胞和炎细胞内COX2呈高表达(EliVisionTM System 法,×200)
四、肝组织AngII的表达血管紧张素II(AngII)在纤维间隔内及部分间质细胞呈强阳性表达,在硬化结节的窦壁细胞及部分肝细胞内表达上调。小血管壁内皮及平滑肌细胞也呈阳性表达(图4)。

图4 活动期肝硬化肝组织AngII的表达 在纤维间隔内及部分间质细胞呈强阳性表达(EliVisionTM System法,×100)
五、肝组织AT1的表达 在肝硬化肝组织纤维间隔周边部肝细胞及间质细胞,AT1呈强阳性表达(图 5)。
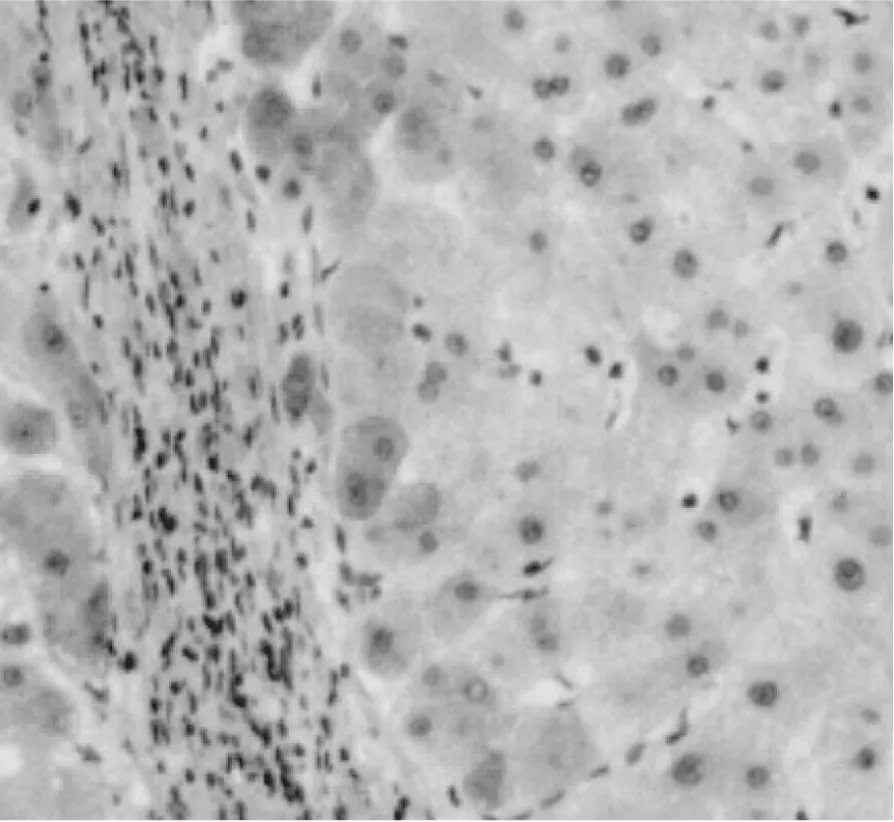
图5 肝硬化肝组织AT1的表达 染色阳性产物定位于肝细胞质(EliVisionTM System 法,×100)
讨 论
肝窦内皮细胞(SEC)含有收缩调节蛋白(α-肌动蛋白),肝窦直径的生理调节由肝星状细胞(HSC)控制。在窦状隙周围激活的肝星状细胞表达α-SMA,并导致窦状隙周围肝纤维化的发展。肝损伤后肝星状细胞激活的最突出特征是调节窦周血管收缩力显著增强,致使肝脏血管排列紊乱,使门脉高压的肝脏内阻力增加[1~3]。
本研究显示,在肝纤维化的肝组织中α-SMA呈强阳性,α-SMA阳性平滑肌细胞、肌纤维母细胞散在分布于小血管周围、边缘区,较健康对照肝组织数目有所增加。
COX有两种同工酶,即COX-1和COX-2。COX-1为结构型表达,COX-2为诱生型表达。本研究结果显示,肝细胞及窦壁细胞COX-1呈高表达。文献报道,COX-2是恶性转化的早期标志[5]。最近报道,COX-2在HCC病人中有过表达,选择性COX-2抑制物有利于恶性肿瘤的治疗[6]。对门脉高压小鼠小剂量阿司匹林有抑制血小板活性作用,是通过COX2途径而不是COX1途径[7]。在脂肪肝、炎症和坏死病理改变的肝组织中,促炎性调解蛋白COX-2mRNA表达水平显著增加,与坏死性炎的改变相一致[4]。COX-2是肝脏炎症和纤维化形成的关键作用因子[8,9]。
人和大鼠HSC均表达AT1,并且外源性AngII能刺激其收缩和增殖[10]。肝脏局部存在由HSC合成和分泌的RAAS,它作用于自身AT1R受体,促进HSC增殖和分泌细胞外基质,促进肝纤维化发生。本研究结果显示,慢性乙型肝炎和肝硬化活检肝组织内α-SMA、COX2、AngII及 AT1 表达水平明显上调。α-SMA、COX2、AngII、AT1 在慢性乙型肝炎及肝硬化肝脏微循环障碍的发生发展中起一定的作用。
[1]TOKAIRIN T,N ISHIKAWA Y,WATANABE H,et al.Osteopontin expression in the liver with severe perisinusoidal fibrosis:autopsy case of Down syndrome with transient myeloproliferative disorder[J].Pathol Int,2008,58(1):64-68.
[2]ROCKEY DC.Hepatic blood flow regulation by stellate cells in normal and injured liver[J].Semin Liver Dis,2001,21(3):337-343.
[3]TIPOE GL,LIONG EC,CASEY CA,et al.A voluntary oral ethanol-feeding rat model associated with necroinflammatory liver injury[J].2008,32(4):669-682.
[4]El-BASSIOUNY AE,ZOHEIRY MM,NOSSEIR MM,et al.Expression of cyclooxygenase-2 and transforming growth factor-beta1 in HCV-induced chronic liver disease and hepatocellular carcinoma[J].Med Gen Med,2007,9(3):45.
[5]BREINIG M,SCHIRMACHER P,KERN MA.Cyclooxygenase-2 (COX-2)-a therapeutic target in liver cancer[J].Curr Pharm Des,2007,13(32):3305-3315.
[6]EIZAYAGA FX,AGUEJOUF O,DESPLAT V,et al.Modifications produced by selective inhibitors of cyclooxygenase and ultra low dose aspirin on platelet activity in portal hypertension[J].World J Gastroenterol,2007,13(38):5065-5070.
[7]PISTON D,WANG S,FENG Y,et al.The role of cyclooxygenase-2/prostanoid pathway in visceral pain induced liver stress response in rats[J].Chin Med J(Engl),2007,120(20):1813-1819.
[8]HORRILLO R,PLANAGUMO A,GONZALEZ-PERIZ A,et al.Comparative protection against liver inflammation and fibrosis by a selective cyclooxygenase-2 inhibitor and a nonredox-type 5-lipoxygenase inhibitor[J].J Pharmacol Exp Ther,2007,323(3):778-786.
[9]BATALLER R,GINES P,NICOLAS JM,et,al.Angioensin II induces contraction and proliferation of human hepaticstellatecells[J].Gastroenterology,2000,118:1149-1156.
[10]张晶,宗春华,李定国,等.肝星形细胞存在局部肾素-血管紧张素-醛固酮系统[J].中华消化杂志,2003,21:38-40.

