腔内治疗幼儿Budd-Chiari综合征1例并文献分析
田 磊,王中华,陈学东,王仕华,王育红
布-加综合征(Budd-Chiari syndrome,BCS)是一种肝静脉和(或)其开口以上的下腔静脉阻塞性病变引起的伴有或不伴有下腔静脉高压为特点的一种肝后性门脉高压症。BCS发生于3岁以下幼儿者罕见。本文报道2岁10个月龄幼儿患BCS 1例,并复习文献资料,对患者年龄与BCS的病因、病理生理因素、诊疗方案等的相互影响进行初步探讨。
1 临床资料
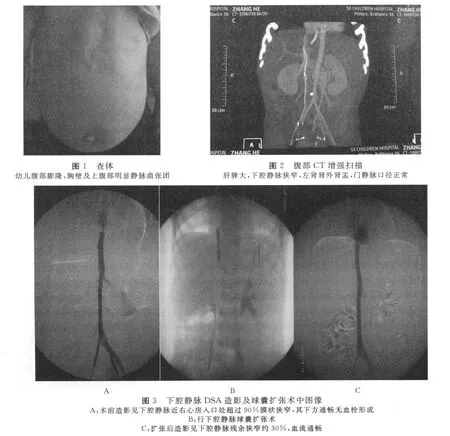
患儿,男性,2岁10个月龄。患儿家长于2008年7月无意中发现患儿腹部逐渐膨隆,胸壁及上腹部出现少许蚓状团块,无恶心、呕吐、呕血、腹泻、发热等症状,为进一步确诊2009年8月13日收住我科。查体:无肝掌及蜘蛛痣,全身浅表淋巴结未触及肿大;心肺正常;腹软,略膨隆,胸壁及上腹部可见静脉曲张团(图1),未见肠型及蠕动波,全腹无压痛,腹部未触及明显包块;肝肋下4 cm可触及,脾肋下3 cm可触及;双下肢可见轻度肿胀。腹部B超及腹部CT增强显示:肝脾大,少量腹水,下腔静脉狭窄,左肾肾外肾盂,门静脉口径正常(图2)。家长否认有家族遗传病史。实验室检查:红细胞计数(RBC)5.12×1012/L,血红蛋白(Hb)116 g/L,红细胞压积(HCT)0.36,白细胞计数(WBC)6.34×109/L,中性粒细胞0.24;肝功:总胆红素(TBIL)84 mol/L,直接胆红素(DBIL)46 mol/l,总蛋白(TP)53 g/L,白蛋白(ALB)30 g/L,球蛋白(GLO)23 g/L,谷丙转氨酶(ALT)21 U/L,谷草转氨酶(AST)57 U/L,碱性磷酸酶(ALP)196 U/L;凝血功能正常。入院诊断:①Budd-Chiari综合征;②左肾肾外肾盂。患儿于2009年8月18日在静脉全麻下行下腔静脉行数字减影血管造影术,见下腔静脉近右心房入口处膜状狭窄,狭窄率超过90%,其下方通畅无血栓形成(图3-A)。当即决定行下腔静脉球囊扩张术,以0.018超滑导丝通过下腔静脉狭窄段,更换5 F血管鞘,置入6.0 mm×40.0 mm Sailor球囊反复扩张狭窄段(图3-B),扩张后造影见残余狭窄约30%(图3-C)。手术顺利,患儿术后恢复出院,嘱咐4~6个月后来院复查或再次行球囊扩张。
2 讨论
布-加综合征是由肝静脉或其开口以上的下腔静脉阻塞引起的以门静脉高压或门静脉和下腔静脉高压为特征的一组疾病[1]。该病由Budd和Chiari于1845年和1899年分别报道,故被命名为Budd-Chiari综合征并沿用至今。该病发病率较低,最常见的表现为肝静脉开口以上的下腔静脉隔膜和(或)肝内静脉血栓形成。临床特征主要为上腹部疼痛、肝肿大、腹水、下肢浮肿、静脉曲张和门脉高压等。因本病病程进展缓慢,临床早期诊断较困难,容易误诊,故国内外文献对于年幼者布-加综合征报道极少。叶志球等[2]于2000年报道儿童布-加综合征6例,最小年龄5岁。本例患儿2岁10个月龄,极为罕见。
BCS的病因可分为原发性和继发性2类[1,3]。原发性多因先天性肝静脉发育不良,部分闭锁或下腔静脉先天性隔膜狭窄造成,多见于亚洲人群。继发性多为肝静脉血栓形成,血液高凝状态,红细胞增多症,腔外压迫如肿瘤、妊娠、肝结核性肉芽肿、肝包虫病等均可导致本病发生,欧美国家多见。文献显示,我国25岁以下BCS人群多为原发性,鲜有继发因素引起该病[4],部分患者可有明确家族遗传史[5]。本例患儿属于原发性,发病时间早,实验室检查无肝炎及凝血功能异常等表现,DSA造影可见下腔静脉近右心房入口处膜状狭窄,其下方及肝静脉通畅无血栓形成,为Ⅰ型BCS。
BCS的诊断除根据门静脉高压和下腔静脉阻塞综合表现外,彩色多普勒显像检查可以发现是否存在肝静脉或其开口以上下腔静脉的阻塞,是其主要依据之一。另外,CT血管造影(CTA)、磁共振血管造影(MRA)等对本病诊断均具有决定性意义,部分患者存在血液高凝状态也支持本病诊断。行下腔和肝静脉血管造影为诊断此病的金标准[3],造影不仅能明确诊断,又可显示阻塞部位、程度、范围、侧支循环情况,下腔静脉及肝静脉主干及开口部位是否通畅,有无外来压迫,并可推测阻塞的性质,对选择手术术式也十分必要。本患儿1岁余即出现胸壁及上腹部少许静脉团,后逐渐增大,腹部逐渐隆起,双下肢轻度肿胀等典型的症状体征,B超及CT检查发现肝脾肿大、少量腹水、下腔静脉狭窄;入院后行下腔静脉造影进一步明确了下腔静脉狭窄的位置及程度,确诊为Ⅰ型BCS,亦为选择合理的治疗方式提供了可靠依据。
本病治疗以疏通肝静脉和下腔静脉流出道、降低门脉和下腔静脉压力为原则,可采用外科手术及介入治疗[6],早期治疗可以达到消除腹水、防治曲张静脉破裂出血和后期的肝硬化[7]。具体治疗方法的选择取决于肝脏损害程度和血管阻塞的解剖学特征[8]。传统手术方式很多,主要包括直接手术(直接解除梗阻)如经右心房手指破膜术、直视下根治性手术等;间接手术(减压性手术)如门腔静脉分流、肠腔静脉分流、下腔静脉-右心房分流、肠系膜上静脉-右心房分流、门静脉-右心房转流及肝-颈静脉转流术等[9];部分终末期患者甚至需要行原位肝移植[10]。近年来,随着微创介入技术的发展,经皮血管腔内球囊扩张术、血管腔内支架植入术(MSE)等[11]在BCS治疗中广泛应用。本例患儿年龄小,造影显示为Ⅰ型布-加综合征,即单纯下腔静脉膜型阻塞,肝静脉通畅,遂决定经股静脉进行下腔静脉球囊扩张成形术(percutaneous transluminal angioplasty,PTA)。
由于下腔静脉阻塞端形态多样化,在进行破膜时准确地了解其阻塞端形态,对术中选择正确的破膜方向,避免破膜时损伤心包、穿破血管壁或撕裂侧支血管均具有重要的意义。本例的DSA造影显示,下腔静脉近右心房入口处超过90%膜状狭窄,阻塞端呈孔型,有少量血流通过,遂选用0.018超滑导丝由下至上通过该狭窄段阻塞孔再跟进6.0 mm×40.0 mm Sailor球囊,安全顺利,无并发症发生。该术式具有创伤小、并发症少、难度小、费用少及易于重复等优点,非常适合该Ⅰ型布-加综合征幼儿患者。
对于成人Ⅰ型BCS患者,目前大多数学者认为,在用球囊破膜后为防止再狭窄可随即放置支架成形[12]。本例为幼龄童,尚未发育成熟,隔膜上方下腔静脉与右心房的距离很短,尽管扩张破膜后还残余≤30%,但不应同时放置支架。我们建议患儿来院定期随访检查,如出现再狭窄,可用球囊反复扩张,待患儿发育成熟后再根据实际情况考虑放置支架成形或传统手术治疗。
[1]Aydinli M,Bayraktar Y.Budd-Chiari syndrome:etiology,pathogenesis and diagnosis[J].World J Gastroenterol,2007,13(19):2693-2696.
[2] 叶志球,邓志真,李鹤红,等.小儿Budd-Chiari综合征的CT分析:附6例报告[J].影像诊断与介入放射学,2000,9(2):107,111.
[3]Cura M,Haskal Z,Lopera J.Diagnostic and interventional radiology for Budd-Chiari syndrome[J].Radiographics,2009,29(3):669-681.
[4]冯博,徐克,姜宏,等.FV Leiden突变与我国汉族人布-加综合征的相关性及其临床意义[J].中华医学杂志,2000,80(5):355-357.
[5] 王玉林,朱惠明,李光展.同胞兄妹共患Budd-Chiari综合征的家系调查[J].中国现代医学杂志,2001,11(9):42-43.[6]王宝恩,张定凤.现代肝脏病学[M].北京:科学出版社,2003:753-761.
[7]Orloff MJ,Daily PO,Orloff SL,et al.A 27year experience with surgical treatment of Budd-Chiari syndrome[J].Ann Surg,2000,232(3):340-352.
[8]Rav-Acha M,Gur C,Ilan Y,et al.Budd-Chiari syndrome:updated treatment modalities[J].Harefuah,2004,143(5):372-376,389.
[9]梁发启.血管外科手术学[M].北京:人民卫生出版社,2002:326-418.
[10]华积德,郑成竹,方国恩.临床普通外科学:诊断分析与治疗领略[M].北京:人民军医出版社,2003:750-756.
[11]Qiao T,Liu CJ,Liu C,et al.Interventional endovascular treatment of Budd-Chiari syndrome with long-term followup[J].Swiss Med Wkly,2005,135(21/22):318-326.
[12]Reza F,Naser DE,Hossein G.Combination of thrombolytic therapy and angioplastic stent insertion in a patient with Budd-Chiari syndrome[J].World J Gastroenterol,2007,13(27):3767-3769.

