小鼠白内障基因突变方式、分布及基因定位
赵丽亚,鲍世民,赵国际,梁银明,李 凯,周宇荀,肖君华
(1.东华大学生物科学与技术研究所,上海 201620;2.中国科学院上海生命科学研究院实验动物中心,上海 201615)
小鼠白内障是一种进行性晶状体混浊病变,当各种原因引起房水成分或晶状体囊通透性改变及代谢紊乱,晶状体蛋白变性,纤维间出现水隙、空泡、细胞上皮增值等改变,透明晶状体变为混浊即形成白内障。随着国际小鼠基因组测序联盟与Celera公司分别完成C57B/6J与其他三个品系(129X1/SvJ、129S1/Sv ImJ、A/J)的序列测定,为小鼠白内障基因的研究应用奠定了良好的基础[1,2]。迄今,国内外已发现了约140个遗传性白内障小鼠模型,主要通过自发突变、诱发突变与敲除突变或转基因小鼠等方式得到。通过对遗传性白内障基因的研究,可深入了解晶状体病变的机制。
本文着重讨论国内外在小鼠中发现的白内障致病基因突变方式、染色体上的分布及基因定位方法,并简要总结了胚胎时期晶状体相关重要基因的表达起始时间。
1 小鼠白内障致病基因的突变方式
最早系统收集突变小鼠的方法是由30年前Kratochvilova和Ehling起始的(1979),以X-射线照射雄性亲本的生殖细胞,后来这种方法发展为ENU(乙酰基亚硝基脲)诱变[3]。
1.1 自发突变
1.1.1 无义突变:自然界中,基因自发突变产生白内障的频率很低,主要偶发自大规模饲养群体。偶发突变中碱基替换、碱基缺失、碱基插入等均可造成晶状体相关基因转录的特异性终止,从而引发白内障。
碱基缺失引发基因产物截短的小鼠白内障最多。如2004年,英国Durham大学Sandilands等[4]报道了129X1/SvJ小鼠基因Bfsp2发生自发突变,该突变是由于Bfsp2第二个外显子结合位点缺失,导致移码突变,并在第三个外显子引入终止密码子。2008年,哈佛大学医学院儿童医院Matteson等[5]鉴定了C3H/HeSnJ中自发突变产生的空泡晶状体(vl)小鼠,突变同时引起先天性白内障和神经管缺陷,定位克隆表明是Gpr161基因产生缺失突变,导致其编码蛋白的C-末端被截断。
碱基替换中G→A的转换通常会产生终止密码子。2002年,中国科学院Bu等[6]在昆明远交系小鼠饲养中发现一种晶状体浑浊隐性遗传白内障小鼠。该突变是由于Crygs的489位发生G→A的转换,最终形成截短的基因产物。
基因片段的插入往往由转座子引起。2006年,美国Wisconsin大学医学院Talamas等[7]在RIIIS/J品系中发现自发突变产生常染色体隐性遗传白内障小鼠。经鉴定Hsf4基因在内含子和外显子连接的上游61bp处,在9内含子中插入一个早期转座元件(ETn)。ETn的插入改变了Hsf4基因的剪接和表达,产生截短的HSF4蛋白。
1.1.2 错义突变:白内障晶状体蛋白基因产生突变,这种导致蛋白发生理化性质的变化,通常可产生不正常的晶状体纤维。1999年,美国Jackson实验室Chang等[8]报道了隐性遗传自发突变白内障小鼠lop18,17号染色体上Cryaa基因第1外显子中发生错义突变,从而改变了晶状体蛋白的折射性质和透明度,最终产生畸形晶状体纤维,形成白色核型白内障。类似的包括2003年,日本Tohoku大学Okamura等[9]在DDI品系中发现显性白内障突变(CatTohm)。该突变小鼠的Aqp0基因有12bp的缺失,导致AQP0蛋白的第二跨膜区缺失4个氨基酸,晶状体纤维细胞的严重退化。
自发突变还可造成晶状体蛋白破裂。2008年,日本Shiga医学中心研究院Omi等[10]鉴定了14号染色体上隐性基因遗传的晶状体破裂白内障,由Dock5的第15个外显子末端有27个碱基缺失引起的。在突变型和野生型中都存在Dock5基因的mRNA,但在突变型中检测不到DOCK5蛋白,表明突变使DOCK5蛋白不稳定。
1.2 诱发突变
通过诱发使生物产生大量而多样的基因突变,短时间内可选育出具备特殊性状的动物模型。目前,白内障诱发突变主要采用物理和化学诱变等方法进行。
1.2.1 物理诱变
1.2.1.1 X-射线诱变:X-射线照射可导致当代小鼠形成白内障。晶状体上皮细胞的辐射后受损细胞连续积累,这些细胞非正常迁移,并离开晶状体表面部位,最终导致环境中的氧与结合性活性氧簇一起进入晶状体中,导致晶状体蛋白聚集,从而形成皮质性白内障[11],属非遗传性白内障。
当X-射线辐射较强时,可导致生殖细胞产生突变,得到遗传性白内障模型。2001年,美国宾夕法尼大学Sidjanin等[12]发现X-射线可导致精子基因部分缺失(76bp),得到显性白内障突变小鼠Hfi,杂合子小鼠表现为晶状体纤维水肿,纯合子小鼠则表现为晶状体全混浊。X-射线亦可造成白内障基因发生碱基替换,如Maf基因中发生碱基G→A转换,使DNA结合区域第291位精氨酸被丙氨酸替换,产生粉状白内障的动物模型[13]。碱基替换的另一种后果可改变终止密码子的位置,如2008年,德国化境健康研究中心Ganguly等[14]用X-射线诱变雄性小鼠,在后代得到一种显性白内障小鼠,该突变是由于5号染色体上crybb2基因的第5个内含子末端发生了A-T的转换,导致mRNA中插入57bp碱基,从而使多肽链增加了19个氨基酸。
1.2.1.2 γ-射线:γ-射线属于电离辐射,易引起DNA缺失和损伤。2001年,德国Klopp等[15]用γ-射线照射亲本后,后代产生两侧带状核白内障。通过测序发现γ-E晶状体编码基因Cryge外显子2中存在1bp碱基缺失。
1.2.2 化学诱变:ENU(乙酰基亚硝基脲)是公认的最强的小鼠诱变剂。诱变处理的雄鼠与正常雌鼠交配可在F1代筛选显性突变或通过N2或N3代筛选隐性突变[16]。
1.2.2.1 化学诱变引起显性白内障:化学诱变产生白内障的突变似乎多为T→A的颠换。如Graw等[17-19]用ENU诱变雄性C3HeB/FeJ小鼠,得到的显性白内障基因均为T→A的颠换。后来改用甲基苄肼处理亲本,筛选得到的突变小鼠经定位测序也是Crygf基因T→A的颠换[20]。同样的,2007年,加利福尼亚大学Wang等[21]利用ENU诱变剂得到一种显性白内障小鼠系(L23),发现Crygd中发生了一个T→A的错义突变。这就提示我们,在对化学诱变的白内障小鼠测序时,对测序图的检查重点放在T→A突变上。
1.2.2.2 化学诱变引起隐性白内障:隐性白内障筛选的突变品系明显少于显性,究其原因在于隐性表型容易漏筛。2006年,加利福尼亚大学Xia等[22]利用ENU诱变剂同时得到两种遗传方式不同的白内障,一种为显性,另一种为隐性,并且是Cryaa基因在不同位置上的突变。2008年,韩国大学Kang等[23]报道了用ENU诱变得到Kec白内障小鼠,为常染色体隐性遗传,不过该突变基因尚未明确。可见,从大量的随机突变中通过表型筛选并鉴定点突变依然耗费时力[24]。
1.3 转基因技术
1.3.1 转基因小鼠:白内障转基因小鼠可直接锚定人类眼睛发育相关基因的网络通路。如2000年,美国Albert Einstein大学Melinda等[25]将人类PAX6(5a)基因转到小鼠中,他们通过研究PAX6(5a)在基因调控网络中的作用,鉴别出一些被Pax6直接或间接调控的基因序列。Bornheim等[26]报道构建了R113C点突变转基因小鼠系,发现了二个相关效应位点,可在晶状体中引起疾病表型。
转基因白内障小鼠的研究还表明,晶状体蛋白过度表达容易导致白内障。2007年,美国芝加哥大学Chung等[27]的转基因小鼠由鸡的βB1-晶状体蛋白启动子驱动人类Cx50编码区表达。结果转基因小鼠表达Cx50蛋白的表达水平要比非转基因小鼠高出3(13倍,从而导致转基因小鼠形成白内障。
1.3.2 定向敲除:发现白内障突变基因后,许多研究人员会对该基因进行定点敲除验证。如2008年,中国第二军医大学Zhang等[28]敲除Crybb2基因,发现小鼠患白内障的程度有随着年龄越加严重及应激能力下降的现象。2009年,上海交通大学Shi等[29]报道了Hsf4敲除小鼠(Hsf4-/-)能部分模仿由HSF4突变引起的人类白内障。HSF4对晶状体的发育非常重要,其基因缺失至少以3种途径导致白内障。
当定向敲除非已知白内障相关基因时,常可意外收获白内障疾病模型,表明白内障基因受到非常复杂基因网络的调控。如2008年,Jackson实验室Ghima等[30]敲除了引起人类宫颈癌的候选基因HPV18E7。结果没有一只小鼠形成宫颈癌,但是所有的转基因小鼠都形成了皮质性白内障。同样的例子在肌肉僵硬性敲除模型中发现[31]。
2 白内障相关基因的分布与基因定位方法
2.1 白内障相关基因的分布
白内障具有高度的遗传异质性,任何与晶状体发育和分化有关的基因突变都可形成遗传性白内障。,已经发现每条染色体上都有与白内障相关的基因,其中以1号染色体的基因突变最多,尤以Cryg基因家族为最,已知的突变位点多达24个(http://www.informatics.jax.org/javawi2/servlet/WIFetch?page=markerQF)。根据NCBI中的信息,我们绘制了20条染色体上已知白内障基因的分布图(图1)。
2.2 基因定位方法
2.2.1 全基因组扫描:基因组扫描是指对基因组中DNA多态性标记逐个进行筛查,基因组扫描的关键是计算所需遗传位标的个数。一般认为72只F2代患病白内障小鼠仅需要46个STR(short tandem repeat)位点用于基因定位[32]。对于显性遗传性白内障小鼠,若某位点纯合基因型占患病样本的比率低于25%,即为连锁[17],从而确定该基因在染色体上的粗略位置。
2.2.2 单倍型分析确定候选基因:针对白内障基因所在染色体区段,继续挑取STR位点进行精细定位,用单倍型进行分析,从而将致病基因定位在较小的区域,挑取染色体区段内已知的白内障基因为候选基因[17],并对候选基因进行测序确定白内障基因突变位点。
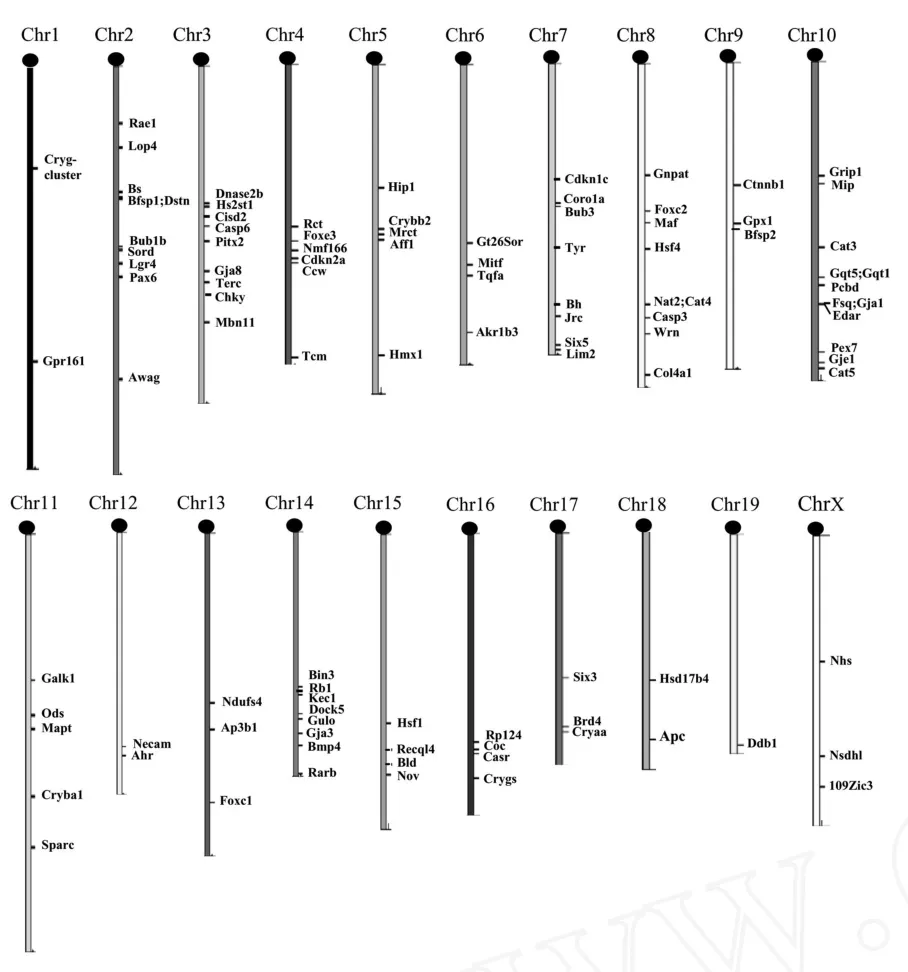
图1 小鼠白内障基因在染色体上的分布Fig.1 The distribution of mouse cataract genes on chromosomes
3 白内障相关基因的表达时间
晶状体发育早期易受转录因子的基因影响,如Maf家族是亮氨酸链(bZIP)的转录因子,主要在晶状体纤维早期发育和分化阶段表达,是晶状体球蛋白基因调控的中枢,在胚胎期10.5d到胚胎期11.0d之间的小鼠眼睛中检测到Maf的起始表达,该基因的突变极易引发先天性白内障[33],其他转录因子包括Pax6[34],Pitx3[35],或Sox[36]等基因突变也会引发先天性白内障。如果晶状体结构蛋白连接蛋白(connexins)[3,37,38]、内源性膜蛋白(MIP)[38],晶状体内源性膜蛋白(Lim-2)[38]或晶状体纤维细胞液结构蛋白(晶状体结构蛋白)[33,39]开始表达,其突变就会直接影响晶状体的发育,形成白内障。以上描述的晶状体相关基因表达时间如图2所示,不一一赘述。
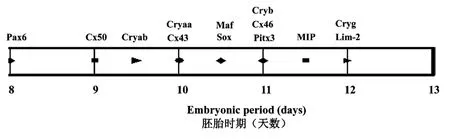
图2 胚胎时期晶状体发育相关基因转录启动时间Fig.2 Transcription start-up time of the lens development-related genes during embryonic period
4 结论与展望
据世界卫生组织统计,全世界约有4 500万人失明,其中有一半是由白内障导致[40]。由于先天性白内障疾病的复杂性,目前的研究还远远不够,距离真正了解这一疾病还有很大距离。为了解更多白内障发展进程、致病因素,为白内障个体化诊治阐明更明确的各类白内障致病机制,寻找各种合适的动物模型就显得尤其重要。
通过对众多白内障相关基因的网络调控研究与详细的表型分析,将使我们更深入了解眼睛发育的通路。因此,所有对这些突变的详细分析均是十分必要的,能使我们更清楚的描述白内障致病机理。从而使得白内障疾病成因的复杂调控网络得以更加明晰。
[1]Mouse genome sequencing Consortium.Initial sequencing and comparative analysis of the mouse genome[J].Nature,2002,420(6915):520-562.
[2]Mural RJ,Adams MD,Myers EW,et al.A comparison of whole-genome shotgun-derived mouse chromosome 16 and the human genome[J].Science,2002,296(5573):1667-1671.
[3]Graw J,Löster J.Developmental genetics in ophthalmology[J].Ophthalmic Genet,2003,24(1):1-33.
[4]Sandilands A,Wang X,Hutcheson AM,et al.Bfsp2 mutation found in mouse 129 strains causes the loss of CP49 and induces vimentin-dependent changes in the lens fibre cell cytoskeleton[J].Exp Eye Res,2004,78(1):109-123.
[5]Matteson PG,DesaiJ,Korstanje R,et al.The orphan Gproteincoupled receptor,Gpr161,encodes the vacuolated lens locus and controlsneurulation and lens development[J].Physiol Genomics,2008,105(6):2088-2093.
[6]Bu L,Yan S,Jin M,et al.The gamma S-crystallin gene is mutated in autosomal recessive cataract in mouse[J].Genomics,2002,80(1):38-44.
[7]Talamas E,Jackson L,Koeberl M,et al.Early transposable element insertion in intron 9 of the Hsf4 gene results in autosomal recessive cataracts in lop11 and ldis1 mice[J].Genomics,2006,88(1):44-51.
[8]Chang B,Hawes NL,Roderick TH,et al.Identification of a missense mutation in theαA-crystallin gene of the lop18 mouse[J],MolVis,1999,5:21.
[9]Okamura T,Miyoshi I,Takahashi K,et al.Bilateral congenital cataracts result from a gain-of-function mutation in the gene for aquaporin-0 in mice[J].Genomics,2003,81(4):361-368.
[10]OmiN,Kiyokawa E,Matsuda M,et al.Mutation of Dock5,a member of the guanine exchange factor Dock180 superfamily,in the rupture of lens cataractmouse[J].Exp Eye Res,2008,86(5):828-834.
[11]Varma SD,Hegde KR,Kovtun S.UV-B-induced damage to the lens in vitro:prevention by caffeine[J].J Ocul Pharmacol Ther,2008,24(5):439-444.
[12]Sidjanin DJ,Parker-W ilson DM,Neuhauser-Klaus A,et al.A 76-bp deletion in the Mip gene causes autosomal dominant cataract in Hfimice[J].Genomics,2001,74(3):313-319.
[13]LyonMF,Jamieson RV,Perveen R,et al.A dominantmutation within the DNA-binding domain of the bZIP transcription factor Maf causes murine cataract and results in selective alteration in DNA binding[J].Hum Mol Genet,2003,12(6):585-594.
[14]Ganguly K,Favor J,Neuhuser-Klaus A,et al.Novel allele of Crybb2 in the mouse and its expression in the brain[J].OphthalmolVis Sci,2008,49(4):1533-1541.
[15]Klopp N,Löster J,Graw J.Characterization of a 1-bp deletion in theγE-crystallin gene leading to a nuclear and zonular cataract in the mouse[J].InvestOphthalmolVis Sci,2001,42(1):183-187.
[16]Brown SD,BallingR.Systematic approachestomouse mutagenesis[J].Curr Opin Genet Dev,2001,11(3):268-273.
[17]Graw J,Jung M,Loster J,et al.Mutation in the bA3/A1-crystallin encoding gene Cryba1 causes a dominant cataract in the mouse[J].Genomics,1999,62(1):67-73.
[18]Graw J,Loster J,Soewarto D,et al.Characterization of a new,dominant V124E mutation in the mouse alphaA-crystallinencoding gene[J].InvestOphthalmol Vis Sci,2001,42(12):2909-2915.
[19]Graw J,Loster J,Soewarto D,et al.V76D mutation in a conserved gD-crystallin region leads to dominant cataracts in mice[J].Mamm Genome,2002,13(8):452-465.
[20]Graw J,Klopp N,Neubauser-KlausA,et al.CrygfRop:The first mutation in the Crygf gene causing a unique radial lens opacity[J].InvestOphthalmolVis Sci,2002,43(9):2998-3002.
[21]Wang K,Cheng C,LiL,et al.γD-crystallin associated protein aggregation and lensfibercelldenucleation[J].Invest OphthalmolVis Sci,2007,48(8):3719-3728.
[22]Xia CH,Liu H,Chang B,et al.Arginine 54 and tyrosine 118 residues of{alpha}A-crystallin are crucial for lens formation and transparency[J].Invest Ophthalmol Vis Sci,2006,47(7):3004-3010.
[23]Kang M,Cho JW,Kim JK,et al.Fine localization of a new cataract locus,Kec,on mouse chromosome 14 and exclusion of candidate genes as the gene that causes cataract in the Kecmouse[J].BMB Rep,2008,41(9):651-656.
[24]孙岩松,杨晓.ENU诱导点突变 —大规模基因突变和功能研究[J].生物工程学报 2001,17(4):365-370.
[25]Duncan MK,Kozmik Z,Cveklova K,et al.Overexpression of PAX6(5a)in lens fiber cells results in cataract and upregulation of(alpha)5(beta)1 integrin expression[J].J Cell Sci,2000,113(18):3173-3185.
[26]Bornheim R,Mller M,Reuter U,et al.A dominant vimentin mutant upregulates Hsp70 and the activity of the ubiquitinproteasome system,and causes posterior cataracts in transgenic mice[J].J Cell Sci,2008,121(22):3737-3746.
[27]Chung J,Berthoud VM,Novak L,etal.Transgenic overexpression of connexin50 induces cataracts[J].Exp Eye Res,2007,84(3):513-528.
[28]Zhang J,Li J,Huang C,et al.Targeted knockout of the mouse βB2-crystallin gene(Crybb2)induces age-related cataract[J].InvestOphthalmolVis Sci,2008,49(12):5476-5483.
[29]Shi X,CuiB,Wang Z,et al.Removal of Hsf4 leads to cataract developmentin mice through down-regulation of gammaS-crystallin and Bfsp expression[J].BMC Mol Biol,2009,10(1):10.
[30]Ghima S,JensonAB,BubierJA,et al.Cataracts in transgenicmice caused by a human papillomavirus type 18 E7 oncogene driven by KRT1-14[J].Exp Mol Pathol,2008,85(2):77-82.
[31]Kanadia RN,Johnstone KA,Mankodi A,et al.A muscleblind knockoutmodel formyotonic dystrophy[J].Science,2003,302(5652):1978-1980.
[32]Silver LM.Mouse genetics:concepts and applications[M].Oxford University Press,New York,1995.
[33]Sandilands A,Hutcheson AM.,Long HA,et al.Altered aggregation propertiesofmutant gamma-crystallins cause inherited cataract[J].EMBO J,2002,21(22):6005-6014.
[34]St-Onge L,Sosa-Pineda B,Chowdhury K,et al.Pax6 is required for differentiation of glucagon-producing alpha-cells in mouse pancreas[J].Nature,1997,387(6631):406-409.
[35]Semina EV,Reiter R.S,Murray JC.Isolation of a new homeobox gene belonging to the Pitx/Rieg family:expression during lens development and mapping to the aphakia region on mouse chromosome 19[J].Hum Mol Genet,1997,6(12):2109-2116.
[36]Kannabiran C,Rogan PK,OlmosL,et al.Autosomal dominant zonular cataractwith sutural opacities is associated with a splice mutation in the betaA3/A1-crystallin gene[J].Mol Vis,1998,4:21.
[37]Jiang JX,Goodenough DA.Heteromeric connexons in lens gap junction channels[J].Proc Natl Acad Sci U S A,1996,93(3):1287-1291.
[38]Zhou L,Chen T,Church RL.Temporal expression of three mouse lens fiber cell membrane protein genes during early development[J].MolVis,2002,8:143-148.
[39]RobinsonML,Overbeek PA.Differential expression of alpha A-and alpha B-crystallin during murine ocular development[J].InvestOphthalmolVis Sci,1996,37(11):2276-2284.
[40]Hammond CJ,Snieder H,Spector TD,et al.Genetic and environmentalfactors in age-related nuclear cataracts in monozygotic and dizygotic twins.N Engl J Med,2000,342(24):1786-1790.

