G蛋白偶联受体激酶5在稳定表达α-Synuclein的SHSY5Y细胞中的基因表达调控功能
刘 鹏,王晓映,高 宁,朱 华,代小伟,黄 澜,徐艳峰,马春梅,秦 川
(中国医学科学院实验动物研究所北京协和医学院比较医学中心卫生部人类疾病比较医学重点实验室,北京 100021)
GRKs(G protein-coupled receptor kinases)是G蛋白偶联受体激酶,属于丝氨酸/酪氨酸蛋白激酶家族。目前发现GRKs的主要功能是对G蛋白偶联受体(G protein-coupled receptor,GPCRs)进行磷酸化,从而介导GPCR的脱敏反应[1,2]。最近研究发现GRKs除了具有通过GPCR发挥G蛋白偶联受体激酶的作用外,还可以通过磷酸化一些非受体底物发挥作用。GRK5是GRKs家族中的一员,具有所有GRK成员的共同特点,其中包括它既可以磷酸化GPCRs,也可以磷酸化一些非受体底物,如tubulin[3],synucleins[4]和核蛋白体P2蛋白[5]等。目前根据GRK5的分布和功能确定出了一些结构和功能域:N-末端磷脂酰环己六醇-4,5-二磷酸(PIP2)结合域,磷脂结合域(氨基酸残基552-562),自体抑制结构域(氨基酸残基563-590),两个钙调蛋白(CaM)结合域(N末端氨基酸残基20-39和C末端氨基酸残基540-578)以及一个DNA结合细胞核定位序列(DNA-binding nuclear localization sequence,NLS)(氨基酸残基388-395)[6-9]。
Arawaka等[10]通过对散发性帕金森病人脑组织进行免疫组化染色发现,路易小体中存在有GRK5蛋白和α-synuclein蛋白,同时发现GRK5具有磷酸化α-synuclein 129位点丝氨酸的功能,而αsynuclein的这种磷酸化修饰作用可能是其对多巴胺神经元具有毒性作用的基础。这一发现揭示了GRK5在帕金森病可能具有致病作用。紧接着Bychkov等[11]发现GRK5的mRNA水平和蛋白水平在帕金森痴呆病人中表达均升高。由于GRK5参与了GPCRs介导的多种细胞信号通路的传导,因此GRK5的表达变化可能会导致帕金森病中信号传导通路紊乱,从而导致疾病的发生。
本课题组前期的研究发现帕金森病α-synuclein转基因小鼠模型具有更高表达水平的GRK5[12],在本文中我们对稳定表达hα-synuclein的SHSY5Y细胞系进行GRK5蛋白表达变化的研究,并对其亚细胞水平的表达变化进行观察。GRK5的DNA结合细胞核定位序列的发现[9],使人们对GRK5在细胞核内是否具有调控功能产生了研究兴趣。2000年,Eckhart等人[13]发现GRK5对一些基因的表达具有调控作用。2008年Martini等人[14]又发现了GRK5除了通过其经典的磷酸化GPCR的功能外,还可以作为HDAC激酶实现对核内基因的调控作用,从而参与心肌肥大疾病的发生。同年Sorriento等[15]发现GRK5通过增加细胞核内IκBα,进而抑制NFκB的转录活性。基于以上报道,本文在确定帕金森病模型中GRK5蛋白表达分布变化的基础上对其核内相关功能进行了进一步的研究。
1 材料与方法
1.1 试剂和抗体
Ripa蛋白裂解液(碧云天公司),Trizol试剂(Invitrogen),RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas公司),Realtime-PCR Master Mix(SYBR Green)(Toyobo公司),BCA蛋白定量试剂盒(Pierce公司),硝酸纤维素膜(Millipore公司),丙烯酰胺、N,N’-亚甲基甲叉双丙烯酰胺和TEMED均购自北京鼎国生物公司,所有引物均由上海生工生物公司合成。GRK5抗体(Santa Cruz公司),αsynuclein抗体(Abcam公司),Bcl-2抗体(Abcam公司),HRP标记的GAPDH抗体(上海康成生物公司),羊抗兔、羊抗鼠IgG/HRP购自北京中杉金桥生物公司。Lipofectin TM2000 transfection Kit(Invitrogen公司),NE-PER Nuclear and Cytoplasmic Extraction Reagents(Pierce公司),干扰GRK5的shRNA(Open Biosystems公司),HDAC Assay Kit(colorimetric detection)(Upstate公司)。
1.2 稳定表达hα-synuclein的SHSY5Y细胞系的建立
神经母细胞瘤细胞SHSY5Y购自中国医学科学院细胞中心,稳定表达hα-synuclein的SHSY5Y细胞系由本课题组建立[16]。
1.3 ShRNA干扰
对转染用shRNA质粒进行提取,将所提取质粒的测序结果与Open Biosystems公司给出的shRNA核苷酸序列进行比较,序列正确的质粒进行细胞转染,转染后72h提取细胞总RNA和总蛋白。用real-time PCR和Western blotting对目标基因进行检测。根据得到的实验结果,我们从5种shRNA中选择了抑制GRK5表达效果较好的2种shRNA进行了后续相应的实验。序列为:
shRNA1-GRK5:5′-CCGGACGAGATGATAGAAACAG AATCTCGAGATTCTGTTTCTATCATCTCGTTTTTT-3′;
shRNA2-GRK5:5′-CCGGCCACCACATAAACTCAAA CCACTCGAGTGGTTTGAGTTTATGTGGTGGTTTTT-3′。
1.4 蛋白提取以及Western Blotting
离心收集细胞,加入含PMSF蛋白裂解液。冰上充分裂解后4℃14 000r/min离心20min。提取上清液于即为总蛋白。利用NE-PER nuclear and cytoplasmic extraction reagents(胞浆胞核蛋白提取试剂)进行胞核和胞浆蛋白的提取,具体步骤参见说明。BCA试剂盒进行蛋白定量后,取等量样本蛋白,加入SDS上样缓冲液,混匀后沸水中变性,10%SDSPAGE电泳分离,电转移至硝酸纤维素膜,含5%脱脂奶粉的TBST缓冲液封闭,抗体4℃过夜杂交。次日 TBST洗膜,辣根过氧化物酶标记的二抗室温孵育lh,TBST洗膜,ECL显影定影显现信号。HRP标记的GAPDH抗体作为总蛋白内参。α-tubulin以及PCNA分别作为胞浆蛋白和胞核蛋白内参。
1.5 RNA提取以及Real-time PCR
Trizol法常规提取RNA,经DNA酶处理后,逆转录为cDNA,采用实时定量聚合酶链反应(real time PCR)进行检测。
GRK5引物序列为:
5′-GACCACACAGACGACGACTTC-3′和5′-CGTTC AGCTCCTTAAAGCATTC-3′;
bcl-2引物序列为:5′-TTCTTTGAGTTCGGTGGGGTC-3′和5′-TGCATATTTGTTTGGGGCAGG-3′;
GAPDH引物序列为:5′-CATGGGT GTGAACCATGAGAGA-3′和5′-TGTGGTCATGAGTC CTTCCA-3′。
1.6 HDAC活性检测
按照说明进行标准品稀释,建立标准曲线(0~1mmol/L)。在样品孔、阳性对照品孔和空白对照孔加入2×HDAC assay buffer(缓冲液),在阴性对照孔中加入4μmol/L trichostatin A,同时在阳性对照孔再加入Hela nuclear extract(核提取物)。各孔均加入4mmol/L HDAC assay substrate,充分混匀37℃孵育60min,加入activator solution(活性物溶液),充分混匀室温孵育20min,酶标仪405nm读数。
2 结果
2.1 稳定表达hα-synuclein SHSY5Y细胞系中GRK5的mRNA和蛋白水平均明显增高
用real-time PCR和Western blotting分析hαsynuclein稳定转染SHSY5Y细胞系和对照组细胞中GRK5的mRNA水平和蛋白水平的变化。图1A显示稳定表达hα-synuclein的SHSY5Y细胞系比对照组SHSY5Y细胞具有更高水平的GRK5mRNA。图1B显示在稳定转染细胞系中GRK5蛋白明显多于对照组SH-SY5Y细胞,图示为三次独立实验并各重复三次的代表图,GAPDH作为内参。
2.2 稳定表达hα-synuclein SHSY5Y细胞核和细胞浆中GRK5的蛋白水平均明显增高
分别提取胞浆蛋白和胞核蛋白,用Western blotting分析hα-synuclein稳定转染SHSY5Y细胞系中GRK5蛋白表达的亚细胞分布。图2显示稳定转染细胞系中GRK5蛋白在胞浆中和胞核的表达均明显多于对照组SHSY5Y细胞,α-tubulin作为胞浆蛋白内参,PCNA作为胞核蛋白内参。图示为三次独立实验并各重复三次的代表图。
2.3 hα-synuclein稳定转染SHSY5Y细胞系中HDAC活性增强
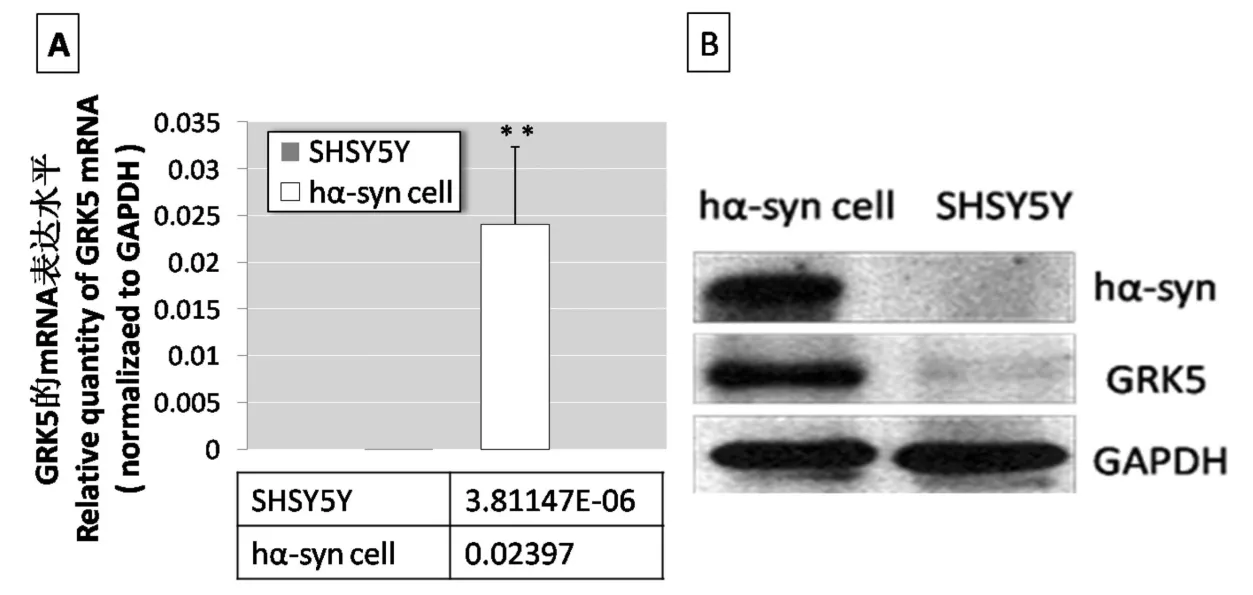
(A)Real-time PCR的统计结果,**P<0.01。(B)Western blotting显示hα-synuclein稳定转染SH-SY5Y细胞GRK5蛋白表达高于对照组SHSY5Y细胞。图1 hα-synuclein稳定转染SH-SY5Y细胞GRK5的mRNA和蛋白的表达分析(A)The statistical results of real-time PCR.(B).Western blot analysis of total protein extracted from hα-synuclein stably transfected cells and SHSY5Y cells(control).Fig.1 Analyzing GRK5 mRNA and protein expression in hα-synuclein stably transfected SH-SY5Y cells
为了研究GRK5蛋白在细胞核中的功能,我们用HDAC assay kit对稳定表达hα-synuclein的SHSY5Y细胞系的HDAC活性进行检测,之后用shRNA1-GRK5和shRNA2-GRK5转染SHSY5Y细胞观察GRK5蛋白表达抑制是否会对HDAC的活性产生影响。图3A显示与对照组SHSY5Y细胞相比,稳定表达hα-synuclein的SHSY5Y细胞的HDAC活性明显增加,对照组SHSY5Y细胞的HDAC活性设定为100%,hα-synuclein稳定转染SHSY5Y细胞的HDAC活性为139%。图3B显示shRNA1-GRK5和shRNA2-GRK5转染SHSY5Y细胞72h后,HDAC活性明显低于阴性对照组SHSY5Y细胞。shRNA1-GRK5转染SHSY5Y细胞中HDAC活性降低约80%,shRNA2-GRK5转染SHSY5Y细胞中HDAC活性降低约50%。与对照组比较,*P<0.05,**P<0.01。
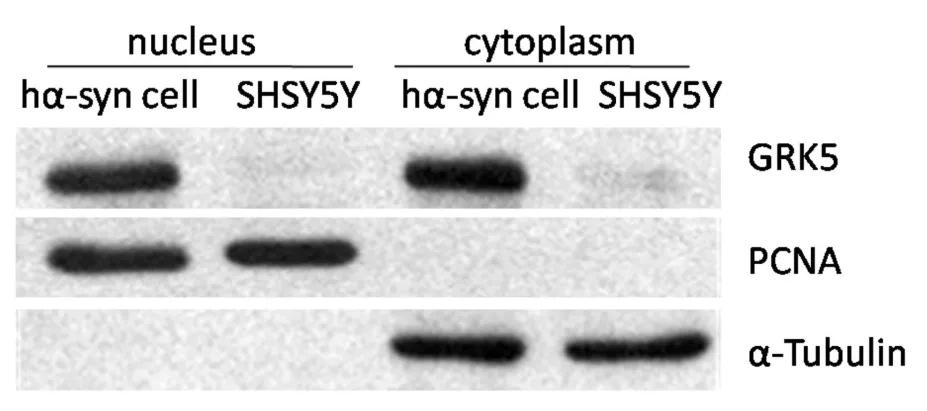
图2 hα-Synuclein稳定转染SHSY5Y细胞核和胞浆中GRK5蛋白的增高。Fig.2 Western blotting of nuclear and cytoplastic proteins extracted from hα-syn-transfected cells and SHSY5Y cells(control).
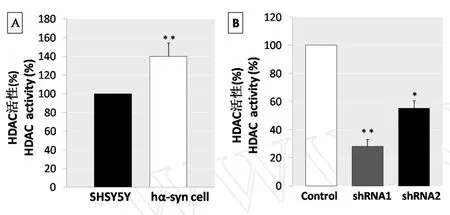
图3 GRK5对HDAC活性的调控Fig.3 Analysis of the histone deacetylase activity regulated by GRK5.
2.4 稳定表达hα-synucle in的SHSY5Y细胞系中bcl-2蛋白表达增加,GRK5对bcl-2基因的表达具有调控作用
我们首先用real-time PCR和Western blotting分析稳定表达hα-synuclein的SHSY5Y细胞系和对照组SHSY5Y细胞中bcl-2的mRNA水平和蛋白水平的变化。由图4A可见稳定表达hα-synuclein的SHSY5Y细胞系比对照组SHSY5Y细胞具有较低水平的Bcl-2mRNA。图4B显示稳定转染细胞系中bcl-2蛋白的表达水平明显低于对照组SHSY5Y细胞。接着用shRNA1-GRK5和shRNA2-GRK5转染SHSY5Y细胞后分析bcl-2mRNA、蛋白的表达情况。图4C显示,shRNA1-GRK5和shRNA2-GRK5转染SHSY5Y细胞72h后,可见GRK5mRNA的表达明显低于阴性对照组SHSY5Y细胞。同时,可见shRNA1-GRK5、shRNA2-GRK5转染SHSY5Y细胞与阴性对照组SHSY5Y细胞相比,bcl-2mRNA的表达明显增加。图4D显示,shRNA1-GRK5和shRNA2-GRK5转染SHSY5Y细胞72h后,GRK5蛋白的表达明显低于阴性对照组SHSY5Y细胞。同时,shRNA1-GRK5、shRNA2-GRK5转染SHSY5Y细胞与阴性对照组SHSY5Y细胞相比,bcl-2蛋白的表达明显增加。说明GRK5的表达抑制可以促使bcl-2的表达增加。GAPDH作为内参,图示为三次独立实验并各重复三次的代表图。*P<0.05,**P<0.01与对照相比。
3 讨论
本研究发现,在稳定表达hα-synuclein的SHSY5Y细胞系中GRK5的mRNA水平和蛋白水平均明显增加,通过进一步检测GRK5蛋白的亚细胞分布时发现无论是在细胞的胞浆中还是在细胞的胞核中GRK5蛋白表达均高于相应的对照组细胞,这些结果提示我们GRK5蛋白的表达增加在帕金森病中可能具有一定的致病作用。
近期研究显示GRK5中包含的DNA结合细胞核定位序列的发现[9],GRK5作为HDAC激酶实现对核内基因的调控作用参与心肌肥大疾病的发生[14]以及GRK5通过增加细胞核内IκBα(抑制性κBα)抑制NFκB(核因子κB)的转录活性[15],上述实验结果提示我们GRK5蛋白在细胞核内具有非常重要的作用,因此我们通过HDAC活性检测试验以及RNA干扰试验对GRK5在稳定表达hα-synuclein的SHSY5Y细胞胞核中的相关功能进行了研究。我们发现与对照组SHSY5Y细胞相比,稳定表达hα-synuclein的SHSY5Y细胞的HDAC活性明显增加,而且HDAC的活性随着GRK5蛋白的表达减少而显著降低。这些结果说明在SHSY5Y细胞中,GRK5对HDAC活性同样具有调节作用。hα-synuclein蛋白的表达增加,可能通过增加GRK5蛋白的表达,从而抑制了HDAC的活性,调控基因的转录和翻译。在稳定表达hα-synuclein的SHSY5Y细胞中bcl-2的mRNA和蛋白水平都是明显降低的,而通过shRNA干扰降低GRK5蛋白表达后,bcl-2的表达显著增加。这一结果证实了GRK5具有对bcl-2基因转录和表达调控的作用,而这一作用可能是通过调控HDAC活性实现的。Blc-2基因表达的调控是很复杂的,最近文献报道的GRK5可以通过增加细胞核内IκBα抑制NFκB的转录活性[15],而1999年Tamatani等[17]证实NFκB可以调控bcl-2基因的表达。因此,我们发现的GRK5的表达增加抑制了bcl-2基因的转录和翻译,可能是由我们证实的GRK5通过影响HDAC活性进行的,也有可能是通过GRK5抑制NFκB转录而实现。基因转录和翻译的调控本身就是非常复杂的,受到多种蛋白的调控,各种蛋白相互协调相互作用,共同调控,所以我们相信GRK5对bcl-2基因的调控也不仅限于这两个方面,更多的参与此调控途径的蛋白还有待于进一步研究。
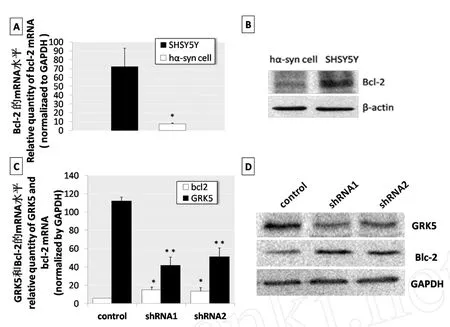
稳定表达hα-synuclein的SHSY5Y细胞系bcl-2的mRNA表达水平(A)和蛋白水平(B),β-actin作为内参,图示为三次独立实验并各重复三次的代表图。shRNA1-GRK5、shRNA2-GRK5瞬时转染SHSY5Y细胞以及对照组SHSY5Y细胞中GRK5和bcl-2mRNA的表达情况(C)以及蛋白的表达情况(D)。图4 GRK5对bcl-2基因的转录和表达具有调控作用The detection of bcl-2mRNA(A)and protein levels(B)in hα-synuclein-expressing cells and SHSY5Y cells(control).Analysis of The mRNA level(C)and protein level(D)of GRK5 and bcl-2 in SHSY5Y cells transiently transfected with shRNA1-GRK5 and shRNA2-GRK5.Fig.4 GRK5 regulates bcl-2 gene transcription and expression
综上所述,我们通过研究发现帕金森病模型中GRK5具有bcl-2基因转录和翻译的调控功能,证实了GRK5在帕金森病中具有一定的作用。这些发现提示我们GRK5可能作为一个新的靶点在帕金森病治疗中发挥一定的作用,同时我们的发现为进一步研究GRKs家族的基因调控功能提供了新的研究方向。
[1]Lefkowitz RJ.G protein-coupled receptors.III.New roles for receptor kinases and beta-arrestins in receptor signaling and desensitization[J].J Biol Chem,1998,273:18677-18680.
[2]Pitcher JA,Freedman NJ,Lefkowitz RJ.G protein-coupled receptor kinases[J].Annu Rev Biochem,1998,67:653-692.
[3]CarmanCV,Som T,Kim CM,etal.Binding and phosphorylation of tubulin by G protein-coupled receptor kinases[J].J Biol Chem,1998,273(32):20308-20316.
[4]Pronin AN,Morris AJ,Surguchov A,et al.Synucleins are a novel class of substrates for G protein-coupled receptor kinases[J].J Biol Chem,2000,275(34):26515-26522.
[5]Freeman JL,Gonzalo P,Pitcher JA,et al.Beta 2-adrenergic receptorstimulated,G protein-coupled receptorkinase 2 mediated phosphorylation of ribosomalprotein P2[J]. Biochemistry,2002,41(42):12850-12857.
[6]Pitcher JA,Fredericks ZL,Stone WC,et al.Phosphatidylinositol 4,5-bisphosphate(PIP2)-enhanced G protein-coupled receptor kinase(GRK)activity.Location,structure,and regulation of the PIP2 binding site distinguishes the GRK subfamilies[J].J Biol Chem,1996,271:24907-24913.
[7]Pronin AN,Carman CV,Benovic JL.Structure-function analysis of G protein-coupled receptor kinase-5[J].J Biol Chem,1998,273:31510-31518.
[8]Levay K,SatpaevDK,ProninAN,et al.Localization of the sites for Ca2+-binding proteins on G protein-coupled receptor kinases[J].Biochemistry 1998,37:13650-13659.
[9]Johnson LR,ScottMG,Pitcher JA.G protein-coupled receptor kinase 5 contains a DNA-binding nuclear localization sequence[J].Mol CellBiol,2004,24:10169-10179.
[10]Arawaka S,Wada M,Goto S,et al.The role of G-proteincoupled receptor kinase 5 in pathogenesisof sporadic Parkinson’s disease[J].J Neurosci,2006,26:9227-9238.
[11]Bychkov ER,Gurevich VV,Joyce JN,et al.Arrestins and two receptor kinases are upregulated in Parkinson’s disease with dementia[J].NeurobiolAging,2008,29:379-396.
[12]刘鹏,高宁,秦川,等.帕金森病α-Synuclein转基因小鼠模型中G蛋白偶联受体激酶 5的表达[J].中国比较医学杂志,2009,19(4):1-5.
[13]EckhartAD,SJ Duncan RB,Penn JL,et al.Hybrid transgenic mice reveal in vivo specificity of G protein-coupled receptor kinases in the heart[J].Circ Res,2000,86:43-50.
[14]Martini JS,Raake P,Vinge LE,et al.Uncovering G proteincoupled receptor kinase-5 as a histone deacetylase kinase in the nucleus of cardiomyocytes[J].ProcNatlAcad SciU SA,2008,105:12457-12462.
[15]Sorriento D,Ciccarelli M,Santulli G,et al.The G-proteincoupled receptor kinase 5 inhibits NFkappaB transcriptional activity by inducing nuclear accumulation of IkappaB alpha[J].Proc NatlAcad SciU SA,2008,105:17818-17823.
[16]Guo JT,Chen AQ,Kong Q,et al.Inhibition of vesicular monoamine transporter-2 activity in alpha-synuclein stably transfected SH-SY5Y cells[J].CellMol Neurobiol,2008,28:35-47.
[17]Tamatani T,Turk P,Weitzman S,Oyasu R,et al.Tumorigenic conversion of a rat urothelial cell line by human polymorphonuclear leukocytes activated by lipopolysaccharide[J].Jpn J Cancer Res,1999,90(8):829-836.

