慢病毒载体法制备红色荧光蛋白转基因小鼠
贾俊双,肖高芳,林晓琳,张 晟,姚志芳,杜文婷,申红芬,刘 科,饶子亮,孙 妍,姚开泰,肖 东,
(南方医科大学1.肿瘤研究所,2.比较医学研究所暨实验动物中心,广州 510515;3.广东省医学实验动物中心,广州 528248)
转基因小鼠已成为研究基因功能、开展发育生物学研究、建造人类疾病动物模型及研究人类疾病发病机制等的最重要的和最佳的模式实验动物[1]。原核显微注射法为目前最经典的和最成熟制备转基因小鼠的方法,但其制备转基因动物的效率很低。近年来,随着不同用途慢病毒载体的问世,慢病毒介导的转基因动物制作方法逐渐受到人们青睐;与原核显微注射法相比,慢病毒载体法主要优势如下:(1)操作较原核显微注射法简单的多,容易被一般人掌握;(2)对用于制作转基因小鼠的小鼠品系无特殊要求,原核显微注射时注射针必须插入核膜清晰的核内,因不同品系小鼠原核大小和核膜清晰度差异明显,而慢病毒受精卵卵周隙注射时,注射针无需插入核内;(3)高的胚胎存活率,因慢病毒卵周隙注射时对细胞膜和核膜均无损伤;(4)慢病毒载体法的转基因效率远高于原核显微注射法[2,3]。
利用遗传工程小鼠在体内解析基因功能的策略可分为:基因功能缺失(Loss of gene function)和基因功能获得(gain of gene function);在体内实现基因功能缺失的策略主要包括:(条件性)基因敲除、(条件性)转基因RNA干涉(RNAi)和负显性突变体(dominant negative mutant)技术等,而在体内实现基因功能获得的主要策略:目的基因(条件性)过表达等;近若干年来,针对不同基因采用不同的基因功能研究策略,利用不同类型的慢病毒载体借助慢病毒载体法建立了相应的转基因小鼠,在转基因小鼠体内已实现或有望实现如下目标:(1)基因功能获得[目的基因(条件性)过表达]和(2)基因功能缺失[(条件性)转基因RNAi和负显性突变体技术],以上策略和方法许多已成功用于在小鼠体内解析基因功能,这些都说明基于慢病毒载体法制备的转基因小鼠为活体内研究基因功能提供了理想三维研究体系[2-10]。
1 材料和方法
1.1 材料
1.1.1 载体和细胞:慢病毒载体phUb-mRFP[11]由美国斯坦福大学的Sanjiv Sam Gambhir博士惠赠,phUb-mRFP中含红色荧光蛋白(monomeric red fluorescence protein,mRFP)基因,其表达受人泛素启动子(human ubiquitin promoter,hUb promoter)调控。慢病毒包装系统购自Invitrogen公司。293FT细胞来源和培养方法等参见文献[12]。
1.1.2 实验动物:ICR小鼠(SPF级,6~8周龄,质量16~22g)由上海斯莱克实验动物中心提供(许可证号:SCXK(沪)2007-0005),饲养于SPF级屏障系统内,设施使用合格证号:SYXK(粤)2006-0074。ICR小鼠用作以下群体:供受精卵用雌鼠、种公鼠、假孕母鼠和结扎雄鼠。
1.1.3 主要试剂:PCR扩增试剂dNTP和Taq酶及限制性内切酶等购自大连TaKaRa公司,质粒提取试剂盒购自QIAGEN公司,KSOM培养液和FHM操作液购自Chemicon公司,透明质酸酶、矿物油和细胞松弛素购自Sigma公司。细胞培养和转染用试剂等来源参见文献[12],其余试剂为国产或进口化学纯或分析纯。
1.2 方法
1.2.1 phUb-mRFP酶切鉴定:用NotI、MluI和BamHI对phUb-mRFP进行单酶切,酶切产物行琼脂糖凝胶电泳。
1.2.2 慢病毒的包装、浓缩及鉴定:慢病毒包装、浓缩和保存步骤和方法详见文献[12]和Invitrogen公司操作手册。经超速离心浓缩的病毒分装后于-80℃保存备用;用浓缩后的病毒感染293FT细胞,24~48h后荧光显微镜下观察是否见红色荧光,以确认病毒是否成功生产。
1.2.3 慢病毒卵周隙注射制备mRFP转基因小鼠:超数排卵后采集受精卵,然后将浓缩后的病毒注射入小鼠受精卵的卵周隙中,并将注射后状态良好的受精卵移植进ICR假孕母鼠输卵管内,仔鼠一般19.5~20.0d后出生。假孕母鼠和结扎雄鼠制备以及超数排卵、受精卵采集、病毒卵周隙注射和受精卵移植等方法参见文献[3,13]。
1.2.4 利用体视荧光显微镜筛选与鉴定mRFP转基因首建鼠:将出生几天后的仔代乳鼠置于体视荧光显微镜下,检测mRFP表达以初筛mRFP转基因鼠,并从中选出荧光强度适中的乳鼠,作标记。此外,小鼠出生3周后,剪取6只F0代鼠的鼠耳,并置于体视荧光显微镜下,检测mRFP表达以进一步鉴定mRFP转基因鼠,并从中选出荧光强度适中的mRFP转基因首建鼠。
1.2.5 采用PCR进行基因型鉴定以验证体视荧光显微镜鉴定结果:在利用体视荧光显微镜初筛和鉴定mRFP转基因鼠的基础上,应用PCR验证mRFP阳性的转基因鼠基因组是否成功整合转基因mRFP。步骤与方法如下:
1.2.5.1 鼠尾基因组DNA提取:小鼠出生3周后,剪鼠尾,采用基因组DNA提取试剂盒(申能博彩生物科技有限公司)从潜在的mRFP转基因鼠和野生型ICR鼠(阴性对照)鼠尾组织提取基因组DNA,操作参见试剂盒说明书和文献[14,15]。
1.2.5.2 基因型鉴定PCR扩增:PCR扩增转基因用引物:P1,5′-CGATGACTTACTGGCGGGT-3′;P2,5′-CGCACCGTATTGGCAAGCA-3′。PCR反应条件:预变性95℃7min;变性95℃50s,退火54℃50s,延伸72℃1min,30个循环;延伸72℃,7min。PCR扩增后,取5μL反应液进行2%琼脂糖凝胶电泳。
1.2.6 mRFP转基因首建鼠繁殖传代及转基因遗传和表达稳定性检测:将mRFP表达阳性及PCR阳性的首建鼠(R3和R4)与野生型ICR鼠交配以传代,获得F1后,用小动物活体成像仪检测mRFP是否在F1代表达,对其表达稳定性作出判断,并进而间接判断外源转基因是否稳定遗传。
2 结果与分析
2.1 慢病毒载体phUb-mRFP鉴定
phUb-mRFP经NotI、MluI和BamHI分别单酶切,产物经电泳均可见两条带,其大小与理论预测值相符(图1)。此外,对phUb-mRFP载体启动子进行测序亦证实phUb-mRFP载体是正确的(数据未显示)。
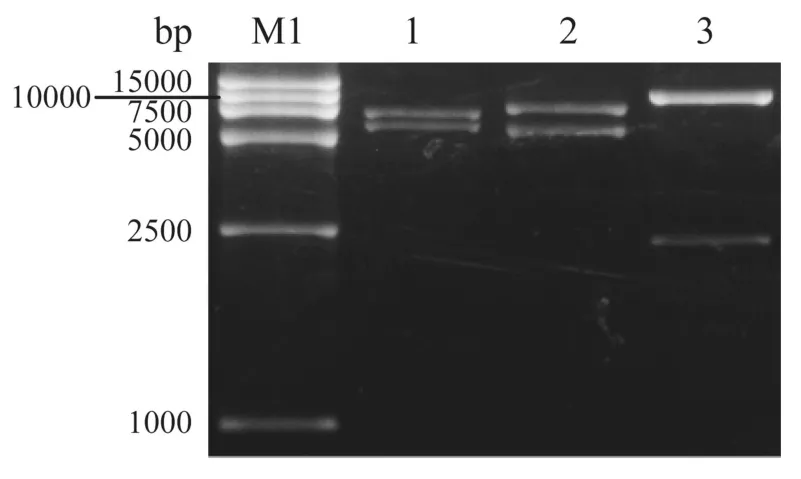
泳道1:DL15 000 marker(TaKaRa);泳道1~3:NotI,MluI或BamHI分别酶切phUb-mRFP图1 慢病毒载体phUb-mRFP酶切鉴定LaneM1:DL15 000(TaKaRa);Lane 1~3:phUb-mRFP cut by NotI,MluIorBamHI,respectively.Fig.1 Lentiviral vector of phUb-mRFP identified by enzymatic digestion
2.2 携带mRFP基因慢病毒的包装、浓缩及成功生产鉴定
将phUb-mRFP与病毒包装质粒共转染293FT细胞,48h后倒置荧光显微镜下可见红色荧光,预示转染成功(图2A)。收集的病毒上清经超速离心浓缩后感染293FT细胞,48h后倒置荧光显微镜下可见红色荧光(图2B),预示病毒成功生产;细胞爬片结果显示浓缩后的病毒可高效率感染293FT细胞(数据未显示)。以上结果表明mRFP转基因能够正常表达(图2见彩插)。
2.3 mRFP转基因小鼠的建立
目前,慢病毒载体法制备转基因小鼠有两种方法:慢病毒卵周隙注射法和慢病毒感染去透明带的受精卵法。本研究采用慢病毒卵周隙注射法建立mRFP转基因小鼠,如图3所示。
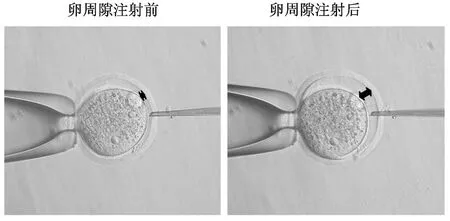
图3 慢病毒受精卵卵周隙注射示意图Fig.3 Schematic illustration of subzonal injection(SLI)of lentivirus into a single-cell zygote
本研究先利用体视荧光显微镜通过检测mRFP表达以从出生后的小鼠中筛选与鉴定mRFP转基因首建鼠,在此基础上进一步采用PCR进行基因型鉴定以验证体视荧光显微镜鉴定结果。
慢病毒注入48枚单细胞受精卵的卵周隙后,存活胚胎42枚,将其中40枚胚胎移植给2只假孕母鼠,2只均怀孕[受孕率为100%(2/2)],共获仔鼠6只[产仔率为15%(6/40)]。
将出生几天的子代乳鼠置于体视荧光显微镜下,观察发现其中两只强表达mRFP(图4)。小鼠出生3周后,利用体视荧光显微镜检测mRFP表达,在蛋白水平证实6只出生的F0代中,2只(R3和R4)鼠耳强表达mRFP,其余的弱表达mRFP(R1,R2和R5 R6)或荧光强度(R6)与野生型ICR小鼠无明显差别(图5A)。
DNA水平检测证实,6只F0代中,5只(其中包括强表达mRFP的2只)基因组中整合有外源基因mRFP,即获得5只PCR阳性的mRFP转基因首建鼠,首建鼠mRFP整合率达83%(图5B)。可见,采用PCR进行基因型鉴定很好验证了体视荧光显微镜鉴定结果。
2.4 mRFP转基因遗传和表达稳定性检测
为证实首建鼠所携带的外源基因可否稳定遗传,将mRFP表达阳性及PCR阳性的首建鼠(R3和R4)与野生型ICR鼠交配以获得F1代。小动物活体成像仪检测显示,F1代鼠中部分个体表达mRFP(图6),这预示外源基因不仅可以从一代向下一代稳定传递,且能够稳定表达(图2、4~6见彩插1)。
3 讨论
3.1 探索非损伤可视转基因跟踪策略与方法
转基因小鼠制作以及随后的培育、纯合子获得和建系等都是费事、费时和费力的工作。如何将繁重的工作降下来一直是许多研究者探索的问题,我们也在积极探索简便易行的“非损伤可视外源转基因跟踪”策略与方法,以便替代PCR和Southern Blot等传统跟踪转基因的方法。如mRFP转基因小鼠筛选与鉴定过程中,首先应用体视荧光显微镜检测各组织(鼠耳、皮肤和毛发等)中mRFP表达情况以初步筛选并鉴定mRFP转基因小鼠,对mRFP表达水平较高的鼠进行基因型鉴定(利用PCR技术),结果显示这些鼠基因组中确实整合了外源转基因mRFP。至此,我们初步建立了简便易行的“非损伤可视外源转基因跟踪”策略与方法,该方法有望替代PCR和Southern Blot等传统跟踪转基因的方法。
3.2 慢病毒感染受精卵方式的选择
慢病毒感染去透明带的受精卵法的优点:(1)较好控制外源转基因整合拷贝数;(2)无需特殊仪器和无需熟练的显微操作技术;(3)适合慢病毒大批量感染受精卵。慢病毒感染去透明带的受精卵法的缺点:(1)去透明带时间不易控制,时间稍长即会对胞膜造成损伤;(2)胚胎存活率下降;(3)移植率和妊娠率下降去透明带法中,胚胎需在体外培养2~3d,在体外过长时间操作,致使胚胎发育延迟,且胚胎在去除透明带后变得容易相互黏附,移植时胚胎形成聚合体,导致移植率和妊娠率下降。慢病毒卵周隙注射法的优点:(1)胚胎存活率高(因卵周隙注射对细胞膜和核膜均无损伤);(2)移植率和妊娠率高(胚胎有透明带保护,同时慢病毒注射后胚胎当日或次日即植入假母体内)。慢病毒卵周隙注射法的缺点:(1)外源转基因整合拷贝数不易控制(因无法精确控制注射入透明带下慢病毒的量,造成不同首建鼠间外源基因整合拷贝数不一致);(2)需要特殊仪器和熟练操作技术人员。可见,慢病毒受精卵卵周隙注射法和慢病毒感染去透明带的受精卵法各有优势,但前者最为常用。
本课题曾尝试用慢病毒感染去透明带的受精卵来制备转基因小鼠,但由于无法克服该方法固有的缺陷,如去透明带后的胚胎往往粘附聚团,极大延迟胚胎发育,甚至导致胚胎发育停止,从而降低移植率和妊娠率。鉴此,本研究采用透明带下注射慢病毒法制备转基因小鼠,以确保得到较高质量的胚胎及较高的移植率和妊娠率等。
3.3 影响mRFP转基因在转基因小鼠体内表达因素的分析
在建立转基因小鼠的过程中,同一转基因在不同首建鼠,外源转基因表达水平往往不同,位置效应和转基因整合拷贝数的不一致通常是造成外源转基因表达水平有差异的主要原因。本研究数据显示,在得到的5只mRFP转基因小鼠中,3只小鼠弱表达mRFP或红色荧光强度与野生型ICR小鼠无明显差异,2只小鼠(R3和R4)强表达mRFP,造成如此结果的可能原因有:(1)外源转基因在染色体上插入位点不同,(2)外源转基因在基因组中整合拷贝数有差异等。接下来,本研究将从5只mRFP表达水平较强的mRFP转基因首建鼠中挑选R3和R4进行mRFP转基因鼠的培育、建系和保种等。
总之,本研究采用慢病毒受精卵卵周隙注射法成功建立mRFP转基因鼠,得以熟练掌握基于慢病毒载体法制备转基因小鼠的技术,这为基于慢病毒载体法制备转基因小鼠,以为活体内研究基因功能提供了技术保障。
[1]Sun Y,Chen X,Xiao D.Tetracycline-inducible expression systems:new strategies and practices in the transgenic mouse modeling[J].Acta Biochim Biophys Sin(Shanghai),2007,39(4):235-246.
[2]Lois C,Hong EJ,Pease S,et al.Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors[J].Science,2002,295(5556):868-872.
[3]Singer O,Tiscornia G,Ikawa M,et al.Rapid generation of knockdown transgenic mice by silencing lentiviral vectors[J].Nat Protoc,2006,1(1):286-292.
[4]Dann CT,Garbers DL.Production of knockdown rats by lentiviral transduction of embryos with short hairpin RNA transgenes[J].MethodsMolBiol,2008,450:193-209.
[5]Rubinson DA,Dillon CP,KwiatkowskiAV,et al.A lentivirusbased system to functionally silence genes in primary mammalian cells,stem cells and transgenic mice by RNA interference[J].Nat Genet,2003,33(3):401-406.
[6]Shin KJ,Wall EA,Zavzavadjian JR,et al.A single lentiviral vector platform formicroRNA-based conditional RNA interference and coordinated transgene expression[J].PNAS,2006,103(37):13759-13764.
[7]Stegmeier F,Hu G,Rickles RJ,et al.A lentiviral microRNA-based system for single-copy polymerase II-regulated RNA interference in mammalian cells[J].PNAS,2005,102:13212-13217.
[8]Szulc J,W iznerowiczM,SauvainMO,et al.A versatile tool for conditional gene expression and knockdown[J].Nat Methods.2006,3(2):109-116.
[9]Tiscornia G,Tergaonkar V,Galimi F,et al.CRE recombinase-inducible RNA interference mediated by lentiviral vectors[J].PNAS,2004,101:7347-7351.
[10]Ventura A,Meissner A,Dillon CP,et al.Cre-lox-regulated conditional RNA interference from transgenes[J].PNAS,2004,101:10380-10385.
[11]Cao F,Lin S,Xie X,et al.In vivo visualization of embryonic stem cell survival,proliferation,and migration after cardiac delivery[J].Circulation,2006,113(7):1005-1014.
[12]贾俊双,孙妍,肖东,等.慢病毒介导的外源基因体外投递系统的建立[J].热带医学杂志,2008,8(10):1028-1029,1037.
[13]Nagy A,Gertsenstei M,Vintersten K,et al.Manipulating the mouse Embryo:A Laboratory Manual[J].Cold Spring Harbor Laboratory Press,2004,192-203.
[14]XiaoD,Yue Y,DengXY,et al.Rescue of the albino phenotype by introducing a functional tyrosinaseminigene into Kunming albino mice[J].World J Gastroenterol,2007,13(2):244-249.
[15]Xu K,Deng XY,Yue Y,et al.Generation of the regulatory protein rtTA transgenic mice[J].World J Gastroenterol,2005,8(19):2885-2891.

