STK15的表达对NIH3T3细胞的影响
朱 焱,王禄增,杨 威,于 洋,王 维,董婉维,汪 瑛,秦 英,郑志红
(1.中国医科大学实验动物部,沈阳 110001;2.沈阳市公安医院,沈阳 110001)
STK15基因是丝/苏氨酸激酶家族成员之一[1]。STK15基因是一种与中心体结构及功能紧密相关的基因,并具有高水平的酪蛋白激酶活性[2]。STK15基因的扩增和过表达使中心体异常扩增,从而导致染色体的异常分配及不稳定,最终癌基因激活,导致肿瘤产生[3],所以STK15的过表达与肿瘤的发生存在一定的联系。本实验构建了pcDNA3.1-STK15质粒,并将其瞬时转染NIH3T3,观察STK15高表达对NIH3T3细胞的影响,以进一步阐明STK15基因在肿瘤发生发展中的作用。
1 材料和方法
1.1 实验材料
脂质体转染试剂、DMEM培养基、TR IZOL均购自Invitrogen。反转录试剂盒、回收试剂盒均购自Qiagen。限制性内切酶、TaqE、dNTP、连接试剂盒、小量质粒提取试剂盒均购自TaKaRa。小牛血清购自天津灏洋。兔抗人STK15多克隆抗体购自AbD Serotec。HRP标记的山羊抗兔的二抗购自中山公司。S-P试剂盒购自福州迈新生物技术公司。MTT购自华美公司。重组人基底膜购自BD公司。
1.2 实验方法
1.2.1 构建质粒pcDNA3.1-STK15:提取人胚肺细胞总RNA,RT-PCR方法扩增STK15cDNA全长,克隆到pTZ57R/T载体,测序。BamH1和XbaI双酶切pcDNA3.1和T-STK15连接产物,回收、连接、转化、鉴定,构建pcDNA3.1-STK15质粒。
1.2.2 细胞转染:将对数生长期细胞(PcDNA3.1、PcDNA3.1-STK15转染NIH3T3细胞)接种于6孔板,转染后培养48h。
1.2.3 RT-PCR:提取细胞RNA,RT-PCR试剂盒检测STK15的表达,扩增片段的长度为498bp。
1.2.4 Western印迹分析:PBS洗2次,裂解液冰上孵育30min,12 000r/min,4℃离心30min,上清液即细胞蛋白。然后加样、电泳、转膜、封闭,加入1∶500的兔抗人的STK15多克隆抗体,室温震荡2h,洗膜3次,加入1∶2 000的山羊抗兔的二抗,室温震荡1h,洗膜3次,显色。
1.2.5 免疫细胞化学:将转染后的细胞传代于有载玻片的六孔板中,次日取出玻片,固定30min。加过氧化物酶阻断液,室温下孵育10min,PBS洗3次。封闭,室温下孵育10min,甩去血清。加一抗(兔抗人STK15抗体1:500稀释)4℃、过夜,PBS洗3次。加生物素标记的第二抗体,室温下孵育10min,PBS洗3次。加链霉素—过氧化物酶溶液(D),室温下孵育10min,PBS洗3次。加DAB显色,自来水冲洗,苏木素复染30s,返蓝,50%甘油封片。
1.2.6 MTT方法:每孔3 000个细胞(NIH3T3细胞、pcDNA3.1转染的NIH3T3细胞、pcDNA3.1-STK15转染的NIH3T3细胞)接种于96孔板,在24、48、72h加入MTT(终浓度5mg/mL),37℃、孵育4h,弃上清,加入DMSO 150μL,低速震荡10min,分光光度计490nm读取A值。每组设8个复孔,共重复3次。
1.2.7 Transwell小室法:人工基底膜胶冰浴过夜融化,用预冷的无血清的DMEM培养液1:5稀释,吸取100μL包被于Trans well小室滤膜上,置5%CO2、37℃、培养24h。上室接种转染的NIH3T3细胞(约2.5×104个细胞)100μL,下室加入10%FBS的DMEM 600μL作为趋化因子,置5%CO2、37℃、培养24h。取出Transwell小室,滤膜用多聚甲醛固定15min,苏木素染核,200倍显微镜下计数上下左右中5个视野的侵袭细胞数,计算平均值。上述实验重复3次。
2 结果
2.1 RT-PCR
转染后48h,pcDNA3.1-STK15转染组扩增出498bp目的基因片段,而pcDNA3.1转染组未能扩增出片段(图1)。
2.2 STK15的蛋白表达
与转染空载体组相比,STK15转染组在48h后可检测到STK15蛋白表达的上调。(图2)
2.3 免疫细胞化学
蓝色为苏木素染色的细胞核,棕红色为DAB标记的STK15蛋白表达阳性区,表明STK15质粒转染组(图3.3)大部分STK15蛋白表达阳性,pcDNA3.1转染组(图3.2)和普通NIH3T3细胞(3.1)中,没有STK15蛋白表达(图3见彩插2)。
2.4 MTT检测
转染STK15质粒的NIH3T3细胞的生长增殖在48、72h显著高于对照组(P<0.05)。(图4)
2.5 Transwell结果
用平均穿膜细胞数标化成相对数后进行统计作图(图5)。STK15转染组的细胞穿膜细胞数为258.45±4.95,而NIH3T3细胞和pcDNA3.1转染组的细胞分别为20.50±4.65和21.00±5.56,,差异均有统计学意义(t分别 =276.00、38.47,P<0.05)。
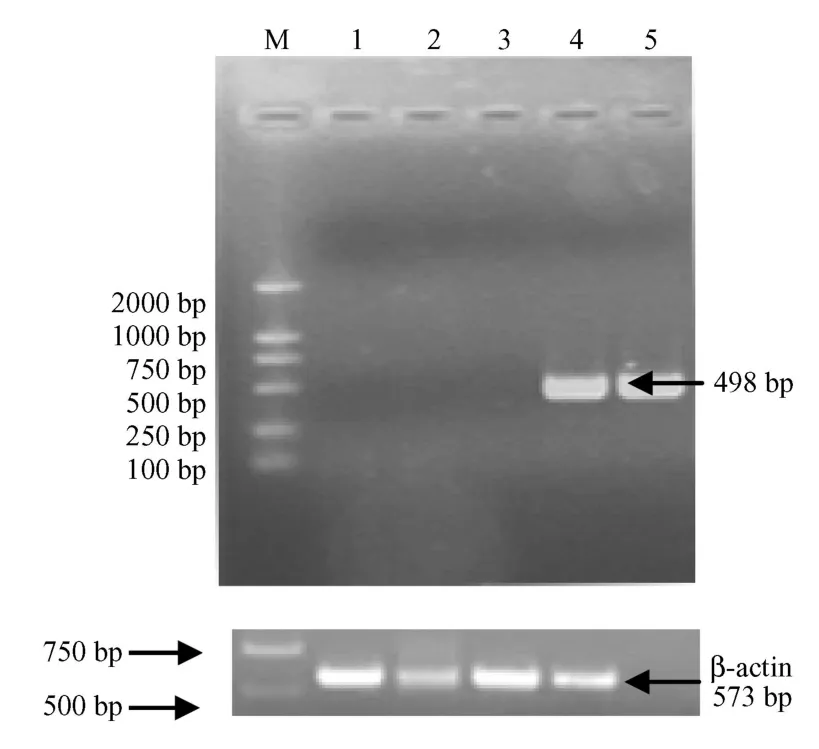
M:DL2000;1:阴性对照;2:N IH3T3细胞中STK15mRNA的表达;3:pcDNA3.1转染组STK15mRNA的表达;4:pcDNA3.1-STK15转染组 STK15mRNA的表达;5:阳性对照。图1 STK15mRNA在转染NIH3T3细胞中的表达M:DNA markerDL2000;1:Negative control;2:Product of STK15 in NIH3T3 cells;3:Product of STK15 transfected by pcDNA3.1;4:Product of STK15 in the cells transfected by pcDNA3.1-STK15;5:Positive control.Fig.1 Expression of STK15 mRNA in the pcDNA3.1-STK15-transfectN IH3T3 cells

1:NIH3T3细胞STK15蛋白的表达;2:pcDNA3.1转染组STK15蛋白的表达;3:pcDNA3.1-STK15转染组STK15蛋白的表达图2 Western blot检测STK15蛋白表达1:Product of STK15 of N IH3T3 cells;2:Product of STK15 of cells transfected by pcDNA3.1;3:Product of STK15 of cells transfected by pcDNA3.1-STK15;1:Product ofβ-actin ofN IH3T3 cells;2:Product ofβ-actin of cells transfected by pcDNA3.1;3:Product oβf-actin of cells transfected by pcDNA3.1-STK15Fig.2 The results of STK15 protein expression assayed byWestern blot
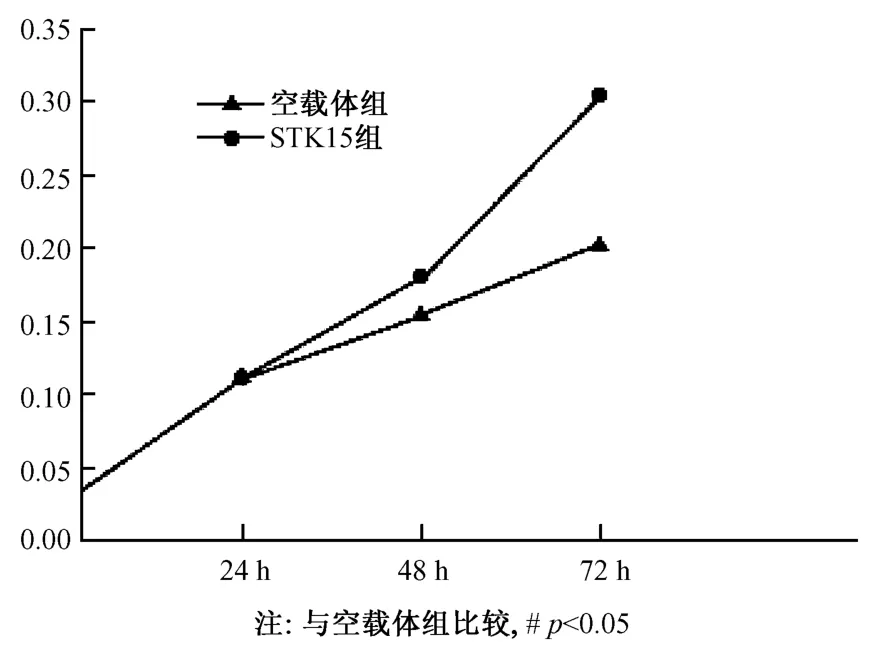
图4 两组细胞不同时间点的MTT检测情况Fig.4 MTT test results of the cells from two groups measured at different times
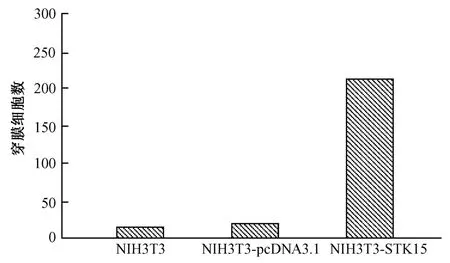
图5 体外跨室趋化运动实验中,质粒pcDNA3.1-STK15转染组与pcDNA3.1转染组及NI H3T3细胞比较Fig.5 Comparason of the results of Transwell test of the pcDNA3.1plas mid-transfected cellsandpcDNA3.1-STK15 plasmid transfected cells,and N I H3T3 cells.
3 讨论
近年来肿瘤研究发现,肿瘤与基因异常密切相关。STK15基因是有丝分裂器的基本调控蛋白,在中心体调节、纺锤体形成、染色体分离、胞质分裂,即有丝分裂的正常进行中发挥至关重要的作用。它的过表达可引起中心体扩增,染色体不稳定,非整倍体的形成而导致肿瘤的发生[4]。
本实验表明,体外转染pcDNA3.1-STK15质粒可以有效地使STK15在NIH3T3细胞中高表达,说明细胞转染成功,MTT结果表明转染pcDNA3.1-STK15质粒组的细胞增殖速率明显高于对照组(p<0.05)说明STK15基因可以使细胞的生长速度加快,进而形成细胞的恶性增殖,诱发肿瘤;Katayama等[5]发现抑制STK15的表达可致细胞分裂停滞于G2/M交界点附近,认为STK15可磷酸化p53蛋白,促进了Mdm2介导的p53蛋白泛素化及降解,减弱了p53介导的细胞有丝分裂监视点机制,促进细胞周期进程,使细胞的生长增殖加快;还有人发现在细胞G2/M转换与STK15磷酸化另一下游抑癌基因产物-BRCA1蛋白有关,认为对细胞G2/M转换同样是必需的[6];以上结论最终说明STK15基因的过表达使细胞增殖速度加快。
本实验采用Trans well小室检测STK15对细胞体外侵袭力的影响,癌细胞要穿透人工基底膜和直径只有8μm的聚碳酸酯微孔滤膜,需要降解Matrigel成分。而且穿透Matrigel膜涉及细胞的粘附、基质降解和移动3个过程,这与在人体内的浸润继而转移过程完全相似。实验结果表明,转染pcDNA3.1-STK15质粒组的细胞穿透Matrigel基底膜的细胞数明显高于对照组(P<0.05),而且质粒转染组表现出比对照组高20倍以上的跨膜运动能力,充分表现出了STK15的高表达可以提高NIH3T3细胞的转化能力和肿瘤化能力。综合以上两点,我们认为将STK15基因转染NIH3T3细胞提高了NIH3T3细胞的增殖速度和体外侵袭能力,这可能是形成肿瘤发病机制之一。
鉴于STK15基因与恶性肿瘤的关系如此密切,不少研究者已经将STK15基因作为研制抗肿瘤新药的靶子。各种能抑制STK15基因的扩增、表达及其生物学活性的物质已成为大家研究的焦点。Tong等[7]人将特异性抑制STK15基因表达的外源性siRNA体外瞬时转染人的食管癌细胞系,结果发现,在转染后48h和72h转染siRNA的人食管癌细胞的侵袭能力明显低于未转染的人食管癌细胞的侵袭能力。Hamada等[8]用STK15基因和STK15反义基因转染B细胞淋巴瘤细胞系,发现STK15反义基因转染的细胞系增殖率更低,并且停顿于G1期的细胞明显增多,此外抑制细胞增殖的程度与反义寡核苷酸的浓度成正比。随着研究的深入,STK15基因必将为恶性肿瘤的治疗提供新的有效手段,对今后癌症的早期诊断和早期治疗均具有重要的临床意义。
[1]ReichardtW,Jung V,Brunner C,et al.The putative serine/threoninekinasegeneSTK15onchromosome 20q13.2 is amplified in human gliomas[J].Oncol Rep,2003,10:1275-1279.
[2]Jeng Y M,Peng SY,Lin CY,et al.Overexpression and amplification of Aurora-A in hepatocellular carcinoma.[J].Clin Cancer Res,2004;15,10(6):2065-2071.
[3]Miyoshi Y,Iwao K,Egawa C,et al.Association of centrosomal kinaseSTK15/BTAK mRNA expressionwith chromosomal instability in human breast cancers[J].Int J Cancer,2001,92:370-373.
[4]叶燕,李福才,王淑云.喉癌中STK15基因扩增及表达的研究[J].中华医学遗传学杂志,2006,23(3):326-329.
[5]Katayama H,Sasai K,Kawai H,et al.Phosphorylation by aurora kinase A induces Mdm22mediated destabilization and inhibition of p53.Nat Genet,2004,36:55-262.
[6]Hannak E,Kirkham M,Hyman A,et al.Aurora A kinase is required for centrosome maturation in Caenorhabditis elegans[J].J CellBiol,2001,155:1109-21116.
[7]Tong T,Zhong Y,Kong J,et al.Overexpression of aurora-A contributes to malignant development of human esophageal squamous cell carcinoma[J]Clin Cancer Res,2004,10(21):7304-7310.
[8]Hamada M,Yakushijin Y,Ohisuka M,et al.Aurora/BTAK/STK15 is involved in cell cycle check point and cell survival of aggressive non-Hodgkin lymphoma[J].Br J Haematol,2003,121(3):439-447.

