清醒状态下电刺激大鼠上矢状窦模型后脑内Fos阳性神经元的分布
王晓琳,于生元,姜 磊,董 钊,王晓辉,周志斌
(中国人民解放军总医院神经内科,北京 100853)
偏头痛是一种临床上常见的慢性、复发性脑功能异常所致的原发性头痛。到目前为止,偏头痛的发病机制仍未完全阐明,主要有血管源性学说、三叉神经血管学说、皮层扩布性抑制学说等。针对不同机制建立的多种偏头痛实验动物模型已被广泛应用于偏头痛的发病机制、药物治疗、行为学观察等研究中。
硬脑膜是颅内主要的伤害性感受组织,在偏头痛的发病过程中起着重要的作用。硬脑膜神经源性刺激模型作为三叉神经血管反射学说所反映的病理生理过程的典型代表,特别是电刺激上矢状窦附近硬脑膜模型,目前被广泛运用于偏头痛的发病机制、药物治疗等方面的研究[1]。电刺激硬脑膜使得脑膜血管扩张加上扩张后释放炎症介质激活了分布于硬脑膜上的三叉神经终末感受器,伤害性信息沿三叉神经节、脊束核、丘脑传递至皮层,产生痛觉,同时激活的三叉神经脊束核逆向调节神经终末释放血管活性物质,进一步增强了伤害性信息,使疼痛在程度和时间上都有所增加[2]。然而,目前使用的该模型基本上是建立在动物麻醉基础上的,对给予刺激的幅度大小主要靠对动物实时心脏、血压、呼吸等方面的监测来反映[3]。
即使不考虑模型制备的复杂性,模型模拟的真实性上也存在明显的问题。因为偏头痛的患者不可能在麻醉的情况下发病,麻醉不但可以减轻疼痛的程度,也会减少剧烈疼痛可能引发的情感及自主神经系统反应。因此,我们实验室建立了一种清醒状态下电刺激上矢状窦硬脑膜观察动物行为学改变的偏头痛实验动物模型,并从动物行为学、血液流变、对吗啡的反应等方面进行了验证。为了进一步明确该模型在给予相应电刺激后脑内的激活情况我们设计了本实验。
1 材料和方法
1.1 实验动物分组
健康雄性SD大鼠30只,体重225~250g。随机分为实验组(电刺激)、对照组(假手术)和正常组(空白),每组各10只。实验组以台式牙钻颅骨钻洞暴露SSS后,安放电极并给予方波电流刺激2h;对照组除不给予电流刺激外所有操作同实验组;正常组在麻醉后直接处死。所有实验动物均由解放军总医院实验动物中心提供(雄性SD大鼠,SCXK(京)2006-0009)。
1.2 动物模型的建立
实验动物以10%水合氯醛(0.4mL/100g,解放军总医院)腹腔内注射麻醉后,剪掉头正中部毛发,固定于立体定位仪上。消毒并逐层切开皮肤、筋膜及骨膜以暴露颅骨。台式牙钻在颅骨上钻直径约1mm圆孔,取点方法为颅中线冠状缝交点前4mm后6mm,暴露上矢状窦硬脑膜。将金属电极的两极分别置于刺激孔的硬脑膜上,并用牙科水泥固定。75%酒精消毒切口及皮肤周围后缝合皮肤,将大鼠置于原环境中静养,期间给予抗生素喂食(阿莫西林胶囊,按30mg/kg与食物混合喂食,3/日),环境中保持安静,室温在25℃左右。大约4~5d后,对实验组大鼠给予电刺激。采用日本光电工业株式会社生产的刺激器(SEN-7103)和分离器(SS-102J)给予电刺激2h(Duration=50,Intervel=250)。实验结束后灌注固定动物。以上所有操作均保证无菌条件,严格按照实验动物伦理委员会关于动物实验相关要求进行。
1.3 灌注固定及染色
所有动物以致死量10%水合氯醛腹腔注射麻醉,插管至左心室,先以100mL生理盐水冲洗血液,再给予500mL含4%多聚甲醛的0.1mol/L磷酸缓冲液(PBS,pH 7.4)灌注固定。灌毕立即取脑,置于上述新鲜固定液中后固定4h,再移入含30%蔗糖的PBS中至组织块沉底(4℃)。将大鼠脑组织用恒温切片机作连续冠状切片,切片厚度25μm,切片隔2张取一张,分3套收集。
第1套切片行免疫组织化学染色,具体步骤:①切片放入小鼠抗Fos血清(1:500;Chemicon)室温下孵育18~24h;②生物素标记的二抗室温下孵育4h;③辣根过氧化酶标记得链霉卵白素室温下孵育30min;④二氨基联苯胺(DAB)中呈色,边反应边观察,待免疫阳性细胞呈棕色时以蒸馏水终止反应。上述抗体和复合物的稀释液均用含0.3%的Triton X-100和0.5%正常羊血清的PBS,各步骤间用PBS彻底清洗片子。最后将切片脱水透明封片并进行观察。
第2套切片用于正常小鼠血清的孵育,后续的反应过程同上,进行替代对照试验。第3套切片进行Nissl染色,用以对照观察和定位免疫组织化学染色的阳性结果。
2 结果
镜下切片背景为棕黄色,Fos免疫反应阳性神经元呈深棕黄色或深褐色,形状呈卵圆形或椭圆形,直径在5~8um之间,与以往报道相同[4]。
实验组Fos免疫反应阳性神经元在脑内分布较广泛,主要集中的高颈段脊髓后角、三叉神经脊束核尾侧亚核、中缝核簇、中脑导水管周围灰质、脚间核、下丘脑、丘脑等部位。其中,高颈段脊髓后角、三叉神经脊束核尾侧亚核、中缝核簇、中脑导水管周围灰质的数量较多,与以往研究报道类似[5]。而对照组的Fos免疫反应阳性神经元在形态上与实验组一致,但在分布位置和数量上存在明显差别:主要分布在中脑导水管周围,数量较实验组明显下降;在高颈段脊髓后角和三叉神经脊束核尾侧亚核仅有零散分布。空白组未发现Fos免疫反应阳性神经元。
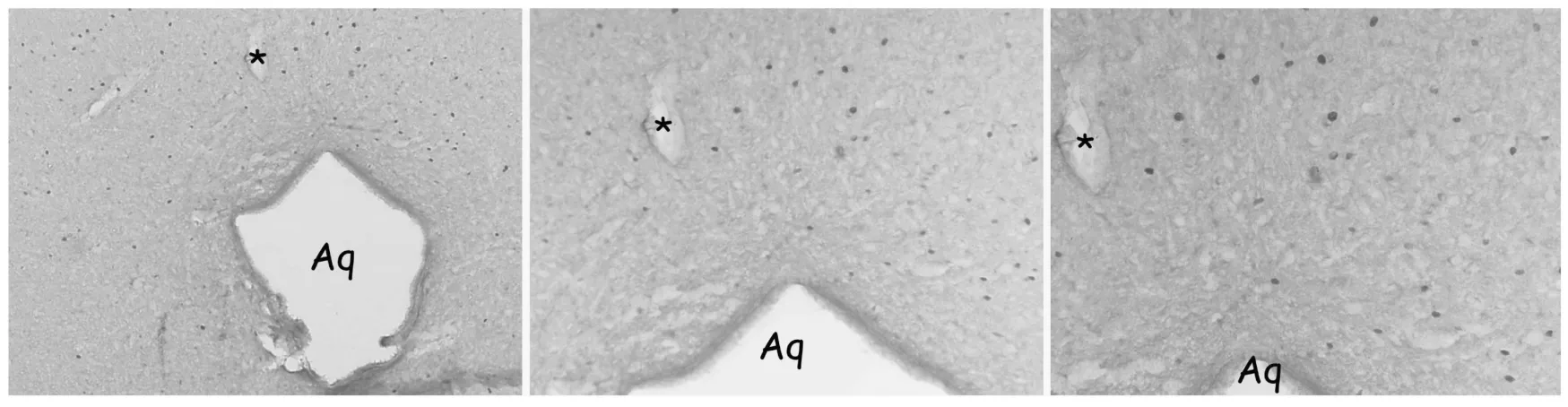
图1 fos阳性神经元中脑导水管Fig.1 fos-immunoreactive neurons in the aqueduct(Aq)
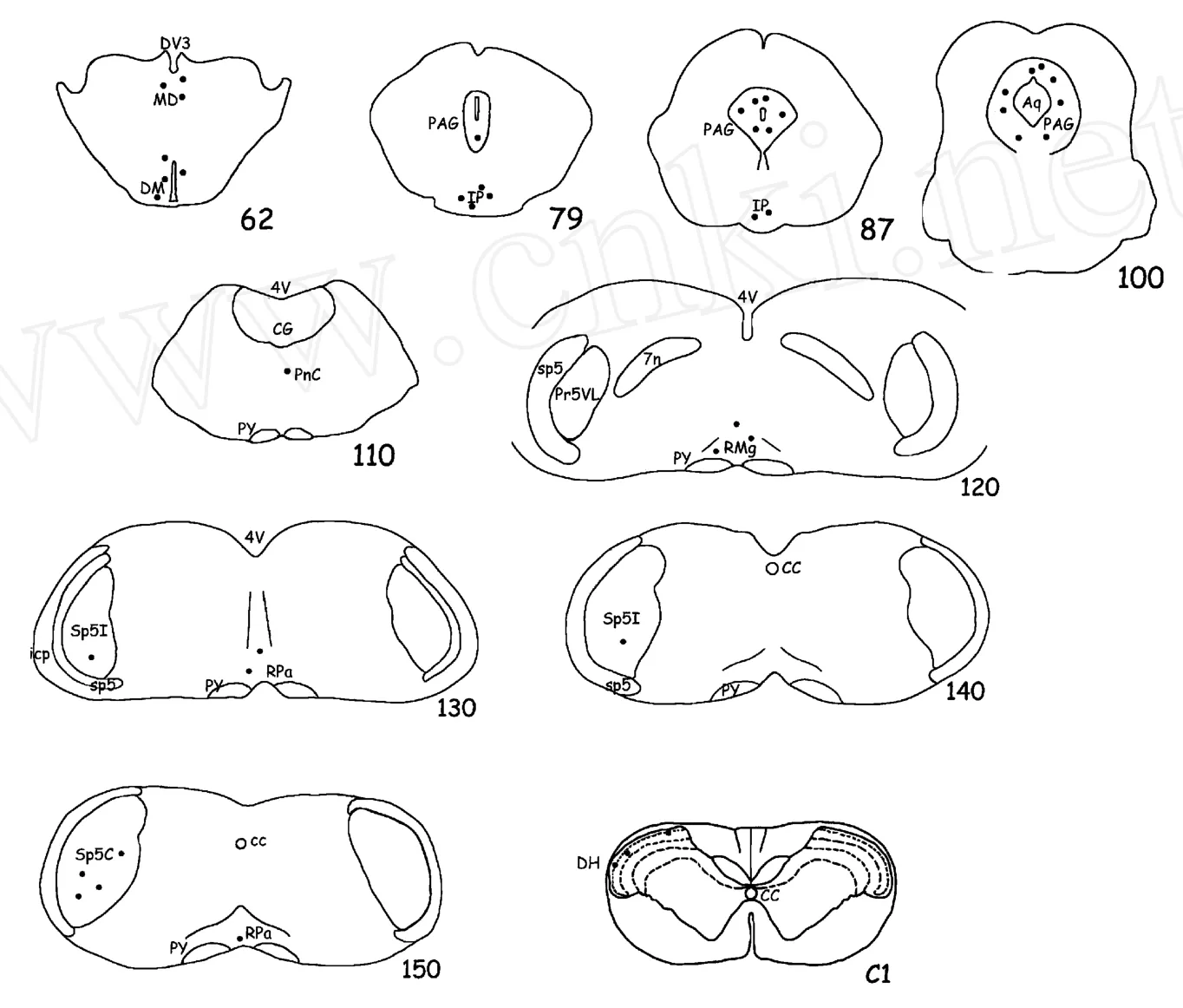
图2 fos表达部位的示意图(The rat brain 5th.Paxinos andWatson).Fig.2 Drew pictures showing the distribution of fos-immunoreactive neurons.Each black dot indicates 3 positive neurons.
3 讨论
即刻早期基因c-fos和它的转录产物Fos蛋白作为细胞功能活动状态的标志,常常被用于机能与形态相结合的实验研究[6]。当细胞受到刺激后,胞核内的c-fos基因mRNA转移至胞浆并翻译为Fos蛋白,对该蛋白进行免疫组织化学染色可以间接的反应机能相关的细胞在脑内的分布。但是这种方法的特异性较弱,Fos蛋白对刺激反应敏感,任何刺激(光、温度、机械或其他刺激)都可以引起表达。因此,在进行用Fos免疫组织化学染色时需要严格控制实验条件,尽量减少外界非特异性刺激,同时进行了对照实验,以保证结果的特异性[7]。
本实验的研究结果所呈现的Fos阳性神经元与既往研究一致。与麻醉状态下进行的中枢神经系统内Fos染色结果有差异[8],除了报道的高颈段脊髓后角、三叉神经脊束核尾侧亚核外和中脑导水管周围灰质外,尚有中缝核簇、脚间核、下丘脑和丘脑等部位也观察到了分布密集的Fos阳性神经元。
我们都知道疼痛的三级神经元传递机制:即被根节(三叉神经节)-脊髓后角(三叉神经脊束核尾侧亚核)-丘脑-皮层。作为疼痛初级中枢,脊髓后角、三叉神经脊束核尾侧亚核外和丘脑在有伤害性信息传递时细胞呈活跃状态是可以理解的[9]。由于头面部的感觉支配主要是由高颈段和三叉神经的分支,所以在电刺激硬脑膜所致的偏头痛模型中,高颈段脊髓后角、三叉神经脊束核尾侧亚核和丘脑出现Fos阳性神经元,从形态学角度说明该模型有效模拟了头面部的疼痛。
在中枢神经系统内存在对疼痛自行调节的两个下行系统:即内源性下行抑制系统和易化系统[10]。目前的研究认为两者均起源于PAG,并经由中缝核簇和蓝斑、蓝斑下核介导后分布在延髓和脊髓后角,完成其对伤害性信息的调控。在偏头痛的研究过程中,发现在人的PAG植入电极并加以刺激可以诱导出偏头痛样发作[11];由于血管性或炎性病变等破坏PAG可使原本没有头痛的病人罹患偏头痛样头痛[12];神经影像学检查提示偏头痛发作时PAG部位代谢活跃,血流增加,各种证据证明PAG在其发病和后续病理生理改变中担任了重要角色[13]。在本实验中,PAG和中缝核簇内分布了大量的Fos阳性细胞,说明在刺激后这些部位的神经元激活,符合上述研究结论,但激活后的功能尚需进一步的研究。
脚间核属于边缘系统,对其在功能上的认识曾有报道其参与疼痛、情绪等方面的调节,但具体还不是很清楚。下丘脑是一个非常重要的皮质下中枢,是自主神经系统的最高中枢,控制着机体血压、心率、呼吸、体温、胃肠道等,对维持机体内环境的稳定和平衡起着重要作用。同时,下丘脑还参与调控周期性情感,有研究认为下丘脑功能障碍是抑郁症发病的机制之一[14]。我们知道在偏头痛的发生过程中,一般伴随有恶心、呕吐、大汗、心慌等自主神经反应,并且慢性偏头痛的患者往往伴有抑郁、焦虑等负面情绪甚至病症,因此在治疗时推荐同时抗抑郁或焦虑治疗,而且复合治疗比单纯治疗的效果满意。本实验中得到的这一结果尚未见有类似报道,麻醉状态下的Fos表达并未涉及中脑以上部位,但是由于脚间核和下丘脑在自主神经控制、情感调节方面功能,所以该结果对偏头痛的研究是有意义的,可能参与了偏头痛发作时伴随症状的发生。
本实验对清醒状态下电刺激大鼠上矢状窦硬脑膜模型大鼠的脑内Fos蛋白表达进行了系统的研究,从结果来看激活脑区主要在高颈段脊髓后角、三叉神经脊束核尾侧亚核、中缝核簇、中脑导水管周围灰质、脚间核、丘脑和下丘脑等部位,从形态学角度评估了该模型,为进一步的功能及药物研究提供了基础。
[1]Benjamin L,Levy MJ,Lasalandra MP,et al.Hypothalamic activation after stimulation of the superior sagittal sinus in the cat:a Fos study[J].NeurobiolDis,2004,16:500-505.
[2]Welch K,Michael MD,Cutrer F,et al.Migraine pathogenesis:Neural and vascularmechanis ms[J].Neurology,2003,60:9-14.
[3]Goadsby PJ,Hoskin KL,Kinght YE.Substance P blockade with the potent and centrally acting antagonist GR205171 does not effect central trigeminal activity with superior sagittal sinus stimulation[J].Neuroscience,1998,86(1):337-343.
[4]王贺波,于生元,王卫东.刺激猫上矢状窦区硬脑膜诱发三叉神经脊束核尾侧段和上颈段后角c-fos蛋白的表达[J].中国疼痛医学杂志,2002,8(1):26-30.
[5]Karen L,Hoskin,David C.E.,Bulmer et al.Fos expression in the midbrain periaqueductal grey after trigeminovascular stimulation[J].J Anat,2001,198:29-35.
[6]宿长军,段丽,饶志仁,等.大鼠束缚后脑内Fos蛋白的表达[J].解剖学报,2005,36:123-126.
[7]刘俊华,赵正卿,雷辉,等.热应激对大鼠脑桥臂旁核Fos和GFAP表达的影响[J].神经解剖学杂志.2007,23(4):367-372.
[8]Hoskin KL,Bulmer DC,Goadsby PJ.Fos expression in the trigeminocervical complex of the cat after stimulation of the superior sagittal sinus is reduced byL-NAME[J].NeurosciLett,1999,266(3):173-176.
[9]Chen T,Dong YX,Li YQ.Fos expression in serotonergic neurons in therat brainstem following noxious stimuli:an immunohistochemical double-labelling study[J].J Anat,2003,203(6):579-588.
[10]PaceMC,Mazzariello L,PassavantiMB,et al.Neurobiology of pain[J].J Cell Physiol.2006,209(1):8-12.
[11]Raskin NH,Hosobuchi Y,Lamb S.Headache may arise from perturbation of brain[J].Headache,1987,27(8):416-420.
[12]HaasDC,Kent PF,Friedm8n D I.Headache caused by a single lesion of multiple sclerosis in the periaqueductal gray aera[J].Headache,1993,33:452-455.
[13]刘若卓,于生元.中脑导水管周围灰质在大鼠血管源性头痛模型中的作用[J].中华神经医学杂志,2005,4(7):672-676.
[14]Wang SS,KamphuisW,Huitinga I,et al.Gene expression analysis in the human hypothalamus in depression by laser microdissection and real-t ime PCR:the presence of multiple receptor imbalances[J].Mol Psychiatry,2008,13(8):786-799.

