组织相容性复合体在实验鸡中的应用
高彩霞,韩凌霞,韩建林
(1.中国农业科学院哈尔滨兽医研究所实验动物中心,哈尔滨 150001;
2.甘肃农业大学动物科学技术学院,兰州 730070; 3.中国农业科学院国家家畜研究所畜禽牧草遗传资源联合实验室,北京 100094)
专家论坛
组织相容性复合体在实验鸡中的应用
高彩霞1,2,韩凌霞1,韩建林3
(1.中国农业科学院哈尔滨兽医研究所实验动物中心,哈尔滨 150001;
2.甘肃农业大学动物科学技术学院,兰州 730070; 3.中国农业科学院国家家畜研究所畜禽牧草遗传资源联合实验室,北京 100094)
鸡主要组织相容性复合体(MHC)基因位于鸡 16号染色体上,具有高度的多态性。现已发现,不同MHC-B单倍体对各种疾病的抗性不同。本文主要介绍了鸡MHC的结构特点、鸡MHC与抗病性的关系、鸡MHC检测方法的研究进展以及其在鸡抗病育种中的应用前景。
鸡MHC;抗病育种;遗传质量控制
鸡作为实验动物最早可以追溯到 1789年Pasteur用鸡做鸡霍乱的研究,近年来为了应对越来越复杂的禽传染病研究,对实验动物鸡的质量要求也越来越高。而且作为实验动物,不允许进行疫苗免疫和使用抗生素,因此微生物质量的保证和敏感品系的建立只能通过遗传学选育的方式。鸡主要组织相容性复合体 (major histocompatibility complex, MHC)是目前发现的多态性最丰富的基因群,与各种疾病高度相关,是禽病免疫学研究和疾病防控技术研究的主要候选基因。例如美国 ADOL(The Avian Disease and OncologyLaboratory)根据MHC单倍体已经建立了多种近交系和同类系实验鸡群,为阐明包括多种肿瘤性疾病的致病机理和确定致瘤相关基因提供了不可代替的实验材料[1]。本文将对鸡MHC的结构特点、鸡MHC-B单倍体与疾病的抗病性关系及检测方法做一综述。
1 鸡M HC的结构特点
鸡MHC作为血型群基因座首先被发现,也称为复合体[2]。鸡 B血型基因座与基因控制组织相容性有关[3],它是由紧密连锁、高度多态的基因座位组成的一个遗传区域,与核仁组织区(NOR)相连锁,高度多态和保守。它包含 B基因座和 Rfp-Y基因座两个基因座,它们均被定位于 16号染色体上,但二者在遗传上不连锁。
B基因座主要包括三个高度多态的基因座:B-F (Class I)、B-L(Class II)和 B-G(Class IV),分别编码细胞表面的 I类、II类和 IV类抗原[4]。其中 I类和 II类与哺乳动物中相应染色体上的糖蛋白分子在结构、功能、组织分布和存在的 T淋巴细胞表面抗原等相似, IV类抗原是禽类所特有,在红细胞上和特定的间质细胞以及肠上皮细胞中有其表达产物。这 3个基因座虽然是高度多态的,但它们之间的重组率却较低[5]。B-F和 B-L基因同处 B-F/B-L亚区,鸡MHC的 B-F/B-L区结构简单、紧凑,在 92 kb的DNA中包含 19个基因,与 B-G亚区紧密连锁。从 Class IIβ基因延伸到 Class I基因的中心区域尤其紧凑,没有重复单位,此区域 11个基因的内含子长为 200 nt,基因间距 (不包括启动子)只有 30 nt,使得总长度约为 44 kb,大约只有哺乳动物同源物的 1/3,比人的MHC小 20倍 (图 1)[6]。
脊椎动物MHC基因中,Class II类基因分别由编码 Class II类抗原分子的α链、β链基因所组成,但鸡的 class IIα(B-LA)基因位于离 B基因座的 5 cM处[7],不在 MHC区域内,所以通常所说的鸡MHC II类基因一般指B-LB基因。根据序列相似性鸡B-LB基因分为 3个基因家族:B-LBII家族(包括B-LB I和 B-LB II基因)、B-LBIII家族 (包括 B-LBⅢ、Ⅳ、Ⅴ基因)和 B-LBⅥ基因[8]。三个家族的基因数目在鸡MHC每个单倍体中均有差异,有 1~3个 B-LB II基因,1~3个 Y-LB(BLB III)基因,没有或只有一个B-L B V I基因。
Rfp-Y基因座是第二个具有多态性且独立遗传的一组MHC基因,也包括多态的 I类基因、II类基因、C-型植物血凝素 (lectin)基因和其它基因座位[9,10]。
2 鸡M HC与抗病性的关系
MHC单倍体分型在鸡的抗病性研究中具有重要意义,已报道的有与鸡马立克氏病 (Marek’s disease,MD)、禽流感 (Avian influenza,A I)、劳氏肉瘤病 (Rous sarcoma,RS)、禽白血病 (Avian leukosis, AL)、传染性法氏囊病 (Infectious bursal disease, I
BD)、禽传染性支气管炎 (Infectious bronchitis, IB)、球虫病以及沙门氏菌 (Sa lm onella enteritidis,SE)和大肠杆菌 (E.coli)等细菌性疾病抗性的关系,见表1。
由表 1可看出,研究最多的单倍体包括B2、B5、B12、B13、B15、B19和 B21。抗病性较好的单倍体有B2、B12和B21,而抗性较差的有B5、B13、B15和B19,例如B5和B13对所研究的病毒均有明显的易感性,但对于多数单倍体来说,对不同疾病的抗性不同,如 B2对MD、 IBD和 RS有抗性,却易感ALV和球虫;B21对MD、A I、 IBD和球虫病抗性强,死亡率低,但对AL、 IB和大肠杆菌抗性弱;B12对AL和RS有抗性,却易感 IBDV;对病毒似乎有较广泛的易感性;B19对AL有抗性,却对MDV、 IBDV和球虫易感。当然,这些疾病的抗性一般都是由多基因控制,这些基因中既有B复合体,又有非MHC基因也可能起着重要的作用。
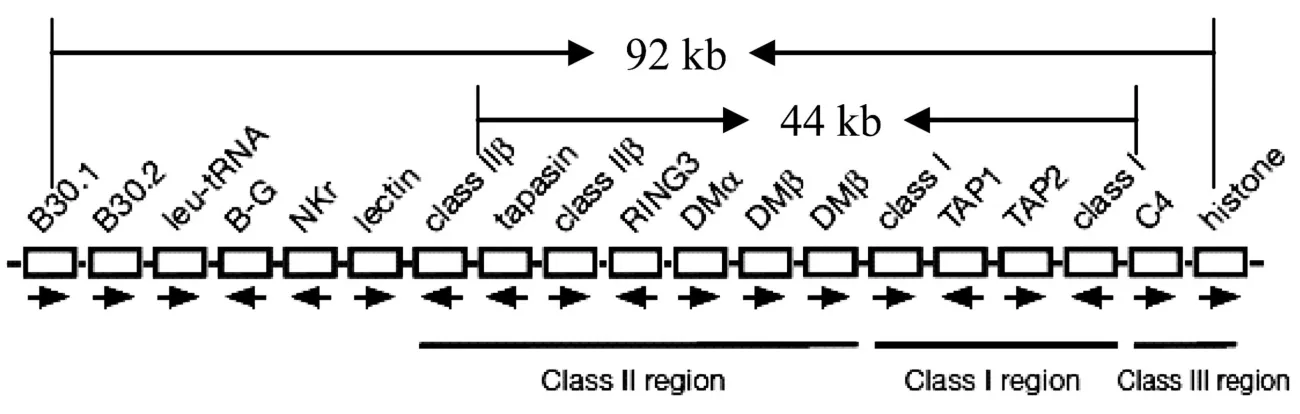
图 1 B12单倍体的B-F/B-L区的基因序列 (Kaufman,et al.1999)Fig.1 Gene sequences ofB-F/B-L region ofB12 haplotype
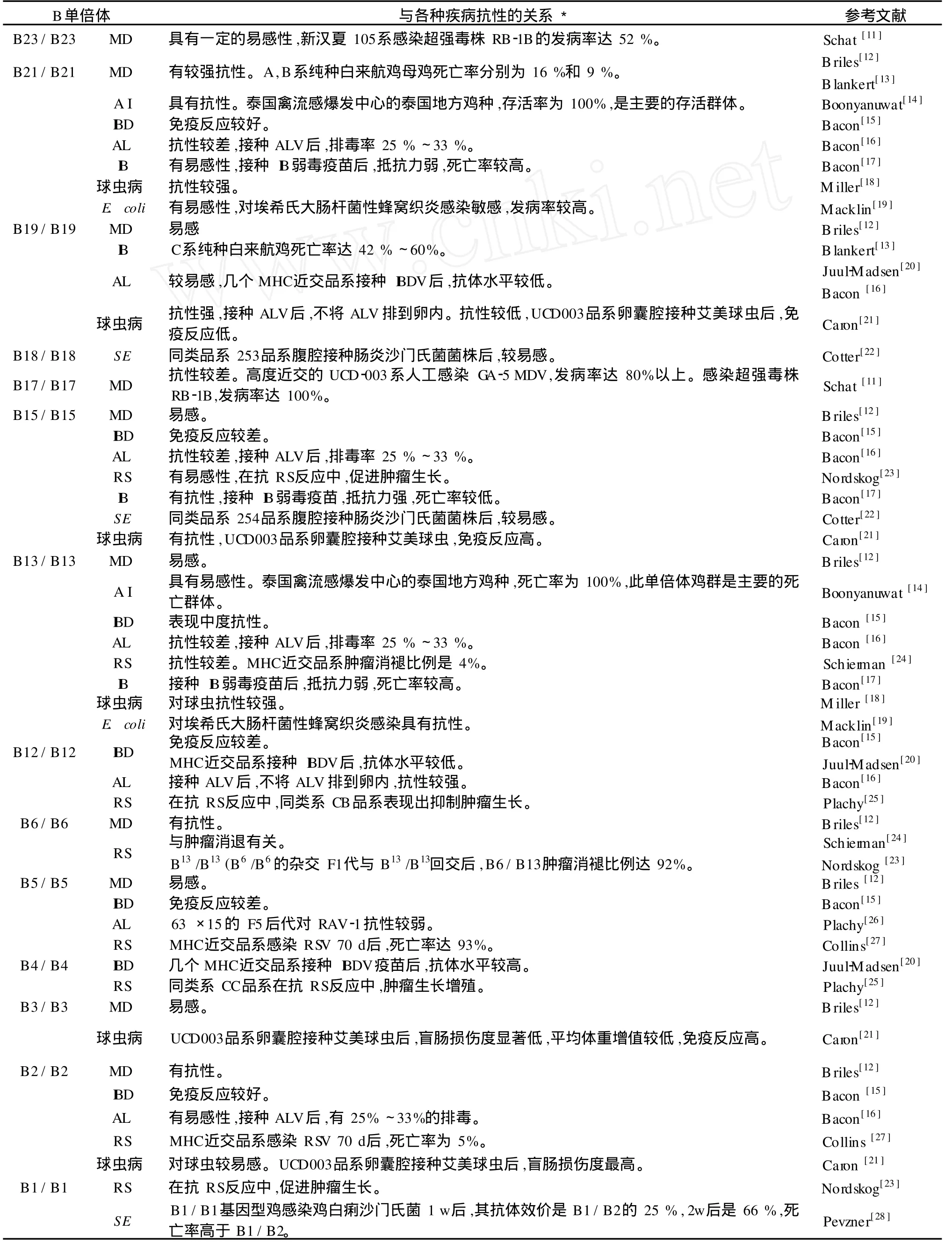
表1 鸡MHC-B单倍体与各种疾病抗性的关系Tab.1 The relation be tweenMHC-B haplotypes and disease resistance
3 实验鸡M HC检测方法的研究进展
实验动物的遗传质量对生命科学研究中动物实验结果的准确性、重复性及科学性有重要影响。我国实验动物遗传检测工作起步较晚,目前只有针对近交系小鼠和大鼠的生化标记位点国家检测标准,尚无实验禽类的遗传学检测标准。从上世纪八十年代开始,分子遗传学的理论和技术飞速发展,产生了一系列高新技术手段,应用较广泛的有:限制性片段长度多态性 (restriction fragment length polymorphis m,RFLP)、随机引物扩增多态性 DNA (random amplified polymorphis m DNA,RAPD)、扩增片段 长 度 多 态 性 (amplified fragmentlength polymorphis m,AFLP)、微卫星 DNA标记技术(microsatellite DNA,Ms DNA)和单核苷酸多态性(single nucleotide polymorphis m,SNP)等。
RFLP是最早研究并应用的分子标记之一。其基本原理是基因组DNA由于突变,增加或减少了某些限制性内切酶位点,在限制性内切酶作用下产生大小不等的 DNA片段。RFLP在各种生物的各类DNA中普遍存在,只要有探针就可以检测不同物种同源DNA分子的 RFLP;无表型效应,其检测不受环境、性别及年龄的影响;等位基因间呈共显性,非等位基因间无基因互作效应。但是,多数 RFLP突变率太低,位点信息含量较低,且费用昂贵,操作复杂,检测周期长,不适用于分析样本量较大的群体,还有一个主要的缺陷,就是克隆可表现基因组DNA多态性的探针较为困难。
RAPD是利用随机脱氧核苷酸序列引物扩增基因组DNA,扩增的不同DNA片段反映了基因组相应区域的 DNA多态性。RAPD扩增引物没有物种和数量上的限制,一套引物可用于不同物种基因组分析而且可以囊括基因组中所有位点,其技术简捷方便,可进行大量样品的筛选。但引物模板的非特异配对使 RAPD产物对 PCR反应条件非常敏感,稳定性、重复性和可比性较差,而且它作为显性标记,不能鉴别杂合子和纯合子。
AFLP是将基因组 DNA进行限制性内切酶酶切,然后选择特定的片段进行 PCR扩增,使用双链人工“接头”与基因组DNA的酶切片段相连接作为扩增反应模板,“接头”与“接头”相邻的酶切片段的几个碱基序列作为引物的结合位点。AFLP技术对基因组 DNA质量要求较高,操作成本也相对较高,且所得到的分子标记多为显性标记。
微卫星DNA是指以少数几个核苷酸(多为 1~6 bp)为单位构成核心序列,经多次串联重复形成的DNA片段,由两侧保守的侧翼序列定位于染色体上,核心序列重复数的差异形成微卫星的高度多态性。微卫星 DNA能够准确判定变异位点,敏感性高、样本需要量少、简便快速,但操作复杂;工作量大;判型主观性大,成本高。
SNP是生物体基因组中存在最广泛的一类变异,由碱基置换、插入或缺失等单碱基突变造成位点多态性,因此由点突变引起的 RFLP也属于 SNP。它们是所有基因组中可以检测到的最普遍的多态性,大多数的基因型变异可以导致表型发生变化。SNP遗传稳定,在基因组中的数目多,覆盖密度大,检测快速高效,但它与 RFLP一样,突变率太低,由于 SNP在任一特定位点上只有 2个等位基因,因此,与简单序列长度多态性相比,多态信息含量很有限。
4 展望
由于鸡MHC单倍体型与机体的免疫应答密切相关,且遗传稳定,是研究实验禽抗病性、与病原体相互作用机制极好的遗传标记,最终为禽病学研究和防制措施的建立提供依据。
[1] Bacon L D,Hunt H D,Cheng HH.A Review ofthe development of chicken linesto resolve genes determining resistance to diseases[J].Poult Sci,2000,79:1082-1093.
[2] Briles WE,McGibbon WH,Irwin MR.On multiple alleles effecting cellular antigens in the chicken[J].Genetics,1950, 35:633-652.
[3] Schierman LW,Nordskog AW.Relationship of blood type to histocompatibility in chickens[J].Science,1961,134:1008 -1009.
[4] Pink JRL,DroegeW,Hala K,et al.A three-locusmodel for the chicken major histocompatibility complex[J].I mmunogenetics, 1977,5:203-216.
[5] Yonash N , Kaiser M G,HelerE D, etal. Major histocompatibilitycomplex (MHC) related cDNA probes associated with antibody response in meat-type chickens[J]. Anim Genet,1999,30(2):92-101
[6] Kaufman J,Milne S,Gobel T W,et al.The chicken B locus is a minimal essential major histocompatibility complex[J].Nature, 1999,401:923-925.
[7] Kaufman J,BumsteadN,MillerM,et al.The chicken class IIa gene is located outside of the B complex. In:Davison TF,Bumstead N,Kaiser P(eds)Advances in Avian Immunology Research.Carfax,Abingdon,pp 119-127.
[8] Zoorob R,Bernot A,Renoir DM,et al. Chicken major histocompatibility complex class I IB genes:analysis of interallelic and interlocus sequence variance[J].Eur J Immunol,1993,23 (5):1139-1145.
[9] MillerMM,Goto R,BemotA,et al.TwoMHC Class I and two Mhc class II genesmap to the chicken Rfp-Y system outside the B-complex[J].Proc Nad Acad Sci,1994,91:4397-4401.
[10] Miller MM,Bacon LD,Hala K,et al.Nomenclature for the chicken major histocompatibility(B and Y) complex[J]. I mmunogenetics,2004,56(4):261-279.
[11] Schat KA,Taylor RL,Briles WE.Resistance to Marek’s disease in chickens with recombinant haplotypes of the major histocompatibility(B)complex[J].Poult Sci,1994,73(4): 502-508.
[12] BrilesWE,BrilesRW,McGibbonWH,et al.Identification ofB alloalleles association with resistance to Marek’s disease. In: Resistance and Immunity to Marek’s Disease,edited by Biggs PB.Luxembourg:Commission of the European Communities, Directorate General Scientific and Technical Information,1980, 395-413.
[13] Blankert JJ,Albers GAA,Briles WE,et al.The effect of serologically defined major histocompatibility complex haplotypes on Marek’s disease resistance in commercially bred white Leghorn chickens[J].Avian Dis,1990,34(4):818-823.
[14] Boonyanuwat K, ThummabutraS, Sookmanee N, etal. Influences of major histocompatibility complex class I haplotypes on avian influenza virus disease traits in Thai indigenous chickens [J].Animal Sci,2006,77:285-289.
[15] Bacon LD.Influence of the major histocompatibility complex on disease resistance and productivity[J].Poult Sci,1987,66:802 -811.
[16] Bacon LD,W itter RL,Crittenden LB,et al.B haplotype influence on MD,Rous sarcoma,and lymphoid leukosis virusinduced tumors in chickens[J].Poult Sci,1981,60(6):1132 -1139.
[17] Bacon LD,Hunter DB,Zhang HM.Retrospective evidence that the MHC(B haplotype)of chickens influences genetic resistance to attenuated infectious bronchitis vaccine strains in chickens [J].Avian Pathol,2004,33(6):605-609.
[18] Miller TK,Bowman DD,Schat KA.Inhibition of the in vitro development of Eimeria tenella in chick kidney cells by immune chicken splenocytes[J].Avian Dis,1994,38(3):418-427.
[19] Macklin KS,Ewald SJ,Norton RA.Major histocompatibility complex effect on cellulitis among different chicken lines[J]. Avian Pathol,2002,31(4):371-376.
[20] Juul-Madsen HR,Nielsen OL,Krogh-Maibom T,et al.Major histocompatibility complex-linked immune response of young chickens vaccinated with an attenuated live infectious bursal disease virus vaccine followed by an infection[J].Poult Sci, 2002,81,(5):649-656.
[21] Caron LA,AbplanalpH, Taylor RL,et al. Resistance, susceptibility, and immunity to Eimeria tenella in major histocompatibility(B)complex congenic lines[J].Poult Sci, 1997,76:677-682.
[22] Cotter PF,Taylor Jr RL,Abplanalp H.B complex associated immunity to Salmonella enteritidis challenge in congenic chicken [J].Poult Sci,1998,77(12):1846-1851.
[23] Nordskog AW,Gebriel G M.Genetic aspects of Rous sarcomainduced tumor expression in chickens[J].Poult Sci,1983,62: 725-732.
[24] Schier man LW, CollinsWM. Influence of the major histocompatibility complex on tumour regression and immunity in chickens[J].Poult Sci,1987,66:812-818.
[25] Plachy J.Hierarchy of the B (MHC)haplotypes controlling resistance to Rous sarcomas in a modelof inbred linesof chickens [J].Folia Biol,1984,30:412-425.
[26] Plachy J,Chausse AM,Thoraval P,et al.Molecular genotyping of recombinant congenic lines provides evidence for crossing-over within the B-G region of the major histocompatibility complex of the chicken[J]. Immunogenetics,1992,36(4):270-273.
[27] Collins WM,Briles WE,Zsigray RM,et al.The B locus (MHC) in the chicken:Association with the fate of RSV-induced tumors[J].I mmunogenetics,1977,5(1):333-343.
[28] Pevzner IV,NordskogAW,KaeberleML. Immune response and the B blood group locus in chickens[J].Genetics,1975,80: 753-759.
Application ofMajor Histocompatibility Complex in Laboratory Chickens
GAO Cai-xia1,2,HAN Ling-xia1,HAN Jian-lin3
(1.LaboratoryAn imal Center of Harbin Veterinary Research Institute,CAAS,Harbin 150001,China; 2.College ofAnimal Science and Technology of Gansu AgriculturalUniversity,Lanzhou 730070; 3.CAAS- ILR IJointLaboratory ofLivestock and Forage Genetic Resources,Institute of Animal Science,Chinese Academy ofAgricultural Sciences,Beijing 100094)
Chicken major histocompatibility complex(MHC)has been a research focus for its high polymorphism and close relation with varying resistance against diseases.It is located on a microchromosome(chromosome 16).It has been found that it has different resistance against diseases for different B haplotypes. The article gives a detailed introduction about structural characteristics,relation to diseases resistance,the progress in detection methods of chicken MHC,and the prospect of application ofMHC in molecular breeding for disease resistance in chickens.
ChickenMHC;Breeding,disease resistance;Genetic quality control
R-33
A
1671-7856(2010)02-0001-05
2009-11-15
高彩霞(1982-),女,甘肃农业大学在读博士。E-mail:gaocx78@163.com。
韩凌霞,副研究员。E-mail:hlx1993@126.com;韩建林,研究员。E-mail:hanjl@iascaas.net.cn。
本文由《中国比较医学杂志》副主编曲连东研究员推荐

