苯并[a]芘对小鼠肝脏和肾脏中丙二醛和过氧化氢酶的影响
胡梦林,石 勇,金明华,刘晓梅,杜海英,刘 颖,孙志伟
(吉林大学公共卫生学院,长春 130021)
苯并[a]芘(benzo[a]pyrene,B(a)P)是第一个被发现的环境致癌物,属多环芳烃类,致癌性强,可诱发多种实验动物发生肿瘤。流行病学研究提示B(a)p与人类肺癌的发生有关,已被世界卫生组织所属的国际癌症研究机构(IARC)列为第二类A组人类致癌物[1]。广泛的存在于煤焦油、烟囱、燃烧烟草的烟雾和内燃机尾气及烹饪的油烟和熏炸的食物等。苯并[a]芘为前致癌物,进入人体内后通过细胞色素P450类酶氧化成活性氧物质[2],进而引发机体产生自由基、氧化应激及干扰细胞第二信号传导系统正常运行等相关[3-6]。生物体内不仅有自由基产生体系,还有清除自由基的抗氧化系统,其中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶是抗氧化系统中的酶促系统的三种重要保护酶,这些抗氧化酶能清除机体内的活性氧,有利于维持体内活性氧产物和淬灭的动态平衡,
从而抑制脂质过氧化的进程。本实验以丙二醛(MDA)作为脂质过氧化物的指标,过氧化氢酶(CAT)作为酶性抗氧化能力的指标,通过测定染毒小鼠肝脏和肾脏的丙二醛(MDA)和过氧化氢酶的含量,探讨苯并[a]芘对机体脂质过氧化和抗氧化能力的影响。
1 材料和方法
1.1 主要试剂与仪器
苯并[a]芘,德国Merck公司;考马斯亮兰G250,中国民药(集团)上海化学试剂公司;30%过氧化氢,北京化工厂;钼酸铵,沈阳市试剂一厂;硫代巴比妥酸,上海试剂二厂;1.1.3.3-四乙氧基丙烷,沈阳市试剂一厂;低温离心机(MTX-150),日本TOMY;721分光光度计,上海第三分析仪器厂;电热三用水箱,北京医疗设备厂。
1.2 动物与分组
实验动物由吉林大学实验动物中心提供的健康ICR雄性小鼠,体重23±2g,按照随机分组原则,将小鼠分成4组,分别为玉米油溶剂对照组,5、10、20mg/kgB(a)P组,每组6只小鼠。动物合格证号:SCXK-(吉)2003-0001。
1.3 染毒方法
小鼠在灌胃前后禁食水3h,对照组给予玉米油。3个实验组分别给以玉米油为溶剂B(a)P5、10、20mg/kg的剂量口腔灌胃给药,连续给药3d后将小鼠断头处死,迅速取出肝、肾组织剔除脂肪称重,然后置于冰浴中,加冰冷的pH7.4的缓冲液于玻璃匀浆器中进行匀浆。肝、肾匀浆比均为1:10。在4℃离心,肾10 000r/min,10min。肝3 000r/min,10min。上清液置4℃冰箱备用。
1.4 蛋白含量测定
取上清液用考马斯亮兰法测定蛋白质含量。取10μL上清液加入0.99mL的pH 7.4磷酸盐缓冲液,加入3mL考马斯亮兰溶液,混匀,在波长595nm波长下测定A595nm值。
1.5 TBA比色法检测MDA[7]
取组织匀浆上清液0.4mL,以同样体积的标准应用液(10μmol/mL四乙基丙烷的甲醇溶液)作空白对照,向上述各管中加入20%的三氯醋酸(TCA)2.5mL,混匀,加入1%TBA 1.0mL混匀,沸水浴30min后流水冷却至室温,加入正丁醇4.0mL,振荡或颠倒混匀数次。5 000r/min离心10min,吸取上清液于535nm比色,丙二醛的浓度=(f/F)×10nmol/mL,F:由标准液测得的光密度。f:由样品溶液测得的光密度。10nmol/mL:标准应用液浓度。
1.6 钼酸铵比色法测定CAT含量[8]
取样品各10μL,每一样品都设空白管1(B1)和测定管(U)。将基质液37℃水浴预温5min。于空白管2(B2):加1.0mL基质液,1.0mL钼酸铵与上清液相同体积的pH 7.4的缓冲液。空白管B1加1.0mL基质液,1.0mL钼酸铵与组织的上清液,测定管U:加上清液,1.0mL基质液,37℃水浴准确保温60s(以秒表计时),立即加入1mL钼酸铵,摇匀。放置10min后,721分光光度计测定吸光度(λ=405nm;0.5cm比色杯;蒸馏水调零)。
CAT活性(kU/L)=(AB1-AU)×65×1000×1/(0.2×1000×AB2)式中65:H2O2浓度;分子1000=1升样品;分母1000=换算为千国际单位kU;0.2:样品测定时用量
1.7 统计学方法
2 结果
2.1 B(a)P对小鼠肝脏和肾脏MDA含量的影响
随着染毒剂量的增加,肝中各剂量染毒组的MDA含量均有所增加其中5mg/kg、10mg/kg剂量组与油剂对照组比较差异有显著性(P<0.05);肾脏中各剂量染毒组的MDA含量均有所增加,其中10mg/kg剂量组与对照组比较差异有显著性(P<0.05)。见表1。
2.2 B(a)P对小鼠肝脏和肾脏CAT含量的影响
随着染毒剂量的增加,肝脏中各剂量染毒组的CAT的含量在5mg/kg剂量组时有所增加,但在10、20mg/kg剂量组CAT的含量与对照组比较有所降低,肾脏中的CAT含量,各染毒剂量组均高于对照组,但与对照组比较均无显著性差异(表2)。
表1 苯并(a)芘对小鼠肝脏和肾脏MDA含量的影响Tab.1 The effect of B(a)Pon MDA in the mouse liver and kidney(nmol/mg)(±s)
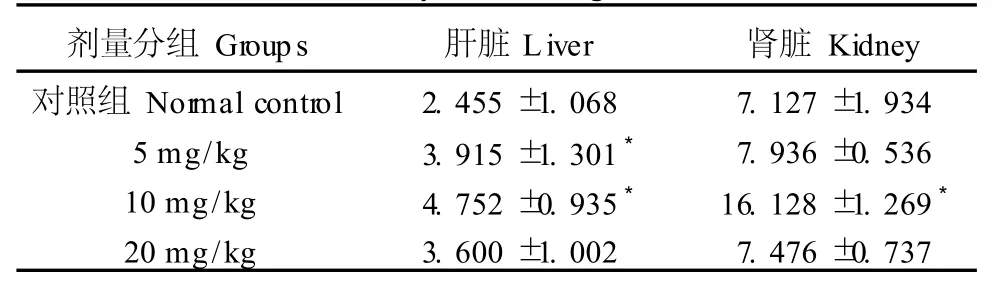
表1 苯并(a)芘对小鼠肝脏和肾脏MDA含量的影响Tab.1 The effect of B(a)Pon MDA in the mouse liver and kidney(nmol/mg)(±s)
与对照组比较P<0.05 Note:vs.the nor malk control group
剂量分组Groups 肝脏Liver 肾脏Kidney对照组 Normal control 2.455±1.068 7.127±1.934 5mg/kg 3.915±1.301* 7.936±0.536 10mg/kg 4.752±0.935* 16.128±1.269*20mg/kg 3.600±1.002 7.476±0.737
表2 苯并(a)芘对小鼠肝脏和肾脏CAT含量的影响Tab.2 The effect of B(a)P on CAT in the mouse liver and kidney(kU/g)(±s)
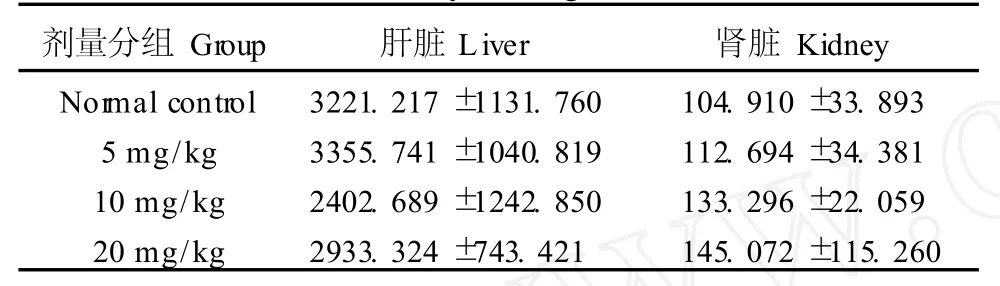
表2 苯并(a)芘对小鼠肝脏和肾脏CAT含量的影响Tab.2 The effect of B(a)P on CAT in the mouse liver and kidney(kU/g)(±s)
剂量分组Group 肝脏Liver 肾脏Kidney Normal control 3221.217±1131.760 104.910±33.893 5mg/kg 3355.741±1040.819 112.694±34.381 10mg/kg 2402.689±1242.850 133.296±22.059 20mg/kg 2933.324±743.421 145.072±115.260
3 讨论
B(a)P进入人体内后通过细胞色素P450类酶氧化成活性氧物质,引发机体产生自由基。自由基在发挥损伤过程中,首先攻击组织的细胞膜、线粒体、溶体酶和内质网等膜性结构中的多聚不饱和脂肪酸,发生脂质过氧化反应。
脂质过氧化反应指多价不饱和脂肪酸(PUBA)双键上一系列链锁式自由基反应,是机体通过酶系统与非酶系统而产生的氧自由基攻击生物膜中的多不饱和脂肪酸而形成脂质过氧化物,如醛基(丙二醛)、酮基、羟基、羰基、氢过氧基、一氧化氮(NO)或内过氧基甚至新的氧自由基等。脂质过氧化作用一方面将活性氧转化成活性化学剂,即非自由基性的脂类分解产物,而且通过链式或链式支链反应,起到放大活性氧的作用,从而导致很多脂类分解产物的形成,这些分解产物中,一些是无害的,另一些则能引起细胞的代谢与功能障碍,甚至死亡。氧自由基不但通过生物膜中PUFA的过氧化引起细胞损伤,而且还能通过脂氢过氧化物的分解产物引起细胞损伤,因而测定MDA的量常常可反映机体内脂质过氧化的程度,从而间接反映细胞损伤程度[9,10]。
SOD、CAT和GSH-PX是机体内清除自由基的特异酶类,其活性的降低表明机体内自由基产生的增加。正常机体存在着一套健全的抗氧化系统,其中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)及过氧化氢酶(CAT)起着重要的作用。它们在体内具有清除有害过氧化物,减轻和阻断脂质过氧化链锁反应等作用,从而保护生物膜功能完整的重要作用。当自由基增加到一定程度时,清除自由基的特异酶类如SOD、GSH-PX、CAT等的活性就降低,机体清除自由基的能力下降,造成自由基在体内堆积,脂质过氧化产物如MDA等增加,最终导致机体的脂质过氧化而致损伤。
肝脏是多环芳烃类化学物进行生物转化的重要器官,也是受其有害作用的重要靶器官。B(a)P可以引起肝脏肿瘤,并导致细胞癌基因的突变和抑癌基因的突变以及DNA链断裂损伤等[11-13]。大量的实验研究表明:多环芳烃类化合物经代谢活化成含氧自由基产物是致癌和致突变机制重要的途径,也是导致机体肝脏损伤的途径之一[14]。肾脏是内毒素和外来化合物的主要排泄器官,因其血流量大且肾髓质有浓缩功能,使肾脏易受很多毒物的影响。MDA是目前公认能反映氧自由基产生及引发的脂质过氧化反应的间接指标,其含量变化不但可以反映氧自由基生成的量及氧化反应强烈程度,还可反映其对组织损伤的严重程度。H2O2虽不是自由基,但它属于活性氧类,有高反应性,可促进自由基的生成,引发生物膜的脂质过氧化反应,导致细胞的坏死和凋亡[15]。一般情况下,生物体内的过氧化氢常被酶系统所清除,如过氧化氢酶和谷胱甘肽过氧化物酶。
实验结果表明:随染毒剂量增加小鼠肝脏中MDA的含量增加,其中5mg/kg、10mg/kg剂量组与油剂对照组比较有显著性差异。肾脏中各剂量染毒组的MDA含量均有所增加。MDA是脂质过氧化的产物,其生成的增加表明脂质过氧化作用的增强。肝、肾组织MDA含量都高于油剂对照组,并且在肝脏组织中二者有显著性差异(P<0.05),说明B(a)P对这两种组织都造成脂质过氧化作用,并且在肝脏组织中脂质过氧化作用比较明显.。这可能与肝是哺乳动物体内最主要的解毒器官有关。
随着染毒剂量增加小鼠肝脏中CAT的含量低剂量增加高剂量减少,考虑机体对外来化合物的应激性代偿反应,使酶活力升高。但因其本身也可捕捉有机自由基而引起失代偿。因此,在高染毒剂量时作为解毒主要器官的肝内的CAT含量减少,抗氧化能力下降。
本研究发现:一定剂量的苯并[a]芘可引起小鼠的肝、肾脂质过氧化损伤,其具体机制有待于进一步的研究。
[1]Winston GW,DiGuilio RT.Prooxidant and antioxidant mechanis ms in aquaticorganis ms[J].Toxicology,1991,19:137-161.
[2]张宝旭.外源化学物的生物转运和生物转化.见:周宗灿.毒理学基础(第2版)[M].北京:北京医科大学出版社,2000.24-45.
[3]Heidel S M,Mac W illiams PS,Baird WM,et al.Cytochrome P450 1B1 mediates induction of bone marrow cytotoxicity and preleukemia cells in mice treated with 7,12-dimethylbenz[a]anthracene[J].Cancer Res,2000,60:3454-3460.
[4]Mann KK,Doerre S,SchlezingerJJ,et al.The role ofNF-kappa B as a survival factor in environmental chemical-induced pre-B cell apoptosis[J].Mol Pharmacol,2001,59:302-309.
[5]Burchiel S,Luster M I.Signaling by environmental polycyclic aromatic hydrocarbons in human lymphocytes[J].J Toxicol Environ Health,2001,98:2-10.
[6]庞战军.周玫.陈瑷.自由基医学研究方法[M].人民卫生出版社,2000.6(1):62-64.
[7]Halliwell B.Chloroplast metabolis m:the structure and function of chloroplasts in green leaf cells[M].Oxford:Clarendon Press,1984,180-202.
[8]ManjanathaMG,Li EE,Fu PP,et al.Rasmutationalprofiles in chemically induced liver tumors from B6C3F1 and CD-1 mice[J].J Toxicol Environ Health,1996,47:195-208.
[9]Wirnitzer U,Topfer R,Rosenbruch M.Altered p53 expression in early stages of chemically induced rodent hepatocarcinogenesis[J].Toxicol Pathol,1998,26:636-645.
[10]程鲁京.孟泽.钼酸铵显色法测定血清过氧化氢酶[J].临床医学杂志,1994,12(1):25-27.
[11]Slater TF.Free radical mechanismsin tissue injury[J].Biochem,1984,222(1):1-15.
[12]Vaghef H,W isen AC,Hellman B.Demonstration of benzo(a)pyrene induced DNA damage in mice by alkaline:single cell gel electrophoresis:evidence for strand breaks in liver but not in lymphocytes and bone marrow[J].Phar macol Toxicol,1996,78(1):37-43
[13]Lee SK,Lee BM.Oxidation of erythrocyte protein and lipid.and hemolysis in rabbit red blood cells treated with benzo[a]pyrene or adriamycin[J].J Toxicol Environ Health,1997,51:557-569.
[14]Baek S M.Kwon CH.Kim JH,et al.Differential roles of hydrogen peroxide and hydroxyl radical in cisplatin-induced cell death in renal proximal tubular epithelial cells[J].J Lab Clin Med,2003,142(3):178-186.
[15]张梦寒,徐幸莲,周光宏.肌肽对脂质的抗氧化作用[J].食品科学,2002,23(7):52-54.

