基因打靶定点突变秦川牛MSTN基因
刘永刚,华松,兰杰,宋永利,何玉龙,权富生,张涌
西北农林科技大学动物医学院 农业部动物生理生殖和胚胎工程重点实验室,杨凌 712100
基因打靶定点突变秦川牛MSTN基因
刘永刚,华松,兰杰,宋永利,何玉龙,权富生,张涌
西北农林科技大学动物医学院 农业部动物生理生殖和胚胎工程重点实验室,杨凌 712100
Myostatin (MSTN,肌肉生长抑制素) 基因属于TGF-β超家族,对骨骼肌的生长发育具有负调控作用。该基因的功能缺失,能够引起肉用动物的“双肌”表型,从而提高产肉率。基因打靶技术是制作转基因动物的常用方法。构建了两个置换型打靶载体pA2T-Mstn4.0和pA2T-Mstn3.2,通过同源重组将G938A突变点引入秦川牛MSTN基因第三外显子。电穿孔方法转染秦川牛胎儿成纤维细胞,经过600 µg/mL G418和50 nmol/L GCV的药物正负筛选,共得到170个药物抗性细胞克隆。对细胞克隆进行PCR、测序及Southern blotting 鉴定,结果显示,第58号细胞克隆为发生了正确同源重组的中靶细胞。牛胎儿成纤维细胞中的MSTN基因的一条等位基因被成功改造。
肌肉生长抑制素,基因打靶,定点突变,成纤维细胞,秦川牛
秦川牛是中国著名的肉牛品种。提高产肉率是秦川牛良种选育工作的主要目标之一。常规的选育方法存在费时、费力的缺陷。本研究通过基因打靶技术,在秦川牛MSTN基因第三外显子引入G938A点突变,改变该基因的生物学功能,并建立携带G938A突变点的秦川牛胎儿成纤维细胞株,为核移植方法批量生产“双肌”秦川牛提供供体细胞,并为肉牛品种改良建立一套快速、有效的方法。
1 材料和方法
1.1 材料
40日龄的秦川牛胎儿由杨凌科元克隆股份有限公司提供。质粒 pA2T打靶骨架载体由本实验室保存。LA Taq酶、T4 DNA连接酶购自TaKaRa公司。DNA凝胶回收试剂盒购自杭州博日公司。各种限制性内切酶购自MBI公司。细胞培养相关试剂,包括DMEM/F12(GIBCO)、胎牛血清 (GIBCO)、L-谷氨酰胺、丙酮酸钠、非必需氨基酸、碱性成纤维细胞生长因子(GIBCO)、G418(GIBCO)、GCV(InvivoGen)。Southern 杂交Ⅱ型试剂盒 (Roche)。细胞基因组提取试剂盒购自天根公司。引物合成、基因测序工作及定点突变均由南京金斯瑞生物科技有限公司完成。电转染仪ECM 2001购自BTX公司。
1.2 方法
1.2.1 打靶载体的构建
利用本实验室保存的通用型打靶载体 pA2T作为骨架载体。采取秦川牛血液,提取基因组并以此为模板,用 LA Taq酶扩增同源臂。根据GenBank中公布的牛MSTN序列 (Accession No. AF320998)设计同源臂引物。同源长臂分别利用2对不同的引物 (C1s/C1a和C2s/C2a) 进行扩增,得到2条不同的同源长臂,以引物Ds/Da扩增同源短臂。将PCR产物进行电泳鉴定,再通过PCR方法在长臂的上游和下游分别引入酶切位点Sgs I和Bsp1407 I;在短臂的上游和下游分别引入酶切位点Cla I和Spe I。将同源臂进行TA克隆后,送公司测序,同时在短臂上完成G938A的定点突变。同源臂完成测后,用Sgs I和Bsp1407 I双酶切长臂TA克隆,再以Spe I和Cla I双酶切短臂TA克隆,回收同源臂,再用相同的酶分别双酶切 pA2T之后与同源臂连接,构建完成pA2T-Mstn4.0和pA2T-Mstn3.2打靶载体 (图1)。经过Sac II线性化之后,电转染牛胎儿成纤维细胞。
1.2.2 原代牛胎儿成纤维细胞的分离培养
将怀孕40 d的牛胎儿无菌取出,去除头部、内脏及四肢,PBS洗数次,用剪刀将其剪碎,然后用0.25%的胰酶在37℃条件消化约 15 min[7]。将消化后的细胞悬液离心,去上清后,将细胞团块重悬在含有2 mmol/L 的L-谷氨酰胺、5 ng/mL bFGF、10%胎牛血清、100 U/mL的青霉素、100 µg/mL的链霉素的DMEM中,最后将细胞悬液移入60 cm培养皿中,于37℃、5% CO2、饱和湿度的培养箱内培养,每3天换液1次,在细胞密度达到80%左右时将其冻存备用。
1.2.3 打靶载体转染牛胎儿成纤维细胞及细胞筛选
在60 cm培养皿培养的胎儿成纤维细胞90%汇合时,消化悬浮细胞。吸取细胞悬液 (细胞数量约2×106),离心后,用无血清培养液重悬,再次离心,弃上清。用电转液悬浮细胞,加入10 µg 的线性化后的质粒,混匀,4℃放置 10 min,转移至0.4 cm电转杯,在1250 V/cm,1 ms条件下,电穿孔3次。电击完毕,在37℃放置10 min,接种在10 cm培养皿中,添加10 mL培养液。电转染36 h后,换含有600 µg/mL G418进行正筛选,待对照组细胞死完,在培养液中加入 50 nmol/L GCV进行负筛选。每2~3 d更换1次培养液,大约筛选10~13 d后,可见有细胞克隆形成。将边缘清晰、生长旺盛的细胞克隆用克隆环挑取后转移至48孔细胞培养板中。待细胞克隆长至80%~90%密度时,传代接种24孔板中。细胞数量扩增到一定数量,消化、分离出一半的细胞,提取基因组用于PCR鉴定,其余细胞继续扩增培养。
1.2.4 细胞单克隆的PCR鉴定及测序
根据牛 MSTN 基因序列 (Accession No. AF320998) 和Neo基因序列设计2对鉴定引物:P1/P2和P3/P4,见表1。其中,P1、P2分别位于Neo两侧的同源臂上;P3位于 Neo表达框架内;P4位于同源短臂的外侧 (图2)。将P1/P2、P3/P4扩增出的PCR产物纯化后,送公司测序,以进一步验证同源重组的发生。

图1 打靶载体PA2T-Mstn构建图Fig. 1 Structure of targeting vector pA2T-Mstn.

表1 引物序列Table 1 Primers used in this study
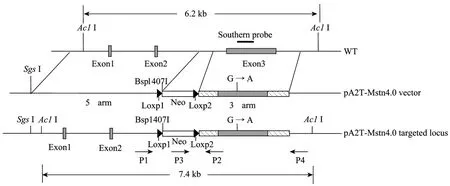
图2 牛MSTN基因打靶示意图Fig. 2 Diagram of gene targeting in bovine MSTN.
1.2.5 中靶细胞克隆的Southern blotting鉴定
扩增培养阳性单克隆细胞,提取基因组DNA。取约20 µg中靶细胞克隆的基因组DNA,经Ac1 I酶切后,在浓度为0.8%的琼脂糖凝胶中进行电泳,分离条带。通过向上毛细管转移法将DNA转移到带正电荷的尼龙膜上,80℃固定2 h。PCR扩增同源短臂的其中一段作为模板制作探针,按照Southern杂交试剂盒说明书进行杂交、免疫反应和X光片曝光,最后得到X光片图像。
1.2.6 中靶细胞中MSTN基因突变位点的测序检测
以中靶细胞基因组为模板,在第三外显子G938A突变位点两侧设计引物P5和P6,利用高保真酶进行PCR扩增。所扩增的PCR产物纯化后送TaKaRa公司测序,验证打靶成功后基因组MSTN基因中G938A突变点是否存在。
2 结果
2.1 PA2TMSTN打靶载体的构建
牛MSTN基因有3个外显子和2个内含子,同源长臂包括了外显子 1和外显子 2,短臂包括了外显子3及G928A突变点。本实验构建了2个置换型打靶载体pA2T-Mstn4.0和pA2T-Mstn3.2,线性化后分别为14.2 kb (图3) 和13.3 kb (图4) (载体构建示意图见图 2)。这两个载体使用了相同的同源短臂,其长臂长度分别为4.0 kb和3.2 kb,且选取部位不同。两个同源臂的中间是Neo表达框,用于正筛选。在Neo表达框的两侧设计了Loxp序列,打靶成功后,可以通过传染 Cre酶表达系统切去基因组中的Neo表达框,避免 Neo表达带来的不良影响[8]。在两个同源臂的外侧各设计了一个tk基因,用于负筛选。通过电转染的方法转染胎儿成纤维细胞,发生正确的同源重组后,Neo代替MSTN基因第2内含子区的部分序列,同源短臂与基因组中的同源序列发生交换,同时将G938A引入基因组中。
2.2 药物抗性细胞的获得及PCR检测
将 SacⅡ线性化的打靶载体 pA2T-Mstn4.0和pA2T-Mstn3.2分别电转染牛胎儿成纤维细胞 (图5A、5B),经过G418和GCV正负筛选,分别得到了60和110个具有药物抗性的细胞克隆 (图5C、5D)。细胞克隆经过扩增培养,提取部分细胞的基因组经行PCR鉴定。先用P1/P2引物进行PCR鉴定,以转染pA2T-Mstn4.0载体的第58号细胞基因组为模板,PCR扩增出两条带,一条2.5 kb片段,另一条3.6 kb片段 (图6A)。再用P3/P4引物PCR鉴定58号细胞,扩增出一条1.8 kb的带 (图6B),其他细胞扩增结果为阴性。经过两对引物的PCR鉴定,确定pA2T-Mstn4.0转染的58号细胞克隆为中靶细胞,结果说明MSTN基因的一条等位基因被打靶成功。将 PCR扩增片段测序后,证实与预期的序列一致。
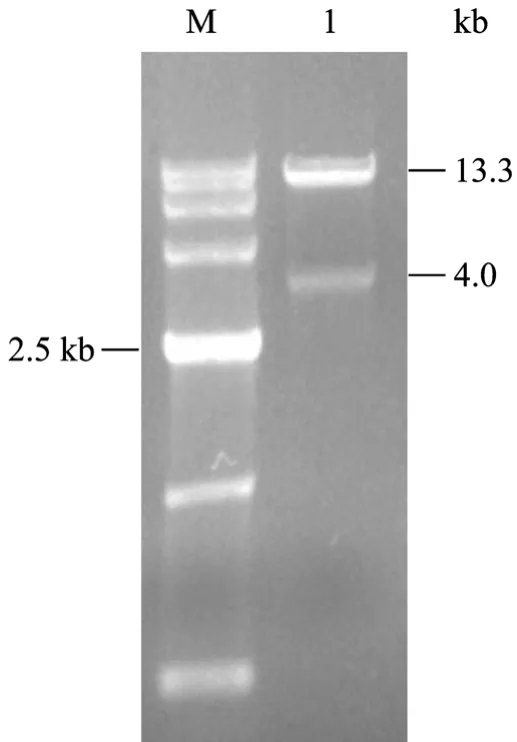
图3 打靶载体PA2T-Mstn4.0的酶切鉴定图Fig. 3 Identification of pA2T-Mstn4.0 vector by enzyme digestion. M: DNA marker D15000; 1: PA2T-Mstn4.0 digested with Sgs I and Bsp1407I.

图4 打靶载体PA2T-Mstn3.2的酶切鉴定图Fig. 4 Identification of pA2T-Mstn3.2 vector by enzyme digestion. M: DNA marker D15000; 1: pA2T-Mstn3.2 digested with Sgs I.

图5 原代胎儿成纤维细胞及转染PA2T-Mstn4.0载体后细胞Fig. 5 Cattle fetus fibroblast cells and cells transfected with pA2T-Mstn4.0. (A) Fetus fibroblast cells (40×). (B) Fetus fibroblast cells after transfection(40×). (C) Selection with G418+GCV after transfection (40×). (D) Selection with G418+GCV after transfection (100×).
2.3 中靶细胞克隆的Southern bloting鉴定
为了进一步验证同源重组事件的发生,将阳性细胞克隆扩增并提取基因组,进行Southern杂交鉴定。通过 Acl I酶切细胞基因组,并提取未转染细胞的基因组作为对照。打靶载体与 MSTN基因位点发生了同源重组,酶切并进行凝胶电泳之后在MSTN基因位点会产生两条带,一条为中靶的等位基因7.4 kb,一条为野生型等位基因6.2 kb。而未转染的细胞基因组,经酶切之后,只有一条6.2 kb的条带 (图7)。Southern 杂交结果证明所检测 58号细胞克隆为发生正确同源重组的细胞克隆。
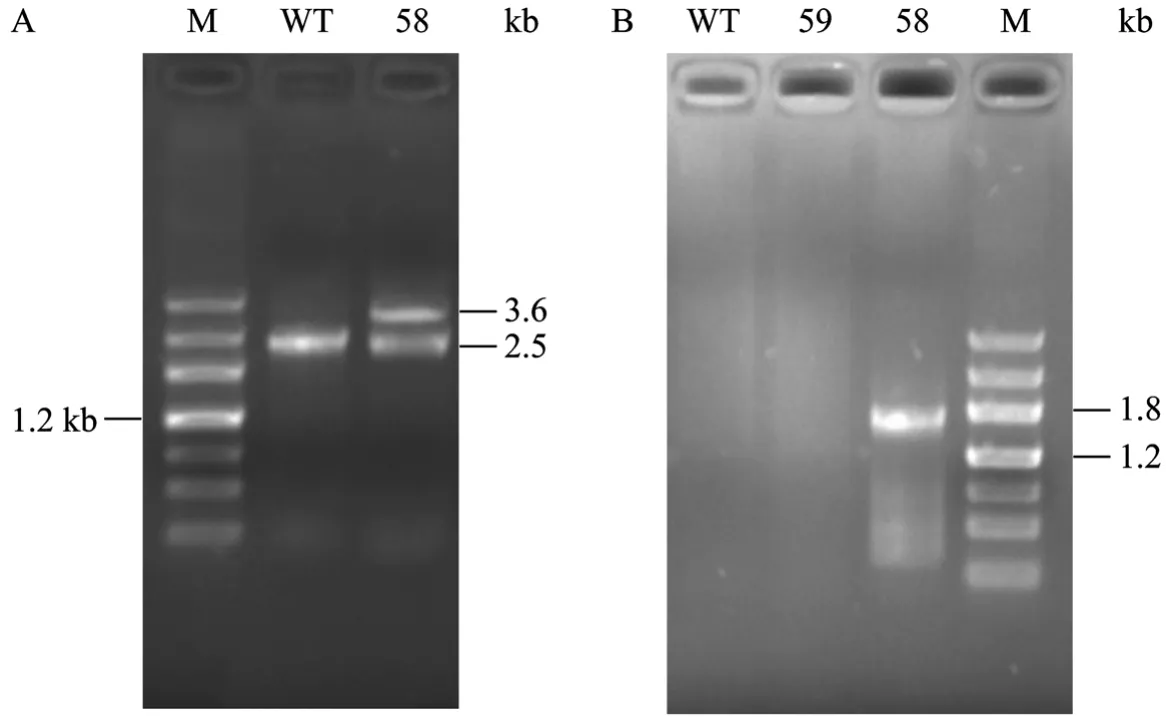
图6 药物抗性细胞PCR鉴定结果Fig. 6 PCR analysis of drug-resistant cell colonies. (A) PCR products of P1/P2. (B) PCR products of P3/P4. M: DNA marker Ⅲ.
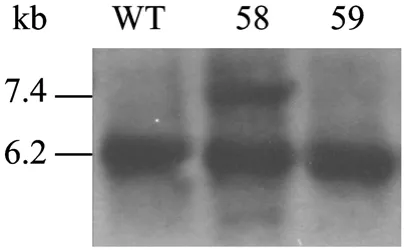
图7 中靶细胞克隆的Southern blotting鉴定图Fig. 7 Southern blotting analysis of positive cell colony. WT: wild-type MSTN; No. 58 and No.59 are drug-resistant cell colony.
2.4 药物抗性细胞中MSTN基因突变位点的测序结果
PCR鉴定阳性细胞基因组中G938A突变位点,所扩增的PCR片段包括了突变位点G938A,测序结果证实中靶细胞MSTN基因中存在突变G938A (图8、9)。

图8 58号中靶细胞突变位点与野生型MSTN基因的对比Fig. 8 MSTN mutation in 58 cell line compared with wild-type normal cell.

图9 58号中靶细胞基因组突变位点测序结果Fig. 9 Sequencing result of G938A in the No.58 cell colony.
3 讨论
MSTN基因通过调控肌卫星细胞的活化和自我更新来调控肌肉生长发育[9]。敲除小鼠的 MSTN基因,或者抑制该基因的功能后,肌肉增大了20%~ 30%[10-12]。通过基因打靶技术对家畜原有基因进行改造、敲除或敲入新的基因,再结合体细胞克隆技术生产转基因动物,在羊、猪和牛中都已有成功的先例[13-15]。本实验通过基因打靶定点突变了秦川牛MSTN基因,以期得到具有“双肌”表型的秦川牛。在构建打靶载体过程中,同源臂的选取部位及长度与打靶效率有一定的关系[16],本实验构建了两个打靶载体pA2T-Mstn4.0和pA2T-Mstn3.2,这两个载体使用了相同的短臂,只是长臂的选取部位及长度不同。转染pA2T-Mstn4.0,筛选得到60个具有药物抗性细胞克隆,经过PCR鉴定,确定了58号细胞克隆为中靶细胞。转染 pA2T-Mstn3.2,共得到了 110个细胞克隆,但是未鉴定出发生正确同源重组的细胞克隆,分析其原因可能是pA2T-Mstn3.2同源长臂较短,以至于发生同源重组的效率非常低;也可能是同源长臂的选取位点不易发生重组。
经过 PCR检测中靶细胞的基因型,结果证实MSTN基因的一条等位基因被打靶成功,说明该基因的两条等位基因中只有一条被引入 G938A突变点,另一条为野生型,这就意味着基因的功能并没有全部丧失。通过 Wheeler等的研究发现,MSTN基因杂合子牛 (只有一条等位基因被引入G938A突变点) 的表型介于野生型和纯合子牛之间,与正常牛相比不仅产肉率提高了,而且肉的口味也有所提高[17]。产生这种现象的原因可能是由于失去功能的等位基因所产生的蛋白仍然可以结合特异性受体,对野生型蛋白起到竞争抑制的作用[18],结果使整个基因的功能受到抑制,并非完全丧失功能,其详细机理需要进一步验证。这种MSTN基因杂合子牛同纯合子皮爱蒙特牛相比,尽管产肉率稍低,但是由于肌肉高度发达而引发的负面影响也显著小于纯合子牛。各种动物是经过长期进化而来的,若完全改变动物基因组中的某个基因功能很可能会引起难以预见的负面影响,因此,本实验通过MSTN基因一条等位基因的成功改造及阳性细胞的获得,为实际生产中制作转基因牛、加速肉牛的品种改良具有重要意义。
REFERENCES
[1] McPherron AC, Lawler AM, Lee SJ, et al. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member. Nature, 1997, 387(6628): 83−90.
[2] Langley B, Thomas M, Bishop A, et al. Myostatin inhibits myoblast differentiation by down-regulating MyoD expression. J Biol Chem, 2002, 277(51): 49831−49840.
[3] McPherron AC, Lee SJ. Double muscling in cattle due to mutations in the myostatin gene. Proc Natl Acad Sci USA, 1997, 94(23): 12457−12461.
[4] Grobet L, Poncelet D, Royo LJ. Molecular definition of an allelic series of mutations disrupting the myostatin function and causing double-muscling in cattle. Mamm Genome, 1998, 9: 210−213.
[5] Berry M, Thomas M, Langley B, et al. Single cysteine to tyrosine transition inactivates the growth inhibitory function of Piedmontese mystatin. Am J Physiol Cell Physiol, 2002, 283: C315–C141.
[6] Nishi M, Yasue A, Nishimatu S, et al. A missense mutant myostatin causes hyperplasia without hypertrophy in the mouse muscle. Biochem Biophys Res Commun, 2002, 293(1): 247−251.
[7] Bashir M, Jorge AP. Nuclear localization signal and cell synchrony enhance gene targeting efficiency in primary fetal fibroblasts. Nucleic Acids Res, 2004, 32(3): e25.
[8] Fiering S, Epner E, Robinson K, et al. Targeted deletion of 5'HS2 of the murine β-globin LCR reveals that it is not essential for proper regulation of the β-globin locus. Gene Dev, 1995, 9: 2203−2213.
[9] McCroskery S, Thomas M, Maxwell L. Myostatin negatively regulates satellite cell activation and self-renewal. J Cell Biol, 2003, 162(6): 1135−1147.
[10] Lee SJ, Alexandra CM. Regulation of myostatin activity and muscle growth. Proc Natl Acad Sci USA, 2001, 98: 9306−9311.
[11] Thomas M, Langley B, Berry C, et al. Myostatin, a negative regulator of muscle growth, functions by inhibiting myolast proliferation. J Biol Chem, 2000, 275(51): 40235−40243.
[12] Zhu X, Hadhazy M, Wehling M. Dominant negative myostatin produces hypertrophy without hyperplasia in muscle. FEBS Lett, 2000, 474: 71−75.
[13] Denning C, Dickinson P, Burl S. Gene targeting in primary fetal fibroblast from sheep and pig. Cloning Stem Cells, 2001, 3(4): 221−231.
[14] Dai Y, Vaught TD, Boone J. Targeted disruption of the α1,3-galactosyltransferase gene in clone pigs. Nat Biotechnol, 2002, 20: 251−255
[15] Kuroiwa Y, Kasinathan P, Matsushita H. Sequential targeting of the genes encoding immunoglobulin-µ and prion protein in cattle. Nat Genet, 2004, 36(7): 775−780.
[16] Hasty P, Perez JR, Bradley A. The length of homology required for gene targeting in embryonic stem cells. Mol Cellular Biol, 1991, 11(11): 5586−5591.
[17] Wheeler TL, Shackelford SD, Casas E. The effects of Piedmontese inheritance and myostatin genotype on the palatability of longissimus thoracis, gluteus medius, semimembranosus, and biceps femoris. J Anim Sci, 2001, 79: 3069−3074.
[18] Fernandez C, Barroso A, Canon J, et al. Myostatin dominant negative allele products interact positively with wild type monomers. Anim Biotechnol, 2004, 15(2): 133−143.
Site-directed mutagenesis of MSTN gene by gene targeting in qinchuan cattle
Yonggang Liu, Song Hua, Jie Lan, Yongli Song, Yulong He, Fusheng Quan, and Yong Zhang
Key Laboratory of Animal Reproductive Endocrinology & Embryo Engineering, Ministry of Agriculture, College of Veterinary Medicine, Northwest A & F University, Yangling 712100, China
Myostatin, a member of the transforming growth factor β (TGF-β) family, is a negative regulator for muscle growth. Loss of the function of this gene is associated with the phenotype described as “double muscling”, an extreme form of muscle development characterized by a large increase in muscle mass. Two replacement vectors, pA2T-Mstn4.0 and pA2T-Mstn3.2, were constructed, linearized, and transfected into the bovine fetal fibroblasts through electroporation. 170 drug-resistant cell colonies were obtained in cell culture medium containing 600 µg/mL G418 and 50 nmol/L GCV. Targeted homologous integration occurred in colony No. 58 as identified by PCR, and the targeted colony was further confirmed by sequencing and Southern blotting. This suggested that one allele of myostatin was successfully mutagenized in bovine fetal fibroblasts.
myostatin, gene targeting, site-directed mutagenesis, bovine fetal fibroblasts, Qinchuan cattle
肌肉生长抑制素,又称生长分化因子8(GDF-8),属于TGF-β超家族,其结构具有TGF-β超家族的典型特征[1]。MSTN基因对肌肉生长发育具有负调控作用,在调节肌肉生长发育过程中起主要作用,不仅抑制肌细胞的增殖,还抑制肌细胞的分化[2]。将小鼠MSTN 基因敲除之后,发现突变小鼠的体重比杂合体和野生型小鼠体重增加约30%,肌细胞增生和肌纤维肥大双重作用所造成的肌肉肥大是造成体重增加的主要原因,并且这一表型与动物的性别及年龄无关[1]。世界著名的具有“双肌”表型的比利时兰牛和皮埃蒙特牛在其MSTN基因的编码区均存在突变。比利时兰牛MSTN基因的第三外显子缺失了11个核苷酸,而在皮爱蒙特牛的第三外显子的一个核苷酸由鸟嘌呤突变为腺嘌呤 (G938A),导致第313个氨基酸由半胱氨酸突变为苯丙氨酸[3-4]。由于G938A点突变影响了蛋白质水平二硫键的形成,导致蛋白质结构发生改变,进而MSTN基因的生物学功能发生改变[5]。为了进一步验证G938A突变位点与肌肉表型的关系,Nishi等制作了G938A点突变转基因小鼠,该小鼠表现出了类似于皮爱蒙特牛的肌肉表型[6],证实了G938A是导致MSTN基因功能缺失,并表现“双肌”表型的关键突变点。
November 26, 2009; Accepted: January 27, 2010
Supported by:Program for Disease-resistant Transgenic Cattle (No. 2008ZX08007-004).
Yong Zhang. Tel: +86-29-87080085; E-mail: zhy1956@263.net
抗病转基因牛新品种培育项目 (No. 2008ZX08007-004) 资助。

