猪瘟DNA疫苗研究进展
李娜,孙元,仇华吉
中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,哈尔滨 150001
1 DNA疫苗概述
DNA疫苗又称核酸疫苗或基因疫苗,是 20世纪90年代Wolff等首创的新型疫苗[1],本质是编码免疫原或与免疫原相关的真核表达质粒DNA (有时也可是RNA),是指将编码某种蛋白质抗原的重组真核表达载体直接注射到动物体内,使外源基因在活体内表达,产生的抗原激活机体的免疫系统,从而诱导特异性的体液免疫和细胞免疫应答,因而起到免疫保护作用。DNA疫苗是疫苗学发展的一个重要里程碑,是极有发展潜力的一种新型疫苗。
DNA疫苗具有许多优点:1) 在宿主体内表达抗原过程中与自然感染相似,表达的抗原以天然构像递呈给宿主免疫系统,无抗原表位的改变。2) 克服了 MHC限制性,DNA免疫不仅可诱导对同类MHC的细胞毒性T细胞 (Cytotoxic T lymphocytes,CTL) 应答,同时也可以诱导在不同MHC间交叉的CTL应答。3) DNA疫苗不仅能诱导体液免疫,更重要的是产生强有力的细胞免疫[2-3]。4) 一般来说,外源DNA不会整合到寄主细胞的染色体中,因此应用起来较安全稳定[4]。目前尚未见DNA疫苗有常规疫苗和灭活疫苗可能产生的毒力“返祖”或残留强毒入侵而引发疾病危险的报道。5) DNA疫苗不受母源抗体的影响,可产生很好的交叉反应;诱导产生母源抗体,但不会被来源于母体的抗体所识别,因而在幼龄动物的早期免疫中具有十分重要的意义,可广泛用于对许多疾病的早期预防[5-6]。6) 将多种质粒DNA简单混合,就可将生化特性类似的抗原 (如来源于相同病原菌的不同菌株) 或一种病原体的多种不同抗原结合在一起,组成多价疫苗,从而使一种DNA疫苗能够诱导产生针对多个抗原表位的免疫保护作用,使DNA疫苗生产的灵活性大大增加。
和减毒活疫苗相比,DNA疫苗安全性更高,因为它不涉及与野毒可能重组的危险。而且质粒DNA在动物体内会缓慢降解,不会造成动物的自体免疫[7],也不随卵子和精子传入子代体内,它随生物链进入其他物种体内时也会失活,而且对环境的污染很小,因此其危险性远低于现用疫苗。通常DNA疫苗仅携带病原体最具免疫原性的一个 cDNA,所以它可以被用于开发CSFV标记疫苗。
近年来,许多畜禽病毒性传染病已不能依靠传统疫苗如灭活疫苗、弱毒疫苗等对其进行防治,DNA疫苗的出现使得这一状况得到改善。编码病毒、细菌和寄生虫等不同种类抗原基因的质粒DNA,能够引起脊椎动物如哺乳类、鸟类和鱼类等多个物种产生强烈而持久的免疫反应。DNA疫苗被称为继灭活疫苗和弱毒疫苗、亚单位疫苗之后的“第三代疫苗”,具有广阔的发展前景。
2 猪瘟DNA疫苗的构建和评价
2.1 常规DNA疫苗
目前关于猪瘟DNA疫苗国内外均有报道。余兴龙等[8]构建了4种包含全长E2基因序列的真核表达质粒,其中 pcDSW (含有信号肽序列) 质粒肌肉注射小鼠后可诱导小鼠抗 CSFV的体液免疫,用pcDSW 免疫兔和猪后可获得保护。在 Ganges等[9]的实验中,用 pCDNA-E2(TMR+E2) 免疫猪只,攻毒后除了一头猪有轻微的临床症状和病理变化外,另外两头猪得到了完全保护。Andrew等[10]最先评价了针对CSFV的DNA疫苗,将E2基因的全长cDNA克隆到质粒载体pCI上。动物试验中,使用了不同的免疫方法和剂量。用无针注射器 (Panjet needleless) 接种耳朵,单次射击200 µg pCI-gp55或两次射击50 µg pCI-gp55就足以诱导坚强的免疫力,保护所有免疫猪抵抗致死性CSFV的攻击。然而,Hammond等[11]发现用100 µg pCI-gp55免疫两次并没有有效预防临床症状或者是脾、淋巴节的损伤,最终仅有一半的猪存活下来。为了得到满意的保护,对于 pCI-gp55高剂量和多次免疫似乎是必要的。而且,还需要采取一些策略来提高 pCI-gp55的免疫原性。
在评价候选标记疫苗时,能否诱导中和抗体的产生常常被看作是一个重要的参数 (剂量和产生时间)。在一些免疫攻毒试验中,DNA免疫后,中和抗体 (nAb) 产生水平的高低和免疫效力有很大的关系[10],但也不全是这样[9,11]。在 Andrew 等[10]和Hammond等[11]的研究中,在攻毒前所有产生中和抗体的猪都被保护了,然而,并不是所有存活下来的猪在攻毒前都有nAb的产生[10-11]。这暗示有可能涉及到nAb非依赖性的保护。Ganges等[9]发现攻毒前pCDNA3.1/E2 (CSFV的全长E2基因) 并没有检测到抗 CSFV抗体的产生,但是,它激活了特异性的MHC Ⅱ类限制的T细胞应答。攻毒后,nAb的滴度在免疫猪体内迅速升高,这个结果表明可以用诱导Th应答的策略去设计标记疫苗而不是直接诱导高滴度的中和抗体应答。因此,攻毒前检测不到免疫动物体内的抗 CSFV中和抗体的存在就能较容易地区分感染动物和免疫动物。
在设计DNA疫苗时,E2蛋白跨膜区 (TMR) 的作用是一个令人感兴趣的话题。大多数猪瘟DNA疫苗研究采用全长 E2基因[9-13],而在余兴龙等[8]和Markowska-Daniel等[14]的研究中,带有信号肽序列而没有TMR的E2基因被用于构建猪瘟DNA疫苗。余兴龙等[8]的研究表明,质粒 pcDSW (编码不带TMR的 E2基因) 能够保护猪抵抗致死性的攻毒,但是质粒pcDST (带有TMR的E2基因) 诱导的免疫应答明显弱于pcDSW诱导的免疫应答。Markowska-Daniel等[14]证实,gp55 pCIneo (含有TMR的E2基因) 不能保护免疫猪,然而 Sigp55pTargeT (含有不带TMR的E2基因) 免疫猪除了仅有瞬时的低热外都得到保护。这些看似矛盾的发现可能是由于他们之间的实验体系不同造成的。实际上,有或没有TMR的E2基因DNA疫苗都是有效的候选疫苗。缺失跨膜区可以使抗原更容易分泌到细胞外的空间[15],因而加强了体液免疫应答。相比而言,包含TMR的全长E2基因的表达更倾向于将E2蛋白保留在细胞膜上递送给T细胞。对于携带全长E2基因的质粒,高免疫剂量似乎是产生有效的体液免疫应答的一个重要因素。
2.2 新型DNA疫苗
近年来,甲病毒 (Alphaviruses) 尤其是Semliki Forest病毒 (Semliki Forest virus,SFV) 和Sindbis病毒 (SINV) 衍生的DNA/RNA载体被广泛用于外源基因的表达。甲病毒复制子载体是衍生于RNA病毒基因组并能自主复制的RNA分子。RNA复制子疫苗是一种基于RNA复制子的新型疫苗,这种疫苗不会产生感染性病毒粒子,不会与细胞基因组发生整合,但能复制和表达外源性抗原基因,并诱导全身免疫和粘膜免疫及细胞免疫,因此非常安全有效。RNA复制子疫苗有几种投递方式:一是将RNA复制子包装于病毒样颗粒;二是体外转录成裸 RNA (RNA载体);三是将复制子置于RNA聚合酶II启动子控制下 (DNA载体),由细胞RNA聚合酶II体内转录成RNA。
由甲病毒 (主要是 SFV或 SINV) 衍生的DNA/RNA复制型载体,由于具有安全、操作方便、表达外源基因效率高等特点,在基因免疫[16-17]和基因治疗[18]中得到广泛应用。已经证明,这种以复制子为基础的DNA疫苗优于常规DNA疫苗[17,19-25]。研究发现,这种疫苗表达效率的提高不止是因为外源抗原表达量的增多[21-26]。用复制子载体疫苗转染细胞后,其RNA复制酶合成大量双链RNA (dsRNA)复制中间体,激活RNase L和RNA依赖的蛋白激酶(PKR),导致被转染细胞的凋亡。dsRNA还可激活并诱导树突状细胞 (DC) 的成熟[27],增加DC等抗原递呈细胞对凋亡细胞的摄取[28]。有研究证明,共转染凋亡基因CD95/Fas或Caspase,可以增加常规基因疫苗的免疫原性和表达效率[29-30]。Leitner等用表达抗凋亡基因 Bcl-X(L) 的质粒和表达黑色素瘤分化抗原TRP-1的SINV复制子载体一同递送,虽然转染细胞存活时间变长,抗原表达量增加,体内产生抗体提高,但由于干扰了细胞凋亡,大大降低了小鼠对于肿瘤攻击的保护作用[31]。而经同样操作的常规DNA疫苗,其效力并不受Bcl-X(L)的影响。这些研究结果证实了细胞凋亡在诱导免疫反应中的重要作用,并为复制子疫苗通过细胞凋亡增强免疫反应提供了强有力的佐证。dsRNA还可被天然免疫受体如Toll-like受体3(TLR-3) 或其他TLR识别,产生高水平的I型干扰素 (IFN-α和IFN-β) 或其他细胞因子,前者是宿主细胞在病毒感染后释放的主要细胞因子[32-33],对 DC的分化和成熟有重要促进作用,在免疫应答中起强大的佐剂作用,大大提高了复制子疫苗抗病毒或肿瘤的效应。
邓瑶等比较了不同剂量的SFV复制子载体疫苗pSCA-SSl的免疫效果,表明1 µg诱导的抗体滴度反而高于10 µg和100 µg两个高剂量组[25],说明对于pSCA这类复制型载体,免疫接种的质粒DNA并不是越多越好,这也是由复制型载体的特性所决定的。正如上述,细胞凋亡是复制子疫苗免疫效率增强的必要条件[31],但并非诱导细胞凋亡的能力越强,对激发的免疫反应越有利。Sasaki等曾将表达流感病毒 HA基因的质粒与表达部分灭活的突变 Caspase (可在诱导凋亡小体前表达抗原蛋白) 的质粒联合免疫小鼠,能显著增强 HA特异性免疫反应,但与诱导细胞凋亡的野生型 Caspase表达质粒联合免疫却不能增强免疫反应[29]。另外,免疫质粒剂量太多,宿主细胞摄入较多复制子质粒后,产生大量dsRNA,迅速诱导细胞凋亡,反而影响抗原的表达和处理,从而影响免疫效果。
此前有研究者构建了基于SFV复制子载体、表达CSFV E2基因的新型DNA疫苗pSFV1CS-E2[34],用此疫苗按600 µg/头的剂量通过肌肉注射途径免疫猪,共免疫3次,间隔3周,免疫猪产生了低水平的抗体,并且能抵抗致死性猪瘟强毒的攻击[35]。鉴于前人报道的低剂量复制子疫苗可以诱导更好的免疫效果,同时出于成本考虑,研究者又尝试用较低的免疫剂量 (100 µg/头) 和较少的免疫次数 (2次)[36]。这在已发表的以肌肉注射方式对 CSFV基因疫苗进行效力评价的研究报道中,免疫次数和剂量都是最少的[8-10]。按此策略免疫猪只,二免后抗体水平持续上升至较高水平,攻毒后第2天起,抗体快速上升,表明产生了回忆性免疫应答,攻毒猪均获得了完全的临床保护[36]。虽然RT-nPCR和荧光定量RT-PCR检测个别猪攻毒后出现短期 (攻毒后第 4~6天) 病毒血症,但病毒载量很低 (RT-nPCR第二轮扩增才能检出,病毒RNA含量不高于103拷贝/µL血液),而对照组在攻毒后第 2天直到死亡 (或剖杀) 其血液中 CSFV拷贝数一直处于较高水平,表明复制子疫苗有效降低了病毒载量,缩短了病毒血症。
2.3 新型给药途径和递送工具
基因疫苗的给药途径比较简单,大多是颈部或腿部肌肉内注射、耳部皮下注射。但这些方法好像激发的免疫原性不够好。比较新型的递送工具包括针管注射 (Needle injection) 和生物弹射击技术(Biolistic system)。针管注射容易操作,准备注射用的DNA只要将其溶于盐水中即可。生物弹射击技术比如基因枪 (Gene gun) 或者生物喷射器 (Biojector)的优势在于其能提高免疫效力,已经表明在小鼠实验中用生物弹射击技术所用的 DNA比用针管注射技术低100倍剂量的DNA二者可以产生相当的抗体免疫应答[37-41]。基因枪免疫,就是将DNA包被到金颗粒中,用基因枪将包被的DNA推进到表皮。这种装置推动包被DNA的金颗粒直接进入表皮细胞,产生的免疫应答已经在各种体系中得到验证[37,42]。在临床试验中使用基因枪,使得所有用编码乙型肝炎B抗原的DNA的疫苗免疫动物都发生了血清阳转,甚至连那些对已经合法化的重组蛋白疫苗没有反应的动物也出现血清阳转[43-44]。
许多给药途径可以提高细胞的转染或者定位DNA到特异的细胞。这些给药途径包括定位到粘膜或者有益于转染皮肤内的朗罕氏细胞的推进设施。粘膜喷射注水器 (无针注射器) (Jet injector) 已经被用于HIV DNA疫苗的临床试验[45-46]。定位到粘膜的好处是因为大部分病原都是通过粘膜进入身体,所以经粘膜给药的疫苗可以产生更好的粘膜免疫应答。电穿孔设备被评价可以极大地提高DNA的吸收和编码蛋白的表达[47-48]。通过往体内递送小量的电流在细胞局部打孔,目的是为了使大部分被注射的DNA进入到细胞。
将DNA封装入或者封装在载体上形成微粒[49-50]或者装入细菌内[51-52]是另一种保护 DNA不被降解和/或者加强抗原递呈细胞吸收的方法。这种方法可以增强对编码蛋白的CTL应答。可生物降解的非抗原的聚乳酸聚羟基乙酸 (PLGA或者 PLG) 微球体作为一个疫苗递送体系有很多益处,抗原封装到或者连接到PLG微球体上可以将细胞免疫和体液免疫反应都激发出来。使用的微粒直径大都在1~10 µm之间,这种尺寸的微粒很容易被树突状细胞和其他抗原递呈细胞所吞噬[53]。通过在细胞间释放抗原微球可以激发出CD8+和CD4+ T细胞应答[54]。微球递送加强了针对DNA质粒的免疫应答[49,55]。
3 佐剂在猪瘟DNA疫苗中的应用
为了提高DNA疫苗的免疫效果,研究者们选用了不少免疫佐剂来提高DNA疫苗的免疫原性。
用细胞因子作为佐剂也可以提高CSFV DNA疫苗的效力。Andrew等[12]发现共递送IL-3或GM-CSF能够加强pCI-gp55诱导的中和抗体滴度和保护力。Wienhold等[13]构建了共表达CSFV E2蛋白和细胞因子 (IL-12、IL-18或CD-40L) 的嵌合质粒,共表达IL-18或CD-40L的质粒诱导了更坚强的免疫力,而共表达 IL-12似乎降低了疫苗的效力 (中和抗体诱导更慢、滴度更低、保护力更差)。在研究BVDV的DNA疫苗中,Nobiron等发现用BVDV E2-DNA免疫小鼠[56-57]和牛[58],共递送的IL-2可以增强抗原特异性的免疫应答。所以IL-2对于CSFV DNA疫苗来说可能是又一种有前景的细胞因子佐剂。在研究细胞因子的佐剂效应时,必须谨慎,因为对于不同的DNA疫苗或不同的宿主佐剂的免疫效力也许差别很大。有时剂量也会影响到佐剂效应。已经发现共递送高剂量的IL-3在猪体内会引起免疫抑制,而低剂量的IL-3会增强免疫[12]。
除了细胞因子,免疫刺激基序 CpG和 BCGDNA在DNA免疫中也是很好的佐剂。对几种动物实验的研究表明,CpG寡核苷酸 (ODN) 可以加强和调节对抗原Th1/Th2的应答[59]。Zang等发现共递送BCG-DNA可以大大提高小鼠抗CSFV的抗体水平,但是很难影响E2-DNA诱导的CTL应答或IL-4和IFN-γ的产生[60]。
4 猪瘟DNA疫苗与其他疫苗的联合应用
Hammond等[10]采用 Prime-boost的方法,先用表达CSFV E2基因的裸露质粒DNA pCI-gp55免疫断奶仔猪 (6周龄) 和7日龄提前断奶乳猪,然后这两组猪群均用表达 E2基因的腺病毒重组体(rPAV-gp55) 加强免疫1次,用CSFV攻毒后,断奶猪没有发热症状,脾和淋巴结也没有病理变化,并且100%的断奶仔猪和75%的乳猪获得保护。所有存活下来的6头猪仅有1头分离到了CSFV。用此免疫程序还可减少或阻止CSFV攻毒后猪只的排毒。
已有研究证实,采用Prime-boost策略可以提高复制子疫苗的免疫原性[61]。鉴于此,研究者用复制子疫苗pSFV1CS-E2初免,然后再用表达CSFV E2蛋白的重组腺病毒 (rAdV-E2) 加强免疫,结果表明,Prime-boost免疫后所有免疫猪都产生了高水平的 CSFV特异性的抗体,用 CSFV强毒攻击后,rAdV-E2加强免疫猪没有出现临床症状,攻毒后也没有检出CSFV RNA,而同源pSFV1CS-E2加强免疫组部分猪出现发热和病毒血症。这证明异源性的Prime-boost是很有潜力的免疫策略[62]。
5 目前猪瘟DNA疫苗存在的问题和解决途径
上述目前所有的猪瘟DNA疫苗主要存在2个问题:1) 免疫剂量大,免疫次数多,有时激发的免疫反应弱,达不到所需的免疫效果。在余兴龙等[8]对猪的免疫攻毒试验中,一次免疫就用了2.2 mg DNA疫苗pcDSW,共免疫3次,共用了6.6 mg DNA疫苗;在Ganges等[9]的研究中,共免疫3次,每次400 µg,共用了1.2 mg DNA疫苗;在Andrew等[10]的报道中,同时比较了几种方式的免疫方法,最后还是确定肌肉注射1 mg DNA疫苗pCI-gp55免疫效果最好。2) 导入细胞和机体的效率差,抗原表达水平低,接种 CSFV基因疫苗后,免疫动物出现特异性免疫应变反应较慢,血清中的抗体水平亦不很高,这与多数疫病的基因疫苗的免疫应答反应类似[7]。一般说基因疫苗可诱发强烈的免疫应答反应,是相对于疫苗质粒接种后在体内的抗原表达量而言的(表达量只是ng水平)。因此,提高接种后疫苗质粒在机体中的抗原表达量,是目前基因疫苗研究领域中的重要课题之一[63]。
针对以上两种缺陷,研究者们采用了很多方法去克服猪瘟DNA疫苗的不足。比如用细胞因子、免疫刺激基序CpG和BCG-DNA等作为佐剂来加强猪瘟DNA疫苗的免疫效力。用Prime-boost的策略来增强猪瘟DNA疫苗的效力 (前文已述及)。
以甲病毒 (主要是 SFV) 衍生的复制子疫苗(亦即“自杀性”DNA疫苗) 是解决常规DNA疫苗用量较大的策略之一。有实验证实对于这类复制型载体免疫接种的质粒DNA并不是越多越好,这是由其复制型载体的特性决定的。已有研究者证实免疫100 µg复制型DNA疫苗pSFV1CS-E2两次,攻毒后免疫猪从临床上获得了完全保护。尽管甲病毒为基础的载体能高效表达外源蛋白,但是由于其复制对宿主细胞造成的强烈毒性,抑制宿主细胞蛋白的合成,导致细胞过早调亡,致使外源基因不能持续表达,不利于外源蛋白的转运和免疫细胞对其的加工呈递[64]。为了克服这一缺陷,笔者构建了基于pSFV1CS-E2的编码CSFV E2蛋白和伪狂犬病病毒(PRV) VP22的融合蛋白的质粒 pSFV1CS-E2-UL49[65],经证实,PRV UL49基因的编码蛋白VP22,是一种重要的非结构蛋白,具有蛋白转导 (Protein transduction) 功能,能将与之融合表达的绿色荧光蛋白在无任何辅助条件介导下 (如脂质体、磷酸钙、电转化、病毒载体等) 直接导入细胞[66]。在Zhao等[65]的研究中,将pSFV1CS-E2和pSFV1CSE2-UL49诱导的细胞免疫 (CMI) 在小鼠模型上进行了评价,结果表明这两种疫苗都能诱导CSFV特异的淋巴细胞增殖反应和细胞因子的产生,并且pSFV1CS-E2-UL49比pSFV1CS-E2诱导了更强的淋巴细胞增殖反应和更高的细胞因子水平。这些发现表明,甲病毒复制子衍生的 DNA疫苗能够诱导CMI,而且PRV VP22能够增强共递送抗原的免疫原性。上述的Prime-boost实验表明此方法也是提高复制子疫苗的策略之一。
6 小结
总之,对于CSFV标记疫苗来说,DNA免疫是其中非常有前景的策略。到目前为止,所有的猪瘟候选DNA疫苗都是利用E2蛋白作为免疫原诱导免疫应答,Erns作为新成员也可以用于开发DNA疫苗。高剂量多次免疫和共递送细胞因子或免疫刺激基序佐剂或采用Prime-boost的策略,是提高DNA疫苗效力的切实可行的方法。但目前的实验室研究中,首次免疫E2-DNA疫苗和实验性攻毒的时间间隔长于其他候选疫苗,如果在DNA免疫后不能很快产生坚强的免疫力,长的“窗口期”将会成为DNA疫苗在现地应用中非常不利的因素[67](图1)。
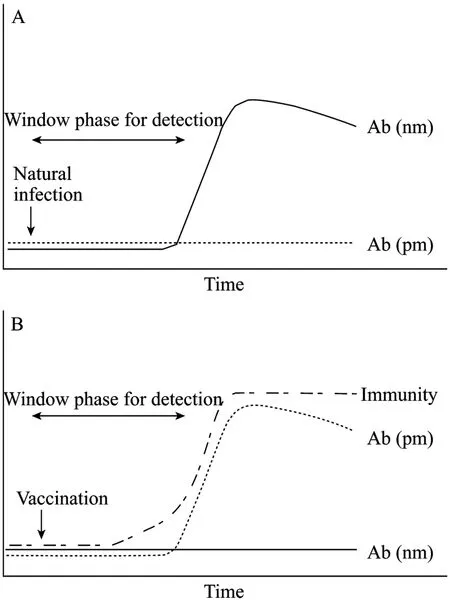
图1 检测 (A) 和保护 (B) 的“窗口期”(Ab(nm):针对阴性标记的抗体应答;Ab(pm):针对阳性标记的抗体应答)[67]Fig. 1 “Window phase” for detection (A) or protection (B). Ab(nm): antibodies response against negative marker; Ab(pm): antibody response against positive marker[67].
REFERENCES
[1] Wolff JA, Malone RW, Wiliams P, et al. Direct gene transfer into muscle in vivo. Science, 1990, 247(4949 Pt 1): 1465–1468.
[2] Han Y, Wang XL. Immunomechanism and optimized strategies of DNA vaccines. J Med Mol Biol, 2005, 2(2): 143–146.韩岳, 王希良. DNA疫苗的免疫机制及其优化策略. 医学分子生物学杂志, 2005, 2(2): 143–146.
[3] Leclerc C. New approaches in vaccine development. Comp Immuol Microbiol Infect Dis, 2003, 26(5/6): 329–341.
[4] Zhong H, Cao C, Li P, et al. Induction of protective immune responses in Rhesus monkey by immunization with recombinant plasmids of polyvalent epitopes of Plasmodium falciparum using cholera toxin B as adjuvant. Acta Genet Sin, 2000, 27(2): 95–100.钟辉, 曹诚, 李平, 等. 以恒河猴为模型的DNA的免疫保护作用研究. 遗传学报, 2000, 27(2): 95–100.
[5] Donnclly JJ, Ulmer JB, Liu MA. DNA vaccines. Life Sci, 1997, 60(3): 163–172.
[6] Seo SH, Wang L, Smith R, et al. The carbosyl-terminal 120-residue polypeptide of infectious bronchitis virus nucleocapsid induces cytotoxic T lymphocytes and protects chickens from acute infection. Virology, 1997, 71(10): 7889–7894.
[7] Chen HL, Yu KZ, Tian GB, et al. Protective immune response against avian influenza virus in chicken induced by DNA inoculation. Sci Agric Sin, 1998, 31(5): 63–68.陈化兰, 于康震, 田国滨, 等. DNA免疫诱导鸡对禽流感病毒的免疫保护反应. 中国农业科学, 1998, 31(5): 63–68.
[8] Yu XL, Tu CC, Li HW, et al. Construction of eukaryotic expression plasmids of CSFV E2 gene and the study on DNA vaccine. Virol Sin, 2000, 15(3): 264–271.余兴龙, 涂长春, 李红卫, 等. 猪瘟病毒E2基因真核表达质粒的构建及基因疫苗的研究. 中国病毒学, 2000, 15(3): 264–271.
[9] Ganges L, Barrera M, Nunez JI, et al. DNA vaccine expressing the E2 protein of classical swine fever virus elicits T cell responses that can prime for rapid antibody production and confer total protection upon viral challenge. Vaccine, 2005, 23(28): 3741–3752.
[10] Andrew ME, Morrissy CJ, Lenghaus C, et al. Protection of pigs against classical swine fever with DNA-delivered gp55. Vaccine, 2000, 18(18): 1932–1938.
[11] Hammond JM, Jansen ES, Morrissy CJ, et al. A prime-boost vaccination strategy using naked DNA followed by recombinant porcine adenovirus protects pigs from classical swine fever. Vet Microbiol, 2001, 80(2): 101–119.
[12] Andrew M, Morris K, Coupar B, et al. Porcine interleukin-3 enhances DNA vaccination against classical swine fever. Vaccine, 2006, 24(16): 3241–3247.
[13] Wienhold D, Armengol E, Marquardt A, et al. Immunomodulatory effect of plasmids co-expressing cytokines in classical swine fever virus subunit gp55/E2-DNA vaccination. Vet Res, 2005, 36(4): 571–587.
[14] Markowska-Daniel I, Collins RA, Pejsak Z. Evaluation of genetic vaccine against classical swine fever. Vaccine, 2001, 19(17/19): 2480–2484.
[15] Yu X, Tu C, Li H, et al. DNA-mediated protection against classical swine fever virus. Vaccine, 2001, 19(11/12): 1520–1525.
[16] Dubensky TW Jr, Driver DA, Polo JM, et al. Sindbis virus DNA-based expression vectors: utility for in vitro and in vivo gene transfer. J Virol, 1996, 70(1): 508–519.
[17] Berglund P, Smerdou C, Fleeton MN, et al. Enhancing immune responses using suicidal DNA vaccines. Nat Biotechnol, 1998, 16(6): 562–565.
[18] Herweijer H, Latendresse JS, Williams P, et al. A plasmid-based self-amplifying Sindbis virus vector. Hum Gene Ther, 1995, 6(9): 1161–1167.
[19] Berglund P, Tubulekas I, Liljestrom P. Alphaviruses as vectors for gene delivery. Trends Biotechnol, 1996, 14(4): 130–134.
[20] Schlesinger S. Alphavirus vectors: development and potential therapeutic applications. Expert Opin Biol Ther, 2001, 1(2): 177–191.
[21] Leitner WW, Ying H, Driver DA, et al. Enhancement of tumor-specific immune response with plasmid DNA replicon vectors. Cancer Res, 2000, 60(1): 51–55.
[22] Driver DA, Polo JM, Belli BA, et al. Plasmid DNA-based alphavirus expression vectors for nucleic acid immunization. IDrugs, 1998, 1(6): 678–685.
[23] Cheng WF, Hung CH, Chai CY, et al. Enhancement of Sindbis virus self-replicating RNA vaccine potency by linkage of herpes simplex virus type 1 VP22 protein to antigen. J Virol, 2001, 75(5): 2368–2376.
[24] Schirmacher V, Forg P, Dalemans W, et al. Intra-pinna anti-tumor vaccination with self-replicating infectious RNA or with DNA encoding a model tumor antigen and a cytokine. Gene Ther, 2000, 7(13): 1137–1147.
[25] Deng Y, Meng X, Xu HL, et al. A comparative study on SFV-based DNA vaccine and the conventional DNA vaccine. Chin J Virol, 2002, 18(4): 328–330.邓瑶, 孟昕, 许洪林, 等. Semliki森林病毒衍生的DNA疫苗与常规 DNA疫苗的比较. 病毒学报, 2002, 18(4): 328–330.
[26] Leitner WW, Hwang LN, deVeer MJ, et al. Alphavirus-based DNA vaccine breaks immunological tolerance by activating innate antiviral pathways. Nat Med, 2003, 9(1): 33–39.
[27] Wang L, Smith D, Bot S, et al. Non-coding RNA danger motifs bridge innate and adaptive immunity and are potent adjuvants for vaccination. J Clin Invest, 2002, 110(8): 1175–1184.
[28] Ying H, Zaks TZ, Wang RF, et al. Cancer therapy using a self-replicating RNA vaccine. Nat Med, 1999, 5(7): 823–827.
[29] Sasaki S, Amara RR, Oran AE, et al. Apoptosis-mediated enhancement of DNA-raised immune responses by mutant caspases. Nat Biotechnol, 2001, 19(6): 543–547.
[30] Chattergoon MA, Kim JJ, Yang JS, et al. Targeted antigen delivery to antigen-presenting cells including dendritic cells by engineered Fas-mediated apoptosis. Nat Biotechnol, 2000, 18(9): 974–979.
[31] Leitner WW, Hwang LN, Bergmann-Leitner ES, et al. Apoptosis is essential for the increased efficacy of alphaviral replicase-based DNA vaccines. Vaccine, 2004, 22(11/12): 1537–1544.
[32] Asselin-Paturel C, Trinchieri G. Production of type I interferons: plasmacytoid dendritic cells and beyond. J Exp Med, 2005, 202(4): 461–465.
[33] Tough DF. Type I interferon as a link between innate and adaptive immunity through dendritic cell stimulation. Leuk Lymphoma, 2004, 45(2): 257–264.
[34] Li N, Qiu HJ, Li GX, et al. A Semliki Forest virus RNA replicon-based DNA plasmid encoding classical swine fever virus E2 gene induces immune response in mice. China Biotechnol, 2005, 25(1): 53–58.李娜, 仇华吉, 李国新, 等. 基于 Semliki Forest病毒RNA复制子的猪瘟RNA疫苗的初步研究. 中国生物工程杂志, 2005, 25(1): 53–58.
[35] Li N, Qiu HJ, Zhao JJ, et al. A Semliki Forest virus replicon vectored DNA vaccine expressing the E2 glycoprotein of classical swine fever virus protects pigs from lethal challenge. Vaccine, 2007, 25(15): 2907–2912.
[36] Li N, Zhao JJ, Zhao HP, et al. Protection of pigs from lethal challenge by a DNA vaccine based on an alphavirus replicon expressing the E2 glycoprotein of classical swine fever virus. J Virol Methods, 2007, 144(1/2): 73–78.
[37] Fynan EF, Webster RG, Fuller DH, et al. DNA vaccines: protective immunizations by parenteral, mucosal, and gene-gun inoculations. Proc Natl Acad Sci USA, 1993, 90(24): 11478–11482.
[38] Bennett AM, Phillpotts RJ, Perkins SD, et al. Gene gun mediated vaccination is superior to manual delivery for immunisation with DNA vaccines expressing protective antigens from Yersinia pestis or Venezuelan Equine Encephalitis virus. Vaccine, 1999, 18(7/8): 588–596.
[39] Lodmell DL, Parnell MJ, Bailey JR, et al. One-time gene gun or intramuscular rabies DNA vaccination of non-human primates: comparison of neutralizing antibody responses and protection against rabies virus 1 year after vaccination. Vaccine, 2001, 20(5/6): 838–844.
[40] Oliveira SC, Rosinha GM, de-Brito CF, et al. Immunological properties of gene vaccines delivered by different routes. Braz J Med Biol Res, 1999, 32(2): 207–214.
[41] Dégano P, Schneider J, Hannan CM, et al. Gene gun intradermal DNA immunization followed by boosting with modified vaccinia virus Ankara: enhanced CD8+ T cell immunogenicity and protective efficacy in the influenza and malaria models. Vaccine, 1999, 18(7/8): 623–632.
[42] Fuller JT, Fuller DH, McCabe D, et al. Immune responses to hepatitis B virus surface and core antigens in mice, monkeys, and pigs after Accell particle-mediated DNA immunization. Ann N Y Acad Sci, 1995, 772(27): 282–284.
[43] Roy MJ, Wu MS, Barr LJ, et al. Induction of antigen-specific CD8+ T cells, T helper cells, and protective levels of antibody in humans by particle-mediated administration of a hepatitis B virus DNA vaccine. Vaccine, 2000, 19(7/8): 764–778.
[44] Swain WE, Heydenburg Fuller D, Wu MS, et al. Tolerability and immune responses in humans to a PowderJect DNA vaccine for hepatitis B. Dev Biol, 2000, 104: 115–119.
[45] Lundholm P, Leandersson AC, Christensson B, et al. DNA mucosal HIV vaccine in humans. Virus Res, 2002, 82(1/2): 141–145.
[46] Lundholm P, Asakura Y, Hinkula J, et al. Induction of mucosal IgA by a novel jet delivery technique for HIV-1 DNA. Vaccine, 1999, 17(15/16): 2036–2042.
[47] Widera G, Austin M, Rabussay D, et al. Increased DNA vaccine delivery and immunogenicity by electroporation in vivo. J Immunol, 2000, 164(9): 4635–4640.
[48] Zucchelli S, Capone S, Fattori E, et al. Enhancing B- and T-cell immune response to a hepatitis C virus E2 DNA vaccine by intramuscular electrical gene transfer. J Virol, 2000, 74(24): 11598–11607.
[49] O’Hagan D, Singh M, Ugozzoli M, et al. Induction of potent immune responses by cationic microparticles with adsorbed human immunodeficiency virus DNA vaccines. J Virol, 2001, 75(19): 9037–9043.
[50] Roy K, Mao HQ, Huang SK, et al. Oral gene delivery with chitosan-DNA nanoparticles generates immunologic protection in a murine model of peanut allergy. Nat Med, 1999, 5(4): 387–391.
[51] Sizemore DR, Branstrom AA, Sadoff JC. Attenuated Shigella as a DNA delivery vehicle for DNA-mediated immunization. Science, 1995, 270(5234): 299–302.
[52] Fennelly GJ, Khan SA, Abadi MA, et al. Mucosal DNA vaccine immunization against measles with a highly attenuated Shigella flexneri vector. J Immunol, 1999, 162(3): 1603–1610.
[53] Tabata Y, Ikada Y. Effect of the size and surface charge of polymer microspheres on their phagocytosis by macrophage. Biomaterials, 1988, 9(4): 356–362.
[54] Falo LD Jr, Kovacsovics-Bankowski M, Thompson K, et al. Targeting antigen into the phagocytic pathway in vivo induces protective tumor immunity. Nat Med, 1995, 1(7): 649–653.
[55] Hedley ML, Curley J, Urban R. Microspheres containing plasmid-encoded antigens elicit cytotoxic T-cell responses. Nat Med, 1998, 4(3): 365–368.
[56] Nobiron I, Thompson I, Brownlie J, et al. Co-administration of IL-2 enhances antigen-specifc immune responses following vaccination with DNA encoding the glycoprotein E2 of bovine viral diarrhea virus. Vet Microbiol, 2000, 76(2): 129–142.
[57] Nobiron I, Thompson I, Brownlie J, et al. Cytokine adjuvancy of BVDV DNA vaccine enhances both humoral and cellular immune responses in mice. Vaccine, 2001, 19(30): 4226–4235.
[58] Nobiron I, Thompson I, Brownlie J, et al. DNA vaccination against bovine viral diarrhoea virus induces humoral and cellular responses in cattle with evidence for protection against viral challenge. Vaccine, 2003, 21(17/18): 2082–2092.
[59] Mutwiri G, Pontarollo R, Babiuk S, et al. Biological activity of immunostimulatory CpG DNA motifs in domestic animals. Vet Immunol Immunopathol, 2003, 91(2): 89–103.
[60] Zhang S, Guo YJ, Sun SH, et al. DNA vaccination using bacillus-Calmette-Guerin-DNA as an adjuvant to enhance immune response to three kinds of swine diseases. Scand J Immunol, 2005, 62(4): 371–377.
[61] Quintana-Vazquez D, Vazquez-Blomquist DM, Galban Rodriguez E, et al. A vaccination strategy consisting of Semliki-Forest-virus (SFV) DNA prime and fowlpox-virus boost significantly protects mice from a recombinant (HIV-1) vaccinia virus infection. Biotechnol Appl Biochem, 2005, 41(1): 59–66.
[62] Sun Y, Liu DF, Wang YF, et al. A prime-boost vaccination strategy using a Semliki Forest virus replicon vectored DNA vaccine followed by a recombinant adenovirus protects pigs from classical swine fever. Chin J Biotech, 2009, 25(5): 679–685.孙元, 刘大飞, 王宇飞, 等. 猪瘟甲病毒复制子载体DNA疫苗与重组腺病毒活载体疫苗联合免疫效果评价.生物工程学报, 2009, 25(5): 679–685.
[63] Hariharan MJ, Driver DA, Townsend K, et al. DNA immunization against herpes simplex virus: enhanced efficacy using a Sindbis virus2 based vector. J Virol, 1998, 72(2): 950–958.
[64] Frolov I, Schlesinger S. Comparison of the effects of Sindbis virus and Sindbis virus replicons on host cell protein synthesis and cytopathogenicity in BHK cells. J Virol, 1994, 68(3): 1721–1727.
[65] Zhao HP, Sun JF, Li N, et al. Prime-boost immunization using alphavirus replicon and adenovirus vectored vaccines induces enhanced immune responses against classical swine fever virus in mice. Vet Immunol Immunopathol, 2009, 131(3/4): 158–166.
[66] Niu CS, Xiao SB, Fang LR, et al. Transduction function of pseudorabies virus VP22 protein and its enhancement of DNA vaccine immunogenicy//Proceedings of 10thCongress of Animal Infectious Disease Branch of Chinese Society of Animal Husbandry and Veterinary Medicine, 2003: 440.牛传双, 肖少波, 方六荣, 等. 伪狂犬病毒VP22的蛋白转导特性及其增强 DNA疫苗免疫的初步研究//中国畜牧兽医学会家畜传染病学分会成立 20周年庆典暨第十次学术研讨会论文集, 2003: 440.
[67] Dong XN, Chen YH. Marker vaccine strategies and candidate CSFV marker vaccines. Vaccine, 2007, 25(2): 205–230.

