南美蟛蜞菊毛状根诱导及其离体培养
欧少云,施和平,曾宝强
1 华南师范大学生命科学学院广东省植物发育生物工程重点实验室,广州 510631
2 清远职业技术学院,清远 511510
3 香港教育学院科学与环境学系,香港新界
利用发根农杆菌Agrobacterium rhizogenes Ri质粒的T-DNA片段在植物基因组中的插入、整合和表达所产生的生长迅速的毛状根培养物来产生植物尤其是药用植物的次生物质,已在人参Panax ginseng L.、褐脉少花龙葵Solanum nigrum L. var. pauciflorum、三裂叶野葛Pueraria phaseoloides L.和Ruta graveolens L.等药用植物中获得成功[1-4];同时由于 Ri质粒 TDNA的rol基因诱导产生的毛状根再生成植株具有诸如矮化、茎节数减少、花序缩短、开花延迟等特征[5];因而国内外已有不少学者在开展利用毛状根技术来改良植物观赏性状,尝试培育诸如矮化、花叶形态改变的新品种[6-7]。南美蟛蜞菊 Wedelia trilobata (L.) A.S.Hitche,别名三裂叶蟛蜞菊、属菊科多年生草本,花黄色且全年见花。有研究表明,南美蟛蜞菊含有具有化感作用的倍半萜内酯成分[8];同时它也是良好的耐阴地被植物和护坡好材料;但在用作园林绿化的地被植物使用时,由于其生长较快,节间长,必须定期进行人工修剪。因而,园艺生产上也迫切需要开发出矮化、节间显著缩短的南美蟛蜞菊品种来用作“地被”植物进行广场和坡地绿化种植。而有关南美蟛蜞菊的组织培养研究虽有少量报道[9],但到目前为止,未见利用发根农杆菌对南美蟛蜞菊遗传转化及其毛状根次生物质产生和植株再生的研究报道。为此,本研究拟通过发根农杆菌对南美蟛蜞菊叶片的遗传转化,产生出可自主生长的毛状根,并研究该毛状根液体培养周期中蔗糖、无机元素N、P和Ca的消耗变化,为今后利用该毛状根的离体培养来生产具有化感作用的次生物质,以及通过毛状根的组织培养来快速繁殖出矮化的、无需修剪的南美蟛蜞菊新品种等奠定实验和技术基础。
1 材料与方法
1.1 细菌菌株及培养
农杆碱型发根农杆菌 ATCC15834由德国马丁.路德大学的Peter Lindemann博士提供。挑取该农杆菌单菌落,接种于添加了20 µmol/L 乙酰丁香酮的YEB液体培养基中,28℃振荡 (160 r/min) 培养30 h后,供感染用。
1.2 外植体的制备
取南美蟛蜞菊植株的幼嫩叶片,在超净工作台上经70%酒精和0.1% HgCl2溶液常规消毒后,切成1 cm2左右具叶脉的叶片外植体,接种于无外源激素的MS培养基预培养24 h后,用于转化。
1.3 毛状根的诱导和培养
将上述预培养的叶片外植体浸入用MS培养基稀释 5倍的发根农杆菌 ATCC15834菌悬液中15 min,取出、吸干多余菌液并放回原培养基上共培养2 d后,转入MS+500 mg/L头胞噻肟钠的无外源激素的MS培养基上,在25℃每天14 h散射光下诱导毛状根。切取从外植体产生的毛状根置于含500 mg/L头胞噻肟钠的无外源激素的MS培养基上进行单根除菌培养,直到获得无菌的毛状根。
1.4 毛状根的PCR检测
取能在无外源激素的培养基上快速自主生长的无菌毛状根500 mg,按Ewards等[10]的方法提取毛状根基因组DNA,纯化后用作PCR扩增的模板。以南美蟛蜞菊非转化植株根的基因组总 DNA作对照。根据Furner等[11]发表的序列,设计并合成扩增rol B、rol C的PCR引物。根据Choi等[12]发表的序列设计并合成扩增vir C的PCR引物。Rol B引物:P1: 5'-GCTCTTGCAGTGCTAGATTT-3',P2:5'-GAA GGTGCAAGCTA CCTCTC -3';rol C引物:P1:5'-CTC CTG ACA TCA AAC TCG TC-3',P2:5'- TGC TTC GAG TTA TGG GTA CA-3';vir C引物:P1:5'-GGC TTC GCC AAC CAA TTT GGA GAT-3';P2:5'-TTT TGC TCC TTC AAG GGA GGT GCC-3' (引物由中国科学院上海细胞生物研究所合成)。
在0.2 mL的硅化离心管中加入50 ng模板DNA,Taq DNA聚合酶2个单位,PCR反应总体积为50 µL。PCR扩增参数如下:rol B、rol C基因扩增条件相同,其PCR扩增的反应参数为:94℃热变性3 min;94℃变性1 min,53.5℃退火1 min和72℃延伸反应1 min,进行35个循环;最后72℃延伸10 min。vir C基因的扩增条件为,94℃热变性5 min;94℃变性45 s,55℃退火45 s和72℃延伸反应2 min,进行30个循环;最后72℃延伸7 min。扩增产物采用0.8%琼脂糖凝胶电泳和EtBr染色进行分析。
1.5 培养过程中培养基蔗糖、硝态氮、无机磷、Ca2+含量的变化
将来自同一克隆系的生长旺盛的南美蟛蜞菊毛状根,切成长4~5 cm、具根尖的毛状根根段,接入盛有灭菌的 MS液体培养基中进行培养。起始接种量约为0.1 g FW/瓶,在为期42 d的培养过程中,每隔7 d随机抽取毛状根培养物3瓶;收取毛状根,用无菌水冲洗后、用滤纸吸干毛状根培养物表面的水分后测定其生物量。将毛状根取样后的 MS培养液过滤、去离子水定容后,供测定培养基残余的蔗糖、硝态氮、无机磷和 Ca2+的含量变化用。其中,培养基中蔗糖含量的测定、硝态氮含量的测定、无机磷含量的测定按照文献[13]的方法;培养液中Ca2+浓度的 EDTA络合滴定按照文献[14]的方法。实验重复测定3次,取平均值。
2 结果与分析
2.1 南美蟛蜞菊毛状根的诱导和培养
未感染的南美蟛蜞菊幼嫩叶片外植体在无外源激素的MS+500 mg/L头胞噻肟钠的培养基上连续培养25 d后无一生根,仅可见大部分的叶片外植体边缘变黄或变褐;仅个别叶片外植体的形态学下端切口中脉处产生少量浅黄绿色致密的愈伤组织。而感染发根农杆菌的叶片外植体培养7 d后,从其叶片切口中脉处或附近表面产生毛状根 (图 1A),或从叶脉处产生的浅黄绿色愈伤组织上产生毛状根;当从叶片外植体产生的毛状根置于光下培养10 d后,毛状根不仅快速生长,而且根呈紫红色 (图1B)。将所产生的毛状根切下并置于 MS+500 mg/L头胞噻肟钠中单根除菌培养,每隔7 d左右转接1次,约5~6次后即可完全除菌。无菌毛状根可在无外源激素的 MS固体或液体培养基上快速自主生长,且具较多分枝 (图1C)。所获得的可自主快速生长的毛状根置于无外源激素的 MS培养基中继代保存,供进行遗传转化鉴定用。
2.2 毛状根中rol基因的PCR扩增

图1 发根农杆菌ATCC15834诱导南美蟛蜞菊叶片外植体产生的毛状根及其培养Fig. 1 Hairy roots induced from leaf explants of W. trilobata after infection with A. rhizogenes ATCC15834 and its in vitro culture. (A) Hairy roots induced from leaf explants 10 days after infection. (B) Hairy roots from leaf explants cultured under light. (C) Hairy roots by liquid culture.

图2 南美蟛蜞菊毛状根vir C、rol B和rol C基因的PCR扩增产物的凝胶电泳分析Fig. 2 Gel electrophoresis analysis of PCR fragments of vir C, rol B and rol C genes amplified from the genomic DNA of W. trilobata hairy roots. 1: 1 kb DNA marker; 2, 6, 9: fragments amplified from the cells of A.rhizogenes ATCC15834. 3, 5, 8: fragments amplified from untransformed roots. 4, 7, 10: fragments amplified from hairy roots.
rol B 和 rol C 是发根农杆菌 Ri质粒TL-DNA(T-DNA 左臂) 上的两个生根基因,而vir C是Ri质粒中仅参与T-DNA转化过程但其本身并不整合进植物基因组中的毒性基因之一。本实验中,采用对毛状根基因组DNA进行vir C基因的PCR扩增,以确保毛状根的除菌效果。以vir C、rol B和rol C的引物分别从南美蟛蜞菊非转化根 (自然根)、毛状根基因组 DNA及发根农杆菌单菌落扩增产物的电泳结果如图2。从图2可见,利用rol B和rol C的PCR引物能从南美蟛蜞菊毛状根的总 DNA及发根农杆菌 ATCC15834 单菌落克隆中分别扩增到期望的540 bp和770 bp左右的特异性DNA片段,而从南美蟛蜞菊非转化根的总 DNA中扩增不到任何片段。而以vir C引物仅能从发根农杆菌ATCC15834单菌落中扩增出约650 bp的条带,而不能从南美蟛蜞菊非转化根和毛状根中扩增出任何片段。这说明,发根农杆菌含rol基因的RiT-DNA部分已在南美蟛蜞菊毛状根基因组中整合并得到表达。
2.3 南美蟛蜞菊毛状根的生长特性
将经遗传转化鉴定为阳性的南美蟛蜞菊无菌毛状根接种至液体MS培养基中培养1~2 d后,可观察到从毛状根根段开始产生出新的乳白色分枝根;而且随着培养时间的延长,根段不断伸长;同时发现,随着培养的进行,毛状根的颜色逐渐由白色变为浅紫色,较老部分呈绿色;培养28 d后,还可观察到小部分毛状根的起始根段处开始出现局部轻微褐化;35 d后,毛状根变得纤细,老化明显加重,色泽变暗,呈现墨绿色。图3为南美蟛蜞菊毛状根在液体培养过程中的生长变化曲线。从图3可见,南美蟛蜞菊毛状根的生长曲线基本符合“S”型。0~7 d内处于生长迟滞期;7~21 d为快速生长期;21 d后进入生长减慢期;35 d后,毛状根生物量增长呈下降的趋势,此时还可观察到大部分毛状根表面出现不同程度地褐化,并发现在毛状根培养过程中可能不断向培养基中分泌次生代谢产物,并最终使培养基颜色由开始时的无色逐渐变成黄绿色。

图3 南美蟛蜞菊毛状根液体培养生长曲线Fig. 3 Growth curve of W. trilobata hairy roots cultured in liquid MS medium.
2.4 毛状根液体培养过程中培养基蔗糖浓度的消耗变化
图4为南美蟛蜞菊毛状根液体培养过程中培养基蔗糖的消耗变化。从图 4可见,在毛状根液体培养过程中,培养基中蔗糖被快速吸收和利用,表现在其浓度急剧下降;培养至7 d时,培养基中蔗糖被消耗近50%;而随着培养时间的延长培养基的蔗糖浓度不断降低;培养至35 d时,培养基的蔗糖浓度仅约为其起始浓度的 3.39%。这表明对南美蟛蜞菊毛状根生长而言,其培养基中的蔗糖代谢较快,其代谢周期约为35 d左右。
2.5 毛状根液体培养过程中培养基 NO3−-N的消耗变化

图4 南美蟛蜞菊液体培养过程蔗糖的消耗变化Fig. 4 Changes of sucrose content in the medium during liquid culture of W. trilobata hairy roots.

图5 南美蟛蜞菊毛状根液体培养过程中培养基中硝态氮含量的变化Fig. 5 Changes of NO3−-N content in the medium during liquid culture of W. trilobata hairy roots.
图5为南美蟛蜞菊毛状根液体培养过程中培养基中NO3−-N的消耗变化。从图5可见,在毛状根液体培养的0~7 d内,培养基中硝态氮被迅速消耗;培养至7 d,培养基的硝态氮含量约为其起始硝态氮含量的5.8%;而培养至35 d时,培养基的硝态氮含量降到最低,约0.01 mg/mL,约为培养基起始硝态氮含量的1.82%,而此时毛状根的生物量 (鲜重)也达到最大;但培养35 d以后,培养基的硝态氮含量又呈略升高的趋势,至结束培养时培养基的硝态氮含量仅约为起始浓度的 4.28%。该结果表明,在液体摇瓶培养时,南美蟛蜞菊毛状根对硝态氮的利用迅速,其培养基硝态氮的代谢周期约为35 d。
2.6 毛状根液体培养过程中培养基 Ca2+的消耗变化
图6为南美蟛蜞菊毛状根液体培养过程中培养基Ca2+的代谢变化。从图6可见,培养基中Ca2+浓度随着培养时间的延长逐渐降低,但与培养基硝态氮的消耗变化相比,毛状根对 Ca2+的吸收和利用速度相对较慢且不完全;培养至35 d时,培养基中仍残存有占起始浓度约61.3%的Ca2+。这表明,虽然钙是南美蟛蜞菊毛状根生长所必需的矿质元素,但它对钙的吸收和利用要比氮源 (硝态氮) 慢得多。
2.7 毛状根液体培养过程中培养基无机磷的消耗变化
图7为南美蟛蜞菊毛状根液体培养过程中培养基无机磷的代谢变化。从图 7可见,培养基的无机磷被快速消耗,其浓度急剧下降;培养 7 d后,培养基的无机磷浓度只约为其起始浓度的 1.76%;这表明在液体培养过程中毛状根对无机磷的吸收和代谢很快;而在随后的培养时间内,培养基的无机磷浓度变化不大。这表明与硝态氮一样,无机磷是南美蟛蜞菊毛状根生长所必需的矿质元素,而且毛状根对磷的吸收和利用要比Ca2+快得多。
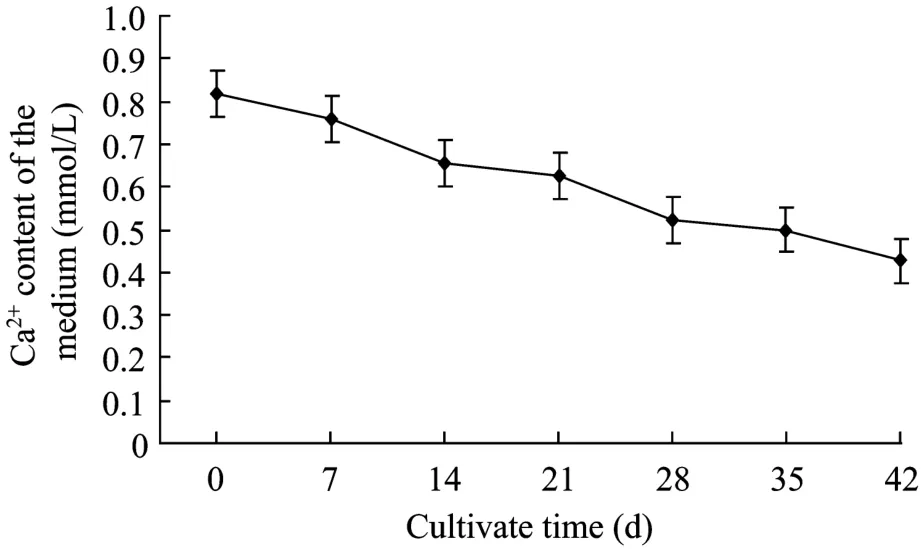
图6 南美蟛蜞菊毛状根液体培养过程中培养基钙含量的变化Fig. 6 Changes of Ca2+ content in the medium during liquid culture of W. trilobata hairy roots.

图7 毛状根液体培养过程培养液中无机磷含量的变化Fig. 7 Changes of phosphorus content in the medium during liquid culture of W. trilobata hairy roots.
3 讨论
利用发根农杆菌 Ri质粒的遗传转化产生生长迅速的毛状根,已在人参 P. ginseng、褐脉少花龙葵S. nigrum L. var. pauciflorum和三裂叶野葛P. phaseoloides等多种植物中获得成功[1-3]。但至今为止,未见有关利用发根农杆菌对南美蟛蜞菊遗传转化获得毛状根的正式报道。在本实验中,利用含野生农杆碱型Ri质粒的发根农杆菌ATCC15834对南美蟛蜞菊的遗传转化,获得了能在无激素培养基上自主生长的毛状根,而且发现所获得的离体培养毛状根提取物中分离到可抑制多种种子萌发的具有化感作用的物质 (另文发表);同时,所获得的毛状根为接下来通过毛状根组织培养途径繁殖出具矮化等性状的、无需修剪的南美蟛蜞菊新品种奠定了实验和技术基础。此外,在本实验中观察到,发根农杆菌ATCC15834感染南美蟛蜞菊叶片外植体后,毛状根可从叶片外植体的叶脉切口处直接产生,或从切口处形成的浅黄绿色愈伤组织上产生。然而,Bercetche等报道,被发根农杆菌感染后,发现毛状根仅从胡萝卜块根外植体的愈伤组织及烟草茎段外植体形成的愈伤组织上产生[15];但也有报道表明,马铃薯Solanum tuberosum L.的毛状根可从其叶片和块茎外植体切口处直接产生,但其茎段外植体被发根农杆菌感染后,毛状根只从茎段外植体的愈伤组织上产生[16],这与本实验的结果不一致。在本实验中,发根农杆菌ATCC15834感染南美蟛蜞菊叶片外植体后,毛状根可从叶片外植体的叶脉切口处直接或从形成的浅黄绿色愈伤组织上再产生出毛状根。而这种差异的产生可能与植物的类型及所取的外植体的类型等有关。
研究培养基中主要营养元素的代谢变化是建立和确定南美蟛蜞菊毛状根的最佳离体培养条件及利用该毛状根进行药用次生代谢物质生产的前提和基础。蔗糖作为毛状根培养基中最常用的碳源和能源,以往的研究几乎都集中在研究培养基的蔗糖浓度对毛状根生长及其次生代谢物积累的影响,而对毛状根培养过程中蔗糖本身的代谢或消耗速率的变化与毛状根生长的关系研究较少[17-18]。在何首乌Polygonium multiflorum Thunb毛状根培养过程中,培养基中蔗糖的消耗变化与毛状根的生长速率呈正相关[17]。而胡之璧等在培养丹参Salvia miltiorrhiza Bge毛状根时发现,培养基的蔗糖在16 d内消耗完毕[18]。此外,在玫瑰茄Hibiseus sabdariffa L.细胞悬浮培养时也发现,培养基的蔗糖在培养至16 d时已全部被吸收利用[19]。而三裂叶野葛毛状根液体培养0~4 d的生长停滞期内,培养基的蔗糖被消耗了极少部分,但在培养4~16 d的毛状根生长时期,培养基的蔗糖被迅速消耗;培养至16 d时几乎被消耗完毕[20],而这与本实验的结果类似。在本实验中,培养基的蔗糖被快速吸收和利用,培养至 7 d时,培养基中蔗糖被消耗近50%;而随着培养时间的延长培养基的蔗糖浓度不断降低;培养至35 d时,培养基中的蔗糖浓度仅约为其起始浓度的3.39%。然而,在培养火焰菜Beta vulgaris L.毛状根时发现,在接种后3 d内,毛状根还处于生长停滞期时,培养基的蔗糖就会被迅速消耗,其蔗糖浓度急剧下降,降幅达50%[21]。而郭志刚等在培养栝楼Trichosanthes kirilowii Maxim.毛状根时也发现,接种后3~4 d的生长停滞期内,毛状根的生物量积累虽很小,但其培养基中的蔗糖浓度却快速下降[22]。这显然与本实验的结果不一致。作者认为,这种差异的产生说明培养基的蔗糖消耗可因植物种类和培养体系的不同而有所差别。
硝态氮是毛状根培养基中最重要的氮源之一。迄今为止,关于培养基中氮源 (硝态氮和铵态氮) 的含量或种类及其配比对毛状根的生长及其次生代谢产物的影响已有一些研究报道[23-25]。如高浓度氮会抑制总黄酮合成,而硝态氮在总氮中含量大于50%时更有利于水母雪莲Saussurea medusa Maxim毛状根的生长和次生物质总黄酮的积累[23]。而且发现,培养基中硝态氮和铵态氮的比率还能明显影响颠茄Atropa belladonna L.毛状根的生长及其次生物质东莨菪碱/天仙子胺的比率;而降低培养基的硝态氮浓度还可促进毛状根中生物碱的产生[24]。此外,在培养基中添加NO3−能使Datura candida × D. aurea毛状根的生物量增加及显著提高天仙子胺生物碱的含量,但同时会使毛状根的东莨菪碱 (Scopolamine)含量明显降低[25]。可见,培养基的氮含量是影响毛状根生长及其代谢的一个非常重要的因素。然而,相比之下,对毛状根培养过程中培养基氮源本身的消耗速率与毛状根生长的关系的研究较少。在培养栝楼T. kirilowii毛状根时,培养基中铵态氮和硝态氮随着生长的进行而被逐渐消耗,在培养24 d时铵态氮已被完全消耗,而此时仍有17%的硝态氮未被消耗和利用[22];然而,在高山红景天 Rhodiola Sachalinensis A. Bor. 细胞悬浮培养中却观察到,其培养基中 NO3−/NH4+浓度比几乎为一恒定值[26]。而三裂叶野葛毛状根液体培养20 d后,其培养基的硝态氮和铵态氮均被消耗殆尽[20]。而这些与本实验的结果不完全一致。在本实验中,在南美蟛蜞菊毛状根液体培养的0~7 d内,培养基的硝态氮被迅速消耗;培养至7 d时,培养基的硝态氮含量只剩下起始硝态氮含量的5.8%;而培养至35 d时,培养基的硝态氮含量降到最低,约0.01 mg/mL,约占培养基起始硝态氮含量的1.82%;但培养35 d以后,培养基中的硝态氮含量又呈略升高的趋势,至结束培养时培养基的硝态氮含量约占起始浓度的 4.28%。而这种差异的产生可能与毛状根的类型及植物种类等有关。而在毛状根生长达到高峰以后,培养基的硝态氮含量出现回升,这可能与毛状根的老化导致细胞死亡自溶并向培养液释放硝态氮有关。
与氮一样,磷(P) 也是毛状根生长发育及其次生代谢调节的必需元素,它的消耗变化或供给状态可反映或影响毛状根的生长和代谢状况。目前对于可离体自主生长的毛状根而言,有关其培养过程中培养基磷的消耗变化已有少量研究报道。如三裂叶野葛毛状根培养16 d 时培养基中的PO43−被消耗殆尽[20]。而在培养长春花Catharanthus roseus L.毛状根时发现,培养基的磷酸盐在培养8 d后就被全部消耗完毕[27]。而王玉春等[28]发现,在青蒿Artemisia annua L.毛状根的液体培养过程中,培养液的铵态氮、硝态氮和磷酸盐的消耗变化都与毛状根的生长成正相关,其中尤以磷酸盐的消耗最快,约在接种后15 d被完全吸收。而这与本实验的结果不完全一致。在本实验中,南美蟛蜞菊毛状根液体培养过程中培养基的无机磷被快速消耗,其浓度急剧下降,培养7 d后,培养基的无机磷浓度就下降至只约为其起始浓度的 1.76%,表明南美蟛蜞菊毛状根对磷的代谢很快。
与磷一样,钙也是植物细胞生长发育必需的矿质元素之一。有研究表明,培养基中的 Ca2+浓度或Ca2+拮抗剂等能提高水蓼 Polygonum hydropiper L.悬浮细胞黄酮醇的产量[29]或促进长春花C. roseus L.毛状根中吲哚生物碱的产生和释放[27]。而在三裂叶野葛毛状根培养过程中发现,培养基的 Ca2+可被毛状根逐渐吸收和利用,但与培养基的磷酸盐、铵态氮和硝态氮的消耗变化相比,毛状根对 Ca2+的吸收速度慢且利用不完全[20]。而这与本实验的结果类似。在本实验南美蟛蜞菊毛状根液体培养过程中,培养液的 Ca2+含量也呈现逐渐下降趋势,但毛状根对Ca2+的吸收和利用速度相对较慢且不完全;甚至培养至35 d时,培养基中仍残存有占起始浓度约61.3%的Ca2+。
本实验结果表明,培养基的蔗糖、硝态氮、磷、钙离子的消耗变化可因植物毛状根的种类和培养体系的不同而有所差别,而通过对培养基中蔗糖、硝态氮、磷、钙离子的消耗变化的测定,将能为大规模培养毛状根时确定培养周期以及整个培养周期中碳源、氮源、钙盐等的供给量提供理论依据和技术参数。本实验结果为今后利用南美蟛蜞菊毛状根的规模培养来生产具化学它感作用的次生物质,以及通过毛状根组培途径快繁出节间缩短的矮化新品种奠定了实验和技术基础。
REFERENCES
[1] Yoshikawa T, Furuya T. Saponin production by cultures of Panax ginseng transformed with Agrobacterium rhizogenes. Plant Cell Rep, 1987, 6: 449−453.
[2] Wu XF, Shi HP, Tsang PK Eric. Induction and in vitro culture of hairy roots of Solanum nigrum L. var. pauciflorum Liou and its solasodine production. J Mol Cell Biol, 2008, 41(3): 183−191.吴晓凤, 施和平, Tsang PK Eric. 褐脉少花龙葵毛状根的诱导、培养及其澳洲茄胺的产生. 分子细胞生物学报, 2008, 41(3): 183−191.
[3] Shi HP, Liang P, Kintzios S. Culture of hairy roots in Pueraria phaseoloides and its puerarin production. Acta Biol Experi Sin, 2003, 36(6): 407−413.施和平, 梁朋, Kintzios S. 三裂叶野葛毛状根的培养及其葛根素的产生. 实验生物学报, 2003, 36(6): 407−413.
[4] Sidwa-Gorycka M, Krolicka A, Orlita A,et al. Genetic transformation of Ruta graveolens L. by Agrobacterium rhizogenes: hairy root cultures a promising approach for production of coumarins and furanocoumarins. Plant Cell, Tissue and Organ Culture, 2009, 97: 59−69.
[5] Koike Y, Hoshino Y, Mii M, et al. Horticultural characterization of Angelonia salicariifolia plants transformed with wild-type strains of Agrobacterium rhizogenes. Plant Cell Rep, 2003, 21: 981−987.
[6] Winefield C, Lewis D, Arathoon S, et al. Alteration of Petunia plant form though the introduction of the rolC gene from Agrobacterium rhizogenes. Mol Breeding, 1999, 5: 543−551.
[7] Christensen B, Sriskandarajah S, Serek M, et al. Transformation of Kalanchoe blossfeldiana with rol-genes is useful in molecular breeding towards compact growth. Plant Cell Rep, 2008, 27: 1485–1495.
[8] Zhang YH, Liu MF, Ling TJ, et al. Allelopathic sesquiterpene lactones from Wedelia trilobata. J Tropical Subtropical Bot, 2004, 12(6): 533−537.张玉虎, 刘梅芳, 凌铁军, 等. 三裂叶南美蟛蜞菊中的倍半萜内酯成分及其化感作用. 热带亚热带植物学报, 2004, 12(6): 533−537.
[9] Liu JX, Yu YX, Xu SX, et al. Tissue culture and rapid propagation of Wedelia trilobata Hitchc. Plant Physiol Commun, 2008, 44(1): 117.刘娟旭, 余义勋, 许淑贤, 等. 南美蟛蜞菊的组织培养与快速繁殖. 植物生理学通讯, 2008, 44(1): 117.
[10] Edwards K, Johnstone C, Thompson C. A simple and rapid method for the preparation of plant genomic DNA for PCR analysis. Nucleic Acids Res, 1991, 19: 1349.
[11] Furner I, Huffman G, Amasino R, et al. An Agrobacterium transformation in the evolution of the genus Nicotiana. Nature, 1986, 319: 422−427.
[12] Choi PS, Kim YD, Choi KM, et al. Plant regeneration from hairy roots culture transformed by infection with Agrobacterium rhizogenes in Catharanthus roseus. Plant Cell Rep, 2004, 22: 828−831.
[13] Zhang ZL, Zhai WJ. A Text-Manual for Plant Physiology. 3rd ed. Beijing: Higher Education Press, 2003: 48–52, 128–129.张志良, 翟伟菁. 植物生理学实验指导. 3版. 北京: 高等教育出版社, 2003: 48–52, 128–129.
[14] Ruan XY, Su YL. Experiments for Analytic Chemistry. Guangzhou: Guangdong Higher Education Press, 1998: 124–128.阮湘元, 苏亚玲. 分析化学实验. 广州: 广东高等教育出版社, 1998: 124–128.
[15] Bercetche J, Chriqui D, Adam S, et al. Morphogenetic and cellular reorientiation induced by Agrobacterium rhizogenes(strains 1855, 2659 and 8196) on carrot, pea and tobacco. Plant Sci, 1987, 52: 195–210.
[16] Ottani MP, Schel JHN, Hanisch ten Cate ChH. Variation in structure and plant regeneration of Agrobacterium rhizogenes transformed and control roots of the potato cv Bintje. Plant Cell, Tissue and Organ Culture, 1990, 20: 25–34.
[17] Wang L, Yu RM, Zhang H, et al. Hairy root culture of Polygonium multiflorum Thunb and the production of its active constituents anthraquinones. Chin J Biotech, 2002, 18(1): 69−73.王莉, 于荣敏, 张辉, 等. 何首乌毛状根培养及其活性成分的产生. 生物工程学报, 2002, 18(1): 69−73.
[18] Hu ZB, Alfermann AW. Diterpenoid production in hairy root cultures of Salvia miltiorrhiza. Phytochemistry, 1993, 32(2): 699−703.
[19] Hou XW, Guo Y. The effect of various carbon sources on the assimilation of nutrients in Roselle suspension culture. Guihaia, 1999, 19(1): 73−77.侯学文, 郭勇. 不同碳源对悬浮培养玫瑰茄细胞主要基质消耗的影响. 广西植物, 1999, 19(1): 73−77.
[20] Zhang Y, Shi HP, Luo GY. Relationship between growth and medium nutrient consumption during the culture of Pueraria phaseoloides hairy roots. Life Sci Res, 2007, 11(1): 52−57.张艳, 施和平, 罗刚跃. 三裂叶野葛毛状根的生长及其培养基营养物质的消耗变化. 生命科学研究, 2007, 11(1): 52−57.
[21] Shin KS, Chakrabarty D, Ko JY, et al. Sucrose utilization and mineral nutrient uptake during hairy root growth of red beet (Beta vulgaris L.) in liquid culture. Plant Growth Regul, 2003, 39: 187−193.
[22] Guo ZG, Diao JY, Liu RZ , et al. Kinetics of growth and nutrition depletion in hairy roots of Trichosanthesis kirilowii. Biotechnology, 2001, 11(5): 18−20.郭志刚, 刁劲羽, 刘瑞芝, 等. 栝楼毛状根的生长与营养消耗动态研究. 生物技术, 2001, 11(5): 18–20.
[23] Yang R, Fu CX, Jin ZP, et al. Effects of physical and chemical factors on hairy root growth and flavonoids biosynthesis in the cultures of Saussurea medusa Maxim hairy root. Chin J Biotech, 2005, 21(2): 233−238.杨睿, 付春祥, 金治平, 等. 不同理化因子对雪莲毛状根生长和总黄酮生物合成的影响. 生物工程学报, 2005, 21(2): 233−238.
[24] Bensaddek L, Gillet F, Saucedo Jen, et al. The effect of nitrate and ammonium concentrations on growth and alkaloid accumulation of Atropa belladonna hairy roots. J Biotech, 2001, 85: 35−40.
[25] Nussbaumer P, Kapetanidis I, Christen P. Hairy roots of Datura candica × D. aurea: effect of culture medium composition on growth and alkaloid biosynthesis. Plant Cell Rep, 1998, 17: 405−409.
[26] Xu JF, Han AM, Feng PS. Growth, nutrient uptake and stoichiometry in suspension culture of Rhodiola sachalinensis A.Bor. Chin J Appl Environ Biol, 1997, 3(2): 100−105.许建峰, 韩爱明, 冯朴荪. 高山红景天细胞悬浮培养生长和营养成分摄取动力学及其计量关系. 应用与环境生物学报, 1997, 3(2): 100−105.
[27] Moreno-Valenzuela O, Minero-Garcia Y, Chan W, et al. Increase in the indole alkaloid production and its excretion into the culture medium by calcium antagonists in Catharanthus roseus hairy roots. Biotech Lett, 2003, 25(16): 1345−1349.
[28] Wang YC, Liu CZ, Zhao B, et al. Kinetics and stoichiometry in suspension culture of Artemisia annua L. hairy roots. Eng Chem Metallurg, 2000, 21(1): 42−46.王玉春, 刘春朝, 赵兵, 等. 青蒿毛状根悬浮培养动力学及其计量关系. 化工冶金, 2000, 21(1): 42−46.
[29] Nakao M, Ono K, Takio S. The effect of calcium on flavanol production in cell suspension cultures of Polygonum hydropiper. Plant Cell Rep, 1999, 18: 759−763.

