PHD finger protein 8蛋白多克隆抗体的制备、纯化与检测
蔡荣,叶昕
中国科学院微生物研究所,北京 100101
PHD finger protein 8蛋白多克隆抗体的制备、纯化与检测
蔡荣,叶昕
中国科学院微生物研究所,北京 100101
PHD finger8 (PHF8) 蛋白是最新发现的一种带有PHD结构域和Jmjc结构域的蛋白。现有研究表明其可能在基因转录、组蛋白去甲基化等方面发挥重要作用。为研究其功能,本研究构建原核表达载体pET41b-PHF8 (aa886-936),在大肠杆菌Escherichia coli BL21中诱导表达带有GST标签的PHF8 (aa886-936) 亲水片段融合蛋白,并纯化该片段作为抗原免疫家兔,再以CNBr活化Sepharose 4B微珠纯化抗血清制备PHF8特异性多克隆抗体。Western blotting以及免疫荧光检测表明该抗体具有很好的特异性,同时免疫荧光染色的结果也表明PHF8蛋白定位于细胞核。
PHF8,多克隆抗体,亲和纯化
1 材料与方法
1.1 材料
E. coli Top10、BL21菌株和HeLa细胞株由实验室 保 存 ; pCMV-SPORT6-PHF8 质 粒 购 于Openbiosystem。CNBr活化 Sepharose 4B微珠和Glutathione Sepharose 4B微珠购于GE Health公司;限制性内切酶、Pyrobest酶、dNTPs购于TaKaRa公司;IPTG购于 Merck公司;多聚甲醛购于 Sigma公司。
1.2 表达载体构建
在 GenBank查得此基因序列信息,用 BioEdit软件分析其疏水性和抗原性,选取aa886-936这一段作为免疫家兔的抗原。以购买的 pCMV-SPORT6-PHF8载体为模板,用上游引物 (5′-cgGAATTCgcaaaa gaagaaatatatc-3′) 和下游引物 (5′-tacgGTCGACttcact caggaggaggcagggg-3′) PCR扩增 PHF8 (aa886-936)片段。扩增条件为:94℃ 1 min, 55℃ 45 s,72℃ 20 s,24个循环。PCR产物经纯化后和pET41b载体分别经EcoR I和Sal I双酶切并回收。回收的载体和片段经T4 DNA连接酶16℃连接过夜,转化入E. coli Top10菌株。挑取的阳性克隆经测序证实为所要的克隆。
1.3 抗原蛋白的表达与纯化
将以上构建的质粒转入E. coli BL21菌株。用终浓度0.5 mmol/L的IPTG诱导GST融合蛋白表达。离心收集菌体后用10倍菌体积的PBS将其重悬,在终浓度2 mmol/L PMSF下超声裂解。裂解液经12 000 × g,4℃离心10 min后取上清。诱导表达的蛋白在 N端带有 GST标签,可以用 Glutathione Sepharose 4B微珠亲和纯化。将适量 Glutathione Sepharose 4B微珠加入上清中,4℃结合4 h后,用10倍微珠体积的PBS洗去非特异性结合。洗过的微珠用100 mmol/L的谷胱甘肽4℃洗脱。洗脱下的蛋白用PBS透析后经SDS-PAGE电泳检测其纯度和浓度,符合要求即可用于家兔的免疫。
1.4 兔抗PHF8蛋白抗体血清的制备
将上述抗原混入同等体积的弗氏完全佐剂免疫家兔。雌性家兔背部皮下取三点注射,每次免疫使用抗原0.5 mg,体积1 mL。每隔2周免疫1次,免疫3次后用间接ELISA法检测抗血清效价。效价符合要求后按常规方法采集血清,血清中加入 0.01%的叠氮化钠分装,−20℃保存。
1.5 抗体亲和纯化
CNBr活化Sepharose 4B微珠各400 µL分别结合GST蛋白和GST-PHF8 (aa886-936) 融合蛋白形成共价偶联。偶联后的微珠用于后续的亲和纯化。
首先用Sepharose 4B-GST微珠除去抗血清中的GST抗体。400 µL微珠加入6 mL兔抗血清在纯化柱中4℃孵育过夜,然后过柱子收集上清用于下一步纯化。Sepharose 4B-GST柱子用100 mmol/L甘氨酸(pH 2.7) 洗脱GST抗体之后按说明书以高盐缓冲液和低盐缓冲液平衡。收集的上清再次通过平衡后的柱子以彻底除去血清中的GST抗体。
除去抗血清中的GST抗体后,再用CNBr活化的Sepharose 4B-GST-PHF8 (aa886-936) 微珠亲和纯化其中的PHF8抗体。室温下将该上清 3次通过400 µL柱子,使其中的PHF8抗体与微珠上共价偶联的抗原充分结合。然后 10倍体积 PBS过柱子 3次除去非特异性结合。再用3 mL pH 2.7的100 mmol/L甘氨酸洗脱PHF8抗体,600 µL分装1管。最后用pH 8.0的Tris-HCl调pH至7.0,加入0.01%的叠氮化钠4℃保存。
1.6 免疫印迹法检测
取转染质粒 pFLAG-CMV2-PHF8过表达FLAG-PHF8蛋白以及pFLAG-CMV2空载体的293T细胞裂解液和未转染质粒的 293T细胞裂解液SDS-PAGE电泳、转膜之后进行Western blotting实验。实验中,一抗为纯化得到的抗体,二抗为带辣根过氧化物酶的羊抗兔抗体。
1.7 免疫荧光染色检测
将 HeLa细胞置于玻片上,24 h后收样,PBS洗过之后用4%多聚甲醛室温固定10 min。固定后的细胞用1%TritonX-100 PBS打孔1 min,然后以10%山羊血清0.5%NP-40 PBS室温封闭1 h。随后一抗37℃室温孵育1 h,荧光二抗避光室温孵育1 h。最后DAPI染色后封片在荧光显微镜下观察。
2 实验结果
2.1 抗原蛋白的制备
将构建好的 pET41b-PHF8 (aa886-936) 质粒转化到E. coli BL21工程菌株,扩大化培养。菌体经IPTG诱导后取样进行SDS-PAGE蛋白电泳,考马斯亮蓝染色结果表明该融合蛋白表达正常。将菌体超声裂解后取上清,加入适量 Glutathione Sepharose 4B微珠进行亲和纯化,获得纯度较高的GST融合蛋白。获得的蛋白溶液经透析之后取5 µL样进行SDS-PAGE电泳和考马斯亮蓝染色检测,结果表明已制得纯度和浓度都较高的融合蛋白 (图1)。
2.2 抗血清的获得
将纯化后的抗原加入等体积弗氏完全佐剂,免疫家兔。3次免疫之后血清采样用于ELISA检测。结果表明免疫 2只家兔获得的抗血清效价均大于100 000,效价较高。
2.3 PHF8抗体亲和纯化
通过 GST-Sepharose 4B微珠除去抗血清中的GST抗体之后,结合在 Sepharose 4B微珠上的GST-PHF8 (aa886-936) 抗原特异性地和抗血清中的PHF8抗体相结合。用3 mL的pH 2.7的甘氨酸洗脱PHF8抗体,每600 µL分装1管。每管分别取1 µL样进行 SDS-PAGE电泳,并进行考马斯亮蓝染色(图 2)。染色结果表明通过实验得到了纯度较高的PHF8抗体,其中第2管的纯度和浓度都最高。
2.4 纯化抗体的免疫印迹检测
为检测纯化抗体的特异性,取转染质粒pFLAG-CMV2-PHF8过表达PHF8蛋白的293T细胞裂解液和未转染质粒的293T细胞裂解液,用制得的抗体进行免疫印迹检测。制得的抗体分别检测到了内源以及外源过表达的 PHF8蛋白,条带清晰,表明抗体具有很好的特异性 (图3)。
2.5 免疫荧光染色
将 HeLa细胞置于玻片上再转染质粒 pFLAGCMV2-PHF8,收样后依照上述方法分别以 FLAG抗体和PHF8抗体为一抗进行免疫荧光染色分析。未转染质粒的 HeLa细胞也同样固定进行了染色分析。结果显示PHF8蛋白广泛分布在细胞核中,并在某些区域形成致密的点状结构 (图 4)。PHF8抗体和FLAG抗体所得到的结果一致,而兔IgG染色未检测到信号,也表明制得的抗体具有很好的特异性。
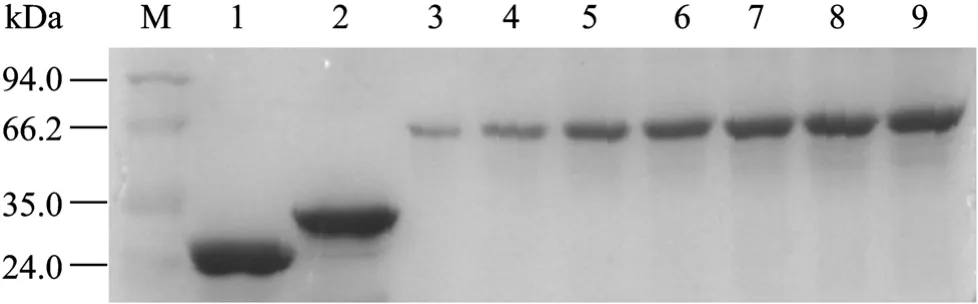
图1 GST-PHF8 (aa886-936) 蛋白的纯化Fig. 1 Purification of GST-PHF8 (aa886-936) fusion protein. M: protein marker; 1: GST protein; 2: GST-PHF8 (aa886-936) fusion protein; 3−9: BSA proteins, they were loaded in the order of 0.5 µg, 1.0 µg, 2.0 µg, 2.5 µg, 3.0 µg and 3.5 µg.
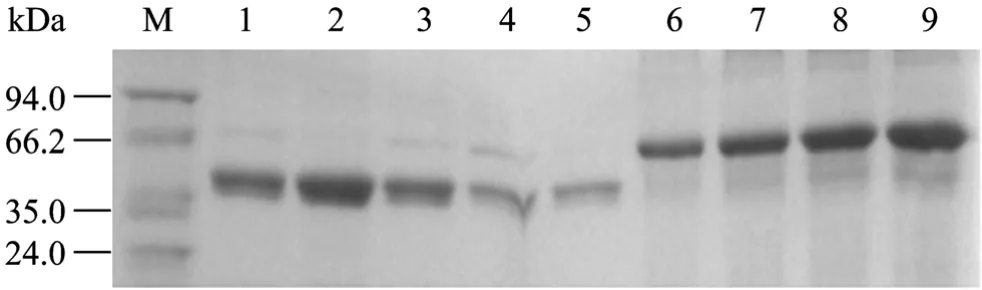
图2 亲和纯化后的PHF8抗体Fig. 2 Affinity Purified PFH8 antibody. M: protein marker; 1−5: purified PHF8 antibody, elution 1 to 5; 6−9: BSA proteins were loaded in the order of 1 µg, 2 µg, 3 µg and 4 µg.

图3 免疫印迹检测293T细胞中的PHF8蛋白Fig. 3 Detection of PHF8 protein in 293T cells by Western blotting. 1: cell lysate from 293T cells transfected with pFLAG-CMV2-PHF8; 2: 293T cells transfected with pFLAG-CMV2; 3: 293T cell lysate.
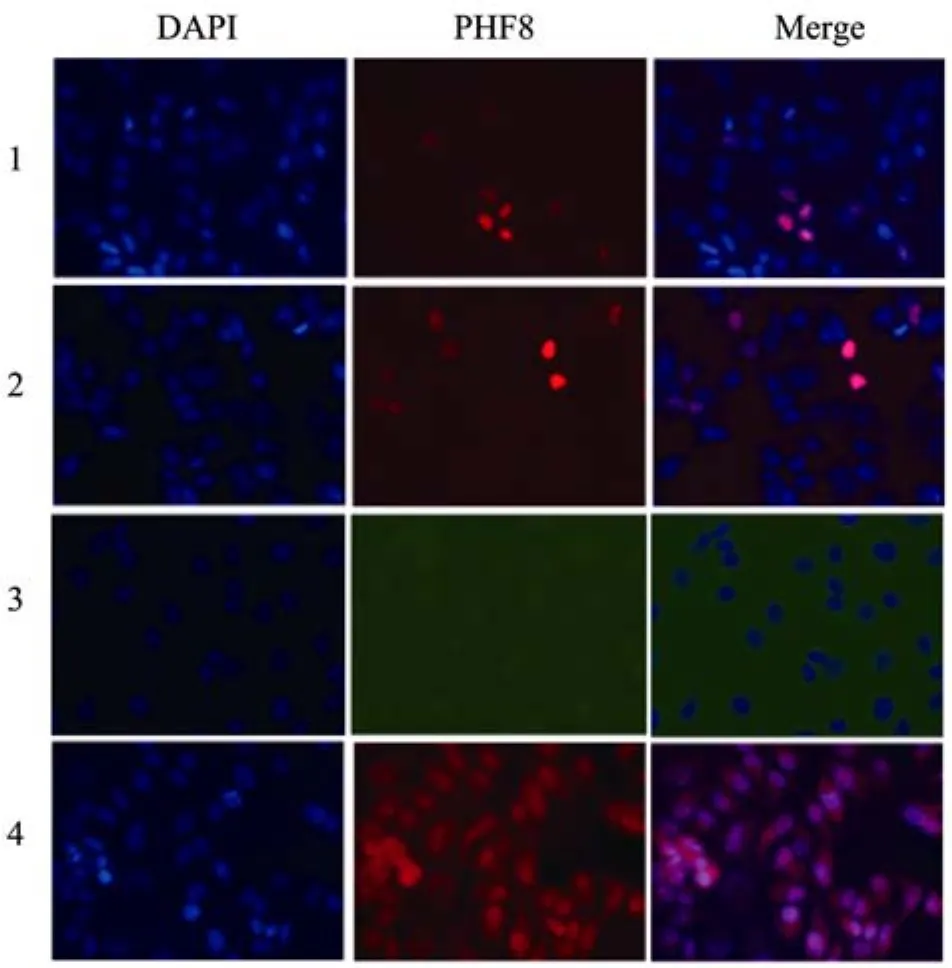
图4 纯化的抗体以及FLAG抗体对PHF8的免疫荧光染色Fig. 4 Immunofluorescence of PHF8 protein in HeLa cells with purified antibody. 1: HeLa cells were transfected with pFLAG-CMV2-PHF8 and immunostained with FLAG antibody as a positive control; 2: HeLa cells were transfected with pFLAG-CMV2-PHF8 and immunostained with PHF8 antibody; 3: HeLa cells were immunostained with Rabbit IgG as a negative control; 4: HeLa cells were immunostained with PHF8 antibody. Nuclei were labeled with DAPI (blue).
3 讨论
为研究 PHF8蛋白的功能,本实验以免疫家兔获得抗血清,再亲和纯化抗血清制备 PHF8多克隆抗体。实验所选取的抗原具有较好的免疫原性和亲水性,免疫家兔得到了效价较高的抗血清。抗血清的成分比较复杂,直接用于实验往往非特异性信号较多而影响观察。为得到高特异性的抗体,需要对抗血清中的抗体进行纯化。
实验室一般使用膜纯化、柱纯化或者分级沉淀[14]的方法进行亲和纯化。膜纯化是较早出现的一种方法[15],即将抗原通过SDS-PAGE电泳之后转移到硝酸纤维膜上,然后使膜和抗血清充分结合使抗血清中的抗体和膜上的抗原在膜上形成复合物,再将结合到膜上的抗体洗脱下来。这种方法由于抗原量的限制,得到的抗体量较少,而且抗原也可能从硝酸纤维膜上洗脱下来掺入抗体之中,影响抗体的纯度。柱纯化因使用填料的种类也分为不同的类型。如使用A蛋白珠子[16]结合抗血清中的抗体进行初步的纯化。或者使用 Sepharose微珠[17]结合抗原作为填料以增加抗体的特异性。但这种方法里微珠和抗原也是以氢键、疏水堆积等作用力结合,与抗原抗体结合作用力类似,因而对洗脱抗体的条件要求较苛刻,否则抗原依然会一起洗脱下来。柱纯化的方法能制得大量的抗体,其难点在于提高抗体的纯度。
本实验中使用CNBr活化Sepharose 4B微珠[18]作为填料进行柱纯化。抗原能和这种微珠形成稳定的共价结合,因而不会随抗体一起洗脱下来。这种方法不仅提高了抗原的纯度,也能使抗体更彻底地洗脱下来,提高了抗体的总量。本实验通过这种方法得到了大量 PHF8多克隆抗体,并用免疫印迹的方法验证其特异性。用该抗体进行免疫荧光染色的结果则表明 PHF8蛋白定位在细胞核内。它在核内有着广泛的分布,并在某些地方形成致密的点状结构。制得高特异性抗体为 PHF8蛋白的功能研究打下了良好的基础。
REFERENCES
[1] Massagué J. G1 cell-cycle control and cancer. Nature, 2004, 432(7015): 298–306.
[2] Geng Y, Lee YM, Welcker M, et al. Kinase-independent function of cyclin E. Mol Cell, 2007, 25(1): 127–139.
[3] Deng M, Li F, Ballif BA, et al. Identification and functional analysis of a novel cyclin e/cdk2 substrate ankrd17. J Biol Chem, 2009, 284(12): 7875–7888.
[4] Mariann Bienz. The PHD finger, a nuclear proteininteraction domain. Trends Biochem Sci, 2006, 31(1): 35–40.
[5] Musco G, Peterson P. PHD finger of autoimmune regulator: an epigenetic link between the histone modifications and tissue-specific antigen expression in thymus. Epigenetics, 2008, 3(6): 310–314.
[6] Shao Z, Zhang Y, Powell-Coffman JA. Two distinct roles for EGL-9 in the regulation of HIF-1-mediated gene expression in Caenorhabditis elegans. Genetics, 2009, 183(3): 821–829.
[7] Shimazaki N, Tsai AG, Lieber MR. H3K4me3 stimulates the V(D)J RAG complex for both nicking and hairpinning in trans in addition to tethering in cis: implications for translocations. Mol Cell, 2009, 34(5): 535–544.
[8] Sinha KM, Yasuda H, Coombes MM, et al. Regulation of the osteoblast-specific transcription factor Osterix by NO66, a Jumonji family histone demethylase. EMBO J, 2009, 29(1): 68–79.
[9] De Santa F, Narang V, Yap ZH, et al. Jmjd3 contributes to the control of gene expression in LPS-activated macrophages. EMBO J, 2009, 28(21): 3341–3352.
[10] Horton JR, Upadhyay AK, Qi HH, et al. Enzymatic and structural insights for substrate specificity of a family of jumonji histone lysine demethylases. Nat Struct Mol Biol, 2009, 17(1): 38–43.
[11] Abidi FE, Miano MG, Murray JC, et al. A novel mutation in the PHF8 gene is associated with X-linked mental retardation with cleft lip/cleft palate. Clin Genet, 2007, 72(1): 19–22.
[12] Koivisto AM, Ala-Mello S, Lemmelä S, et al. Screening of mutations in the PHF8 gene and identification of a novel mutation in a Finnish family with XLMR and cleft lip/cleft palate. Clin Genet, 2007, 72(2): 145–149.
[13] Loenarz C, Ge W, Coleman ML, et al. PHF8, a gene associated with cleft lip/palate and mental retardation, encodes for an Nepsilon-dimethyl lysine demethylase. Hum Mol Genet, 2010, 19(2): 217–222.
[14] Wang Z, Dai R, Zhang JW, et al. Induced expression of Arabidopsis thaliana WUSCHEL in Escherichia coli, affinity protein purification and polyclonal antibody preparation. Chin J Biotech, 2009, 25(9): 1409–1416.王增, 代茹, 张江巍, 等. 拟南芥WUSCHEL 蛋白的原核表达、亲和纯化和多克隆抗体制备. 生物工程学报, 2009, 25(9): 1409–1416.
[15] Zhang WH, Liu XP, Wang JC, et al. Preparation, purificatioin and idetification of rabbit antiserum against human NDR2 protein. J Fourth Mil Med Univ, 2002, 23(8): 716.张文红, 刘新平, 王吉村, 等. 兔抗人 NDR2高效价抗血清的制备、纯化及鉴定. 第四军医大学学报, 2002, 23(8): 716.
[16] He L, Lao FX, Liu ZH, et al. The expression of the recombinant human FS315 terminal peptide and preparation of its antibody. Chin Biotech, 2005, 5(8): 56.何莉, 劳凤学, 柳忠辉, 等. 重组 FS315 C末端蛋白的表达及其抗体的制备. 中国生物工程杂志, 2005, 5(8): 56.
[17] Shu W, Li FH, Deng M, et al. Preparation, purification the antibody and immunofluorescence analyse of ANKRD17. Lett Biotech, 2007, 18(5): 771–772.舒伟, 李发慧, 邓敏, 等. Ankrd17蛋白抗体的制备、纯化及检测. 生物技术通讯, 2007, 18(5): 771–772.
[18] Jia L, Shi ZY, Zhang JL. Prokaryotic expression and polyclonal antibody preparation of TRαA in Japanese flounder Paralichthys olivaceus. Chin J Biotech, 2009, 25(7): 999–1006.贾亮, 施志仪, 张俊玲. 牙鲆甲状腺激素受体 TRαA 的原核表达和多克隆抗体的制备及应用. 生物工程学报, 2009, 25(7): 999–1006.
Preparation, purification and identification of the polyclonal antibody of PHD finger protein 8
Rong Cai, and Xin Ye
Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
PHD finger protein 8 (PHF8) is a novel protein with PHD domain and Jmjc domain, which may play important role in regulating transcription and histone demethylation. It is necessary to generate the antibody against PHF8 in order to further study its biological function. First we constructed plasmid pET41b-PHF8 (aa886-936) and expressed the GST-PHF8 (aa886-936) fusion protein in Escherichia coli BL21. We then purified the fusion protein by Glutathione Sepharose 4B beads and subjected to immunize the rabbits for acquiring antiserum. We obtained PHF8 polyclonal antibody by affinity purifying the antiserum with CNBr-activated Sepharose 4B beads. The antibody was effective in Western blotting and immunofluorescence with high specificity. Immunofluorescence also showed that PHF8 protein was located in nucleus in HeLa cells.
PHF8, polyclonal antibody, affinity purification
为维持生物体正常的结构与功能,细胞分裂以一个周期的形式有序进行。多种蛋白参与这一过程的调控,以维持细胞周期的正常稳定。Cdk2 (细胞周期素依赖激酶2) 在G1期到S期的转换中发挥至关重要的作用[1]。它与细胞周期素Cyclin E结合,通过磷酸化下游一系列底物如Rb、NPAT、Cdc6等,启动DNA的合成,使细胞不可逆地进入S期[2]。前期的工作表明PHD finger 8 (PHF8)蛋白和Cdk2存在相互作用[3]。PHF8是最新发现的含有 PHD[4-7]和Jmjc[8-10]结构域的蛋白。目前的研究表明这两个结构域的功能和组蛋白去甲基化以及基因转录调控有关。目前在神经发育迟缓病例中发现其多种突变体的存在[11-12],最新研究发现其具有去甲基化的功能[13]。为了研究 PHF8蛋白在细胞中的定位,也为进一步功能研究奠定基础,本实验制备了 GST-PHF8 (aa886-936) 融合蛋白作为抗原免疫家兔获取抗血清,并通过CNBr活化Sepharose 4B微珠亲和纯化抗血清得到了 PHF8特异性多克隆抗体。该抗体用于PHF8蛋白的Western blotting检测以及在HeLa细胞的免疫荧光染色。
November 2, 2009; Accepted: January 7, 2010
Supported by:National Nature Science Foundation of China (No. 30771098).
Xin Ye. Tel: +86-10-64807508; E-mail: yex@im.ac.cn
国家自然科学基金项目 (No. 30771098) 资助。

