拮抗链霉菌S24抗菌物质的提取及其部分理化性质
周启升,曹宁宁,仇念全,张本峰,张楠,刘训理
1 山东农业大学林学院,泰安 271018
2 山东农业大学生命科学学院,泰安 271018
拮抗链霉菌S24抗菌物质的提取及其部分理化性质
周启升1,曹宁宁1,仇念全1,张本峰1,张楠2,刘训理1
1 山东农业大学林学院,泰安 271018
2 山东农业大学生命科学学院,泰安 271018
拮抗链霉菌 S24对黄曲霉、赭曲霉、黑曲霉等粮食和饲料中常见的曲霉菌具有广谱抗性,本试验通过牛津杯法测定抗菌物质的效价,研究了大孔吸附树脂对链霉菌 S24产生的抗菌物质的吸附、解吸性能,筛选了解吸剂,并研究了抗菌物质的部分理化性质。结果表明,大孔吸附树脂 AB-8对抗菌物质的吸附及解吸性能最好,其饱和吸附量为7.0822×104µg/g,最佳解吸剂为85%丙酮,以85%丙酮进行动态解吸,解吸率达93.82%。该抗菌物质对热稳定,对紫外线敏感,对有机溶剂不敏感,对酸敏感,对碱稳定,紫外全波长扫描发现该抗菌物质为多烯大环内酯类抗生素。
拮抗链霉菌,抗菌物质,提取,理化性质
黄曲霉 Aspergillus flavus属曲霉属真菌,是引起粮食及饲料霉变的主要真菌之一,在自然界中广泛存在,粮食和饲料在储藏过程中易受其污染[3]。近年来,由于黄曲霉污染粮食和饲料所导致的人畜曲霉病病例越来越多[4-5],而黄曲霉最大的危害是其产生的次级代谢物黄曲霉毒素 (Aflatoxins),黄曲霉毒素具有诱导突变、抑制免疫和致癌作用,1993年,国际癌症组织 (IARC) 将其确定为一级致癌物质[6]。近几年关于植物源与微生物源活性物质对黄曲霉及其毒素的防治不断引起国内外研究者的重视,相关的报道也逐渐增多。Vargas等[7]从药用植物三齿拉瑞阿 Larrea tridentata中分离到对黄曲霉产生明显抑制作用的活性物质,研究发现该活性物质的主要成分为木质素类;Sanchez等[8]利用不同溶剂提取舌兰属植物糙叶龙舌兰Agave asperrima和线叶龙舌兰Agave striata 的活性物质发现,乙醇、甲醇和水萃取物均能抑制黄曲霉在玉米上的生长及毒素的产生;Roy等[9]在干酪和牛奶上筛选到6个乳酸菌表现出对黄曲霉的抑制活性,活性最强的1株经鉴定为乳酸乳球菌乳酸亚种 Lactococcus lactis subsp. lactis CHD-28.3,其无菌发酵液和细胞裂解液在pH 6.8时对黄曲霉的抑菌直径为15~19 mm,并表现出蛋白质性质;Ono等[10]从链霉菌中提取了一种能抑制黄曲霉毒素产生的物质,该物质与杀稻瘟素结构类似;章挺等[11]从油菜地分离到一株枯草芽孢杆菌,对黄曲霉表现出强烈的拮抗作用,其抗菌物质粗提物对黄曲霉的最低抑菌浓度为31.2 µg/mL。拮抗链霉菌 S24由本实验室从泰山林地土壤中分离获得,该菌株对黄曲霉、赭曲霉、黑曲霉等粮食和饲料中常见的曲霉菌具有较强拮抗作用,发酵性状优异,该菌已在GenBank注册,注册号为 FJ596182,并且初步将其鉴定为白网链霉菌Streptomyces albireticuli近似种[12]。本试验研究了S24菌株抗菌物质的提取及部分理化性质,为该菌株及其抗菌物质的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株
拮抗菌:链霉菌S24由本实验室分离鉴定。现已保藏在中国微生物菌种保藏管理委员会,专利菌种保藏编号为CGMCC 3503。
抗菌物质效价测定指示菌:黄曲霉 Aspergillus flavus CGMCC 3.2890由国家粮食局科学研究院提供。
1.1.2 大孔吸附树脂
AB-8、X-5、D3520、D4020、H103、Nka-9、S-8由南开大学提供。
1.1.3 培养基
菌株活化培养基:土豆200 g,葡萄糖20.0 g,硫酸铵1.0 g,硫酸镁1.0 g,磷酸二氢钾0.6 g,琼脂16.0 g,水1 L。
菌株发酵培养基:淀粉2.5 g,葡萄糖16.0 g,蛋白胨10.0 g,玉米浆1.0 g,氯化钠7.5 g,硫酸铵4.0 g,水1 L。
抗菌物质生测培养基:同菌株活化培养基。
1.2 方法
1.2.1 抗菌物质效价的测定
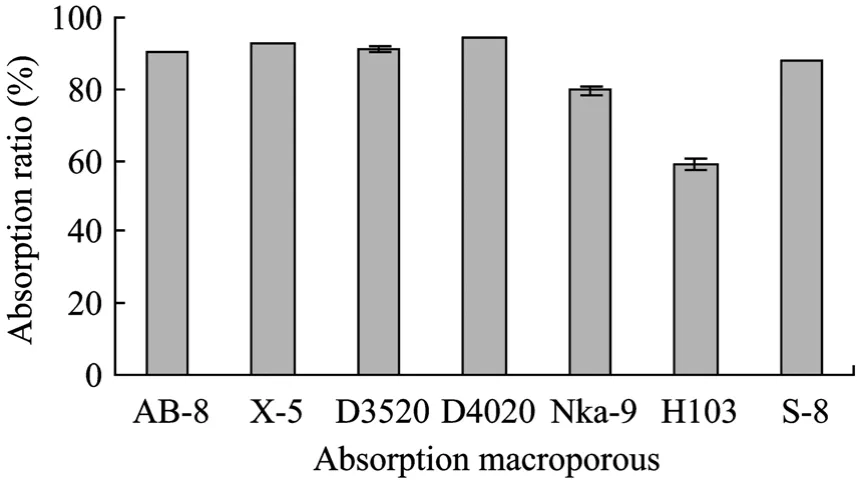
生测平板的制备:生测培养基熔化后,温度降至 50℃~55℃时,加入黄曲霉孢子悬液,使孢子的浓度为2×104~4×104CFU/mL,将培养基孢子悬液倒入培养皿,20 mL/培养皿,制备混菌平板。
效价的测定:采用牛津杯法[13]。将抗菌物质溶液100℃灭菌10 min,加入牛津杯中 (250 µL/孔),28℃培养 18 h,十字交叉法测量抑菌圈直径,根据抑菌圈的直径大小计算其效价,抗菌物质效价计算公式[12]:y=10(x+10.931)/10.797×n〔y:抗菌物质效价(µg/mL);x:抑菌圈直径 (10.5 mm 1.2.2 抗菌物质的发酵 发酵培养基经121℃湿热灭菌20 min,种子液以2%的接种量接种到50 mL/250 mL三角瓶中,200 r/min、30℃振荡培养72 h。发酵液100℃灭菌10 min,低速大容量多管离心机 4200 r/min离心30 min,取上清液备用。 1.3.1 大孔吸附树脂吸附性能的比较 取处理好的吸附树脂 (AB-8、X-5、D3520、D4020、Nka-9、H103、S-8),1 g/份,分别加入S24菌株发酵液离心后的上清液10 mL,150 r/min振荡吸附 4 h,测定发酵原液、吸附残液的效价,计算吸附率,比较各种树脂的吸附性能。每个处理2个重复。 1.3.2 大孔吸附树脂解吸性能的比较 选择吸附性能优良的树脂,1 g/份,分别加入S24菌株发酵上清液 10 mL,150 r/min振荡吸附4 h,然后分别用50%、75%的甲醇、乙醇及丙酮,150 r/min振荡静态解吸2 h。解吸液经真空旋转蒸发除去有机溶剂,蒸馏水定容至原体积。测定发酵原液、解吸液和吸附残液的效价,计算解吸率,比较各种吸附树脂的解吸性能。每个处理2个重复。 1.3.3 丙酮浓度对解吸效果的影响 AB-8树脂吸附完毕,分别以浓度为50%、55%、60%、65%、70%、75%、80%、85%和90%丙酮作为解吸剂,树脂与解吸剂按1:2 (W/V)比例混合,150 r/min振荡静态解吸2 h。解吸液经真空旋转蒸发除去丙酮,蒸馏水定容至原体积,测定发酵原液、解吸液和吸附残液的效价,计算解吸率,选择解吸剂的最佳浓度。每个处理2个重复。 1.3.4 AB-8树脂对抗菌物质饱和吸附量的测定 取筛选到的AB-8树脂,1 g/份,分别加入抗菌物质粗物 (发酵液离心后的上清液经以上筛选到的最佳吸附树脂及最佳解吸剂吸附、解吸后,解吸液经旋转蒸发、冷冻干燥所得褐色粉末为抗菌物质粗物) 5000 µg/mL的溶液5 mL、10 mL、15 mL、20 mL、25 mL,150 r/min 振荡吸附4 h,测定抗菌物质粗物溶液和吸附残液的效价,计算吸附率,确定树脂对抗菌物质的饱和吸附量。每个处理2个重复。 1.3.5 85%丙酮动态解吸曲线及动态解吸率测定 树脂:发酵液 (W/V) =1:10,150 r/min振荡吸附4 h后,将树脂装柱,去离子水洗脱3 BV后,用85%丙酮对抗菌物质进行解吸,流速为0.5 mL/min,每20 min收集一管,每管10.0 mL,测定发酵原液、吸附残液及每管解吸液效价,绘制解吸曲线并计算解吸率。 1.4.1 对热的稳定性 配制抗菌物质粗物水溶液 (5000 µg/mL),分别在50℃、70℃、100℃的水浴中处理10 min、20 min、40 min、60 min、80 min、100 min,微孔滤膜过滤后用无菌水稀释至合适浓度,牛津杯法测定抗菌物质的效价,比较抗菌物质效价的变化。 1.4.2 对酸碱的稳定性 配制0.2 mol/L磷酸氢二钠-0.1 mol/L柠檬酸缓冲液 (pH 2.2~8.0)、0.2 mol/L甘氨酸-0.2 mol/L氢氧化钠缓冲液 (pH 8.6~10.6) 和0.05 mol/L磷酸氢二钠-0.1 mol/L氢氧化钠缓冲液调节,得到pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0的缓冲溶液。利用不同pH的缓冲溶液将抗菌物质样品溶解,室温静置2 h,比较抗菌物质效价的变化。 1.4.3 对紫外线的稳定性 抗菌物质粗物水溶液置于紫外灯下40 cm,分别照射1 h、2 h、3 h、4 h、5 h和6 h时取出样品,进行生测,以未经紫外线照射的样品为对照,比较抗菌物质效价的变化。 1.4.4 对有机溶剂的稳定性 抗菌物质粗物水溶液分别与等体积的氯仿、丙酮、乙醇和甲醇混合。对于氯仿以200 r/min振荡抽提90 min,离心,分层后取上层水相,设未处理对照,比较抗菌物质效价的变化;对于丙酮、乙醇及甲醇以200 r/min振荡90 min后,经真空旋转蒸发除去有机溶剂,蒸馏水定容至原体积,设未处理对照,比较抗菌物质效价的变化。 1.4.5 抗菌物质紫外全波长光谱扫描 取抗菌物质粗物,蒸馏水稀释一定倍数进行紫外全波长扫描,观察抗菌物质的紫外特征吸收峰。 7种吸附树脂对抗菌物质均有较好的吸附效果,其中,AB-8、X-5、D3520、D4020树脂对抗菌物质的吸附率均达到90%以上 (图1)。 分别采用50%、75%的不同有机溶剂 (甲醇、乙醇、丙酮) 作为解吸剂,对抗菌物质进行解吸,由图2可以看出,同一种有机溶剂,高浓度有机溶剂的解吸效果优于低浓度有机溶剂。不同有机溶剂以75%丙酮作为解吸剂时,解吸效果最好,其中4种吸附树脂以 D4020和 AB-8的解吸效果较好,AB-8优于D4020的解吸效果,其静态解吸率达56%。因此选择 AB-8作为抗菌物质的最佳吸附树脂,进一步筛选最佳解吸剂的浓度。 以筛选到的 AB-8树脂作为抗菌物质的最佳吸附树脂,调节不同浓度的丙酮作为解吸剂,其静态解吸效果如图3所示,丙酮浓度在50%~85%,解吸率逐渐升高,85%丙酮的解吸率最高,解吸率为61.2%。 图1 吸附树脂的吸附性能比较Fig. 1 Comparison of adsorption capacity among three macroporous resins. 图2 吸附树脂的解吸性能比较Fig. 2 Comparison of desorption capacity of three macroporous resins. 1: 50% methanol; 2: 50% ethanol; 3: 50% acetone; 4: 75% methanol; 5: 75% ethanol; 6: 75% acetone. 以抗菌物质粗物的质量为横坐标,吸附率为纵坐标,绘制的AB-8树脂的吸附曲线如图4所示。随着抗菌物质质量的增大,吸附率逐渐降低,1 g树脂中加入 2.5×104~5×104µg抗菌物质粗物时,抗菌物质被完全吸附;l g树脂中加入7.5×104µg抗菌物质粗物时,吸附率达到94.43%;考虑到生产实践中应尽量减少抗菌物质的损失,降低生产成本,取吸附率 94.43%时树脂吸附的抗菌物质粗物的质量为其吸附量,AB-8树脂的饱和吸附量为7.0822×104µg/g。 用85%丙酮对抗菌物质进行动态解吸,解吸曲线如图5所示,效价最高管达204 820 µg/mL,以后各管依次降低,解吸液效价比较集中,解吸效果较好,根据公式计算各管的解吸率,结果总解吸率为93.82%,其中,浓度较高部分 (2~11管,100 mL) 的解吸率为89.08%。这一结果说明,试验筛选的树脂和解吸剂都比较理想。 2.6.1 对热的稳定性 抗菌物质对热比较稳定,在50℃和70℃条件下处理10~100 min效价无显著变化,经100℃水浴20 min其效价无显著变化,加热40 min后效价开始略有降低,加热到100 min效价降低18.18% (图6)。 图3 丙酮浓度对解吸效果的影响Fig. 3 Effect of different acetone concentration on desorption. 图4 AB-8树脂对抗菌物质的吸附量Fig. 4 Absorption quality of antibacterial substances on AB-8 resin. 图5 AB-8树脂的动态解吸曲线Fig. 5 Dynamic desorption curve of AB-8 resin. 图6 抗菌物质对热的稳定性Fig. 6 Heat stability of antibacterial substances. 2.6.2 对酸碱的稳定性 抗菌物质对不同pH的敏感程度如图7所示。在碱性条件下比较稳定,对酸敏感,pH 6~9时,抗菌物质保持较高活性,pH为6时,抗菌物质仍表现其活性,当抗菌物质溶液的pH<5时,其活性丧失。 2.6.3 对紫外线的稳定性 抗菌物质对紫外线的稳定性如图8所示,抗菌物质对紫外线表现出不稳定性,紫外线不间断照射6 h后,其效价降低一半。 2.6.4 对有机溶剂的稳定性 抗菌物质经氯仿抽提以后,静置,在氯仿表面呈现一层絮状沉淀,絮状沉淀用少量水溶解后生测,无抑菌活性;取上层水溶液生测,表现抑菌活性,且活性较对照无差异,说明抗菌物质对氯仿不敏感。抗菌物质与丙酮,乙醇及甲醇作用后,其效价与对照无差异,说明抗菌物质活性不受有机溶剂影响。 2.6.5 抗菌物质紫外全波长光谱扫描结果 图7 抗菌物质对不同pH的敏感程度Fig. 7 pH stability of antibacterial substances. 图8 抗菌物质对紫外线的稳定性Fig. 8 Ultraviolet radiation stability of antibacterial substances. 图9 抗菌物质粗物的紫外光区全扫描图谱Fig. 9 UV spectrum of crude antibacterial substance. 经过初步纯化后的抗菌物质的紫外吸收光谱见图9。抗菌物质在350.0 nm、332.6 nm、317.4 nm、304.0 nm、290.1 nm有特征性紫外吸收,符合多烯大环内酯类抗生素四烯 (最大吸收峰波长为 (318± 2) nm、(332±3) nm、(350±3) nm) 和五烯 (最大吸收峰波长为(290±2) nm、(305±2) nm、(318±2) nm) 的紫外吸收特征[14]。这说明抗菌物质的主要成分为一组多烯大环内酯类抗生素。 大孔吸附树脂 AB-8对链霉菌 S24抗菌物质有较大的吸附量,且容易吸附解吸。AB-8树脂对抗菌物质的饱和吸附量为7.0822×104µg/g,最佳解吸剂为85%丙酮,并且该解吸剂对抗菌物质活性无影响,以此解吸剂进行动态解吸,解吸率可达93.82%。大孔吸附树脂是一类多孔立体结构的非离子型人工合成的有机高分子聚合物吸附剂,其理化性质稳定,不溶于酸、碱及有机溶媒,对有机物有浓缩、分离作用且不受无机盐类及强离子、低分子化合物的干扰。其本身由于范德华力或氢键的作用,具有吸附性;还具有网状结构和很高的比表面积,故具有筛选性能[15-16]。大孔吸附树脂在抗生素、维生素、生化药物的分离纯化以及中成药的制备和质量控制研究中越来越广泛[17]。树脂法提取活性物质,具有设备简单、操作方便、生产周期短、能耗和成本低、不加辅料、可以成型等优点,利于工业化扩大生产[18-19]。本试验采用大孔吸附树脂 AB-8提取S24抗菌物质,为该抗菌物质的纯化及应用提供了理论参考。 链霉菌是一类重要的抗生素产生菌,它所产生的许多优良抗生素已被广泛应用。初步研究表明,拮抗链霉菌S24产生的抗菌物质主要成分由四烯和五烯两类多烯大环内酯类抗生素组成,能同时产生此两类抗生素的菌株尚未见报道。此外,抗菌物质经高效液相色谱分析发现,这两类物质均与已报道的四烯和五烯类大环内酯抗生素有一定差别,因此,要确定该抗菌物质为何种化合物还需通过进一步的分离纯化与结构鉴别确定。该抗菌物质具有热稳定性好、对有机溶剂不敏感、pH耐受范围广等优点,显示出较好的应用潜力。本试验在对抗菌物质的性质研究中均采用抗菌物质粗物样品,一定程度上反映了抗菌物质的理化性质,更确切的性质还需要利用纯品进行测定。多烯大环内酯类抗生素由于化学结构的原因,对紫外线较为敏感,不宜与阳光接触,因此,限制了其在大田中的应用,但在医疗、兽药及食品和饲料的防腐方面都得到了较好的应用,此外,多烯类抗生素是一类目前临床常用药中最不容易产生抗药性的抗真菌抗生素[20-21],开发高效低毒的多烯类抗真菌抗生素,是抗真菌药物研发的有效途径之一。 本试验和前期试验结果表明,拮抗链霉菌 S24是一株抗菌谱广、发酵性状优异、遗传稳定的拮抗菌,产生的抗菌物质对多种粮食和饲料中常见的能引起人畜传染性疾病的曲霉菌有强烈的拮抗作用,显示了很好的工业化生产与应用潜力,值得进一步研究。S24菌株产生的抗菌物质的结构及其作用机制的研究正在开展。 REFERENCES [1] Berdy J. Bioactive microbial metabolites. J Antibiot (Tokyo), 2005, 58(1): 1−26. [2] Baker KF. Evolving concepts of biological control of plant pathogens. Ann Rev Phytopathol, 1987, 25: 67−85. [3] Bluma RV, Etcheverry MG. Influence of Bacillus spp. isolated from maize agroecosystem on growth and aflatoxin B1 production by Aspergillus section Flavi. Pest Manag Sci, 2006, 62: 242−251. [4] Ricci RM,Evans JS, Merrert JJ, et al. Primary cutaneous Aspergillus ustus infection second report case. J Am Acad Dermatol, 1998, 38: 797−798. [5] Zhang Q, Li L, Zhu M, et al. Primary cutaneous aspergillosis due to Aspergillus flavus: a case report. Chin Med J, 2005, 18(3): 255−257. [6] Oakley EJ, Schmitt F, Jost JP, et al. Some naturally occurring substances: food items and constituents, heterocyclic aromatic amines and mycotoxins. IARC Sci Publ, 1993, 56 (6): 489−521. [7] Vargas-Arispuro I, Reyes-Baez R, Rivera-Castaieda G, et al. Antifungal lignans from the creosotebush (Larrea tridentata). Ind Crops Products, 2005, 22: 101−107. [8] Sanchez E, Heredia N, Garcia IS. Inhibition of growth and mycotoxin production of Aspergillus flavus and Aspergillus parasiticus by extracts of Agave species. Int J Food Microbiol, 2005, 98: 271−279. [9] Roy U, Batish VK, Grover S, Production of antifungal substance by lactococcus lactis subsp. lactis CHD-28.3. Int J Food Microbiol, 1996, 32: 27−34. [10] Ono M, Sakuda S, Suzuki AA. Aflastatin A, a novel inhibitor of aflatoxin production by Aflatoxigenic fungi. J Antibiot, 1997, 50: 111−117. [11] Zhang T, Hu LB, Wang F, et al. Identification of B-FS06 and the antagonistic activity of its cultural productions against Aspergillus flavus. Chin J Biol Control, 2007, 23(2): 160−165.章挺, 胡梁斌, 王飞, 等. 拮抗菌B-FS06的鉴定及其发酵产物对黄曲霉的抑制作用. 中国生物防治, 2007, 23(2): 160−165. [12] Zhou QS, Sun CP, Zhang N, et al. Identification of actinomycete strain S24 and its antagonistic effects on Aspergillus flavus. Microbiol Chin, 2009, 36(12): 1832−1837.周启升, 孙长坡, 张楠, 等. 拮抗放线菌 S24的鉴定及其对黄曲霉的抑制作用. 微生物学通报, 2009, 36(12): 1832−1837. [13] China Pharamacopoeia Committee. Chinese Pharamacopoeia. Beijing: Chemical Industry Press, 2005: Addenda 84.国家药典委员会. 中华人民共和国药典. 北京: 化学工业出版社, 2005: 附录84. [14] Zhang ZP. Microbial Phamacy. Beijing: Chemical Industry Press, 2003: 253−257.张致平. 微生物药物学. 北京: 化学工业出版社, 2003: 253−257. [15] Yao RP, Chen FH, Gao C. The application of macroporous absorption resin in wastewater treatment. J Environ Manage Coll Chin, 2009, 19(1): 63−66.姚日鹏, 陈凤慧, 高超. 大孔吸附树脂在废水处理中的应用. 中国环境管理干部学院学报, 2009, 19(1): 63−66. [16] Jiang XY, Zhou JH, Zhou CS. Study on adsorption and separation of naringin with macroporous resin. Front Chem Chin, 2006, 1(1): 77−81. [17] Yu HW, Wu JC, Ching CB. Enhanced activity and enantio selectivity of Candida rugosa lipase immobilized on macroporous adsorptive resins for ibuprofen resolution. Biotechnol, 2004, 26(8): 629−633. [18] Wang ZW, Yuan ST, He L, et al. Extraction and proper ties of antifungal active substances produced by Paenibacillus polymyxa Cp-S316. J Agro-environ Sci, 2007, 26(4): 1464−1468.王智文, 袁士涛, 何亮, 等. 多粘类芽孢杆菌 Cp-S316抗真菌活性物质的提取及部分性质研究. 农业环境科学学报, 2007, 26(4): 1464−1468. [19] Ma CY, Tao GJ, Tang J, et al. Preparative separation and purification of rosavin in Rhodiola rosea by macroporous adsorption resins. Sep Purif Technol, 2009, 69: 22−28. [20] Zhang ZP, Hou TJ. Antibiotics and Bioactive Substances Produced by Microbes. Beijing: Chemical Industry Press, 2005: 302, 418.张致平, 姚天爵. 抗生素与微生物产生的生物活性物质. 北京: 化学工业出版社, 2005: 302, 418. [21] Vilar V, Botelho C, Boaventura R. Equilibrium and kinetic modeling of Cd biosorption by algae gelidium and agar extraction algal waste. Water Res, 2006, 40(2): 291−302. Extraction and characterization of antifungal substances produced by antagonistic Streptomyces S24 Qisheng Zhou1, Ningning Cao1, Nianquan Qiu1, Benfeng Zhang1, Nan Zhang2, and Xunli Liu1 Streptomyces S24 has broad spectrum resistance to the Aspergillus in food and feed, such as Aspergillus flavus, Aspergillus niger, Asperegillus alutacells and so on. We studied the adsorption and desorption properties of antifungal substance from Streptomyces S24 on macroporous resins, screened the best elution solution and also investigated some physical and chemical characters of antifungal substance by determining the antifugal activity using oxford plate assay system. According to the analysis results, AB-8 resin offered the best adsorption and desorption capacity for antifungal substance and its saturated absorption capacity was 7.0822×104µg/g, the optimal elution solution was 85% acetone and the dynamic desorption rate could reach 93. 82%. The antifungal substance was stable to heat and alkali, not sensitive to organic solvents, and sensitive to ultraviolet rays and acid. Based on its ultraviolet spectrometry, the antifungal substance was identified as heptaene macrolide antibiotic. antagonistic Streptomyces, antibacterial substances, extraction, characteristic 链霉菌Streptomyces具有丰富的物种多样性和代谢类型多样性,是极其重要的产生天然活性产物的资源微生物。自 Waksman发现链霉素以来,链霉菌的分离及其代谢产物的研究受到微生物学家及药学家的广泛关注。作为一类具有重要经济价值的微生物资源,在迄今已发现的12 000余种微生物来源的生理活性物质中,55%以上是由链霉菌属菌株产生的,其中包括抗生素、免疫抑制剂和酶抑制剂等[1-2]。 October 16, 2009; Accepted: January 13, 2010 Xunli Liu. Tel: +86-538-8249131; E-mail: xlliu@sdau.edu.cn1.3 大孔吸附树脂提取S24菌株产生的抗菌物质
1.4 S24菌株抗菌物质的部分理化性质
2 结果与分析
2.1 大孔吸附树脂吸附性能的比较
2.2 大孔吸附树脂解吸性能的比较
2.3 丙酮浓度对解吸效果的影响
2.4 AB-8树脂对抗菌物质吸附量的确定

2.5 85%丙酮的动态解吸曲线
2.6 S24抗菌物质的部分理化性质







3 结论与讨论
1 College of Forestry, Shandong Agricultural University, Taian 271018, China
2 College of Life Science, Shandong Agricultural University, Taian 271018, China

