嵌合表皮生长因子疫苗E5T-mSEA的设计及抑瘤活性检测
尹晴晴,贾海威,张艳红,刘传暄,马清钧,张部昌,钟辉,胥全彬
1 安徽大学生命科学学院,合肥 230039
2 军事医学科学院 生物工程研究所,北京 100850
3 中国人民解放军海军总医院,北京 100048
EGFR在非小细胞肺癌、乳腺癌、头颈癌等多种肿瘤细胞中高表达,这种高水平表达与肿瘤进行到晚期密切相关[1]。肿瘤细胞以自分泌循环的方式通过EGFR与其配体 (EGF、TGFα) 结合,在此过程中发挥了关键的作用[2-4]。阻断这种相互作用,便成为抗EGFR高表达肿瘤药物的重要研究方向。目前,已经进入市场的EGFR靶向药物主要有两类:一类是 EGFR的拮抗剂,包括小分子药物(Gefitinib、Erlotinib及 Lapatinib) 和单抗药物(Cetuximab、Panitumumab及Trastuzumab);另一类是针对EGF的治疗性亚单位疫苗,如CimaVax EGF。由于现有小分子化合物药物大多有较强的毒副作用,如导致肝毒性、皮肤出现丘脓疱性溃疡等[5],因此,发展以EGFR为靶标的高效、低毒的抗癌药物依然是抗癌药物的研究重点。EGF抗肿瘤疫苗CimaVax EGF正是这样的抗癌药物,它仅会使患者的注射部位出现轻微的红斑和瘙痒症状。该疫苗已经于2009年4月在古巴进入市场,呈现很好的应用前景,而TGFα疫苗目前也正处于临床前研究阶段。
为了开发出能够同时针对 TGFα和 EGF的疫苗,设计了一个由TGFα、EGF组成的50个氨基酸的嵌合分子,该分子包含了与EGFR结合的重要结构域。由于E5T与EGFR天然配体的同源性较高导致其免疫原性较低,如果直接免疫其抗体效价很可能不会太高。为了增强 E5T的免疫原性,本研究没有采用传统的载体蛋白,而是将具有免疫增强作用的金黄色葡萄球菌肠毒素A (Staphylococcus enterotoxin A,SEA) 与之融合。初步研究结果表明:SEA能够明显增强E5T的免疫原性,免疫小鼠能够同时产生针对TGFα和EGF的抗体;将此蛋白抗血清与肿瘤细胞共培养,能显著抑制EGFR阳性细胞A431的生长。因此,E5T-mSEA有可能被进一步发展成为针对EGFR阳性肿瘤细胞的新型治疗性疫苗。
1 材料和方法
1.1 实验材料
人源肿瘤细胞表皮鳞癌 A431细胞及胚肾细胞293T 均为本室保存;细胞培养基 Dulbecco’s Modified Eagle’s Medium (DMEM) 购自 Gibco公司;胎牛血清 (FCS) 购自杭州四季青生物制品公司;青霉素、链霉素等抗生素均购自 Gibco公司;牛血清白蛋白 (BSA)、胰酶等为Sigma 公司生产;C57BL/6小鼠购自军事医学科学院动物中心。
1.2 方法
1.2.1 融合蛋白表达载体的构建
利用PCR分别以EGF和pET-TGFα3-mSEA为模板,扩增出 E5T,具体步骤为:先分别用 P1/P2和P3/P4引物扩增,扩增条件为94℃ 10 s;94℃ 10 s,55℃ 20 s,72℃ 30 s,30个循环;最后72 ℃ 2 min 。然后将两扩增产物等量混合,94℃ 10 s变性后,加入1 µL Pfu酶,72℃保温30 min。1.5%琼脂糖凝胶电泳检测 PCR产物,目的扩增片段预期大小为147 bp。胶回收的PCR产物,用NdeⅠ和BamHⅠ双酶切后,插入经相同酶切处理的质粒载体 pETTGFα3-mSEA中,构建重组质粒 pET-E5T-mSEA。重叠 PCR所用的引物为:P1:5′-CTCATATG A ATTCCGACTCTGAATG-3′;P2:5′-TGGCACACGCA CGCGTATTTTGTC-3′;P3:5′-CAAATACGCGTGCG TGTGCCATTCTG-3′;P4:5′-AACTCGAG GGCCAGG AGG TCCGCATG-3。下划线所示为添加的酶切位点部分。
1.2.2 融合蛋白的制备
重组SEA蛋白的纯化步骤,基本参照胥全彬等的方法[6],并略有修改。将 pET-E5T-mSEA 转化BL-21(DE3),低温诱导制备融合蛋白的可溶表达上清,过滤后4℃保存。装好 Chelating Sepharose 柱,按常规上 Ni2+、平衡层析柱,上样品,用平衡缓冲液 (20 mmol/L Tris-HCl,0.5 mol/L NaCl) 平衡至基线后,用洗脱液 (20 mmol/L Tris-HCl,0.5 mol/L NaCl,80 mmol/L咪唑,pH 6.0) 洗脱,收集洗脱峰,将含目标蛋白的洗脱组分进行浓缩、除盐,并对纯度进行分析。
SDS-PAGE中蛋白相对含量的确定在天能 GIS凝胶图象处理系统中完成。纯化蛋白浓度的测定按BCA Protein Assay Kit (Pierce) 说明进行。
1.2.3 抗融合蛋白抗体的制备、效价测定及纯化
将5周的C57BL/6小鼠随机分为4个组 (E5T-mSEA、rSEA、E5T阳性对照和生理盐水阴性对照),每组10只。免疫前采血,然后分别以10 µg蛋白连续免疫4次,每次间隔10 d;免疫前均采集小鼠尾血,检测血清效价。
用碳酸盐缓冲液将抗原稀释至合适浓度,每孔包被100 µL,具体如下:1) 测定抗E5T-mSEA抗体:用500 ng/0.1 mL E5T-mSEA包被,以1:400稀释抗体;2) 测定抗rSEA抗体:用500 ng/0.1 mL rSEA包被,以1:400稀释抗体;3) 测定抗E5T抗体:用500 ng/0.1 mL TGFα、EGF包被,以1:50稀释抗体;4) 测定抗融合蛋白抗体中E5T抗体:用500 ng/ 0.1 mL EGF、TGF包被,以1:50稀释抗E5T-mSEA抗体;同时以相同倍数稀释抗rSEA抗体及阴性血清对照。
4℃过夜;PBST洗5次,每次2 min;用含1% BSA的封闭液37℃封闭1 h;将阳性及阴性血清进行倍比稀释 (具体倍数见后) ,每个稀释度每孔加入100 µL,37℃孵育1 h;PBST洗5次,每次2 min;然后加入1:5000 HRP标记的酶标二抗,37℃孵育1 h;PBST洗5次,每次2 min;加入新鲜配置的OPD显色液100 µL,显色5 min后,用20 µL 2 mol/L硫酸终止反应,OD495测光密度。各步相应设置一抗、二抗及空白对照。抗体效价判定依据:

(P:阳性血清光密度;N:阴性血清光密度)
1.2.4 免疫印迹试验
将 A431或 293T细胞可溶裂解蛋白按常规SDS-PAGE电泳分离后,转移到硝酸纤维膜上;将转移的硝酸纤维素膜用 10 mL 5%脱脂牛奶在脱色摇床上室温封闭1 h,然后用PBST洗3次,每次15 min。加入1:1000 稀释EGFR抗体 (Santa cruz)或β-actin 抗体 (Santa cruz),室温孵育1 h。PBST洗液漂洗3次后,再加入1:5000稀释的HRP标记二抗,室温孵育1 h。随后步骤按常规操作进行。
1.2.5 抗融合蛋白抗体对肿瘤细胞体外培养的影响
将A431细胞或293T细胞以1×104细胞/孔的密度接种到96孔板,过夜培养后分别加入不同稀释度的抗E5T-mSEA或抗rSEA免疫血清。37℃培养24 h后,相差显微镜下拍照,并按常规MTT法对活细胞进行测定。
2 结果
2.1 融合蛋白的表达与制备
本实验所设计的融合蛋白由E5T和SEA两部分组成,为了避免融合对SEA构象的影响,两者之间添加了8个氨基酸的柔性连接序列 (GGGS)2为:MNSDSECPLSHDGYCLHDGVCMYIEALDKYA CVCHSGYVGARCEHADLLA-GGSGSGGG-SE KSEEINEKDLRKKSELQGTALGNLKQIYYYN EKAKTENKESHDQFLQHTILFKGFFTDHSWY NDLLVDFDSKDIVDKYKGKKVDLYGAYYGYQ CAGGTPNKTACMYGGVTLHDNNRLTEEKKVP INLWLDGKQNTVPLETVKTNKKNVTVQELDL QARRYLQEKYNLYNSDVFDGKVQRGLIVFHT STEPSVNYDLFGAQGQYSNTLLRIYRDNKTI NSENMHIDIYLYTSLEHHHHHH
将重组质粒 pET-E5T-mSEA转化 BL-21(DE3)宿主菌,获得工程菌 BL-21(DE3,pET-E5T-mSEA),用1.0 mmol/L的IPTG进行低温诱导,可以使此融合蛋白高效表达 (图1A)。将低温诱导的可溶性蛋白通过金属螯合亲和层析进行纯化,纯化后的产物经SDS-PAGE分离、考马斯亮蓝染色,结果发现纯化的融合蛋白有2条带,主要条带与预期的分子量相符,为34 kDa,另外一条则约为70 kDa (图1B)。本实验小组的前期研究发现纯化的SEA在SDS-PAGE电泳后,仍有部分蛋白以二聚体形式存在 (另文发表)。因此70 kDa处的蛋白至少部分是因SEA二聚化而形成的E5T-mSEA二聚体。
2.2 抗融合蛋白血清的效价测定
将E5T-mSEA、rSEA及E5T免疫小鼠,结果表明所有E5T-mSEA、rSEA免疫组小鼠均产生了高滴度抗体 (图 2),用相应蛋白包被检测其效价,结果均在1:60 000以上;用TGFα及EGF包被检测两组血清样品,结果在E5T-mSEA血清样品中检测到了针对TGFα和EGF的抗体,针对 TGFα的抗体效价为1:16 000,针对EGF的抗体效价为1:32 000。而所有E5T免疫组小鼠的血清,ELISA检测为阴性。E5T与小鼠的TGFα和EGF均有较高的同源性,在本实验条件下直接免疫小鼠所产生的抗体滴度很低,而与SEA融合后,可显著提高抗体滴度,这表明SEA具有较强的免疫佐剂效应。
2.3 抗融合蛋白抗体能够对EGFR高表达肿瘤细胞产生抑制作用
为了分析融合蛋白抗血清能否抑制EGFR阳性肿瘤细胞的生长,首先对试验细胞的EGFR的表达情况进行了分析。结果表明,在A431细胞中EGFR是高表达的,而在 293T细胞中则没有 EGFR表达(图3A)。

图1 E5T-SEA融合蛋白的表达和纯化Fig. 1 Expression and purification of E5T-SEA fusion protein in E. coli. (A) BL21(DE3) with pET-E5T-mSEA was induced with 1 mmol/L IPTG(lane 1), BL21(DE3) with pET-E5T-mSEA without induction (lane 2), BL21(DE3) with pET-22b(+) (lane 3), protein marker (lane 4). (B) Purified E5T-mSEA(lane 1), protein marker (lane 2).
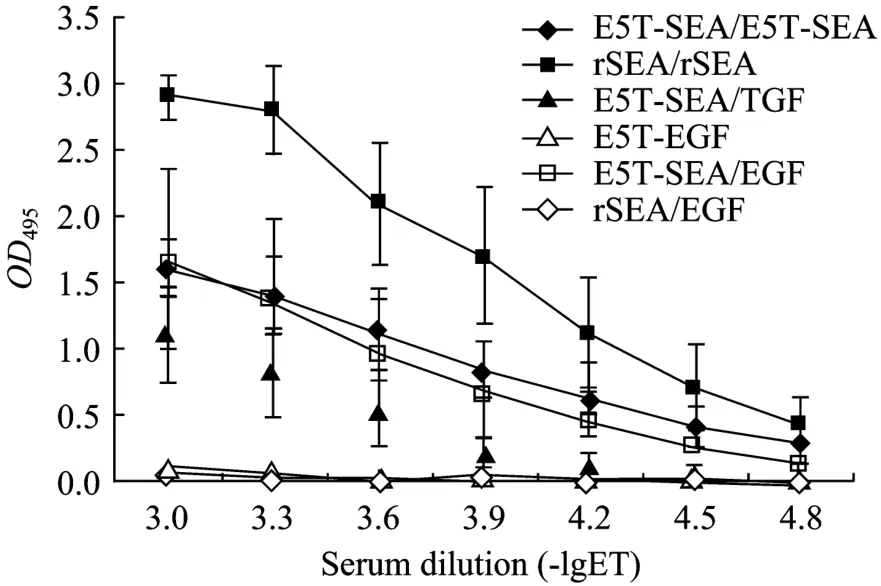
图2 免疫小鼠血清效价的测定Fig. 2 Detection of antibodies titers of serum from immunized mice. 40 mice were randomized into four groups and immunized with E5T-mSEA, rSEA, E5T or adjuvant only. To detect the titers of antibody against E5T-mSEA in serum of E5T-mSEA immunized mice, the E5T-mSEA were coated and corresponding serum were applied sequentially. To detect other antibodies against other interest proteins, the proteins and serum were applied in the same way as E5T-mSEA (serum from applied protein/coated protein).

图3 E5T-mSEA抗血清能显著抑制EGF/TGFα/EGFR依赖性肿瘤细胞的生长Fig. 3 E5T-mSEA anti-serum can inhibit the growth of EGF/ TGFα/EGFR dependent tumor cell lines significantly. (A) The expression level of EGFR in different tumor cell lines. E5T-mSEA anti-serum can inhibit the growth of EGF/TGFα/ EGFR dependent tumor A431 significantly (B, D). But has no effect on EGFR negative cell 293T(C, D). In figure B and C, ET means dilution ratio of E5T-mSEA anti-serum.
向293T 和A431细胞中分别加入不同稀释度的抗E5T-mSEA或抗rSEA (阴性对照) 免疫血清培养24 h后,抗E5T-mSEA免疫血清几乎可以将A431肿瘤细胞完全杀死,而对293T细胞的生长没有明显的影响,死亡率小于5% (图3B、C)。表明抗E5T-mSEA免疫血清只对EGFR高表达的肿瘤细胞有抑制作用。
3 讨论
肿瘤患者机体免疫处于抑制状态[7],肿瘤抗原在机体内免疫原性下降,造成特异性细胞免疫激活不足,外周免疫耐受的状况。因此,肿瘤疫苗设计策略的总体思路是应用各种技术,增强免疫系统对肿瘤抗原的识别能力,改善免疫微环境,引发有力的特异性抗肿瘤细胞免疫,阻止肿瘤进展,最终消除肿瘤[8-9]。葡萄球菌肠毒素 A(Staphylococcal enterotoxin A,SEA) 是金黄葡萄球菌产生的肠毒素之一,为sea基因编码的257个氨基酸组成的多肽,是一种细菌超抗原,在极低剂量时即可直接与抗原提呈细胞 (Antigen presenting cell,APC) MHC II类分子和T细胞抗原识别受体 (T cell receptor,TCR)特异地结合,诱导T淋巴母细胞有丝分裂并促进T细胞释放IL-I、IL-2和TNF-7等多种细胞因子,从而发挥抗肿瘤作用[10-12]。研究报道将牛血清白蛋白BSA及HIV的gp160分别免疫小鼠,随后再用SEA注射小鼠,发现由于超抗原的激活作用使针对胸腺依赖性抗原BSA、gp160的抗体滴度分别增加了3~4倍[13]。这项研究提示利用超抗原SEA来打破对同源蛋白的免疫耐受完全可能。目前,利用超抗原的免疫激活效应来提高抗肿瘤抗原的免疫性已有成功应用。比如,将SEA加上疏水的跨膜区域 (Transmembrane domain,TM) 尾巴以后用来修饰肿瘤衍生的exosome,定位于exosome的表面,形成Exo/SEA-TM,可以诱导肿瘤特异的cytotoxic T lymphocyte (CTL),对肿瘤的生长具有明显的抑制作用[14]。目前,还未见以其为佐剂进行肿瘤疫苗的研究,本实验对此进行了初步的尝试。
本实验所构建的E5T是EGF和TGFα的嵌合分子,其空间构象与 TGFα、EGF的构象非常相似,尤其是EGF (图4),推测其免疫原性可能会比较低,本实验结果也证实了这一点,即直接以E5T免疫小鼠并不能产生高效价抗体 (图2)。本研究以SEA作为E5T的载体蛋白,则能有效激活肿瘤携带体的免疫系统,打破E5T的同源耐受。实验结果表明,融合蛋白E5T-mSEA免疫小鼠后可以产生高滴度的抗体,在E5T-mSEA中均检测到了针对TGFα和EGF的抗体,针对TGFα效价为1:16 000,针对EGF的抗体为1:32 000 (图2)。这提示将SEA作为载体蛋白能够有效激发机体产生针对E5T的抗体。
由于将佐剂与抗原分别注射进行免疫给实际应用带来一定不便,将超抗原与靶抗原融合则使其临床的可能性大为增加。由于SEA只能以完整分子的形式被MHC分子递呈给T细胞,才能启动增强免疫系统识别能力的反应;另一方面,维持 E5T的构象也有利于E5T表位 (线性表位和空间表位) 的完整性。因此,在将靶抗原与SEA进行融合时,为了保证两者空间构象的完整性,在两者之间添加了一个通用的8氨基酸连接肽 (GGGS)2,该肽已经被证实能够很好地保持融合蛋白己酮糖磷酸合成酶 (Hexulose phosphate synthase,HPS) (23 kDa) -GFP(27 kDa) 各自的构象[15]。
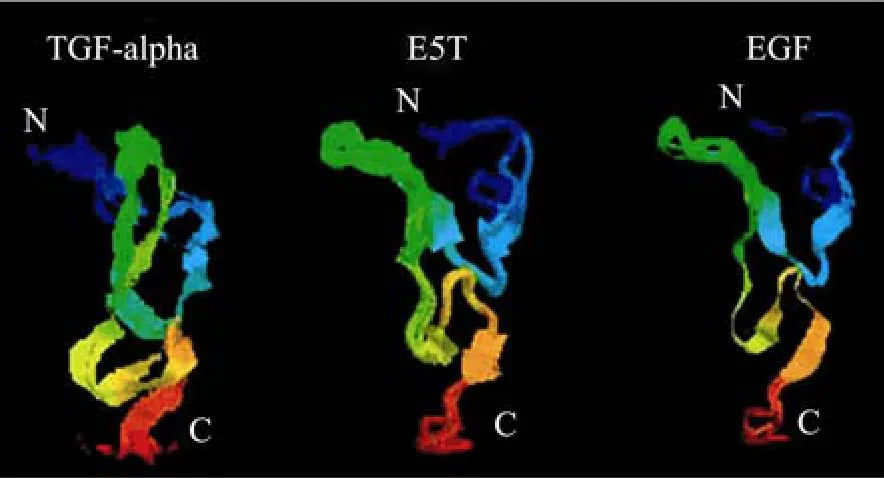
图4 E5T表位嵌合分子保持了与EGF和TGFα相似的空间构象Fig. 4 The E5T shows similar conformation with that of EGF and TGFα.
本研究对以SEA为载体的EGFR配体疫苗进行了探索,初步结果令人振奋。但有很多问题需要回答,如SEA是否能激活E5T特异性CD4+T细胞以及是否优于现有的其他载体蛋白;尽管抗E5T包含了与EGFR结合的重要结构域,抗E5T-SEA血清能识别EGF和TGFα,也能够显著抑制EGFR阳性肿瘤细胞的生长,但由于 A431细胞的生长是依赖于EGF、TGFα之一还是同时依赖于两者目前并不清楚。因而,E5T嵌合蛋白抗体对 EGF/EGFR、TGFα/EGFR相互作用的阻断效率也不清楚。上述问题,有待后续研究中进一步展开。
感谢:感谢军事医学科学院生物工程研究所曹诚教授和靳彦文博士提供有益的建议,感谢本实验室其他同志的支持和帮助。
REFERENCES
[1] Yarden Y, Sliwkowski MX. Untangling the ErbB signaling network. Nat Rev Mol Cell Biol, 2001, 2: 127−137.
[2] Gamett DC, Pearson G, Cerione RA, et al. Sondary dimerization between members of the epidermal growth factor receptor family. J Biol Chem, 1997, 272(18): 12052–12056.
[3] Salomon DS, Brandt R, Ciardiello F, et al. Epidermal growth factor-related peptides and their receptors in human malignancies. Crit Rev Oncol Hematol, 1995, 19: 183−232.
[4] Sartor CI. Biological modifiers as potential radiosensitizers: targeting the epidermal growth factor receptor family. Semin Oncol, 2000, 27(suppl 11): 15−20.
[5] Widakowich C, de-Castro-G Jr, de-Azambuja E, et al. Side effects of approved molecular targeted therapies in solid cancers. The Oncologist, 2007, 12: 1443–1455.
[6] Xu QB, Liu CX, Ma QJ. The expression and activity essay of Staphylococcus enterotoxin A. Chin J Biotech, 2003, 19(4): 402−406.胥全彬, 刘传暄, 马清钧. 金黄色葡萄球菌肠毒素A的基因克隆、表达及活性试验. 生物工程学报, 2003, 19(4): 402−406.
[7] Ding HX. The mechanism of tumor immunity escape. Strait Pharmaceutical J, 2008, 20(7): 12−14.丁红仙. 肿瘤免疫逃逸机制的研究进展. 海峡药学, 2008, 20 (7): 12−14.
[8] Ouyang Q, Wei YY, Jin BQ, et al. The mechanism and research progression about tumor vaccine. J Fourth Mil Med Univ, 2008, 29(19): 1820−1823.欧阳清, 魏玉英, 金伯泉, 等. 肿瘤疫苗的作用机制及研究进展. 第四军医大学学报, 2008, 29(9): 1820−1823.
[9] Du J, Qian XP, Liu BR. A review of clinical trials for cancer vaccine. Modern Oncology, 2009, 17(1): 161−165.杜娟, 钱晓萍, 刘宝瑞. 肿瘤疫苗的临床研究进展. 现代肿瘤医学, 2009, 17(1): 161−165.
[10] Torres BA, Perrin GQ, Mujtaba MG, et al. Superantigen enhancement of specific immunity: antibody production and signaling pathways. J Immunol, 2002, 69(6): 2907−2914.
[11] Yu JY, Tian R, Xiu BS, et al. Antitumor activity of T cells generated from lymph nodes draining the SEA-expression murine B16 malanoma and sondarily activated with dendritic cells. Int J Biol Sci, 2009, 5(2): 135−146.
[12] Xu QB, Zhang YH, Zhang LL, et al. Growth inhibition of tumor by recombinant SEA. Chin J Can Biother, 2005, 12(2): 103−106.胥全彬, 张艳红, 张雷雷, 等. 重组金葡菌肠毒素 A的抗癌效应研究. 中国肿瘤生物治疗杂志, 2005, 12(2): l03−106.
[13] Alan Wells. Molecules in focus: EGF receptor. Int J Biochem Cell Boil, 1999, 31: 637−643.
[14] Xiu FM, Cai ZJ, Yang YS, et al. Surface anchorage of superantigen SEA promotes induction of specific antitumor immune response by tumor-derived exosomes. J Mol Med, 2007, 85: 511−521.
[15] Cabantous S, Terwilliger TC, Waldo GS. Protein tagging and deletion with engineered self-assemblying fragments of green fluorescent protein. Nat Biol, 2004, 23: 102−107.

