姜黄素对人胃癌SGC-7901细胞增殖及COX-2mRNA和COX-2蛋白表达的影响
司 宏,徐艳艳(江苏省南通市肿瘤医院,南通 226361)
姜黄素(curcumin,Cur)是从姜科植物姜黄中提取的酚性有效单体化合物,有抗氧化、抗突变、抗促癌、抗炎等广泛的药理作用。姜黄素在抗肿瘤方面有显著作用[1-4],其主要通过抑制肿瘤细胞增殖并诱导肿瘤细胞凋亡,从而起到抗肿瘤作用。环氧化酶-2(COX-2)在正常组织中一般不表达,但在炎症、生长因子、肿瘤刺激物等诱导下可以迅速合成,多种肿瘤组织和癌前病变中COX-2表达均增。本研究以人胃癌SGC7901细胞为研究对象,探讨姜黄素抑制人胃腺癌细胞增殖对COX-2基因及蛋白表达的影响。
1 材料
人胃癌细胞SGC7901株(上海玉博生物技术有限公司),姜黄素按文献[5]方法实验室自制。小鼠抗人COX-2单克隆抗体(IgG)(Cayman公司),β-actin单抗(晶美公司),HRP标记的羊抗鼠二抗(晶美公司)。MTT和 RPMI1640培养基购自Gibco公司,胎牛血清购自杭州四季青生物公司,胰酶购自Biological Industries公司。主要仪器包括美国Forma Scientific公司的二氧化碳培养箱、日本 Olympus倒置显微镜、美国BECKMAN COULTER公司全自动酶标仪(DTX880UV)等。
2 方法
2.1 细胞培养
胃癌SGC7901细胞接种于含10%胎牛血清的RPMI1640培养液中,置37℃,5%CO2饱和湿度培养箱中培养,常规胰蛋白酶消化法传代培养。
2.2 姜黄素对胃癌SGC7901细胞增殖的影响
取对数生长期的SGC7901细胞悬液,调整细胞浓度为5×105·mL-1,接种于 96 孔板,每孔 90 μL,置 37℃ ,5%CO2,饱和湿度条件下培养24 h,显微镜下观察细胞贴壁。分别加入不同浓度的姜黄素10μL,使姜黄素在细胞的终浓度分别为5、10、20、40 和 80 μg·mL-1,每一浓度均设 5 个平行孔,阴性对照组加入等体积溶剂,置37℃,5%CO2饱和湿度培养箱中继续培养 24、48、72 h 后,每孔加入 12.07 nmol·L-1的 MTT 20 μL,37℃ 孵育 30 min,再加入 DMSO 150 μL/孔,终止反应,用酶标仪检测570 nm波长处吸光度(OD值),各组取3孔OD值的均数,重复3次实验,按公式计算细胞存活率,细胞存活率(%)=(试验孔OD均值/对照孔OD均值)×100%。
2.3 姜黄素对胃癌SGC7901细胞COX-2 mRNA表达的影响
2.3.1 mRNA的提取:收集经药物处理72 h的细胞,胰酶消化后转移至EP管内,1 000转/min离心10 min,弃去上清,用PBS洗1次,加1 mL Trizol混匀室温放置10 min,加0.2 mL氯仿,震荡 15 s,室温静置 2 min,12 000 r·min-1离心 10 min,弃去上清,加75%乙醇洗涤,7 500 r·min-1离心5 min,弃去上清室温晾干,加30 μL DEPC水溶解。经1.5%琼脂糖上电泳鉴定RNA完整性,-70℃保存备用。
2.3.2 RT-PCR:引物参考文献[6]COX-2 引物序列为正义:5′-CAA GTC CCT GAG CAT CTA CG-3′,反义:5′-CAT TCC TAC CAC CAG CAA CC-3(487 bp)。β-actin引物序列为正义:5′-GGC ATC GTG ATG GAC TCC G-3′,反义:5′-GCT GGA AGG TGG ACA GCG A-3′(642 bp)。PCR 循环参数为 COX-2:95℃预变性 30 s;56.5℃ 退火 30 S,72℃ 延伸 30 s,35个循环后72℃延伸 10 min.β-actin:95℃ 预变性 30 S;65℃ 退火 30 S72℃ 延伸 30 S,27个循环后 72℃延伸 10 min。PCR产物1.5%琼脂糖凝胶电泳观察。应用扫描仪扫描条带,以β-actin作为对照,两者光密度比值作为蛋白半定量相对值。试验重复3次。
2.4 Western-blotting考察姜黄素对 SGC7901细胞 COX-2蛋白表达的影响
收集经药物处理72 h的细胞,冰预冷 PBS洗2次,加人100 μL细胞裂解液提取蛋白。以10%SDS-聚丙烯酰胺凝胶电泳分离蛋白(125 g),转印至硝酸纤维素膜后,依次加小鼠抗人COX-2单抗和辣根过氧化物酶标记的羊抗鼠二抗孵育,ECL显色。以β-actin作为对照,X光片灰密度比值作为蛋白半定量相对值。试验重复3次。
3 结果
3.1 系列浓度的姜黄素对胃癌SGC7901细胞增殖的影响
在试验浓度范围内,随着剂量增大,对细胞的抑制率增强,随时时间延长,对细胞的抑制率也增强。姜黄素 5 μg·mL-1时细胞存活为(94.5 ± 4.1)% ,80 μg·mL-1时细胞存活率降至(55.8±2.2)%,见图1。
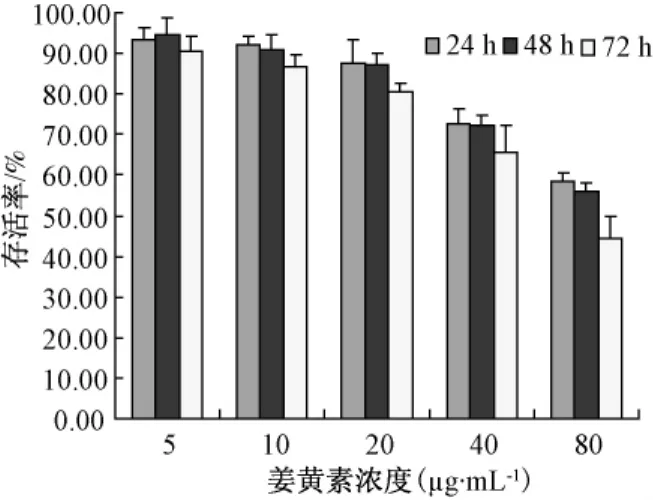
图1 系列浓度的姜黄素对胃癌SGC7901细胞增殖的影响Fig 1 Effects of a different concentration of curcumin on the proliferation of gastric cancer cell line SGC-7901
3.2 姜黄素对SGC7901细胞COX-2 mRNA表达的影响
各组细胞RT-PCR电泳照片见图2,与阴性对照相比,姜黄素对SGC7901细胞COX-2 mRNA有抑制作用,抑制作用呈剂量依赖性,光密度比值见图3。与阴性对照相比,姜黄素5 μg·mL-1组的 COX-2 mRNA表达没有显著差异(P>0.05),10 μg·mL-1组表达有所下降(0.05 > P > 0.01),20 μg·mL-1、40 μg·mL-1和 80 μg·mL-1组 COX-2 mRNA的表达显著下降(P<0.01)。
3.3 姜黄素对SGC7901细胞COX-2蛋白表达的影响
Western-blotting结果显示不同浓度姜黄素对SGC7901细胞COX-2蛋白表达有明显的抑制作用,随着姜黄素浓度的增加,抑制作用逐渐增强,见图4。与阴性对照组相比,姜黄素5 μg·mL-1、10 μg·mL-1组的 COX-2 蛋白表达有所下降(0.05 >P > 0.01),20 μg·mL-1、40 μg·mL-1和 80 μg·mL-1组表达显著下降(P<0.01)。
4 讨论
环氧酶(COX)是花生四烯酸生物合成前列腺素的合成酶,包括COX-1和COX-2。其中COX-2在正常组织中一般不表达,但在炎症、生长因子、肿瘤刺激物等诱导下可以迅速合成,多种肿瘤组织和癌前病变中 COX-2表达均增[7-9]。COX-2肿瘤促进作用的机制虽不十分明确,但多认为与 PG合成增加、抑制凋亡、促进新生血管生成以及增强肿瘤细胞的侵袭性和介导致癌原产生有关[10,11]。流行病学研究表明,非甾体类抗炎药(NSAIDs)可降低大肠癌、胃癌等消化道肿瘤的发病率,这与其能够抑制肿瘤组织中COX-2和(或)PGE的表达有关。因此,通过抑制COX-2的表达以达到抑制肿瘤发生、发展就变得十分有意义。
本研究发现,姜黄素可明显减少体外培养高表达COX-2蛋白的胃癌SGC-7901细胞的数量,抑制细胞增殖,该作用呈明显的浓度依赖性。5个不同浓度的姜黄素对COX-2 mRNA和蛋白的表达均有抑制作用,在低浓度时(5 μg·mL-1)这种抑制作用不明显(P >0.05),在较高浓度(20 ~80 μg·mL-1)时,抑制作用更加明显(P<0.01)。这些提示姜黄素对胃癌SGC-7901细胞的抑制作用与COX-2途径有关,具体机制还有待于进一步研究。
姜黄素不仅具有显著的体内外抗肿瘤活性,而且毒性很低,价格低廉,是一种很有开发前景的天然化合物。有研究表明,姜黄素对COX-2阳性表达肺腺癌和胰腺癌细胞的生长抑制作用要强于COX-2阴性表达癌细胞,对胃癌细胞系AGS的COX-2转录和活性有抑制作用[6,12],提示姜黄素对 COX-2表达抑制作用在其抑癌作用机制中发挥重要作用。姜黄素对胃癌细胞COX-2表达抑制作用的影响,使之有可能成为天然的肿瘤信号转导治疗药物或先导药物,最终开发出高效,低毒的新型抗癌药。
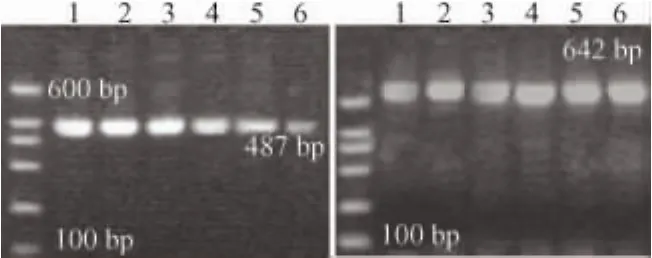
图2 经姜黄素处理72h后对SGC7901细胞COX-2 mRNA的影响Fig 2 Expression of COX-2 mRNA in SGC7901 cells after treatment with curcumin for 72 hours
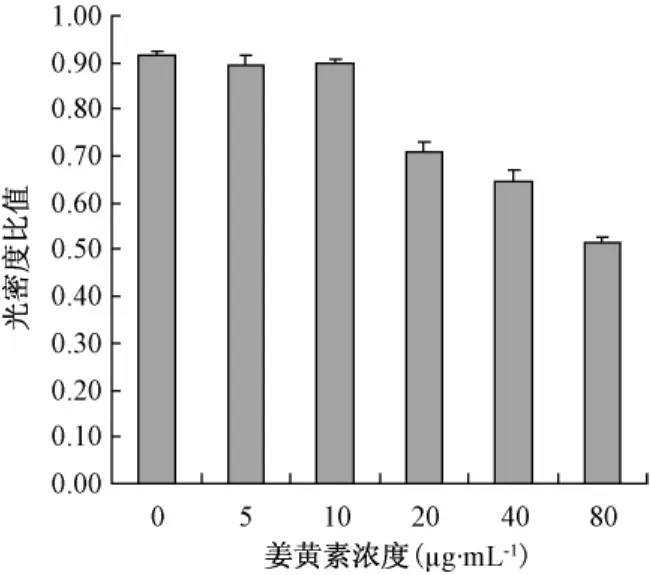
图3 各组细胞COX-2RT-PCR产物光密度比值Fig 3 Optical density ratio of COX-2RT-PCR products of each group of cells
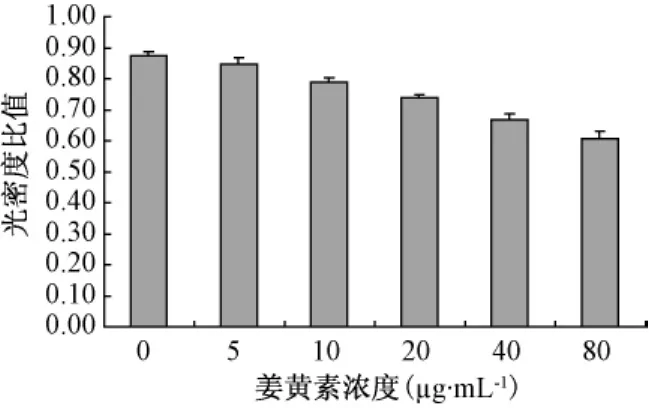
图4 各组细胞COX-2/β-actin灰密度比值Fig 4 Neutral density ratio of COX-2/β-actin of each group of cells
[1] 余美荣,蒋福升,丁志山.姜黄素的研究进展[J].中草药,2009,40(5):828.
[2] 汪海慧,成 扬.姜黄素药理作用的研究进展[J].上海中医药大学学报,2007,21(6):73.
[3] 张丽娟,陆 茵.姜黄素抗肿瘤机制研究进展[J].中国中医药信息杂志,2008,15(4):100.
[4] Costello RT,Rey J,Fauriat C,el al.New approaches in the immunotherapy of haematological malignancies[J].Eur J Haematol,2003,70(5):333.
[5] Uehara SL,Yasuda I,Akiyama K,et al.Diarylheptanoid from the rhizomes of carcuma xanthorriza and alpinia officinarum[J].Chem Pharm Bull,1987,35(8):3298.
[6] 刘 华,沈迎春,郭传勇.姜黄素对胃癌细胞系AGS环氧合酶-2转录和活性的影响[J].同济大学学报(医学版),2008,29(5):23.
[7] Bemis DL,Capodice JL,Anastasiadis AG,etal.Zyflamend,a unique herbal preparation with nonselective COX inhibitory activity,induces apoptosis of prostate cancer cells that lack COX-2 expression[J].Nutr Cancer,2005,52(2):202.
[8] Kang HK,Lee E,Pyo H,et al.Cyclooxygenaseindependent down-regulation of multidrug resistancassociated protein-1 expression by celecoxib in human lung cancer cells[J].Mol Cancer Ther,2005,4(9):1358.
[9] Kim SJ,SeoJH,LeeYJ,etal.Autocrine vascular endothelial growth factor/ascular endothelial growth factor receptor-2 growth pathway represents a cyclooxygenase-2-independent target for the cyclooxygenase-2 inhibitor NS-398 in colon cancer cells [J].Oncology,2005,68(23):204.
[10] Yoshimoto T,Takahashi Y,Kinoshita T,et al.Growth stimulation and epidermal growth factor receptor induction in cyclooxygenase-overexpressing human colon carcinoma cells[J].Adv Exp Med Biol,2002,507:403.
[11] Sun YJ,TangXM,HalfE,etal.Cyclooxygenase-2 overexpression reduces apoptotic susceptibility by inhibiting the cytochrome c-dependent apoptotic pathway in human colon cancer cells[J].Cancer Res,2002,62(21):6323.
[12] Lev-Ari S,Starr A,Vexler A,et al.Inhibition of pancreatic and lung adenocarcinoma cell survival by curcumin is associated with increased apoptosis,Down-regulation of COX-2 and EGFR and inhibition of Erkl/2 activity[J].Anticancer Res,2O06,26(6B):4423.

