1例L型支气管戈登菌肺部感染的报道
陈玉芊,同重湘,姜元,水永珍,田丽丽,张颖,3,祝秉东
1. 兰州大学结核病研究中心暨病原生物学研究所,兰州730000; 2. 兰州市肺科医院,兰州730000; 3. 美国约翰霍普金斯大学公共卫生学院分子微生物免疫学系
为了研究结核分枝杆菌(简称结核杆菌)等细菌的L型,我们筛查了2008年9月~2009年9月于兰州市肺科医院就诊的340例患者痰培养标本,在1例临床疑诊为肺结核病的患者痰标本中筛选到放线菌目戈登菌属支气管戈登菌(Gordoniabronchialis,G.bronchialis)的L型。L型细菌在1935年由英国学者Klieneberger在研究鼠咬热的病原体念珠状链杆菌时报道。由于其细胞壁部分或完全缺失(cell wall deficient form,CWD-form),菌体呈高度多型性,Klieneberger用其研究所Lister的首字母命名为L型细菌[1]。根据细胞壁的缺失程度将其分为原生质体(完全缺失)和原生质球(部分缺失)[2],均可在合适的渗透压培养基中生长繁殖[3]。根据L型细菌自发回复为细胞壁完整细菌的能力,将其分为稳定型和不稳定型[2]。细胞壁的缺失使L型细菌的形态多样,且革兰染色和抗酸染色为阴性[4]。目前认为L型细菌是病原菌与宿主免疫系统相互作用的结果[5],可能与动物和人慢性感染性疾病的发病过程有关[2,6,7],但机制尚不清楚。
1 临床材料
1.1 病例
患者,男性,78岁,农民。间断性咳嗽、咳痰4年,加重1个月,于2008年10月13日入住甘肃省兰州市肺科医院。痰标本培养菌株编号为866。患者自述4年前开始每遇天气转凉即出现咳嗽,咳白色黏液性痰,并伴气短。多次就诊,诊断为“慢性支气管炎、肺心病”。给予抗炎利痰对症治疗后,症状缓解。否认服用抗结核药。入院前1个月上述症状逐渐加重,对症治疗,疗效欠佳。
入院时查体:腋下体温36 ℃, 心率80次/min,血压 155/95 mmHg。神志清,精神欠佳,体形正常,扶入病房。咽部无充血,扁桃体无肿大,双侧呼吸动度减弱,叩诊过清音,双肺呼吸音粗,肺底可闻及细湿啰音。腹平软,无压痛、反跳痛,肝、脾不大。血常规检查:白细胞2.9×109/L,淋巴细胞绝对值0.8×109/L,红细胞6.55×1012/L,血红蛋白含量208 g/L,平均红细胞血红蛋白含量31.7 pg。生化检查:谷丙转氨酶57 u/L,谷草转氨酶41 u/L,谷草转氨酶/谷丙转氨酶0.7,载脂蛋白A 0.94 g/L,载脂蛋白B 1.18 g/L,乳酸脱氢酶260 u/L,腺苷脱氨酶31 u/L,转铁蛋白6.08 g/L,β2-微球蛋白3.3 mg/L。胸腔积液生化显示:总蛋白 52 g/L,腺苷脱氨酶64 g/L,转铁蛋白1.26 g/L。胸腔积液涂片见大量散在的淋巴细胞。胸水中甲胎蛋白0.83 ng/ml,癌胚抗原0.58 ng/ml,肿瘤相关因子18.78 u/ml。入院后常规痰检示痰涂片抗酸杆菌阴性。胸部计算机断层扫描(computed tomography,CT)显示:双肺间质纹理增粗,肺内散布片絮状高密度灶,伴双侧胸腔积液,纵隔可见钙化的淋巴结,左心室增大。
入院诊断为肺心病。肺部有炎症,给予左氧氟沙星0.4 g/d,静脉点滴1周;头孢他啶 2 g/d,静脉点滴1 d;诊断性抗结核治疗(对氨基水杨酸异烟肼片 0.3 g,每天1次;利福平0.45 g,每天1次;乙胺丁醇0.75 g,每天1次)和对症支持治疗,15 d后症状好转出院。
1.2 材料和方法
1.2.1主要试剂Middlebrook 7H9(8X07131)、BACTEC MGIT-960液体培养基购于美国BD公司,小牛血清组分v(A8020)和过氧化氢酶(C8070)购于瑞士罗氏制药公司,基因组提取试剂盒(N9021)购于东盛生物有限公司,DNA STAR 聚合酶和胶回收试剂盒购于TaKaRa,TaqDNA聚合酶为美国Fermentas公司产品,鸡蛋为正大鲜鸡蛋。
1.2.2痰标本的细菌培养取患者晨起漱口后深部咳出的痰做标本,经消化、离心、弃上清液后加入适量磷酸缓冲液(phosphate-buffered saline,PBS),重悬、沉淀,取300 μl分别接种于BACTEC MGIT-960液体、含蔗糖的Middlebrook 7H9(7H9-L)半固体、不含蔗糖的Middlebrook 7H9(7H9-B)半固体、含氯化钠的92-3 TB(92-3 TB-L)液体、不含氯化钠的92-3 TB(92-3 TB-B)液体[8]及罗氏(Lownstein-Jenson,L-J)培养基,37 ℃静置培养。
1.2.3显微镜镜检取患者晨起漱口后深部咳出的痰做检查。①抗酸染色:将痰涂片,加热固定,碱性石炭酸复红初染,3%盐酸酒精脱色,亚甲蓝复染,干燥后光学显微镜下镜检[9]。②革兰染色:将痰涂片,自然干燥,结晶紫初染,碘液媒染,95%乙醇脱色,稀释复红复染,干燥后光学显微镜下镜检[9]。
1.2.4细菌回复实验将该菌株培养至呈煎蛋样生长的L型细菌,接种于罗氏培养基或7H9-B半固体培养基,观察细菌生长状况及形态改变。
1.2.5扫描电子显微镜观察刮取培养的菌落,置于1.5 ml的Eppendorf管中,加入3%磷酸戊二醛固定过夜。在兰州大学医学实验中心电子显微镜室处理并用扫描电子显微镜观察。
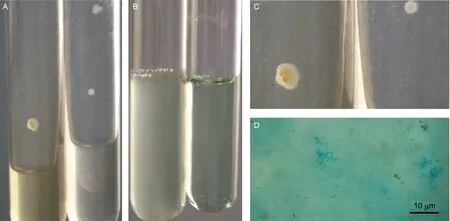
A: Colonies grew on 7H9-L semi-solid medium. B: With the growth of No. 866 strain, the 92-3 TB-L liquid medium (left) became more turbid than the blank (right). C: The fried egg-like colonies (amplified from Fig. A). D: The bacteria before subculture were spherical and negative to the acid-fast staining.图1 不同培养基中编号866菌株培养结果 Fig.1 The culture results of No. 866 strain in different media
1.2.616SrRNADNA的聚合酶链反应(polymerasechainreaction,PCR)扩增用DNA提取试剂盒提取该菌株DNA,扩增长度为580 bp的16S rRNA DNA序列。16S rRNA DNA上游引物:5′-CAC ATG CAA GTC GAA CGG AAA GG-3′;下游引物:5′-GCC CGT ATC GCC CGC ACG CT-3′。引物由上海生物工程技术服务有限公司(NSBC-Sangon,上海)合成。PCR反应体系:DNA混合液(各2.5 mmol/L) 4 μl,PCR缓冲液(5×) 10 μl,PrimeSTAR DNA多聚酶(2.5 u/μl) 0.5 μl,上、下游引物(10 μmol/L)各1 μl,模板DNA 2 μl (20 ng/m1),最后补充双蒸去离子水至50 μl。扩增条件:94 ℃预变性1 min;95 ℃ 10 s,65 ℃ 30 s,72 ℃ 30 s, 35个循环;最后72 ℃ 10 min。
1.2.7PCR产物纯化及DNA序列分析PCR扩增产物在1.0%琼脂糖凝胶(含0.5 μg/ml溴化乙啶)上电泳,按照操作手册用DNA胶回收试剂盒回收目的片段后测序。测序结果用GenBank BLAST软件进行同源性分析。
1.2.8药敏试验应用罗氏培养基按绝对浓度法进行抗结核药敏试验。制备1 mg/ml菌悬液,10倍稀释法稀释至0.01 mg/ml,取0.1 ml分别接种于含药培养基和对照培养基斜面上,每管接种菌量为0.001 mg,37 ℃培养4周。对照培养基生长旺盛而低浓度含药培养基菌落生长者报告为耐药(R)。其他抗生素的测定采用K-B纸片法(包括阿莫西林、甲硝唑、克拉霉素、左氧氟沙星、呋喃唑酮5个药物):0.5麦氏单位菌悬液用无菌棉拭均匀涂布于罗氏培养基,贴药敏纸片后置37 ℃孵箱培养,精确量取抑菌环直径。直径>20 mm为极敏,15~20 mm为高敏,10~14 mm为中敏,<10 mm为低敏,0 mm为不敏。
2 结果
痰标本经培养,在92-3 TB-L液体培养基出现浑浊,表明有细菌生长。在7H9-L半固体含蔗糖培养基中有煎蛋样的菌落出现(图1A~C)。抗酸染色可见抗酸染色阴性、大小不等、球状或短杆状的细菌(图1D)。将上述菌落在罗氏培养基和7H9-B半固体培养基中传代培养,均有橘红色的菌落生长(图2A、B)。少量细菌回复为抗酸染色弱阳性杆状菌,但仍有抗酸染色阴性、大小不等的球状菌(图2C)。革兰染色可见紫红色杆状菌(图2D)。扫描电子显微镜下可见传代培养后菌落呈团块状生长,菌体呈杆状(图2E、F)。PCR扩增16S rRNA DNA的测序结果与支气管戈登菌DSM 43247相似性为100%(图3),可见从该患者痰液中分离、培养出L型支气管戈登菌。药敏试验显示,该菌对利福平、利福喷汀、阿莫西林、左氧氟沙星和克拉霉素敏感,对异烟肼、链霉素、吡嗪酰胺、乙胺丁醇、对氨基水杨酸、丙硫异烟胺、甲硝唑和呋喃唑酮耐药(图4)。
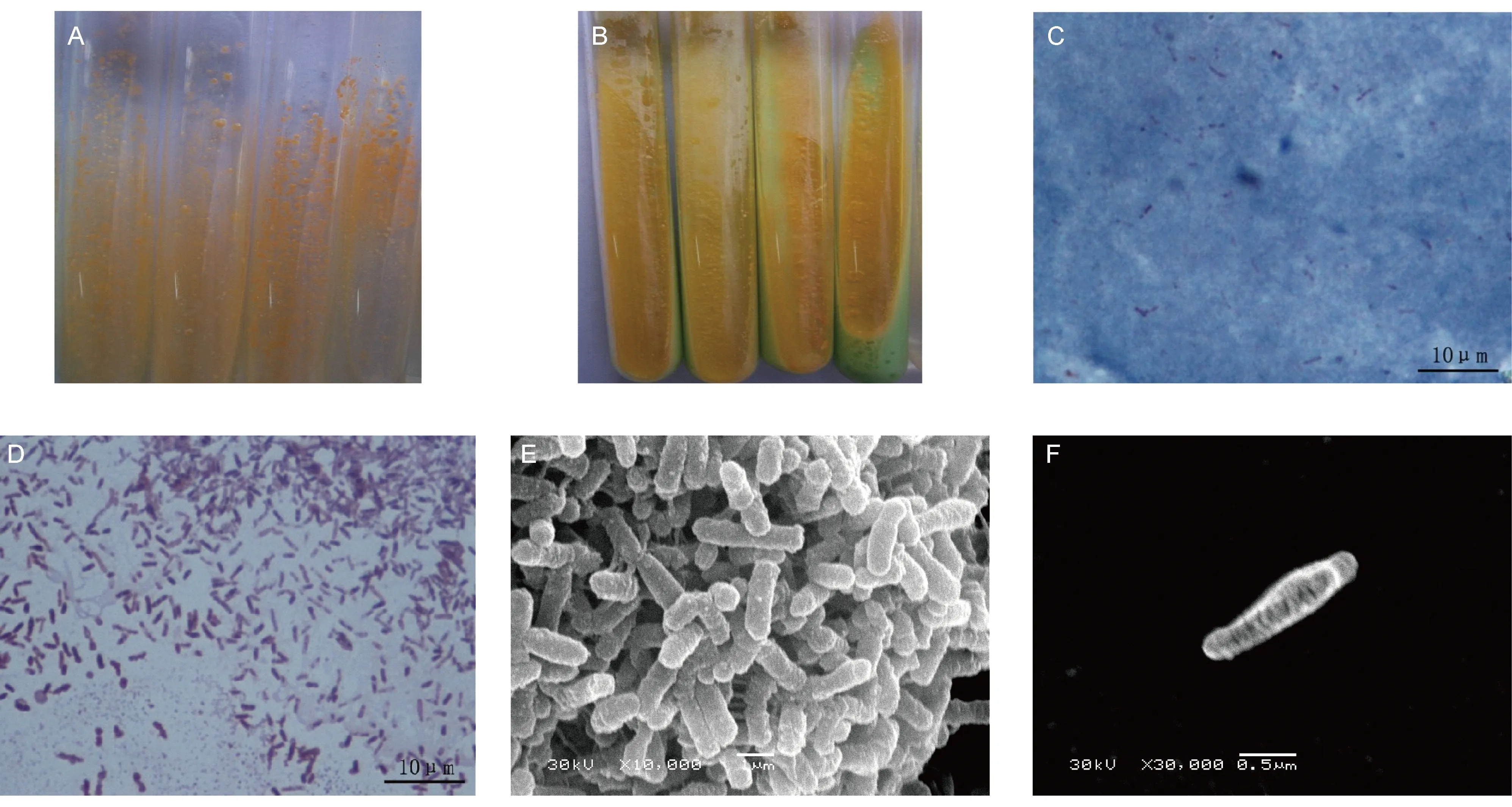
After subculture of the No. 866 strain, some pinkish and reddish colonies grew well in L-J medium (A) and 7H9-B semi-solid medium (B). After acid-fast staining, there were some positive rod-like bacteria (C). The bacteria subcultured were violet after Gram-staining (D). The subcultured bacteria were rod-shaped under scanning electron microscope (E, F).
图2编号866菌株的传代培养
Fig.2ThesubcultureofNo.866strain

Comparing the gene sequence of 16S rRNA DNA of No. 866 strain with the gene pool of National Center for Biotechnology Information (NCBI) by Blast soft, it was 100% similar with that ofG.branchialis. It indicates that the No. 866 strain belongs toG.branchialis.
图3编号866菌株16SrRNADNA基因序列比对分析
Fig.3Thegenesequenceanalysisof16SrRNADNAofNo.866strain

The No. 866 strain was sensitive to rifampin (RFP), rifapentine (RFD), amoxicillin, levofloxacin, and clarithromycin, but resistant to isoniazid (INH), streptomycin (SM), pyrazinamide (PZA), aminosalicylate (PS), ethambutol (EMB), protionamide (TH), metronidazole, and furazolidone. 图4 编号866菌株药敏试验结果 Fig.4 The drug susceptibility test of No. 866 strain
3 讨论
3.1 支气管戈登菌的研究进展
1883年,Malassez等报道结核杆菌的L型可感染动物,并在感染动物组织中可见结核杆菌杆状的完整细菌型[2]。1971年Tsukamura在日本发现放线菌目中的新菌属戈登菌属,易被误诊为结核杆菌,但两者生物学特性并不相同。如戈登菌属抗酸性较结核杆菌弱,呈短杆状,没有菌丝体形成,28~37 ℃培养可见橘黄色粗糙菌落,对小鼠、兔、豚鼠及鸡没有致病性等,其中支气管戈登菌最为典型[10]。本文中866菌株传代培养后呈橘黄色菌落,与既往报道相符。最近几年,不断有关于戈登菌属新型菌株的报道,先后发现了G.westfalica[11]、G.namibiensis[12]、G.soli[13]、G.sinesedis[14]、G.sihwensis[15]、G.defluvii[16]、G.desulfuricans[17]、G.cholesterolivorans[18]和G.shandongensis[19]。
戈登菌可感染免疫力缺陷[20-22]和免疫力正常的患者[23],如支气管戈登菌致糖尿病患者肺部感染[24],引起免疫力正常患者乳腺脓肿[25]。日本Aoyanma等从1999~2008年的临床样本中筛查到31例戈登菌属菌株,其中14株为Gordoniasputi,13株为支气管戈登菌。药敏试验发现它们对氨苄西林(1株例外)、亚胺培南(1株例外)、磺胺类、米诺卡星(1株例外),以及新一代的喹诺酮类如左氧氟沙星和环丙沙星敏感;对苯唑西林、哌拉西林及头孢类抗生素的敏感性有种的差异;同一菌种菌株间又呈多样性[26]。
3.2 L型细菌的形成机制
L型细菌的形成机制尚不清楚。目前认为其形成与细菌生存环境改变和人工诱导作用有关,也可能与治疗过程有关。①抗生素使用不规范:作用于细胞壁类的药物有效浓度不够、疗程不足,造成细菌未被彻底杀死,部分细菌细胞壁无法合成,但菌体仍能生存,成为L型细菌。②宿主机体的代谢原因:酸中毒及厌氧条件(深部感染)下,细菌因生存环境改变而导致L型细菌形成。③宿主机体抗感染免疫系统及免疫物质的作用:宿主的不完全吞噬作用及机体体液中各种抗感染免疫物质如溶菌酶、乙型溶素等对细菌的不完全作用,可诱导L型细菌产生[27,28]。体外使用抗生素可诱导L型细菌形成[29-31]。
3.3 本例分析
本例患者间断性咳嗽、咳痰4年余,多次用抗生素治疗无效;血生化检查,白细胞、淋巴细胞绝对值较正常偏低,提示免疫力低下,构成了L 型细菌形成的条件。菌株培养、电子显微镜及PCR均证实该菌株为L型支气管戈登菌。我们尚不能确定该菌就是引起本例患者肺部感染的致病菌,但结合细菌学检查结果和患者病史,仍推测支气管戈登菌是导致本例患者肺部感染的病原菌之一。
虽然目前也有一些支气管戈登菌致病的报道[10, 24-26,32],但还没有其L型致病的报道。L型细菌与细菌潜伏、持续性感染及疾病的复发有关,是引起难治性肺部感染疾病的原因之一[33,34]。我们在1例肺部感染的老年患者痰液中检出L型支气管戈登菌,提示对反复发作的肺部感染要考虑L型支气管戈登菌感染的可能。
[1] Domingue GJ, Woody HB. Bacterial persistence and expression of disease [J]. Clin Microbiol Rev, 1997, 10(2): 320-344.
[2] Beran V, Havelkove M, Kaustova J, Dvorska L, Pavlik I. Cell wall deficient forms of mycobacteria: a review [J]. Veter Med, 2006, 51(7): 365-389.
[3] Kapralek F. Principles of Bacteriology (in Czech) [M]. Prague: Publisher Karolinum, 2000, 242.
[4] Seiler P, Ulrichs T, Bandermann S, Pradl L. Cell-wall alterations as an attribute of Mycobacterium tuberculosis in latent infection [J]. J Infect Dis, 2003, 188(9): 1326-1331.
[5] Mattman LH. Cell Wall Deficient Forms: Stealth Pathogens [M]. 3rd ed. Boca Raton: CRC Press, 2001, 416.
[6] Markova N, Michailova L, Jourdanova M, Kussovski V, Valcheva V, Mokrousov I, Racoucheva T. Exhibition of persistent and drug-tolerant L-form habit Mycobacterium tuberculosis during infection in rats [J]. Cent Eur J Biol, 2008, 3(4): 407-416.
[7] Shmelev NA, Dorozhkova IR, Zemskova ZS. Persistance of the agent of tuberculosis in the body as an L-form and its damaging effect [J]. Vestn Akad Med Nauk SSSR, 1976, (5): 29-37.
[8] 卢润生, 蒋绍双, 李定越, 郑德福, 邱大志, 陈秋, 杨均. 结核菌-L型培养基的改进[J]. 四川医学, 2004, 25(7): 735-736.
[9] 中国防痨协会. 结核病诊断细菌学检验规程[J]. 中国防痨杂志, 1996, 18(1): 28-31.
[10] Tsukamura M. Proposal of a new genus Gordona for slightly acid-fast organisms occurring in sputa of patients with pulmonary disease and in soil [J]. J Gen Microbiol, 1971, 68(1): 15-26.
[11] Linos A, Berekaa MM, Steinbuchel A, Kim KK, Sproer C, Kroppenstedt RM. Gordonia westfalica sp. nov., a novel rubber-degrading actinomycete [J]. Int J Syst Evol Microbiol, 2002, 52(4): 1133-1139.
[12] Brandao PF, Maldonado LA, Ward AC, Bull AT, Goodfellow M. Gordonia namibiensis sp. nov., a novel nitrile metabolising actinomycete recovered from an African sand [J]. Syst Appl Microbiol, 2001, 24(4): 510-515.
[13] Shen FT, Goodfellow M, Jones AL, Chen YP, Arun AB, Lai WA, Rekha PD, Young CC. Gordonia soli sp. nov., a novel actinomycete isolated from soil [J]. Int J Syst Evol Microbiol, 2006, 56(11): 2597-2601.
[14] Maldonado LA, Stainsby F M, Ward A C , Ward AC, Goodfellow M. Gordonia sinesedis sp. nov., a novel soil isolate [J]. Antonie Van Leeuwenhoek, 2003, 83(1): 75-80.
[15] Kim KK, Lee CS, Kroppenstedt RM, Srackebrandt E, Lee ST. Gordonia sihwensis sp. nov., a novel nitrate-reducing bacterium isolated from a wastewater-treatment bioreactor [J]. Int J Syst Evol Microbiol, 2003, 53(5): 1427-1433.
[16] Soddell JA, Stainsby FM, Eales KL, Seviour RJ, Goodfellow M. Gordonia defluvii sp. nov., an actinomycete isolated from activated sludge foam [J]. Int J Syst Evol Microbiol, 2006, 56(10): 2265-2269.
[17] Kim SB, Brown R, Oldfield C, Gilbert SC, Goodfellow M. Gordonia desulfuricans sp. nov., a benzothiophene-desulphurizing actinomycete [J]. Int J Syst Bacteriol, 1999, 49(4): 1845-1851.
[18] Drzyzga O, Navarro Llorens JM, Fernandez de Las Heras L, Fernandez EG, Perera J. Gordonia cholesterolivorans sp. nov., a cholesterol-degrading actinomycete isolated from sewage sludge [J]. Int J Syst Evol Microbiol, 2009, 59(5): 1011-1015.
[19] Luo H, Gu Q, Xie J, Hu C, Liu Z, Huang Y. Gordonia shandongensis sp. nov. isolated from soil in China [J]. Int J Syst Evol Microbiol, 2007, 57(3): 605-608.
[20] Lesens O, Hansmann Y, Riegel P, Heller R, Djellouli MB, Martinot M, Petit H, Christmann D. Bacteremia and endocarditis caused by a Gordonia species in a patient with a central venous catheter [J]. Emerg Infect Dis, 2000, 6(4): 382-385.
[21] Drancourt M, McNeil MM, Brown JM, Lasker BA,Maurin M, Choux M, Raoult D. Brain abscess due to Gordona terrae in an immunocompromised child: case report and review of infections caused by G. terrae [J]. Clin Infect Dis, 1994, 19(2): 258-262.
[22] Riegel P, Ruimy R, de Briel D, Eichler F, Bergerat JP, Christen R, Monteh H. Bacteremia due to Gordona sputi in an immunocompromised patient [J]. J Clin Microbiol, 1996, 34(8): 2045-2047.
[23] Drancourt M, Pelletier J, Cherif AA, Raoult D. Gordona terrae central nervous system infection in an immunocompetent patient [J]. J Clin Microbiol, 1997, 35(2): 379-382.
[24] Sng LH, Koh TH, Toney SR, Floyd M, Butler WR, Tan BH. Bacteremia caused by Gordonia bronchialis in a patient with sequestrated lung [J]. J Clin Microbiol, 2004, 42(6): 2870-2871.
[25] Werno AM, Anderson TP, Chambers ST, Laird HM, Murdoch DR. Recurrent breast abscess caused by Gordonia bronchialis in an immunocompetent patient [J]. J Clin Microbiol, 2005, 43(6): 3009-3010.
[26] Aoyama K, Kang Y, Yazawa K, Gonol T, Kamei K, Mikami Y. Characterization of clinical isolates of Gordonia species in Japanese clinical samples during 1998-2008 [J]. Mycopathologia, 2009, 168(4): 175-183.
[27] Kami M, Hamaki T, Kusumi E. Cell-wall-deficient bacteria [J]. Lancet, 2001, 357(9271): 1885-1886.
[28] 汪谋岳. 分枝杆菌L型专题研讨会纪要[J]. 中华结核和呼吸杂志, 2002, 25(10): 625-626.
[29] Glover WA, Yang Y, Zhang Y. Insights into the molecular basis of L-form formation and survival in Escherichia coli [J]. PLoS ONE, 2009, 4(10): e7316.
[30] Zhuang YH. Studies on the induction of the L-form in Mycobacteria [J]. Chin J Tuber Respir Dis, 1984, 7(4): 210-212, 253.
[31] Hines ME, Styer EL. Preliminary characterization of chemically generated Mycobacterium avium subsp. paratuberculosis cell wall deficient forms (spheroplasts) [J]. Vet Microbiol, 2003, 95(4): 247-258.
[32] Garton NJ, Sutcliffe IC. Identification of a lipoarabinomannan-like lipoglycan in the actinomycete Gordonia bronchialis [J]. Arch Microbiol, 2006, 184(6): 425-427.
[33] 郑渠, 翁育清, 郭欣然, 林文辉. 200例难治性肺部感染病原学分析与L型细菌检测的临床意义[J]. 中山大学学报(医学科学版), 2003, 24(B03): 96-97.
[34] 卢润生, 蒋绍双, 李筱萍, 徐薇, 陈秋, 郑德福, 邓大志, 周静. 复治难治肺结核中结核菌-L型感染调查[J]. 预防医学情报杂志, 2008, 24(9): 906-907.

