中国部分地区猪细环病毒1型和2型的分子检测
翟少伦,龙进学,岳城,袁世山
1. 中国农业科学院上海兽医研究所猪传染病防治研究室,上海 200241; 2. 新疆农业大学动物医学学院,乌鲁木齐 830052
细环病毒(Torque teno virus,TTV)[1]于1997年由日本科学家Nishizawa等[2]在1例输血后肝炎患者的血清中发现,并将该病毒以患者的名字命名为Torque teno virus。其基因组为单股环状DNA,此前被划为圆环病毒科[3],随后被划为独立的指环病毒属[4]。猪细环病毒(porcine Torque teno virus,PTTV)分2个基因型(PTTV1和PTTV2)。研究认为,患仔猪断奶多系统衰竭综合征的猪群易感染PTTV2[5]。PTTV1与猪圆环病毒2型(porcine circovirus type 2,PCV2)和猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)共感染可导致仔猪断奶多系统衰竭综合征、猪肾病与皮炎综合征的发生[6,7]。
目前,PTTV1和PTTV2的流行已在世界多个国家报道,我国报道还较少。本研究通过聚合酶链反应(polymerase chain reaction,PCR)检测2009年收集的我国部分发病猪场及健康猪场的232份样品,调查PTTV1及PTTV2的流行情况,为PTTV感染的防控提供理论依据。
1 材料和方法
1.1 材料
样品包括2009年送检的来自我国9个省市发病猪场的104份组织、80份血清和7份精液,以及41份健康猪血清。病毒DNA提取试剂盒为天根公司产品,PCR常用相关试剂为东盛公司产品。
1.2 病毒核酸的提取
取200~300 mg组织样品匀浆处理,用1 ml 磷酸缓冲液(phosphate-buffered saline,PBS)稀释溶解,分别取200 μl组织和血清,按DNA提取试剂盒说明书操作。提取后的DNA溶于50 μl Tris-EDTA缓冲液中,冻存于-30 ℃备用。
1.3 PCR 扩增
检测PTTV1所用引物(PTTV1-F:5′-CGGGTTCAGGAGGCTCAAT -3′;PTTV1-R:5′-GCCATTCGGAACTGCACTTACT-3′)以及检测PTTV2所用引物(PTTV2-F:5′-TCATGACAGG GTTCACCGGAA-3′;PTTV2-R:5′-CGTCTGC GCACTTACTTATATACTCTA-3′)参考已发表文献[8],由上海Invitrogen公司合成。 PTTV1和PTTV2的PCR目的产物大小分别为305 bp和253 bp。PCR体系及反应程序略有改动。检测PTTV1的PCR反应体系(25 μl):PTTV1-F(10 μmol/L)0.5 μl,PTTV1-R(10 μmol/L)0.5 μl,2×Mix 12.5 μl,ddH2O 8.5 μl,DNA 3 μl。PCR反应程序:94 ℃预变性5 min;94 ℃变性15 s,60 ℃退火20 s,72 ℃延伸30 s,50个循环;72 ℃再延伸5 min。检测PTTV2的PCR反应体系及反应条件同PTTV1。
1.4 统计学分析
为评估发病猪场及健康猪场中PTTV流行情况是否存在显著性差异,进行卡方检验,P<0.05为有显著性差异。
2 结果
2.1 PTTV在发病猪样品中的检测结果
提取191份病料的DNA,分别用PTTV1和PTTV2特异性引物进行PCR检测,产物进行凝胶电泳分析。结果147份病料出现目的条带,部分样品检测的电泳结果见图1。
检测结果显示,PTTV在我国送检病料的不同地域均有流行。9个省市送检病料中,PTTV的总阳性率为61.0%~100%(表1)。其中,新疆、安徽、北京、江苏和河北送检病料中PTTV总阳性率高达100%。进一步分析发现,病料中PTTV1与PTTV2的共感染率也较高。PTTV在病猪性别或年龄方面的流行病学分析显示,种公猪和种母猪存在较高的流行(69.2%~100%),同时死胎中也检测到PTTV1和PTTV2的存在。另外,在送检的7份精液中仅3份检出PTTV1,没有检测到 PTTV2(样品数量有限)。结果提示,PTTV可通过性接触、人工授精等垂直传播,这可能是仔猪PTTV感染率高(80.3%)的原因之一(表2)。对不同类型样品中PTTV的阳性率分析显示,组织样品中感染率略高于血清样品(表3)。
根据样品的送检日期,按季度分析PTTV的检出率(图2)。结果显示,PTTV在2009年第3、4季度呈高流行,但无显著差异。
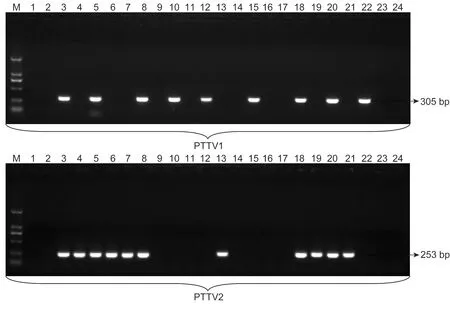
图1PCR检测发病猪样品中PTTV的部分电泳结果
Fig.1ElectrophoresisidentificationresultsofpartialsamplesfromdiseasedpigsforPTTVdetectionbyPCR
表19个不同省市发病猪场中PTTV的检测结果
Tab.1DetectionresultsofPTTVindifferentpigfarmsfrom9regions
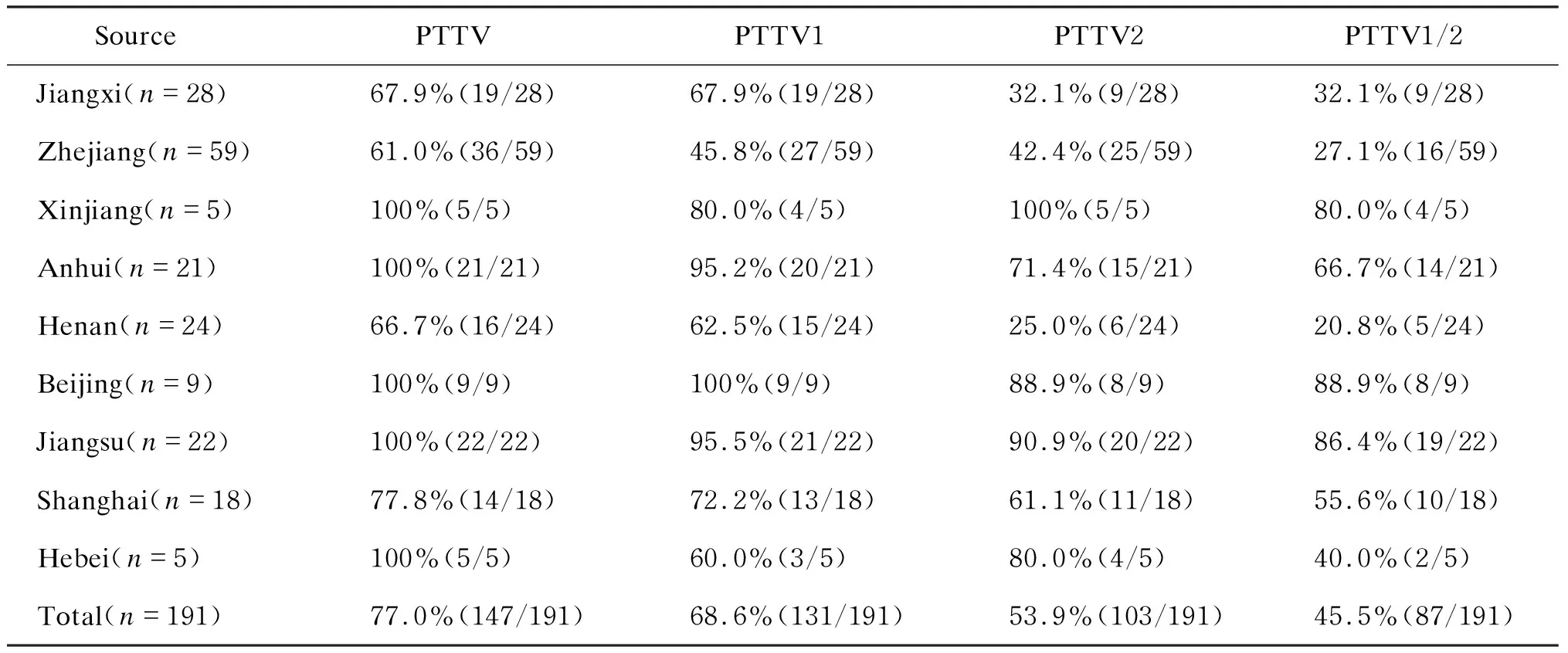
SourcePTTVPTTV1PTTV2PTTV1/2Jiangxi(n=28)67.9%(19/28)67.9%(19/28)32.1%(9/28)32.1%(9/28)Zhejiang(n=59)61.0%(36/59)45.8%(27/59)42.4%(25/59)27.1%(16/59)Xinjiang(n=5)100%(5/5)80.0%(4/5)100%(5/5)80.0%(4/5)Anhui(n=21)100%(21/21)95.2%(20/21)71.4%(15/21)66.7%(14/21)Henan(n=24)66.7%(16/24)62.5%(15/24)25.0%(6/24)20.8%(5/24)Beijing(n=9)100%(9/9)100%(9/9)88.9%(8/9)88.9%(8/9)Jiangsu(n=22)100%(22/22)95.5%(21/22)90.9%(20/22)86.4%(19/22)Shanghai(n=18)77.8%(14/18)72.2%(13/18)61.1%(11/18)55.6%(10/18)Hebei(n=5)100%(5/5)60.0%(3/5)80.0%(4/5)40.0%(2/5)Total(n=191)77.0%(147/191)68.6%(131/191)53.9%(103/191)45.5%(87/191)
表2不同性别或年龄病猪中PTTV的检测结果
Tab.2DetectionresultsofPTTVindiseasedpigswithdifferentgendersorages
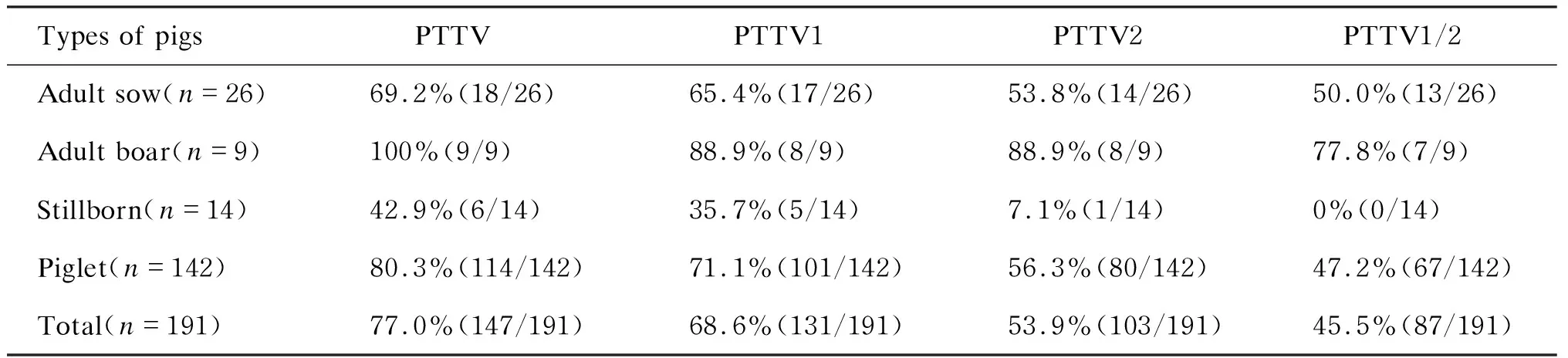
Types of pigsPTTVPTTV1PTTV2PTTV1/2Adult sow(n=26)69.2%(18/26)65.4%(17/26)53.8%(14/26)50.0%(13/26)Adult boar(n=9)100%(9/9)88.9%(8/9)88.9%(8/9)77.8%(7/9)Stillborn(n=14)42.9%(6/14)35.7%(5/14)7.1%(1/14)0%(0/14)Piglet(n=142)80.3%(114/142)71.1%(101/142)56.3%(80/142)47.2%(67/142)Total(n=191)77.0%(147/191)68.6%(131/191)53.9%(103/191)45.5%(87/191)
表3病猪不同类型样品中PTTV的检测结果
Tab.3DetectionresultsofPTTVindifferentsampletypesfromdiseasedpigs
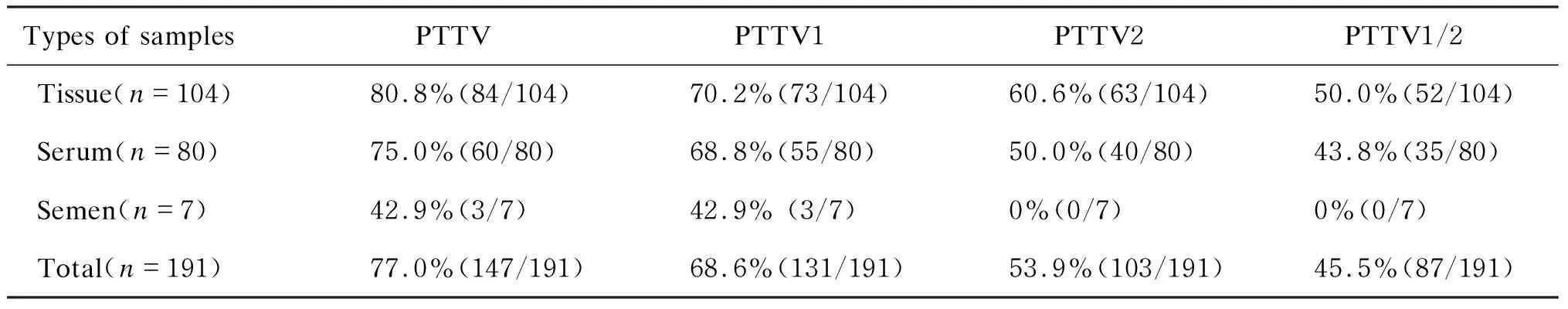
Types of samplesPTTVPTTV1PTTV2PTTV1/2Tissue(n=104)80.8%(84/104)70.2%(73/104)60.6%(63/104)50.0%(52/104)Serum(n=80)75.0%(60/80)68.8%(55/80)50.0%(40/80)43.8%(35/80)Semen(n=7)42.9%(3/7)42.9% (3/7)0%(0/7)0%(0/7)Total(n=191)77.0%(147/191)68.6%(131/191)53.9%(103/191)45.5%(87/191)
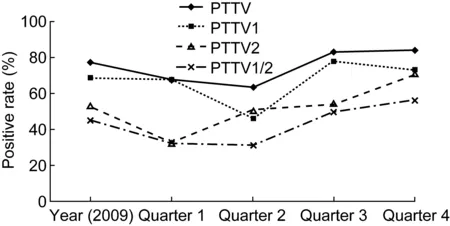
图22009年不同季度PTTV的流行情况
Fig.2PrevalenceofPTTVindifferentquartersin2009
2.2 PTTV在健康猪血清中的检测结果
采取同样的PCR方法,检测41份健康猪血清中PTTV的感染情况。结果显示,PTTV总阳性率、PTTV1单一阳性率、PTTV2单一阳性率及两基因型的共感染率分别为43.9% (18/41)、36.6%(15/41)、24.4%(10/41)和12.2%(5/41)。卡方检验结果显示,健康猪体内PTTV阳性率、PTTV1单一阳性率、PTTV2单一阳性率及两基因型共感染率均比发病猪低(P<0.01)。提示PTTV在发病猪体内可能起一定作用。健康猪隐性携带病毒,因此PTTV可通过地区间的生猪贸易和引种等行为而广泛扩散。
3 讨论
TTV是指环病毒属成员之一,基因组大小为2~4 kb。PTTV的基因组大小为2.7~2.9 kb,目前分为2个不同的基因型(PTTV1和PTTV2)。自2002年日本研究人员[9]分离、鉴定了第1株PTTV(Sd-TTV31株,GenBank登录号为AB076001)以来,至今共有6株PTTV全基因序列报道,包括4株PTTV1和2株PTTV2,但PTTV1与PTTV2的同源性不到50%[10]。大量研究认为,不同物种TTV的非编码区序列比较保守,PTTV1和PTTV2的非编码区也具有保守的基因组序列,因此,目前PTTV的检测法多为基于此保守序列而建立的PCR(套式PCR或PCR)。1999年,Leary等[11]按照人TTV的非编码区保守序列设计1对用于检测猪群中PTTV的引物,结果显示猪群中PTTV的阳性率为20%。2004年,McKeown等[12]采用按Sd-TTV31株序列建立的PCR法检测北京附近商业养猪场的20份血清样品,其中16份存在PTTV感染,这是我国最早报道的PTTV1流行,但未进行分型。随后,有报道在韩国、泰国、加拿大、美国、法国[13]、意大利[14]及西班牙[5,12,15]等国家猪群中存在PTTV。此外,研究认为PTTV在欧洲野猪中也相当流行[16]。
对于我国猪群中PTTV的检测,目前有2篇报道。孙泉云等[17]采用荧光PCR检测随机采样的400份猪血清,PTTV感染率为3.75%;王礞礞等[18]采用套式PCR检测7个省市共258份临床病料发现,PTTV1的单一阳性率为37.6%,PTTV2的单一阳性率为82.6%,两基因型的共感染率为38.4%。本研究结果显示,临床发病猪中PTTV总阳性率为77.0%,其中PTTV1的单一阳性率为68.6%,PTTV2的单一阳性率为53.9%,两基因型的共感染率为45.5%。本研究结果中,PTTV1 和PTTV2单独感染率与王礞礞等的研究结果差异显著,但共感染率无显著差异。孙泉云等报道的PTTV在猪群中的低感染率与本研究结果相差甚远,因为我们检测到PTTV在健康猪体内也有较高的流行率(43.9%)。原因可能是不同研究中所采用的检测方法及所采集的样品不同所致。
关于PTTV的传播,先前研究认为可能的途径为粪-口传播[19]、垂直传播[20]、子宫传播[21]、疫苗传播[8]、性传播[22]等,本研究中也在母猪血清、公猪精液及死胎中检测到PTTV,再次证实PTTV可通过精液、子宫等进行垂直传播。此外,本研究还在健康猪体内检测到较高的PTTV感染率,提示在进行跨地区引种及频繁生猪贸易中,健康猪携带PTTV可能也是传播的重要途径。
目前,在体外还没有合适的研究PTTV的细胞及动物模型,因此其单独的致病性尚不清楚。本研究随机选取来自我国部分省市发病猪和健康猪的样品进行PTTV检测,结果显示发病猪群中PTTV流行率显著高于健康猪。有研究认为PTTV与仔猪断奶多系统衰竭综合征[6]、猪皮炎与肾病综合征[7]的发生有关。本研究结果初步表明,临床上PTTV与目前我国复杂的猪病有一定联系:其单独感染可能引起感染猪发病,也可能与其他病原产生协同致病作用。目前,PRRSV和PCV2感染在我国猪群中广泛流行。PTTV在猪群中存在如此高的感染率,极可能会加剧PRRSV和PCV2感染的大流行。因此,PTTV 值得广大研究者关注,其具体的致病机制需要深入研究。
[1] 陆承平主编. 兽医微生物学 [M]. 第四版. 北京:中国农业出版社,2007,376.
[2] Nishizawa T, Okamoto H, Konishi K, Yoshizawa H, Miyakawa Y, Mayumi M. A novel DNA virus (TTV) associated with elevated transaminase levels in posttransfusion hepatitis of unknown etiology [J]. Biochem Biophys Res Commun, 1997, 241(1): 92-97.
[3] Biagini P. Human circoviruses [J]. Vet Microbiol, 2004, 98(2): 95-101.
[4] Biagini P. Classification of TTV and related viruses (anelloviruses) [J]. Curr Top Microbiol Immunol, 2009, 331: 21-33.
[5] Kekarainen T, Sibila M, Segales J. Prevalence of swine Torque teno virus in post-weaning multisystemic wasting syndrome (PMWS)-affected and non-PMWS-affected pigs in Spain [J]. J Gen Virol, 2006, 87(Pt 4): 833-837.
[6] Ellis JA, Allan G, Krakowka S. Effect of coinfection with genogroup 1 porcine torque teno virus on porcine circovirus type 2-associated postweaning multisystemic wasting syndrome in gnotobiotic pigs [J]. Am J Vet Res, 2008, 69(12): 1608-1614.
[7] Krakowka S, Hartunian C, Hamberg A, Shoup D, Rings M, Zhang Y, Allan G, Ellis JA. Evaluation of induction of porcine dermatitis and nephropathy syndrome in gnotobiotic pigs with negative results for porcine circovirus type 2 [J]. Am J Vet Res, 2008, 69(12): 1615-1622.
[8] Kekarainen T, Martinez-Guino L, Segales J. Swine torque teno virus detection in pig commercial vaccines, enzymes for laboratory use and human drugs containing components of porcine origin [J]. J Gen Virol, 2009, 90(Pt 3): 648-653.
[9] Okamoto H, Takahashi M, Nishizawa T, Tawara A, Fukai K, Muramatsu U, Naito Y, Yoshikawa A. Genomic characterization of TT viruses (TTVs) in pigs, cats and dogs and their relatedness with species-specific TTVs in primates and tupaias [J]. J Gen Virol, 2002, 83(Pt 6): 1291-1297.
[10] Niel C, Diniz-Mendes L, Devalle S. Rolling-circle amplifi-cation of Torque teno virus (TTV) complete genomes from human and swine sera and identification of a novel swine TTV genogroup [J]. J Gen Virol, 2005, 86(Pt 5): 1343-1347.
[11] Leary TP, Erker JC, Chalmers ML, Desai SM, Mushahwar IK. Improved detection systems for TT virus reveal high prevalence in humans, non-human primates and farm animals [J]. J Gen Virol, 1999, 80(Pt 8): 2115-2120.
[12] McKeown NE, Fenaux M, Halbur PG, Meng XJ. Molecular characterization of porcine TT virus, an orphan virus,in pigs from six different countries [J]. Vet Microbiol, 2004, 104(1-2): 113-117.
[13] Bigarre L, Beven V, de Boisseson C, Grasland B, Rose N, Biagini P, Jestin A. Pig anelloviruses are highly prevalent in swine herds in France [J]. J Gen Virol, 2005, 86(Pt 3): 631-635.
[14] Martelli F, Caprioli A, Di Bartolo I, Cibin V, Pezzotti G, Ruggeri FM, Ostanello F. Detection of swine torque teno virus in Italian pig herds [J]. J Vet Med B Infect Dis Vet Public Health, 2006, 53(5): 234-238.
[15] Segales J, Martinez-Guino L, Cortey M, Navarro N, Huerta E, Sibila M, Pujols J, Kekarainen T. Retrospective study on swine Torque teno virus genogroups 1 and 2 infection from 1985 to 2005 in Spain [J]. Vet Microbiol, 2009, 134(3-4): 199-207.
[16] Martinez L, Kekarainen T, Sibila M, Ruiz-Fons F, Vidal D, Gortazar C, Segales J. Torque teno virus (TTV) is highly prevalent in the European wild boar (Sus scrofa) [J]. Vet Microbiol, 2006, 118(3-4): 223-229.
[17] 孙泉云,李凯航,张维谊,邓波,鞠厚斌,鞠龚讷. 上海地区猪和奶牛血清中TTV(Torque teno virus)感染的检测 [J]. 中国动物传染病学报,2009, 17(2): 78-81.
[18] 王礞礞,周艳君,陈宗艳,于海,李国新,阎丽萍,姜一峰,侯军委,童光志. 我国猪群中TTV 的鉴定及其分子流行病学分析 [J]. 中国预防兽医学报,2009, 31(10): 751-755.
[19] Brassard J, Gagne MJ, Lamoureux L, Inglis GD, Leblanc D, Houde A. Molecular detection of bovine and porcine Torque teno virus in plasma and feces [J]. Vet Microbiol, 2008, 126(1-3): 271-276.
[20] Martínez-Guinó L, Kekarainen T, Segalés J. Evidence of Torque teno viru (TTV) vertical transmission in swine [J]. Theriogenology, 2009, 71(9): 1390-1395.
[21] Pozzuto T, Mueller B, Meehan B, Ringler SS, McIntosh KA, Ellis JA, Mankertz A, Krakowka S. In utero transmission of porcine torque teno viruses [J]. Vet Microbiol, 2009, 137(3-4): 375-379.
[22] Kekarainen T, López-Soria S, Segalés J. Detection of swine torque teno virus genogroups 1 and 2 in boar sera and semen [J]. Theriogenology, 2007, 68(7): 966-971.

