淋巴细胞趋化因子增强柯萨奇病毒DNA疫苗黏膜免疫及预防小鼠心肌炎的作用
岳艳,胡林昆,徐薇,熊思东
复旦大学上海医学院免疫生物学研究所,上海 200032
病毒性心肌炎(viral myocarditis,VMC)是一种临床常见的心血管系统疾病,近年来在全球范围内发病呈上升趋势,且已成为青少年不明原因猝死的主要原因之一[1]。柯萨奇病毒B3型(coxsackievirus B3,CVB3)感染是导致人类急、慢性心肌炎和扩张性心肌病的重要原因[2],对其预防性和治疗性疫苗研制的需求极为迫切。我们的前期工作表明,以具良好生物可容性,促黏膜黏附、吸收及安全无毒等多重优良特性的脱乙酰壳多糖chitosan包裹编码CVB3结构蛋白VP1的质粒pcDNA3.1-VP1,可制备新型chitosan-DNA(chi-pVP1)黏膜疫苗。该疫苗通过滴鼻免疫可诱导较高水平的CVB3特异性血清IgG和粪便IgA,以及较强的全身细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)应答,可保护33.3%小鼠抵抗致死性CVB3的攻击[3]。为进一步增强chi-pVP1诱导的黏膜免疫应答,本研究拟从调节黏膜局部微环境、增加免疫细胞数量及功能方面入手,以期获得更有效的免疫保护力。
趋化因子是一大类具有趋引免疫细胞〔特别是抗原呈递细胞(antigen-presenting cell,APC)及T细胞〕到达组织局部﹑发挥炎性功能的重要分子群体,其功能研究和应用一直是免疫学的研究热点[4-6]。研究发现,趋化因子除具有经典的趋化功能外,尚具有抗血管生成,促进淋巴细胞发育和成熟,以及调节局部免疫微环境、诱导免疫应答偏移等多重功效[7],作为免疫佐剂已广泛应用于抗感染及肿瘤疫苗等诸多领域[8,9]。C家族趋化因子的唯一成员——淋巴细胞趋化因子(lymphotactin,LTN)主要由活化的CD8+T细胞和自然杀伤(natural killer, NK)细胞分泌。此外,上皮内γδT细胞、CD4-CD8-T细胞、CD4+NK1.1+T细胞也可表达LTN。由于其主要趋化T细胞和NK细胞,因此被认为是淋巴细胞特异性趋化因子[10]。LTN是肠黏膜分泌的最主要趋化因子,在一定程度上提示其可能参与黏膜免疫应答过程。Lillard等将卵清蛋白(ovalbumin,OVA)与LTN蛋白共同滴鼻免疫小鼠,发现LTN可同时促进OVA特异性黏膜Th1和Th2细胞应答,显著增高黏膜分泌型免疫球蛋白A(secreting immunoglobulin A,SIgA)水平,显示其作为黏膜免疫佐剂的良好潜能[11]。然而,目前对于LTN能否增强黏膜CTL功能尚不清楚。为此,本研究在原有疫苗体系中引入LTN,利用其趋引免疫细胞、调节局部免疫微环境、促进Th1细胞免疫应答等诸多作用来增强chi-pVP1诱导的特异性黏膜免疫应答及免疫保护效力。
1 材料和方法
1.1 材料
小鼠肌酸激酶(creatine kinase,CK)活性检测试剂盒购自南京建成生物工程研究所,chitosan(390×103)购自Sigma公司。BALB/c小鼠辣根过氧化酶(horseradish peroxidase,HRP)-羊抗小鼠IgG、IgM购自美国Southern Bio公司。CVB4 VP1237~24913肽及CVB3 VP11~1515肽由上海吉尔生化有限公司合成。亮抑酶肽(leupeptin)、抑肽酶(aprotinin)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)及羟基荧光素二醋酸盐琥珀酰亚胺酯(5,6-carboxyfluorescein diacetate,succinimidyl ester, CFSE)购自Sigma公司。雄性BALB/c小鼠, 6周龄,购自中国科学院实验动物中心,清洁级饲养。CVB3 Nancy株由复旦大学附属中山医院卫生部病毒性心脏病重点实验室杨英珍教授提供,在HeLa 细胞中繁殖和扩增,分装后置-70 ℃保存。
1.2 方法
1.2.1chi-(pVP1+pLTN)疫苗的制备首先将50 μg pVP1(400 μg/ml)与50 μg pLTN (400 μg/ml)混合,采用复合物共沉淀法,然后在55 ℃水浴中,将0.02% pH 5.7的chitosan溶液逐滴滴入质粒DNA溶液中,同时高速振荡20 s,即可形成均一、略带混浊的chi-(pVP1+pLTN) 复合物。
1.2.2免疫小鼠及样品收集将6周龄BALB/c雄鼠分为chi-(pVP1+pLTN)组、chi-(pVP1+pcDNA3.1)组和chi-pcDNA3.1组,每组6只。轻度麻醉下,将疫苗溶液滴入小鼠鼻孔,免疫剂量为每次各质粒50 μg,隔周免疫,共4次。收集免疫第8周小鼠血清和粪便样品。小鼠粪便以100 mg/ml溶解于磷酸缓冲液(phosphate-buffered saline,PBS)(5%脱脂牛奶、10 mmol/L leupeptin、1 μg/ml aprotinin、1 mmol/L PMSF),充分混匀后离心,收集上清液,冻存于-70 ℃。
1.2.3血清IgG及粪便IgA的酶联免疫吸附试验(enzyme-linkedimmunosorbentassay,ELISA)检测以10 μg/ml VP1237~24913肽包板,4 ℃过夜;PBST(PBS & Tween-20)洗3遍,以1% 牛血清白蛋白(bovine serum album,BSA)-PBS封闭,37 ℃放置2 h;洗3遍,加入100 μ1 1∶40稀释血清及粪便原液,37 ℃放置2 h;洗3遍,加入100 μ1 HRP-羊抗小鼠IgG、IgA,37 ℃放置1 h;洗4遍,加入100 μ1 邻苯二胺(o-phenylenediamine,OPD)底物,避光显色7 min,加50 μ1 H2SO4(1 mol/L)终止,测A490值。
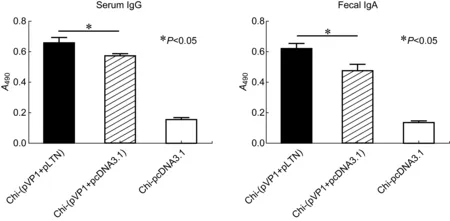
图1 免疫小鼠第8周诱生的CVB3特异性血清IgG及粪便IgA水平 Fig.1 The levels of CVB3-specific serum IgG and fecal IgA in immunized mice induced at week 8
1.2.4免疫小鼠肠系膜淋巴结特异性CTL检测制备正常BALB/c小鼠脾细胞悬液,调整浓度至5×106个/ml,分2份。一份加入CVB3 VP11~15肽(终浓度20 μg/ml), 37 ℃孵育2 h,然后在室温下用高浓度CFSE(5 μmol/L)标记;另一份未荷肽的淋巴细胞用低浓度CFSE(0.5 μmol/L)标记,作为体内对照。洗涤后,从2组中各取1×107个细胞,混合后重悬于0.5 ml PBS中,经尾静脉分别注入各组小鼠体内,18 h后取肠系膜淋巴结行流式细胞术(fluorescence activated cell sorting , FACS)检测。
1.2.5CVB3感染及心肌组织病理学观察调整CVB3剂量为3 LD50/0.1 ml,于末次免疫后2周腹腔注射各免疫组小鼠。7 d后取心脏组织行固定、包埋、切片及HE染色,观察心肌炎症浸润及坏死情况,并对其严重程度进行分级。+:损伤累及范围<25%;++:损伤累及范围25%~50%;+++:损伤累及范围51%~75%;++++:损伤累及范围>75%。
1.2.6血清CK活性测定取CVB3感染7 d后免疫小鼠血清20 μl,用定磷法分析测定。
1.3 统计学处理
实验数据用SPSS 11.5软件处理,P<0.05为有统计学意义。
2 结果
2.1 chi-(pVP1+pLTN)诱生的CVB3特异性抗体免疫应答
以含每种质粒50 μg的chi-(pVP1+pLTN)、chi-(pVP1+pcDNA3.1)和chi-pcDNA3.1于0、2、4、6周滴鼻免疫小鼠,收集第8周血清及粪便样品。ELISA检测结果显示,chi-(pVP1+pLTN)疫苗诱生高水平的血清特异性IgG和粪便IgA,A值分别达0.66和0.62,显著高于chi-(pVP1+pcDNA3.1)组的0.58和0.48,提示LTN共滴鼻免疫不仅可提高全身IgG抗体应答水平,还可增加肠道局部 IgA的产生(图1)。
2.2 chi-(pVP1+pLTN)诱生的肠系膜淋巴结特异性CTL应答
在体内应用CTL实验检测chi-(pVP1+pLTN)诱导的CVB3特异性CTL功能。于末次免疫后2周,经尾静脉注射1∶1混合的荷VP11~15和未荷VP11~15肽段的靶细胞,18 h后取小鼠肠系膜淋巴结进行FACS检测。结果显示,chi-(pVP1+pLTN)组诱生的特异性杀伤率达(67.5±7.3)%,显著高于chi-(pVP1+pcDNA3.1)组的(45.9±4.3)%(P<0.05),提示LTN共免疫可增强胃肠道黏膜特异性细胞免疫应答(图2)。
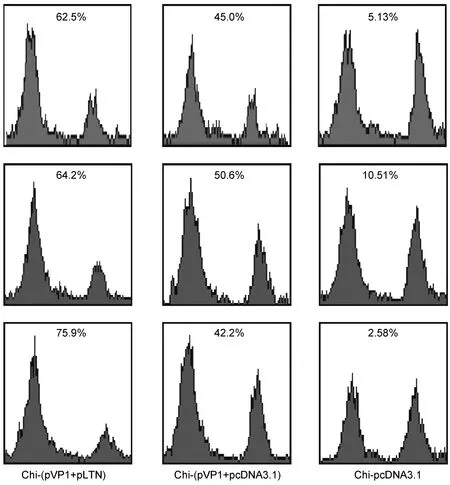
图2chi-(pVP1+pLTN)诱生的肠系膜淋巴结特异性CTL活性
Fig.2CTLactivityinmesentericlymphnodeinducedbychi-(pVP1+pLTN)
2.3 免疫小鼠心肌病理学观察
雄性BALB/c小鼠经chi-(pVP1+pLTN)疫苗隔周滴鼻免疫,共4次,于末次免疫后2周,以3 LD50/0.1 ml CVB3经腹腔感染小鼠。7 d后以心肌组织形态特征和病理分级作为评价心肌炎严重程度的指标进行评判。结果显示,chi-pcDNA3.1组小鼠心室内、外壁均出现大量严重的灶性坏死,大量心肌细胞被破坏,代之以成团的炎性淋巴细胞浸润,心肌坏死性损伤比较严重 (表1、图3)。chi-(pVP1+pcDNA3.1)组小鼠心肌坏死性损伤较轻,心肌实质中仅见少量淋巴细胞浸润和坏死灶,炎症灶多集中于心内膜下,范围较大。chi-(pVP1+pLTN)组小鼠心肌损伤最轻,其中仅1只小鼠心内膜下可见少量炎症病灶且程度较轻;其余5只心肌完全正常,除有细胞浊肿现象和少量淋巴细胞浸润外,无明显异常,近似于正常心肌细胞。结果提示,chi-(pVP1+pLTN)新型疫苗滴鼻免疫可有效预防病毒性心肌炎。
表1各免疫组小鼠病毒性心肌炎病理分级
Tab.1Pathologicalgradingofviralmyocarditisinmicereceivingvariousvaccines
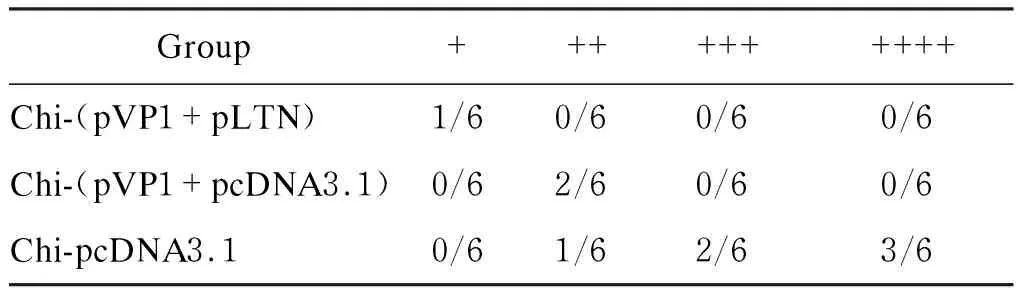
Group++++++++++Chi-(pVP1+pLTN)1/60/60/60/6Chi-(pVP1+pcDNA3.1)0/62/60/60/6Chi-pcDNA3.10/61/62/63/6
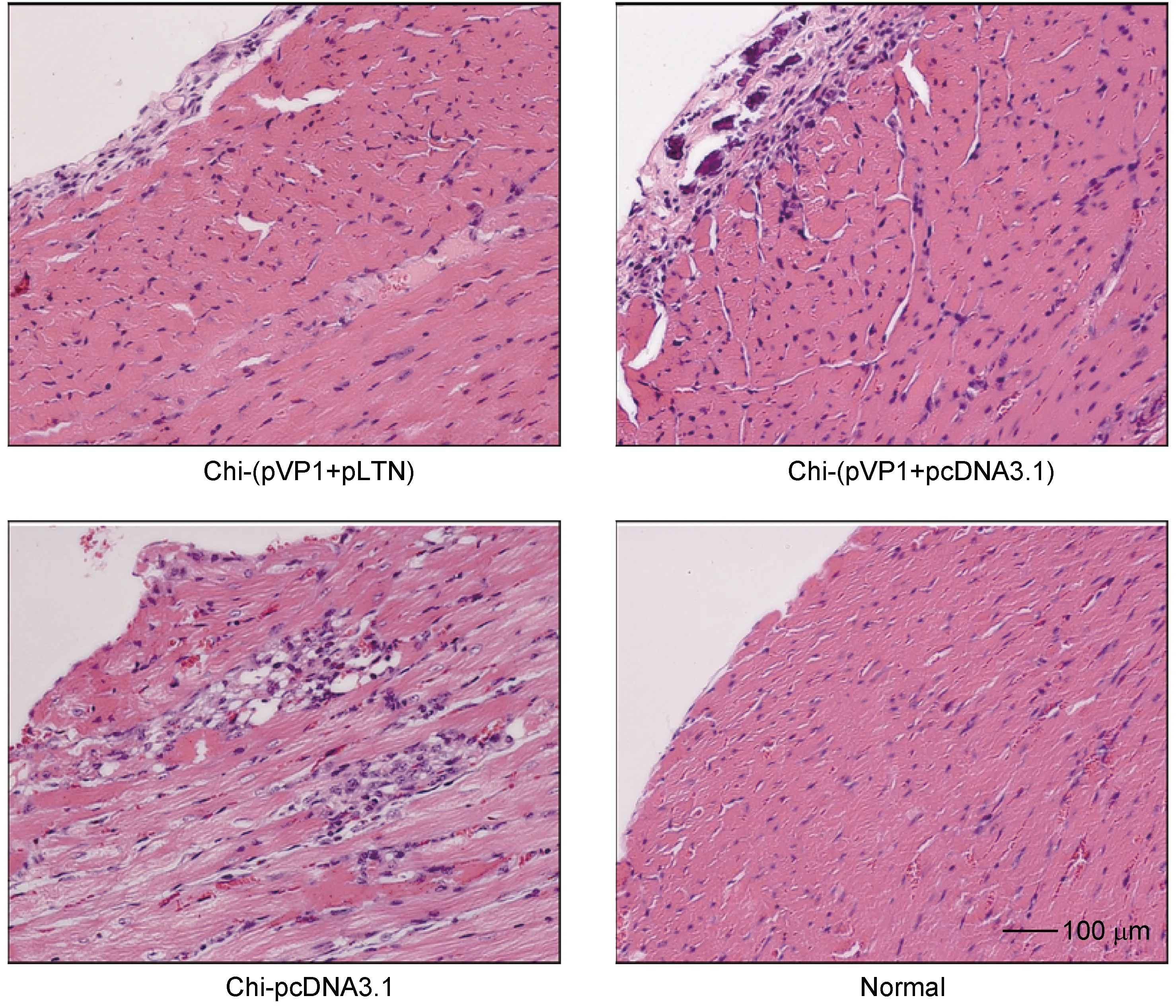
图3 3 LD50/0.1 ml CVB3感染7 d时免疫小鼠心肌组织的病理学观察Fig.3 Histopathological observation of myocardial tissue from immunized mice at day 7 following 3 LD50/0.1 ml CVB3 infection
2.4 血清CK活性检测及心肌炎发病情况
为进一步观察chi-(pVP1+pLTN)疫苗的免疫保护效果,我们统计CVB3感染7 d后各组小鼠心肌炎的发病率,并检测血清CK活性。结果显示,chi-pcDNA3.1组小鼠100%出现病毒性心肌炎,血清CK活性显著升高(371 u/ml),提示有严重的心肌细胞损伤;chi-(pVP1+pcDNA3.1)组发病率为33.3%,血清CK活性为125 u/ml,心肌损伤程度较chi-pcDNA3.1组明显减轻,提示chi-(pVP1+pcDNA3.1)具有一定的免疫保护效果;而chi-(pVP1+pLTN)组仅有16.7%小鼠出现心肌炎,血清CK值也最低,仅为54 u/ml,心肌受损范围最小,程度最轻,提示pLTN共免疫可增强chi-pVP1基因疫苗的免疫保护效果,更有效地预防病毒性心肌炎的发生(表2、图4)。
3 讨论
黏膜是机体抗感染的第1道防线,同时也是诸多病原体〔如人类免疫缺陷病毒(human immuno-deficiency virus,HIV)、结核分枝杆菌、流行性感冒病毒H5N1等〕入侵的主要门户。倘若机体不能诱导有效的黏膜免疫应答,病原体会迅速扩散入血,进而侵犯全身,造成机体损伤;同时易发展为慢性感染,导致严重致死性疾病。因此如何诱导有效的黏膜局部免疫应答成为近年来免疫学领域的热点问题,也成为疫苗研制的重要方向和策略[12-14]。研究证实,黏膜途径给予抗原是诱导黏膜免疫应答最有效的手段。我们前期研究设计的chi-pVP1通过滴鼻免疫可诱生较高水平的黏膜IgA和脾脏CTL应答,具有一定的预防CVB3感染及病毒性心肌炎发生的效果。本研究在原有的chi-pVP1疫苗体系中,引入C家族趋化因子LTN,以期增强黏膜免疫应答,更有效地预防病毒性心肌炎的发生。
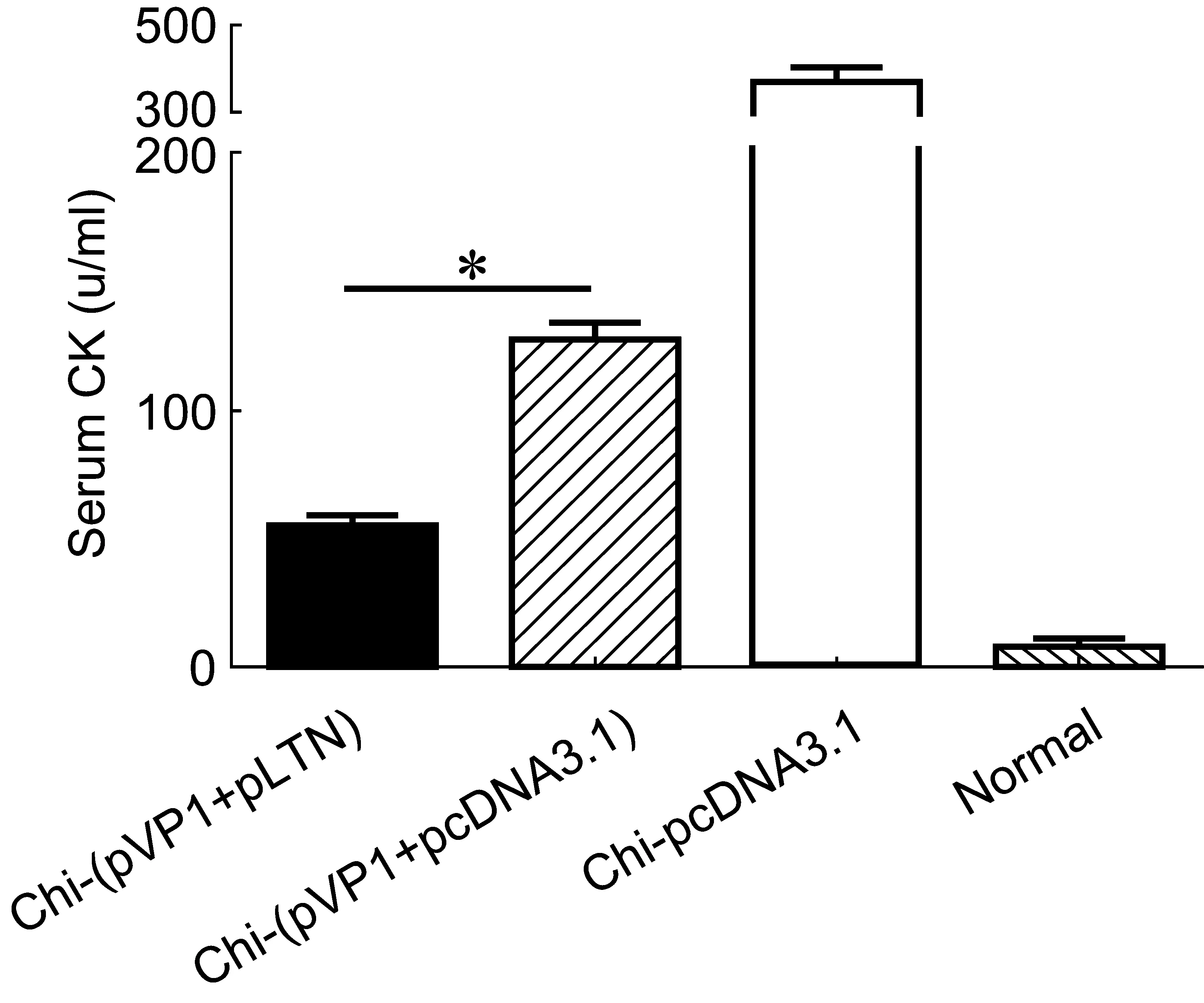
图4 3 LD50/0.1 ml 剂量CVB3感染7 d时免疫小鼠血清CK水平Fig.4 The levels of serum CK in immunized mice at day 7 following 3 LD50/0.1 ml CVB3 infection
表2各免疫组小鼠病毒性心肌炎发生率
Tab.2Incidenceofviralmyocarditisinmicereceivingvariousvaccines
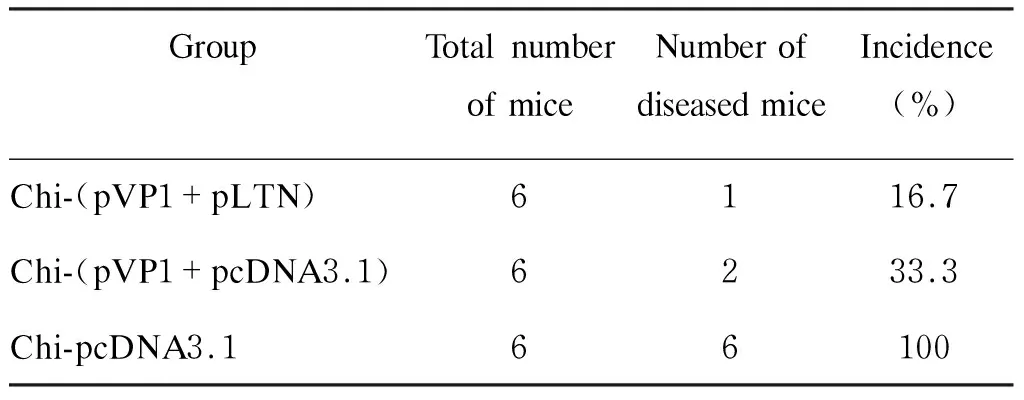
GroupTotal number of miceNumber of diseased miceIncidence (%)Chi-(pVP1+pLTN)6116.7Chi-(pVP1+pcDNA3.1)6233.3Chi-pcDNA3.166100
本研究发现,pLTN滴鼻共免疫可显著提高chi-pVP1诱导的特异性粪便IgA水平,可能是由于LTN诱导黏膜局部免疫应答偏离,促进Th1和Th2型细胞因子分泌。一方面白细胞介素 4(interleukin 4,IL-4)、IL-6等细胞因子促进抗体类别转换,促进IgA的产生;另一方面,LTN可能通过上调黏膜上皮细胞膜上IgA受体pIgR的表达,促进IgA转运[11]。SIgA是黏膜局部重要的免疫效应分子之一,不仅可通过中和作用阻止细菌、病毒等在黏膜局部附着、定植及入侵,还可通过抗体介导的细胞毒作用及调理吞噬作用清除已进入机体循环系统和局部组织的病原体,对抵御病原体感染极为关键[15]。因此,诱导高水平的IgA是黏膜疫苗设计的重要目标之一。此外,本研究还发现滴鼻给予pLTN可增强远端黏膜淋巴组织肠系膜淋巴结的CTL功能。以往研究显示,用LTN修饰肿瘤疫苗后可上调瘤体局部IL-2、γ干扰素(interferon γ,IFN-γ),促进特异性CTL免疫应答[16];更有学者提出,LTN属于Th1型趋化因子[17]。我们的工作证实了上述LTN增强CTL功能的观点和结果,但与以往报道不同的是,本研究将其佐剂效应进一步扩展到黏膜CTL应答的诱导中,即黏膜途径给予LTN DNA质粒可促进黏膜局部淋巴细胞的杀伤功能,这一结果为增强黏膜免疫应答提供了一种新思路。
由于chi-(pVP1+pLTN)疫苗显著增强CVB3特异性黏膜免疫应答,有效清除病毒,成功抵抗CVB3的攻击,因此仅有16.7%的小鼠出现心肌炎症状,且心肌损伤程度极轻。与chi-(pVP1+pcDNA3.1)组33.3%的小鼠出现病毒性心肌炎、心内膜下有较多炎症浸润等相比,具有显著差异,提示chi-(pVP1+pLTN)提供了更为有效的免疫保护效果,能更好地预防病毒性心肌炎的发生。本研究为柯萨奇病毒疫苗的研制、LTN作为黏膜疫苗佐剂的进一步探讨提供了有意义的基础。
[1] Esfandiarei M, Suarez A, Amaral A, Si X, Rahmani M, Dedhar S, McManus BM. Novel role for integrin-linked kinase in modulation of coxsackievirus B3 replication and virus-induced cardiomyocyte injury [J]. Circ Res, 2006, 99(4): 354-361.
[2] Fairweather D, Rose NR. Coxsackievirus-induced myocarditis in mice: a model of autoimmune disease for studying immunotoxicity [J]. Methods, 2007, 41(1): 118-122.
[3] Xu W, Shen Y, Jiang Z, Wang Y, Chu Y, Xiong S. Intranasal delivery of chitosan-DNA vaccine generates mucosal SIgA and anti-CVB3 protection [J]. Vaccine, 2004, 22(27-28): 3603-3612.
[4] Allen SJ, Crown SE, Handel TM. Chemokine: receptor structure, interactions, and antagonism [J]. Annu Rev Immunol, 2007, 25: 787-820.
[5] Kuhmann SE, Hartley O. Targeting chemokine receptors in HIV: a status report [J]. Annu Rev Pharmacol Toxicol, 2008, 48: 425-461.
[6] Miller RJ, Rostene W, Apartis E, Banisadr G, Biber K, Milligan ED, White FA, Zhang J. Chemokine action in the nervous system [J]. J Neurosci, 2008, 28(46): 11792-11795.
[7] Jin T, Xu X, Hereld D. Chemotaxis, chemokine receptors and human disease [J]. Cytokine, 2008, 44(1): 1-8.
[8] Dorgham K, Abadie V, Iga M, Hartley O, Gorochov G, Combadiere B. Engineered CCR5 superagonist chemokine as adjuvant in anti-tumor DNA vaccination [J]. Vaccine, 2008, 26(26): 3252-3560.
[9] Han YW, Aleyas AG, George JA, Kim SJ, Kim HK, Yoo DJ, Kang SH, Eo SK. Genetic co-transfer of CCR7 ligands enhances immunity and prolongs survival against virulent challenge of pseudorabies virus [J]. Immunol Cell Biol, 2009, 87(1): 91-99.
[10] Hedrick JA, Zlotnik A. Lymphotactin [J]. Clin Immunol Immunopathol, 1998, 87(3): 218-222.
[11] Lillard JW Jr, Boyaka PN, Hedrick JA, Zlotnik A, McGhee JR. Lymphotactin acts as an innate mucosal adjuvant [J]. J Immunol, 1999, 162(4): 1959-1965.
[12] Iqbal SM, Kaul R. Mucosal innate immunity as a determinant of HIV susceptibility [J]. Am J Reprod Immunol, 2008, 59(1): 44-54.
[13] Kersten G, Hirschberg H. Needle-free vaccine delivery [J]. Expert Opin Drug Deliv, 2007, 4(5): 459-474.
[14] Yuki Y, Nochi T, Kiyono H. Progress towards an AIDS mucosal vaccine: an overview [J]. Tuberculosis (Edinb), 2007, 87(Suppl 1): S35-S44.
[15] Brandtzaeg P. Induction of secretory immunity and memory at mucosal surfaces [J]. Vaccine, 2007, 25(30): 5467-5484.
[16] Huang H, Bi XG, Yuan JY, Xu SL, Guo XL, Xiang J. Combined CD4+Th1 effect and lymphotactin transgene expression enhance CD8+Tc1 tumor localization and therapy [J]. Gene Ther, 2005, 12(12): 999-1010.
[17] Dorner BG, Scheffold A, Rolph MS, Huser MB, Kaufmann SH, Radbruch A, Flesch IE, Kroczek RA. MIP-1alpha, MIP-1beta, RANTES, and ATAC/lymphotactin function together with IFN-gamma as type 1 cytokines [J]. Proc Natl Acad Sci USA, 2002, 99(9): 6181-6186.

