上海2009甲型H1N1流行性感冒病毒全基因组分析
宋志刚,田棣,张小楠,任广旭,2,周志统,何静,袁正宏,2,胡芸文
1. 上海市(复旦大学附属)公共卫生临床中心,上海201508; 2. 复旦大学上海医学院教育部/卫生部医学分子病毒学重点实验室,上海200032
2009年春夏之际,一种新型H1N1甲型流行性感冒(简称流感)在全球流行。此流行始于墨西哥,迅速传播到美国、加拿大等北美国家,之后引起全球范围内的暴发。同年5月11日,中国内地确诊第1例新型甲型H1N1流感病例。5月24日,上海地区发现第1例输入型甲型H1N1流感病例。该新型病毒含有目前所知的4种甲型流感病毒的基因片段[1],且全球人群普遍缺乏针对该病毒的免疫力。
由于大部分甲型H1N1流感症状与季节性流感(H3N2、H2N1等)相似,而且流感病毒易在人群传播中发生基因变异,导致抗原性和耐药性改变,因此需要对甲型H1N1流感病毒进行病原学的严密监测。本研究从上海地区较早发现的2例输入型甲型H1N1流感病例中分离并鉴定了2株病毒株,探讨其基因特点和生物学特征,为上海地区开展病毒监测和科研工作提供参考。
1 材料和方法
1.1 患者及样本收集
2例输入型甲型H1N1流感患者,其中1例男性患者于2009年5月24日确诊为甲型H1N1流感,另1例女性患者于2009年5月29日确诊为甲型H1N1流感,均住院治疗。患者的临床症状和体征见表1。2例患者均接受奥司他韦(oseltamivir)治疗,每日2次,每次75 mg,共服药5 d,1周后康复出院。患者住院期间,每日早晨取鼻咽拭子,放入病毒维持液内,制成标本悬液,立即送实验室进行病毒检测。
1.2 病毒分离培养
2例患者的咽拭子标本悬液800 μl分别接种至单层犬肾细胞(Madin-Darby canine kidney cell,MDCK细胞)上,37 ℃孵育30 min,再补入8 ml DMEM培养液(含100 u/ml 青霉素、100 μg/ml链霉素和3 μg/ml TPCK-胰酶),37 ℃、5% CO2中培养。观察细胞形态,并每隔3~5 d取培养上清液传代。当细胞出现可识别的细胞病变效应(cytopathic effect,CPE)时,用实时荧光反转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)检测培养上清液中的病毒核酸。用终点法滴定计算每0.1 ml培养上清液中的半数组织培养感染剂量(50% tissue culture infective dose,TCID50)。
表12例甲型H1N1流感患者的资料和症状
Tab.1CharacteristicsandsymptomsoftwopatientsconfirmedasinfluenzaA(H1N1)
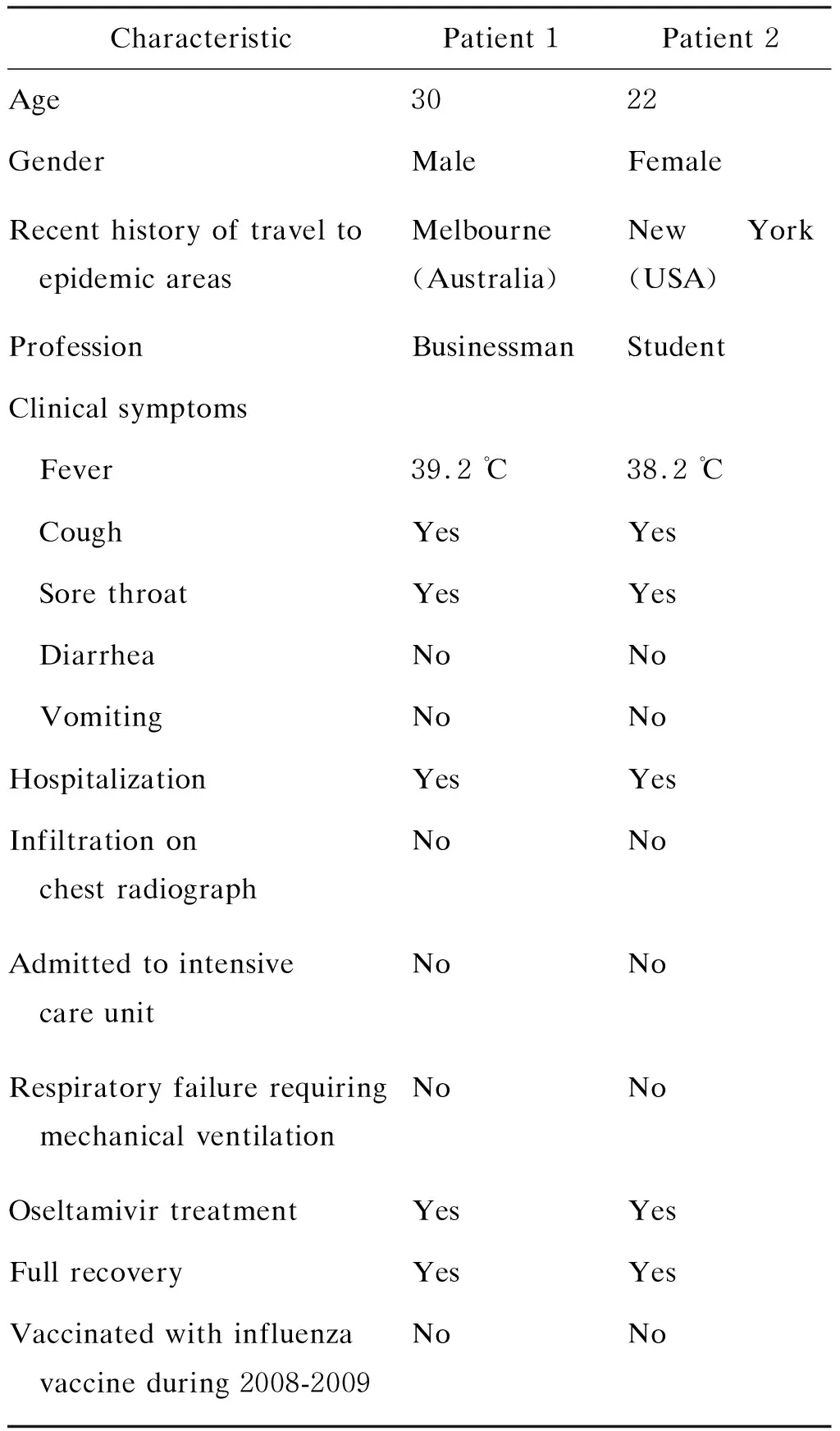
CharacteristicPatient 1Patient 2 Age 3022GenderMaleFemaleRecent history of travel to epidemic areasMelbourne (Australia)New York (USA)ProfessionBusinessmanStudentClinical symptoms Fever39.2 ℃38.2 ℃ CoughYesYes Sore throatYesYes DiarrheaNoNo VomitingNoNoHospitalizationYesYesInfiltration on chest radiographNoNoAdmitted to intensive care unitNoNoRespiratory failure requiring mechanical ventilationNoNoOseltamivir treatmentYesYesFull recoveryYesYesVaccinated with influenza vaccine during 2008-2009NoNo
1.3 RNA提取和实时RT-PCR检测
用QIAamp Viral RNA Mini Kit (Qiagen)提取样本中病毒RNA,按照试剂盒操作步骤进行。取样本140 μl,加入含Carrier RNA的裂解液560 μl,室温放置10 min;加入560 μl乙醇后混匀,用柱子吸附RNA,依次加入缓冲液AW1和AW2洗涤2次;最后用60 μl AVE缓冲液溶解RNA,-80 ℃保存备用。按美国疾病预防控制中心推荐的方法进行甲型H1N1流感病毒实时荧光RT-PCR检测。参考世界卫生组织(World Health Organization,WHO)流感检测方法设计实验引物 (http://www.who.int/csr/ resources/ publications/ swineflu/ realtimeptpcr/en/ index.html)。用一步实时荧光定量RT-PCR体系[2](Invitrogen SuperScript III Platinum One-Step Quantitative Kit)鉴定该流感病毒,反应条件为50 ℃ 30 min,95 ℃ 2 min,95 ℃ 15 s,55 ℃ 30 s,在延伸过程中采集荧光信号。
1.4 免疫荧光检测
在培养MDCK细胞的培养皿中放入盖玻片,24 h后接种病毒,37 ℃、5% CO2孵育72 h;3%聚合甲醛室温固定10 min,并用0.1% Triton X-100穿膜。一抗来自甲型流感患者恢复期血清,二抗为藻红素标记的抗人IgG(P8047,Sigma,1∶200稀释)或FITC标记的抗人IgG。细胞与抗体孵育后,在Olympus FV1000共聚焦显微镜下观察细胞形态和荧光。
1.5 电子显微镜下观察病毒
收集培养流感病毒的MDCK细胞液,置-80 ℃冻存2 h,37 ℃ 融化,反复冻融3次。取冻融液10 ml,1 600g离心10 min,去沉淀物。上清液以130 000g离心90 min,去上清液。沉淀物重悬后滴在有支持膜的网上,负染缓冲液(含2%的2.5 mmol/L磷钨酸,pH 7.0)染色2 min,扫描透射电子显微镜(Philips CM20)成像。
1.6 核酸测序
一步法RT-PCR[2]扩增病毒基因组的8个基因片段并测序。扩增引物参考文献报道[1]。采用ABI 3730XL测序系统(Applied Biosystems)测序,软件VECTOR NTI version 8.0整理测序数据,以A/Carifonia/04/2009(H1N1)全长基因序列作为参考序列。
1.7 系统发生树分析
将分离到的2株病毒全基因序列与来自人甲型流感和猪流感的代表性毒株(http://www.ncbi.nlm.nih.gov/genomes/FLU/FLU.html)进行对比,构建系统发生树。系统发生树的绘制采用邻位连接法(neighbor-joining)和最大组成似然模型(maximum composite likelihood)法。发生树的可靠性通过1 000 replications的bootstrap验证。
2 结果
2.1 RT-PCR检测病毒
取2例流感患者的鼻咽拭子标本悬液,在入院第1、2天检测病毒核酸,结果均为阳性;但从第3天起直至出院,检测结果均为阴性。
2.2 病毒分离
取2例流感患者鼻咽拭子标本悬液,分别接种至MDCK细胞,连续传3代后,可观察到细胞变圆、聚集和从壁上脱离等细胞病变效应(图1B、C)。实时RT-PCR法检测到培养上清液中存在病毒颗粒。分别命名病毒株为A/Shanghai/37T/2009(H1N1) 和 A/Shanghai/71T/2009(H1N1),以下简称37T和71T。细胞培养上清液中的病毒滴度分别为3 200 TCID50/ml和2 545 TCID50/ml。
2.3 免疫荧光检测确认细胞内病毒复制
用免疫荧光染色法对细胞染色,共聚焦显微镜下可见未感染病毒的MDCK细胞中无荧光,如图2A、B所示。病毒感染72 h后的MDCK细胞质内出现红色荧光,呈清晰点状分布,如图2C、D所示。
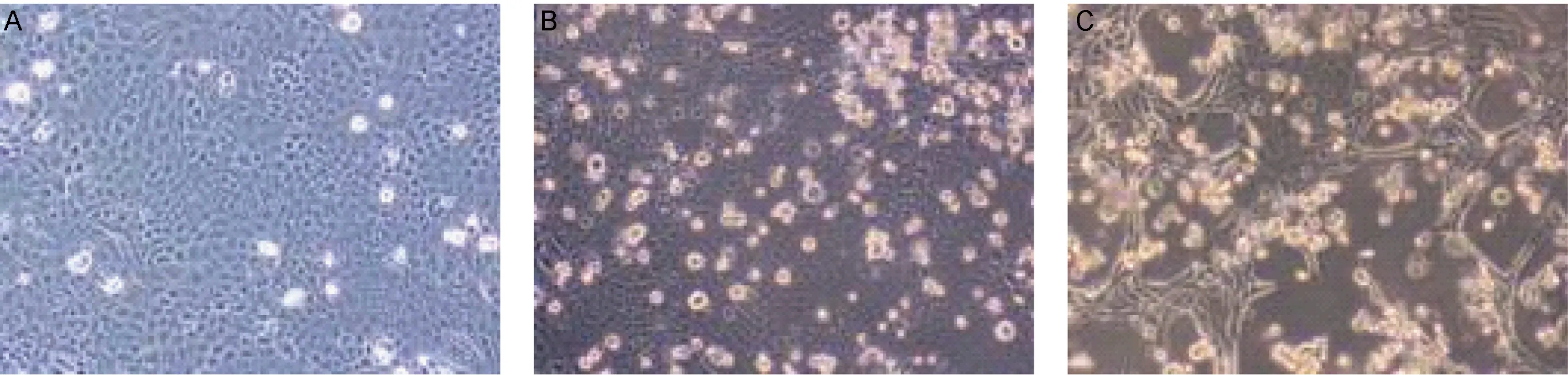
A: Uninfected control monolayers after 72 h. B, C: Infected monolayers 48 and 72 h after inoculation, respectively.
图137T株感染MDCK细胞的病变效应(×40)
Fig.1Cytopathiceffectinducedby37TinMDCKcells(×40)

A:Uninfected MDCK cells. B:Immunofluorescence imaging of uninfected MDCK cells. C:MDCK cells infected by influenza A virus subtype H1N1. D:Immunofluorescence imaging of MDCK cells infected by influenza A virus subtype H1N1.
图2免疫荧光染色和共聚焦分析
Fig.2Immunofluorescencestainingandconfocalmicroscopyanalysis
2.4 电子显微镜观察病毒颗粒形态
37T毒株的扫描透射电子显微镜照片显示,该病毒呈球状,有包膜,颗粒直径60~80 nm,包膜表面有突起围绕,呈现正黏病毒颗粒形态特征(图3)。
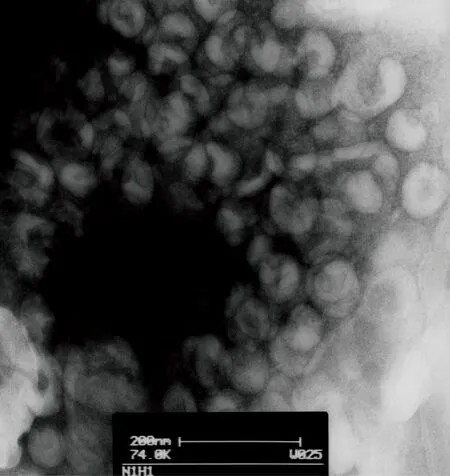
Scale bar, 200 nm.
图3扫描透射电子显微镜下的病毒颗粒
Fig.3Transmissionelectronmicrographofnegativelystainedviralparticlesshowingtypicalorthomyxovirusparticleswitharegularfringeofsurfaceprojection
2.5 病毒核酸序列和氨基酸序列分析
分别对37T和71T毒株的全部8个基因片段(包括PB1、PB2、PA、HA、NA、NS、NP和M基因)进行扩增和测序,并在GenBank中注册。37T的8个基因片段的GenBank编号分别是GQ253489、GQ253490、GQ253491、GQ253492、GQ253493、GQ253494、GQ253495和GQ253496。71T 的8个基因片段的GenBank编号分别是GQ253497、GQ253498、GQ253499、GQ253500、GQ253501、GQ253502、GQ253503 和GQ253504。对比37T和71T的全基因核酸序列与参考株A/California/04/2009(H1N1)的序列,同源性分别为99.79%和99.81%,各基因片段序列与A/California/04/2009(H1N1)株也具有高度的同源性(表2),与输入型甲型流感的判断吻合。
表2上海分离株与参考株核酸序列的相似度
Tab.2Nucleotidesequencesimilarityof37Tand71TcomparedwithreferencestrainA/California/04/2009(H1N1)
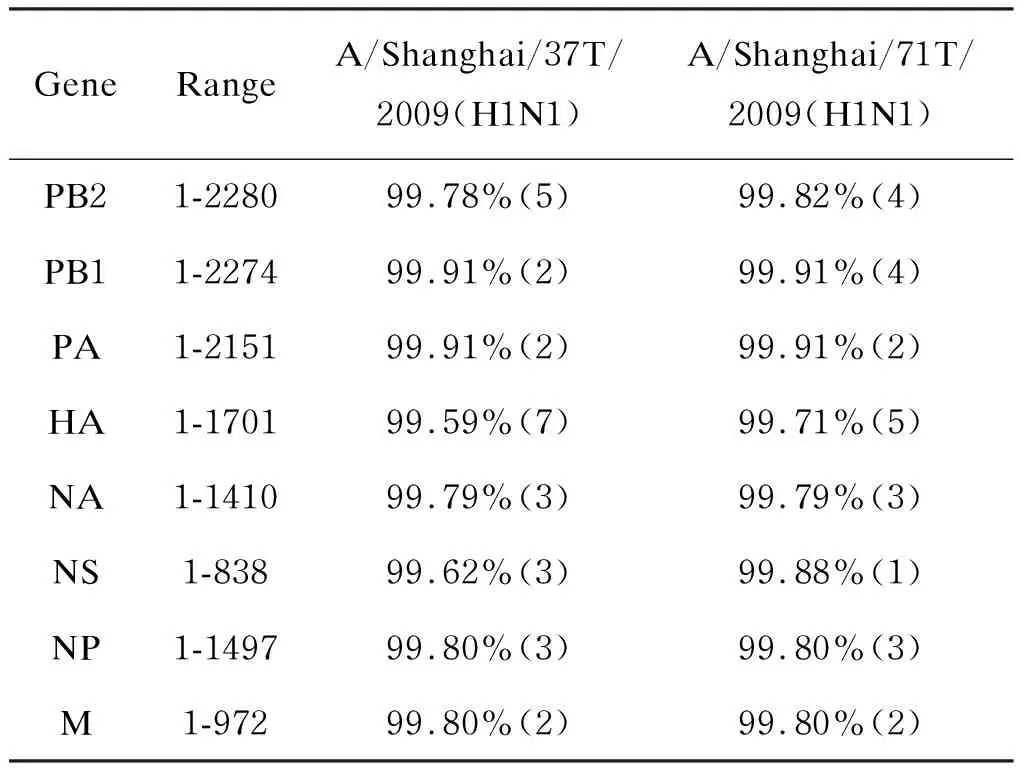
GeneRangeA/Shanghai/37T/2009(H1N1)A/Shanghai/71T/2009(H1N1)PB21-228099.78%(5)99.82%(4)PB11-227499.91%(2)99.91%(4)PA1-215199.91%(2)99.91%(2)HA1-170199.59%(7)99.71%(5)NA1-141099.79%(3)99.79%(3)NS1-83899.62%(3)99.88%(1)NP1-149799.80%(3)99.80%(3)M1-97299.80%(2)99.80%(2)
The data in the parenthesis mean the number of nucleotide differences.
将2株病毒的氨基酸序列与参考株序列进行对比,同源性分别为99.75%和99.77%。其中 PB1和M蛋白没有氨基酸差异,但PB2、PA、HA、NA、NP、NS1和NS2蛋白的氨基酸序列分别有11个(37T)和10个(71T)氨基酸差别(表3)。
进一步对耐药相关位点氨基酸(金刚烷胺和奥司他韦)的分析表明,37T和71T病毒株与参考株的耐药位点氨基酸相同,即M2蛋白氨基酸序列中,金刚烷胺类药物的耐药位点第31位[3]由敏感型的丝氨酸(S)突变为抗药型的天冬酰胺(N),而NA蛋白氨基酸序列与奥司他韦作用相关的第119、152、275、293和295位点氨基酸残基分别为谷氨酸(E)、精氨酸(R)、组氨酸(H)、精氨酸和天冬酰胺,未发生点突变。
表3上海分离株与参考株的氨基酸突变
Tab.3Aminoacidmutationsamongthereferencestrain,37Tand71T

Viral proteinAmino acid siteA/California/04/2009(H1N1)A/Shanghai/37T/2009(H1N1)A/Shanghai/71T/2009(H1N1)PB2703RRKPA224PSSHA100PSS214TAA220STT338IVV428VIVNA106VII248NDNNP100VIINS1123IVVNS273RKK
2.6 系统发生树分析
用HA、NA 和PB2的核苷酸序列分别构建系统发生树,结果显示,37T和71T的HA基因与典型的猪流感病毒位于同一簇内,具有较近的亲缘关系,与人季节性H1N1流感病毒和欧亚系猪流感病毒的亲缘关系较远(图4A);而NA基因与欧亚系(禽样)猪流感病毒位于同一簇内,具有较近的亲缘关系,与人季节性H1N1流感病毒和经典猪流感病毒的亲缘关系较远(图4B);PB2基因与猪H1N2、H3N2和人H1N1位于同一簇内,具有较近的亲缘关系,但与人季节性H1N1流感病毒、经典猪流感病毒和欧亚系猪流感病毒的亲缘关系较远(图4C)。
3 讨论
2009甲型H1N1流感疫情在北美暴发后的几个月内,中国大部分省市包括北京、广东和上海等均陆续出现确诊病例。本研究从2例上海确诊的甲型H1N1流感患者体内,成功分离到2株病毒(37T和71T)。在电子显微镜下呈球状,有包膜,直径60~80 nm,包膜表面有突起围绕,基本符合流感病毒的特征。进一步的免疫荧光结果显示,病毒存在于MDCK细胞质中;核酸检测结果显示该病毒可能是甲型H1N1病毒。
目前有两类抗流感病毒的药物[4]:一类是抑制M2蛋白的药物,如金刚烷胺;另一类是神经氨酸酶抑制剂类,如奥司他韦[5]。奥司他韦对甲和乙型流感病毒均有效,且临床不良反应小。一般来说,季节性甲型H1N1流感对金刚烷胺敏感;而2009甲型H1N1流感对金刚烷胺耐药,其M2蛋白氨基酸序列中,耐药位点第31位[3]由敏感型的丝氨酸突变为抗药型的天冬酰胺。 本研究中37T和71T病毒基因测序结果发现,金刚烷胺耐药位点有改变,奥司他韦敏感性相关位点[6,7]无基因突变现象。患者在使用奥司他韦治疗2 d后,标本中病毒核酸即转阴,说明该病毒对奥司他韦敏感。因此,此2株病毒基因型与病例临床表型是相符的,也与2009甲型H1N1流感病毒的耐药特征相一致。
本实验中采用康复期患者血清作为抗体进行免疫荧光检测,发现该血清与病毒有较强的反应性,提示患者在感染后短期内可能产生了2009甲型H1N1流感病毒的IgG抗体。另一种可能的解释是,2009甲型H1N1流感病毒感染后能激活宿主体内针对既往季节性流感病毒的记忆性T细胞,产生的抗体与本次流行株存在交叉反应。吴迪[8]等对HA蛋白的同源建模分析发现,2009甲型H1N1流感病毒HA1蛋白与人季节性流感(H3N2)、禽流感病毒和猪流感病毒HA蛋白的同源性达40%~84%,HA2蛋白与上述流感病毒HA蛋白的同源性达63%~92%。因此,针对季节性流感的抗体与2009甲型H1N1流感病毒起交叉反应的推测有一定的理论依据,但须通过实验进一步证实。
本研究发现,在系统发生树中,37T和71T病毒的HA、NA、PB2基因分别与典型的猪流感病毒HA基因,欧亚系(禽样)猪流感病毒NA基因,猪H1N2、H3N2和人H1N1的PB2基因具有较近的亲缘关系,与先前研究报道[1,9]相似。经DNA序列对比分析发现,37T和71T病毒只有很少的核酸发生突变,从氨基酸序列上未发现此2株流感病毒与A/California/04/2009(H1N1)参考株在生物学特性、耐药性和抗原性方面存在显著差异,与2009甲型H1N1流感病毒株的研究报道[10]相符合,表明此2株病毒与2009甲型H1N1流感病毒可能为同一来源。
与以往季节性流感相比,流行于 2009年春夏和秋冬季的甲型H1N1流感病毒的传播性更强,并易在肥胖者、孕妇等特定人群中引起重症感染[11]。目前,国内、外研究还未能很好解释上述现象,因此对2009甲型H1N1流感病毒的生物学特性仍需继续观察,其重症发病机制仍需进一步深入研究。

A:HA. B: NA. C: PB2.
The phylogenetic trees made from the two isolated strains (▲) and representative selected strains were generated by using MEGA 4.0 with the neighbor-joining method and bootstrap resampling (1 000 replications). The numbers at each branch represent the bootstrap value (below 60% is not shown). The evolutionary distances were computed by using the maximum composite likelihood method and are in the units of the number of base substitutions per site.
图4上海分离株与相关参考株的HA、NA、PB2基因核苷酸序列系统发生树
Fig.4PhylogenetictreesfornucleotidesequencesofHA,NAandPB2genesof37T,71Tandreferencestrains
[1] Novel Swine-Origin Influenza A (H1N1) Virus Investigation Team. Emergence of a novel swine-origin influenza A (H1N1) virus in humans [J]. New Engl J Med, 2009, 360(25): 2605-2614.
[2] Poon Leo LM, Chan KH, Smith GJ, Leung CSW, Guan Y, Yuen KY, Peiris JSM. Molecular detection of a novel human influenza (H1N1) of pandemic potential by conventional and real-time quantitative RT-PCR assays [J]. Clin Chem, 2009, 55(8): 1555-1558.
[3] Suzuki H, Saito R, Masuda H, Oshitani H, Sato M, Sato I. Emergence of amantadine-resistant influenza A viruses: epidemiological study[J]. J Infect Chemother, 2003, 9(3): 195-200.
[4] Monto AS. The role of antivirals in the control of influenza. Vaccine, 2003, 21(16): 1796-1800
[5] Kiso M, Mitamura K, Sakai-Tagawa Y, Shiraishi K, Kawakami C, Kimura K, Hayden FG, Sugaya N, Kawaoka Y. Resistant influenza A viruses in children treated with oseltamivir: descriptive study[J]. Lancet, 2004, 364(9436): 759-765.
[6] McKimm-Breschkin JL. Management of influenza virus infections with neuraminidase inhibitors: detection, incidence, and implications of drug resistance[J]. Treat Respir Med, 2005, 4(2): 107-116.
[7] 武斌, 王承民. 甲型H1N1 流感病毒北美毒株的分子特征[J]. 科学通报, 2009, 54(12): 1661-1672.
[8] 吴迪,徐天磊.甲型H1N1流感病毒HA蛋白结构模建与构象表位分析[J].科学通报,2009, 54(12): 1642-1644.
[9] Yassine HM, Khatri M, Zhang YJ, Lee CW, Byrum BA, O’Quin J, Smith KA, Saif YM. Characterization of triple reassortant H1N1 influenza A viruses from swine in Ohio[J]. Vet Microbiol, 2009, 139(1-2): 132-139.
[10] Smith GJ, Vijaykrishna D, Bahl J, Lycett SJ, Worobey M, Pybus OG, Ma SK, Cheung CL, Raghwani J, Bhatt S, Peiris JS, Guan Y, Rambaut A. Origins and evolutionary genomics of the 2009 swine-origin H1N1 influenza A epidemic [J]. Nature, 2009, 459(7250): 1122-1124.
[11] Liu SL, Zhang ZR, Wang C, Dong Y, Cui LB, Yang XH, Sun Z, Wang J, Chen J, Huang RJ, Miao F, Ruan B, Xie L, He HX, Deng J. 2009 pandemic characteristics and controlling experiences of influenza H1N1 virus 1 year after the inception in Hangzhou, China[J]. J Med Virol, 2010, 82(12): 1985-1995.

