肠道病毒71型灭活疫苗免疫恒河猴在攻毒实验中的感染动力学
王晶晶,赵红玲,张莹,刘龙丁,王丽春,廖芸,董承红,纳锐雄,张雪梅,李琦涵
中国医学科学院/北京协和医学院医学生物学研究所,昆明 650118
随着手足口病(hand, foot and mouth disease, HFMD)在亚洲地区流行范围的扩大及感染人群的增加[1,2],其公共卫生意义显得日益重要[1],重要原因之一就是HFMD的主要感染病原——肠道病毒71型(enterovirus 71,EV71)可引起少数患者出现临床预后较严重的神经系统综合征及心肺功能衰竭综合征[3,4]。此类病例的存在,使HFMD对婴、幼儿群体产生较大的健康威胁。在目前尚无特异性抗病毒药物的情况下,具有较清楚经验背景的灭活病毒疫苗的研究显然成为重要选择[5]。值得注意的是,虽然同为肠道病毒属的脊髓灰质炎和甲型肝炎灭活疫苗均已有非常成熟的研制背景[6,7],但EV71作为一种感染病理机制尚不完全清楚的病原,其疫苗如何通过诱导机体免疫反应,包括经中和抗体和特异性细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)发挥免疫保护作用,是一个需深入研究的工作。到目前为止,EV71疫苗的研究还没有系统的质量指标,因此其在动物体内诱导的中和抗体反应和相关的细胞免疫反应能在何种水平上具有免疫保护意义,成为迫切需要探讨的问题。特别是目前多数EV71疫苗有效性的评价尚停留在小鼠或乳鼠的动物模型水平,这一研究的应用意义显得尤为重要。
我们在前期进行的EV71灭活疫苗开发的基础上,探讨并建立了恒河猴为对象的EV71感染动物模型[8]。在这一动物模型中,EV71在感染机体的神经、血液及淋巴系统中,表现出相应的增殖规律(待发表)。以该动物模型为基础,进一步对同期研发的EV71灭活疫苗进行了免疫保护性分析。我们所研制的EV71灭活疫苗在按0、4周的程序免疫恒河猴后,可诱导产生明确的中和抗体反应和表现为针对γ干扰素(interferon γ,IFN-γ)特异Elispot反应的细胞免疫反应[9]。但疫苗使用剂量不同,中和抗体反应水平有差异。尽管这些中和抗体在细胞实验及乳鼠保护性实验中均能阻断一定量病毒的感染[9],但在恒河猴体内是否可完全保护机体免受病毒感染尚无定论。因此,本研究采用特定EV71灭活病毒实验性疫苗免疫恒河猴,利用病毒攻击实验和动物体内病原学及病理学指标,具体分析实验性疫苗免疫后的动物对病毒攻击所产生的感染动力学反应,为确定EV71灭活疫苗免疫剂量的研究提供直接依据。
1 材料和方法
1.1 材料
Vero细胞(来自世界卫生组织,经检定可用于疫苗生产)于含有5%小牛血清的DMEM营养液中37 ℃培养。人胚肺成纤维细胞KMB17株(购自医学生物学研究所,经检定可用于疫苗生产)于含有8%小牛血清的DMEM营养液中37 ℃培养。病毒EV71来源于2008年安徽省阜阳市1名重症HFMD患儿,经分离后接种于Vero细胞使之增殖,并在KMB17细胞上适应后进一步完成毒种的培养制备及相关检验。毒种命名为FY-23K-B株,已由中国药品生物制品检定所检定为合格(毒种检验号200900929)。
1.2 方法
1.2.1EV71实验性灭活疫苗免疫使用毒种为FY-23K-B株。按相关生产检定规程制备实验性疫苗[10],疫苗使用剂量分别为20、80、320 EU。每个剂量组使用恒河猴9只,同时设置未免疫对照猴6只。所有实验动物的使用均根据云南省实验动物管理委员会相关规定,并经本所动物伦理委员会批准。免疫程序为0周初免,第4周加强。
1.2.2疫苗免疫动物病毒攻击在二次免疫后第12周时,每剂量组选6只恒河猴经鼻腔感染进行EV71病毒攻击。该毒株来源于重症患者的分离样品,接种Vero细胞后获得, 经聚合酶链反应(polymerase chain reaction,PCR)鉴定,确定为EV71病毒C4亚型,攻击剂量为每只104.5CCID50/100 μl。
1.2.3检测疫苗诱导的中和抗体效价变化各剂量组中未攻击的3只猴在二次免疫后第2、4、6、8、10、12、14、16周采血,分离血清后检测中和抗体效价。样品稀释液为2% MEM ,将血清倍比稀释,56 ℃灭活30 min,4 ℃放置过夜后检测。上样量为50 μl/孔,中和病毒量为300~500 CCID50/孔,同时设血清对照组、病毒对照组、细胞对照组。每天观察细胞对照组、血清对照组不出现病变,同时病毒对照组出现明显病变,在此基础上不出现病变的最高血清稀释度即为该血清的中和抗体效价。
1.2.4监测攻毒后动物体温变化攻毒后14 d内,每天通过肛门监测猴体温2次。
1.2.5RNA提取提取血中总RNA:每天取EDTA抗凝血200 μl,加入800 μl TRNzol-A+,按天根公司TRNzol-A+总RNA提取试剂说明书操作。提取组织中总RNA:在攻毒后第4、9、14天,将猴电击处死,分别采取大脑,小脑,延脑,中脑,脊髓颈、胸、腰段,心,肝,脾,肺,肾,胰,淋巴结等组织器官。初次匀浆后取1.0 g用研磨棒再次匀浆后加入20 ml TRNzol-A+,按天根公司TRNzol-A+总RNA提取试剂说明书操作。
1.2.6探针及引物利用EV71 FY23株基因序列(GenBank号:EU812515)VP1保守区设计引物及探针。Vp1f(2371~2390):5′-AGCCCAAA- AGAACTTCACTA-3′;Vp1r(2531~2541):5′-ATCCAGTCGATGGCTGCTCA-3′;Probe(2411~2438):5′-FAM-AGTGATATCCTGCAGACG- GGCACCATCC-TAMRA-3′。
1.2.7实时PCR检测病毒载量采用实时PCR仪器ABI 7500,反应体系及反应条件按TaKaRa公司 One Step PrimeScriptTMRT-PCR Kit 试剂盒说明书操作。同时将浓度分别为105、104、103、102、101、100、10-1拷贝/μl的EV71 RNA标准品加入同一反应板中,进行PCR反应。
1.2.8Th1/Th2细胞因子检测取抗凝血50 μl,加入BD公司Cytometric Bead Array试剂盒(PE染料50 μl和Capture Beads 50 μl)中,室温避光孵育3 h;加入1 ml Wash Buffer, 2 500 r/min离心5 min;弃上清液后加入300 μl Wash Buffer混匀,上流式细胞仪检测白细胞介素2(interleukin 2,IL-2)、IL-4、IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和IFN-γ。按试剂盒说明书准备标准品,同时上流式细胞仪进行检测。
1.2.9病理学检查在攻毒后第4、9、14天,电击处死猴,分别采取大脑,小脑,延脑,中脑,脊髓颈、胸、腰段,心,肝,脾,肺,肾,胰,淋巴结等组织器官。经固定、脱水、包埋、切片、HE 染色后,观察结果。
2 结果
2.1 EV71灭活疫苗诱导恒河猴产生中和抗体反应
在对二次免疫不同时间点收集的动物血样进行中和抗体分析中,观察到3个不同疫苗剂量免疫的恒河猴均出现不同效价的中和抗体(图1)。在20 EU剂量组,二次免疫后第4周,中和抗体水平上升至最高,达1∶32;之后该抗体水平逐渐下降,至第12周时,已下降至1∶2左右。但80 EU和320 EU剂量组均表现较高的抗体水平。二次免疫后第6周,该两剂量组中和抗体达1∶128~1∶256,之后亦随时间延长而下降;至第16周时,尚维持在1∶16左右。至二次免疫后第12周,20 EU剂量组抗体水平降至最低,约1∶2,而80和320 EU剂量组抗体水平仍然维持在1∶32左右。为比较各剂量组疫苗的保护效果,本文设计二次免疫后第12周进行动物保护疫苗免疫实验。

图1不同剂量EV71灭活疫苗所诱导的中和抗体反应
Fig.1NeutralizingantibodyresponseinducedbyEV71inactivatedvaccineatdifferentdoses
2.2 病毒攻击后恒河猴血清炎性因子反应
二次免疫后的动物接受经鼻腔途径感染的病毒攻击后,体温均在正常范围内波动。而未免疫的对照组动物则出现体温升高,峰值出现在4~7 d。 在检测血清炎性因子水平时,发现疫苗免疫组动物IL-2、IL-4、IL-6轻度上升,均已超出正常值范围;TNF-α和IFN-γ亦轻度上升。而在对照动物中,这几个指标虽有波动,但均在正常参考值范围内(图2)。同时,这些指标的变化在不同剂量免疫组中亦有差异。
2.3 病毒攻击后恒河猴血中病毒载量检测
实时定量PCR分析病毒攻击后14 d内的动物血样,发现对照组在感染后第4~7天表现血中病毒载量升高的峰形变化。有意思的是,在3个剂量免疫组的动物中,均未观察到这一血中病毒载量的阳性变化(图3)。或者说,经疫苗免疫后的恒河猴,在104.5CCID50病毒鼻腔攻击后,实时定量PCR未在血中检出病毒。
2.4 病毒攻击后恒河猴淋巴器官中病毒载量检测
在对病毒攻击后的动物第4、9、14天淋巴器官采样进行病毒载量检测中,观察到一个有意义的现象,即20 EU剂量组所有动物淋巴器官(包括多个淋巴结及脾)中均有一定数量病毒载量。尽管与对照组相比,该病毒载量约低1~1.5个数量级,但80和320 EU剂量组所有动物均未检出阳性病毒载量(图4)。虽然该病毒载量随时间呈降低趋势,但结果提示,在低剂量组中,EV71可在淋巴器官以低水平增殖存在。
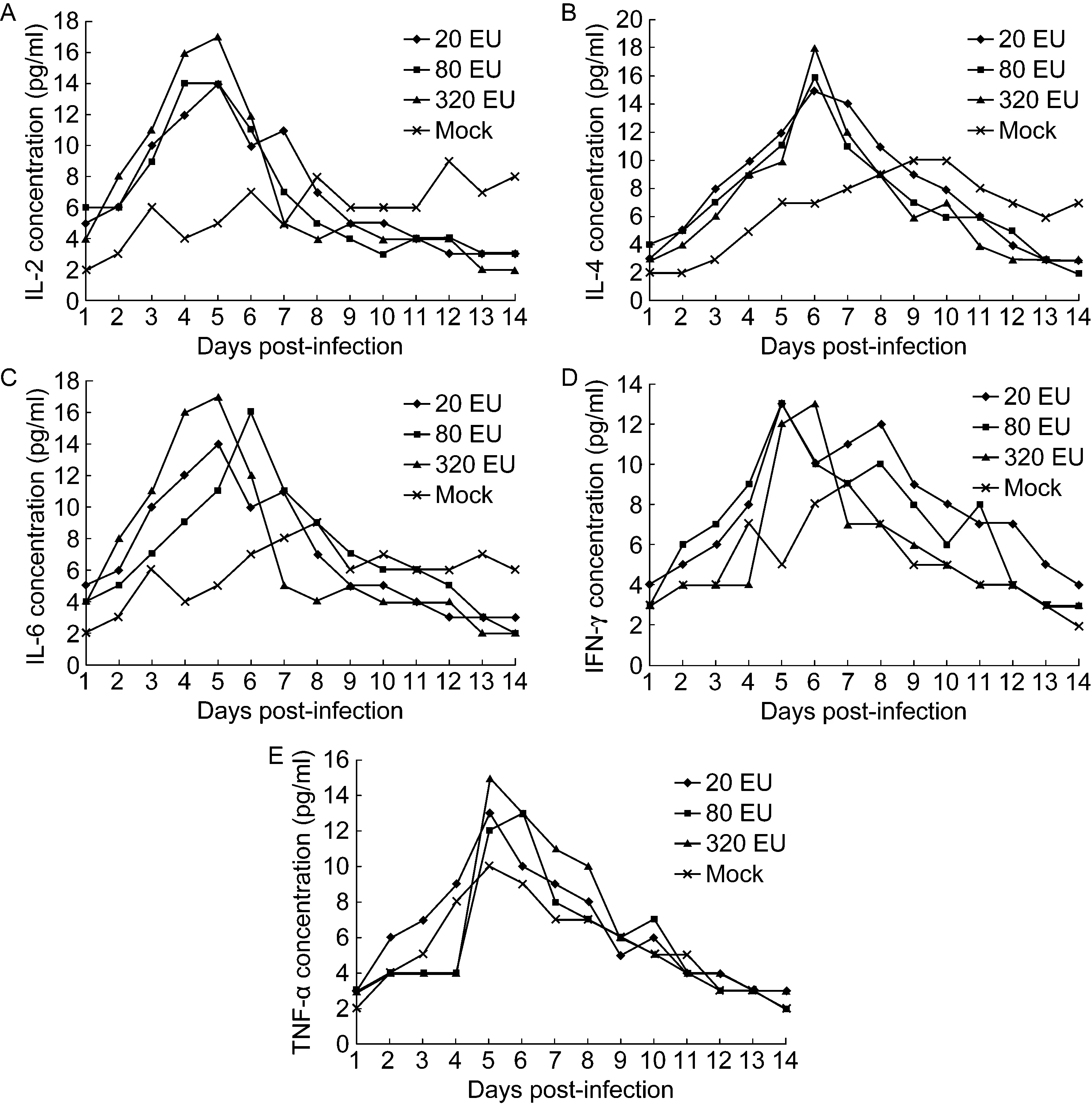
A: IL-2. B: IL-4. C: IL-6. D: IFN-γ. E: TNF-α.
图2疫苗免疫恒河猴在病毒攻击后的炎性因子检测
Fig.2AnalysisoftheinflammatorymarkersinrhesusmonkeysimmunizedbyinactivatedvaccinefollowedwithinfectionofEV71

图3疫苗免疫恒河猴血中病毒的实时定量PCR检测结果
Fig.3ViralloadsinthebloodofrhesusmonkeysimmunizedbyinactivatedvaccinefollowedwithinfectionofEV71usingquantitativereal-timePCR
2.5 病毒攻击后恒河猴主要器官病毒载量检测
我们的前期实验证实,对恒河猴进行EV71鼻腔感染时,可在中枢神经系统和一些主要器官如肺、心等检出病毒增殖(待发表)。本实验中,我们对所有疫苗免疫及对照组动物中枢神经系统和主要器官做病毒载量检测时,亦观察到20 EU剂量组动物的神经、心、肺、肾等均存在低水平病毒增殖,其降低趋势类似于淋巴器官。而80和320 EU剂量组未能检出病毒(图5),进一步证实了上述实验结果。
2.6 病毒攻击后恒河猴的主要组织病理学变化
部分肠道病毒感染病理学的研究已提示,病毒在机体某些靶器官中的增殖常可能伴有细胞的破坏[11]。我们进一步对攻击后不同时间点、不同免疫剂量组的动物主要器官进行组织病理学观察。结果显示,尽管EV71存在于某些器官(如淋巴结、脾)并不绝对与器官的病理损伤相关,但至少在中枢神经组织(包括大脑、中脑、脊髓)和肺,病毒增殖可导致组织病理改变(表1、2)。

图4不同免疫剂量组恒河猴在病毒攻击后淋巴系统中病毒载量的变化
Fig.4ViralloadvariationsinthelymphaticsystemofrhesusmonkeysimmunizedbydifferentdosesofinactivatedvaccinefollowedwithinfectionofEV71

图5病毒攻击后恒河猴主要器官中的病毒载量
Fig.5ViralloadsindifferentmajororgansofrhesusmonkeysimmunizedbyinactivatedvaccinefollowedwithinfectionofEV71
3 讨论
EV71灭活病毒疫苗作为一种尚无质量标准的新疫苗,尽管有些实验为确定其能诱导免疫反应的有效免疫剂量提供了初步数据[12,13],但由于所采用的动物模型多集中于啮齿类,故至今尚未能提供令人信服的、可用于人体免疫的有效免疫剂量的数据。因此,尽管我们前期已成功完成EV71灭活疫苗的乳鼠研究,并利用定量酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)对这一灭活疫苗的抗原含量作了初步设定,确定了可引起小鼠免疫反应的有效剂量为15.7 EU[9]。但这一剂量能否作为人体试验设计的参考,仍无直接的证据支持。根据同为肠道病毒属的甲型肝炎灭活疫苗研究的经验,采用更接近于人类的非人灵长类动物进行免疫学分析及保护性实验,可为这类疫苗最终在人体的应用提供较为可靠的依据[14]。我们前期有关EV71感染生物学的研究,在大量实验基础上建立了恒河猴感染模型。该模型动物在EV71以104.5CCID50的剂量感染鼻腔(气雾剂形式)后,可在中枢神经系统、淋巴系统、肺、心等检出病毒,并伴随相应的病理组织学改变,可观察到典型的病毒血症。其血中病毒检出时间在4~7 d,5~6 d达峰值。该模型为分析EV71感染过程提供了病原学及病理学的指标(待发表)。因此,我们在进行EV71灭活疫苗的免疫学分析中继续使用该模型。本研究结果表明,经EV71灭活疫苗二次免疫的恒河猴均能产生抗EV71的中和抗体反应,尽管20 EU剂量诱导的抗体水平较低,但依然与80和320 EU剂量一样,形成对病毒攻击的抵御作用。20 EU剂量组动物与80和320 EU剂量组一样,未出现感染后的体温改变,而未免疫动物在呼吸道感染EV71后出现典型的体温升高[9];在病毒攻击后的血液病毒载量分析中未观察到病毒血症表现(图3);在病毒攻击后的组织病理学检查中,动物的中枢神经系统以及肺等器官均未出现相关病理损伤(表1、2),而这些阴性指征在未免疫动物中均为阳性(图3~5,表1、2)。值得注意的是,尽管20 EU剂量组动物的机体反应病理学指标均呈阴性,但在病毒攻击后2周内,其淋巴器官、中枢神经系统及其他主要脏器均出现比对照组低但仍为阳性的病毒增殖现象;而80和320 EU剂量组均为阴性(图4、5)。尽管这些器官中的病毒载量并不与器官的病理损伤呈直接相关性,但病毒在这些器官中的增殖会产生何种病理现象尚不能肯定。这一结果提示,诱导恒河猴产生完整的、对机体具有全面保护意义的EV71灭活疫苗剂量可能具有一个阈值,这一阈值决定了免疫后机体在病毒攻击情况下是否具有全面的保护效应。因此,利用小鼠模型确定的免疫有效剂量至少应在灵长类动物中进一步验证。我们在小鼠模型中确定的15.7 EU的有效免疫剂量对恒河猴虽可产生免疫反应,但显然不具有中剂量(80 EU)以上的免疫保护效果,后者能完全阻断病毒在体内的增殖(图3~5),从而完全保护机体组织不受病毒感染。根据免疫恒河猴保护实验所得数据,至二次免疫后第12周,虽然20 EU剂量组较对照组在一定程度上诱导机体产生了一定的抗体,但抗体仅维持在1∶2。综合病原学和病理学的结果,该保护作用并不明显。然而,80和320 EU剂量组此时的抗体水平均维持在1∶32左右,基于病原学和病理学的观察,这一剂量已能有效抵御病毒侵袭,保护效果明显。由图1可看出,本实验所制备的EV71灭活疫苗80和320 EU剂量诱导较高抗体水平,且抗体至少能维持4个月以上。由此,初步推测在人体的免疫保护剂量应该在80 EU以上,以保证免疫后抗体能上升到一定效价并维持相应时间。
表1病毒攻击后疫苗免疫及未免疫恒河猴中枢神经系统病理损伤
Tab.1NeuropathologicalevaluationofrhesusmonkeysunimmunizedorimmunizedbyinactivatedvaccinefollowedwithinfectionofEV71
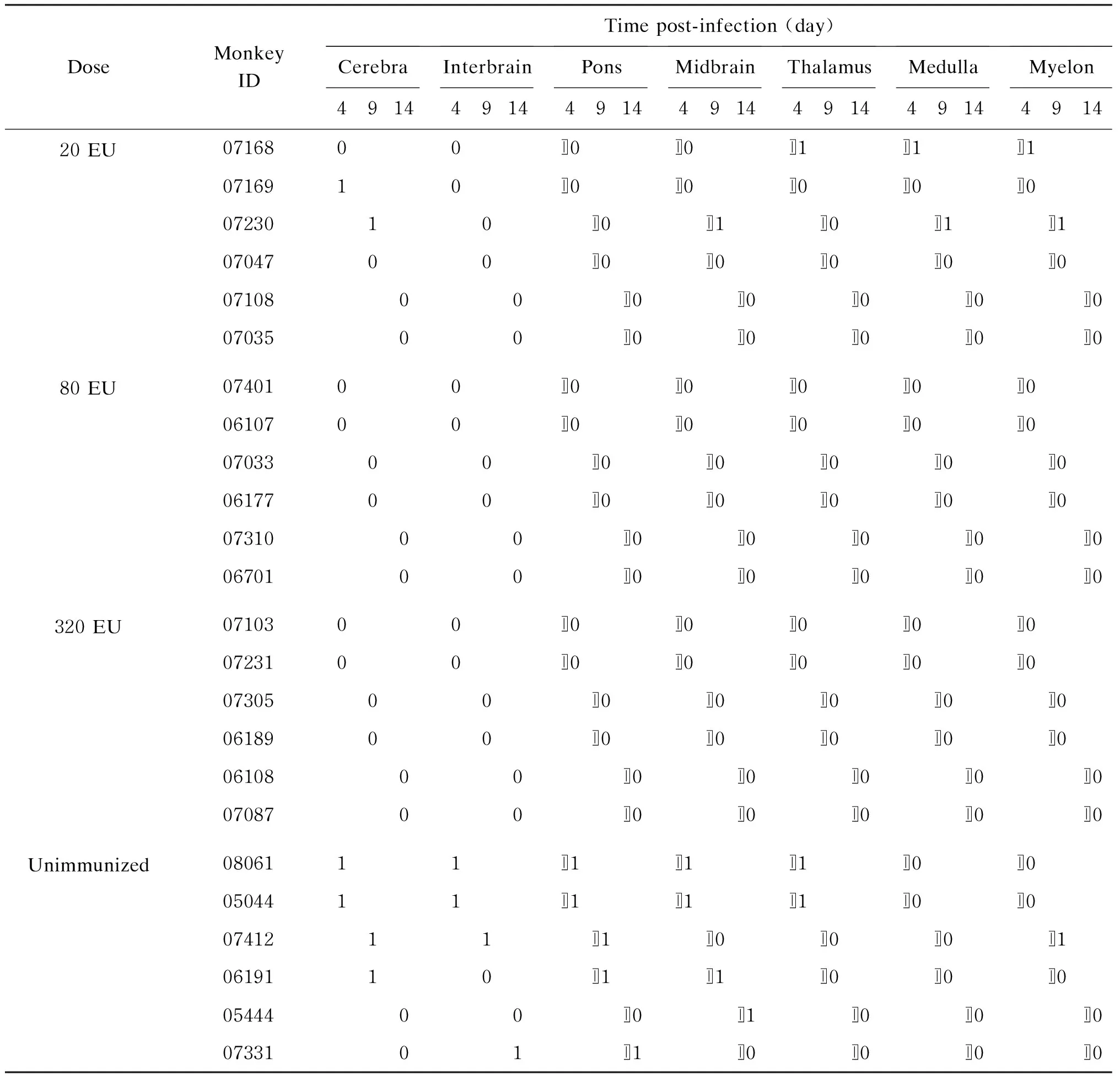
DoseMonkey IDTime post-infection (day)Cerebra4914Interbrain4914Pons4914Midbrain4914Thalamus4914Medulla4914Myelon491420 EU0716800〛0〛0〛1〛1〛10716910〛0〛0〛0〛0〛00723010〛0〛1〛0〛1〛10704700〛0〛0〛0〛0〛00710800〛0〛0〛0〛0〛00703500〛0〛0〛0〛0〛080 EU0740100〛0〛0〛0〛0〛00610700〛0〛0〛0〛0〛00703300〛0〛0〛0〛0〛00617700〛0〛0〛0〛0〛00731000〛0〛0〛0〛0〛00670100〛0〛0〛0〛0〛0320 EU0710300〛0〛0〛0〛0〛00723100〛0〛0〛0〛0〛00730500〛0〛0〛0〛0〛00618900〛0〛0〛0〛0〛00610800〛0〛0〛0〛0〛00708700〛0〛0〛0〛0〛0Unimmunized0806111〛1〛1〛1〛0〛00504411〛1〛1〛1〛0〛00741211〛1〛0〛0〛0〛10619110〛1〛1〛0〛0〛00544400〛0〛1〛0〛0〛00733101〛1〛0〛0〛0〛0
Central nervous system (CNS) lesions were scored according to the evaluation standard of the CNS lesion score recommended by the World Health Organization (WHO) (Arita, 2007): 0, no lesion; 1, cellular infiltration; 2, cellular infiltration with minimal neural damage; 3, cellular infiltration with extensive neural damage; and 4, massive neural damage with or without cellular infiltration.
表2病毒攻击后疫苗免疫及未免疫恒河猴器官病理损伤
Tab.2PathologicalchangesinrhesusmonkeysunimmunizedorimmunizedbyinactivatedvaccinefollowedwithinfectionofEV71

DoseMonkey IDTime post-infection (day)Heart4914Liver4914Spleen4914Lung4914Kidney4914Pancreas4914Lymph node491420 EU0716800〛0〛1〛1〛0〛00716900〛0〛0〛0〛0〛00723000〛1〛1〛0〛1〛00704700〛0〛1〛1〛0〛10710800〛0〛0〛0〛0〛00703500〛0〛1〛0〛0〛080 EU0740100〛0〛0〛1〛0〛00610700〛0〛0〛0〛0〛00703300〛0〛0〛0〛0〛00617700〛0〛0〛0〛1〛00731001〛0〛0〛0〛0〛00670100〛0〛0〛0〛0〛0320 EU0710300〛0〛0〛0〛0〛00723100〛0〛0〛0〛0〛00730500〛0〛0〛0〛0〛00618900〛0〛0〛0〛0〛00610800〛0〛0〛0〛0〛00708700〛0〛0〛0〛0〛0Unimmunized0806111〛0〛1〛0〛0〛00504410〛0〛1〛0〛0〛00741210〛0〛2〛0〛0〛00619101〛0〛2〛0〛1〛00544400〛0〛3〛0〛0〛00733100〛1〛2〛0〛1〛0
0, no obvious pathological change; 1, cellular infiltration; 2, cellular infiltration and damage of tissue; 3, massive cellular infiltration and severe damage of tissue.
本实验结果还显示,EV71灭活疫苗免疫的恒河猴在接受病毒攻击时,其相关免疫因子亦有相应变化(图2)。IL-2、IL-4和IL-6轻微上升,同时TNF-α和IFN-γ亦轻度上升。这样的上升幅度是否具有特定的病理学意义尚不能定论,但Komisar等[15]对恒河猴免疫病理的综合分析显示,这样的变化并不提示任何免疫病理过程的存在。
[1] McMinn PC. An overview of the evolution of enterovirus 71 and its clinical and public health significance [J]. FEMS Microbiol Rev, 2002, 26(1): 91-107.
[2] Shimizu H, Utama A, Onnimala N, Chen L, Zhang LB, Ma JY, Pongsuwanna Y, Miyamura T. Molecular epidemiology of enterovirus 71 infection in the Western Pacific Region [J]. Pediatr Int, 2004, 46(2): 231-235.
[3] Ishimaru Y, Nakano S, Yamaoka K, Takami S. Outbreaks of hand, foot, and mouth disease by enterovirus 71. High incidence of complication disorders of central nervous system [J]. Arch Dis Child, 1980, 55(8): 583-588.
[4] Ooi MH, Wong SC, Mohan A, Podin Y, Perera D, Clear D, del Sel S, Chieng CH, Tio PH, Cardosa MJ, Solomon T. Identification and validation of clinical predictors for the risk of neurological involvement in children with hand, foot, and mouth disease in Sarawak [J]. BMC Infect Dis, 2009, 9: 3.
[5] Wu SC, Liu CC, Lian WC. Optimization of microcarrier cell culture process for the inactivated enterovirus type 71 vaccine development [J]. Vaccine, 2004, 22(29-30): 3858-3864.
[6] Shahzad A, Kohler G. Inactivated polio vaccine (IPV): a strong candidate vaccine for achieving global polio eradication program [J]. Vaccine, 2009, 27(39): 5293-5294.
[7] Innis BL, Snitbhan R, Kunasol P, Laorakpongse T, Poopatanakool W, Kozik CA, Suntayakorn S, Suknuntapong T, Safary A, Tang DB, Boslego JW. Protection against hepatitis A by an inactivated vaccine [J]. JAMA, 1994, 271(17): 1328-1334.
[8] Ma S, Liu J, Wang J, Shi H, Yang H, Chen J, Liu L, Li Q. Genetic analysis of the VP1 region of human enterovirus 71 strains isolated in Fuyang, China, during 2008 [J]. Virol Sin, 2009, 24(3): 162-170.
[9] Dong C, Wang J, Liu L, Zhao H, Shi H, Zhang Y, Jiang L, Li Q. Optimized development of a candidate strain of inactivated EV71 vaccine and analysis of its immunogenicity in rhesus monkeys [J]. Hum vaccin, 2010, 6(12). [Epub ahead of print]
[10] 中国生物制品标准化委员会. 中国生物制品规程 [M]. 化学工业出版社, 2000:187.
[11] Kandolf R, Sauter M, Aepinus C, Schnorr JJ, Selinka HC, Klingel K. Mechanisms and consequences of enterovirus persistence in cardiac myocytes and cells of the immune system [J]. Virus Res, 1999, 62(2): 149-158.
[12] Chung YC, Ho MS, Wu JC, Chen WJ, Huang JH, Chou ST, Hu YC. Immunization with virus-like particles of enterovirus 71 elicits potent immune responses and protects mice against lethal challenge [J]. Vaccine, 2008, 26(15): 1855-1862.
[13] Tung WS, Bakar SA, Sekawi Z, Rosli R. DNA vaccine constructs against enterovirus 71 elicit immune response in mice [J]. Genet Vaccines Ther, 2007, 5: 6.
[14] Ahmad G, Zhang W, Torben W, Damian RT, Wolf RF, White GL, Chavez-Suarez M, Kennedy RC, Siddiqui AA. Protective and antifecundity effects of Sm-p80-based DNA vaccine formulation against Schistosoma mansoni in a nonhuman primate model [J]. Vaccine, 2009, 27(21): 2830-2837.
[15] Komisar JL, Weng CF, Oyejide A, Hunt RE, Briscoe C, Tseng J. Cellular and cytokine responses in the circulation and tissue reactions in the lung of rhesus monkeys (Macaca mulatta) pretreated with cyclosporin A and challenged with staphylococcal enterotoxin B [J]. Toxicol Pathol, 2001, 29(3): 369-378.

