全球人类免疫缺陷病毒疫苗研究的进展、挑战和我国的历史性机遇
邵一鸣
中国疾病预防控制中心性病艾滋病预防控制中心病毒免疫室,北京102206
获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)由人类免疫缺陷病毒(human immunodeficiency virus,HIV)引起,自1981年发现以来已成为全球危害最为严重的传染病之一。尽管防治力度不断加大,AIDS在全球的蔓延势头仍未得到有效控制。世界卫生组织(World Health Organization,WHO)报告,至2009年全球共有约3 330万HIV/AIDS患者,HIV新感染者260多万例[1]。我国HIV/AIDS感染报告数字由2000年的每年5 000多例增加到2009年的每年68 000多例,主要流行由经血传播转为经性传播,主要累及人群从高危人群转为高危人群与普通人群并行,流行地区也从农村扩展到城市,防治形势十分严峻[2]。国内、外AIDS的防治对HIV疫苗的需求更为迫切。本文简要回顾HIV疫苗研究的历史,并结合近年来的最新研究进展,对其未来发展趋势及机遇提出一些意见和建议。
1 以往HIV疫苗研究的经验和教训
HIV疫苗是当今人类面临最难攻克的疫苗之一,科学界已经为之奋斗了20多年,至今未有重大突破。头10年是第1代HIV疫苗的研究阶段。该阶段的研究以诱导传统中和抗体为主,主要参照第1个成功的基因工程疫苗——乙型肝炎疫苗的技术策略,开展针对HIV膜蛋白的蛋白疫苗和多肽疫苗研究。第1代疫苗在经过几十次Ⅰ、Ⅱ期临床试验后,美国VaxGen公司研制的gp120疫苗在美国和泰国开展了2次Ⅲ期临床试验[3]。到21世纪初,该型疫苗上述试验均以失败告终[3,4]。
第2代HIV疫苗的研究始于第1代gp120疫苗试验失败前的20世纪末。因第1代HIV疫苗Ⅱ期临床试验结果十分不理想,疫苗界来不及等其Ⅲ期临床试验结果出来就放弃了该条技术路线,从诱导中和抗体的B细胞疫苗转向诱导杀伤细胞的T细胞疫苗,以降低感染后病毒载量为主要设计目标。经过10年以非复制型病毒载体(痘病毒、腺病毒等)为主的研究和几十次Ⅰ、Ⅱ期临床试验后,由Merck公司研制的基于腺病毒Ad5载体的T细胞HIV疫苗也于2007年再次失败[5]。该疫苗不仅没有对HIV感染产生保护或降低接种者感染后的病毒载量,还在已感染Ad5的人群中观察到比对照组更高的HIV感染率,这对HIV疫苗研究产生了极大冲击。
在国际HIV疫苗界进行科学反思的同时,国内社会上也出现了一股思潮:认为美国科研机构和大公司都失败了,没有希望了,我国应减少或放弃此项研究,待国外成功后再加大研究力度。而笔者认为,正因为国际上还没突破,我们才应该抓住机遇,加大投入,联合攻关,以求在出现突破时占有一席之地。如果国际上已有突破,如几十年前Merck公司研制成功乙型肝炎疫苗,这时才应该减少对原创性研究的投入,以保证技术引进所需的资金。包括我国在内的世界各国,至今还在使用Merck公司的技术生产乙型肝炎疫苗。
从第1、2代HIV疫苗研究的失败中至少有以下值得汲取的经验教训:①第1代HIV疫苗的研究简单模仿乙型肝炎疫苗的技术路线,忽视了不同病毒感染机制、病毒变异和自然感染时有无免疫保护及其作用的本质不同;②在首次Ⅲ期临床试验失败后过早放弃中和抗体的阵地,退守到T细胞免疫的防线;③在HIV疫苗的科学问题还没有解决时,就将资源过分集中于“主流研发路线”,限制了本该进行的百花齐放式的探索性研究;④“主流研发路线”进行了大量重复研究,消耗了大量人力和物力资源;⑤在疫苗研发中追求100%的安全性,违背疫苗总会有一定不良反应的客观规律,放弃了许多免疫原性更好的疫苗载体,如复制型病毒载体疫苗的研究。
2 国际HIV疫苗研究的新动向和标志性进展
HIV疫苗研究一直在失败和挫折中不断探索前行,近年来新的研究理念和技术路线也在不断涌现[6]。研究的新动向和新领域包括改造HIV天然抗原的新免疫原设计研究、以提高HIV抗原免疫原性并兼顾细胞免疫和体液免疫的复制型病毒载体研究、以诱导黏膜免疫为主的新载体研究和更加注重经诱导固有免疫继而激活继发免疫的新佐剂研究等。病毒学家和疫苗学家也更致力于与系统生物学家和免疫学家合作,以系统生物学和系统免疫学的方法来指导疫苗免疫保护机制的研究,借以寻找并指导HIV疫苗研究的新方向[7-9]。此外,HIV疫苗临床试验目的也发生转变。与传统的以注册为目的的临床试验不同,HIV疫苗临床试验将转向以回答只有在人体试验才能得到结果的特定科学问题而设计的试验。平行推进多项此类试验,将不会延缓还会加速开展传统的Ⅲ期临床试验的进程[10]。
近两年来,国际HIV疫苗研究进展很快,仅举以下几项重要的标志性成果加以介绍。
2.1 泰国RV144 Ⅲ期临床试验
跨国公司及美国军队与泰国卫生部合作,在泰国进行由第1、2代HIV疫苗组合(VaxGen的gp120和Aventis Pasteur公司的重组禽痘疫苗)而成的疫苗(RV144)Ⅲ期临床试验。该试验于2009年宣布了出人意料的试验结果。对招募的16 000多名受试者进行为期3年的观察随访,结果显示该疫苗预防HIV感染的保护率为31%[11]。尽管该疫苗因如此低的保护率无法获美国食品药品管理局(Food and Drug Administration,FDA)批准上市,也无价值用于预防,但这是25年的HIV疫苗研究历史中首次证明,预防性HIV疫苗的目标并非遥不可及,而是可以实现的。该疫苗试验结果的发表,使整个HIV疫苗界一夜之间由以T细胞疫苗为重点转回到以B细胞疫苗为重点的疫苗研究轨道。
2.2 获取历史上最强的广谱中和抗体
美国国立卫生研究院(National Institutes of Health,NIH)疫苗研究中心(Vaccine Research Center,VRC)于2010年发表了他们的重要研究结果,从HIV感染者分离到迄今为止中和活性最强、中和谱最广的中和抗体VRC01,并完成其晶体结构的解析[12,30]。VRC01抗体能模仿人体的CD4免疫细胞,“绑定” HIV的gp120膜蛋白的CD4结合表位,而后者在HIV入侵人体的机制中发挥着非常重要的作用。其结构解析有助于理解中和机制并为新免疫原设计提供重要的参考,但并不能保证获得诱导类似抗体的新型HIV免疫原。多年前发现广谱中和抗体2G12后,经过多项努力,也没能设计出可诱导出类似抗体的免疫原[13]。近年来HIV疫苗研究多次证实,抗原性并不等于免疫原性,两者是不同的免疫属性。从抗原刺激到机体产生相应抗体是一漫长过程,在免疫学上仍是一个“黑箱”。美国NIH VRC最近发现,从针对HIV的低亲和力的胚系抗体到高亲和力的成熟VRC01抗体,它们之间有极高的突变率和很大的差异。
笔者认为,疫苗研制的成功不仅取决于对病毒抗原结构特性的认识,更有赖于对人类免疫系统的深入认识。例如,鉴于人类基因组中丰度最高的基因之一是内源性反转录病毒序列[14],探讨很难诱导出抗HIV广谱中和抗体的原因,还应从身为反转录病毒的HIV是否通过诱导免疫耐受来阻止有效中和抗体产生而逃脱免疫监视的角度加以考察。寻找打破此类免疫耐受的安全途径和措施,应成为诱导针对HIV广谱中和抗体的策略。
2.3 诱导中和抗体的基因治疗方案
鉴于很难通过免疫途径诱导出抗HIV高效广谱中和抗体,美国宾夕法尼亚州立大学和哈佛大学的学者使用腺相关病毒载体的基因治疗技术,直接将广谱中和抗体基因注射到猴体内。结果显示,猴体可持续表达高水平的针对猴免疫缺陷病毒(simian immunodeficiency virus,SIV)的中和抗体,维持时间达1年以上。该组猴能完全对抗SIV的静脉攻毒[15]。此技术巧妙地绕过了机体的获得性免疫系统,克服了SIV疫苗很难诱导猴体产生高水平中和抗体的障碍,为探索有效的HIV疫苗提供了一条新的技术策略。对HIV疫苗,也可考虑用基因工程技术直接呈递抗体,作为疫苗研究的新策略。
2.4 新型T细胞疫苗设计和免疫策略
尽管Merck公司的Ad5疫苗失败,但研制T细胞疫苗的努力并未停止。美国NIH VRC研制的DNA与Ad5联合疫苗于2010年开始了新的Ⅱ期临床试验(HVTN502)。哈佛大学及其他大学学者也设计了新的T细胞疫苗并取得进展:使用Ad5的异源联合免疫策略可使猕猴对抗致病性SIV的攻击,大幅降低SIV载量[16];对全球各亚型HIV-1优势表位序列进行优化,最终设计出嵌合表位的疫苗,并在猴体中证明可有效提高针对多种HIV-1流行株的免疫反应[17]。多价嵌合型免疫原能诱导针对各种病毒蛋白多表位的CD8+T细胞反应[18]。一般认为,增加HIV免疫反应表位数量和强度,有助于抵御异源病毒的感染(自然感染时的状况)。
3 我国HIV疫苗研究的进展
我国HIV疫苗研究起步虽晚,但近年来进展较快,并具有创新性的研究策略和技术路线。例如,中国疾病预防控制中心(Chinese Center for Disease Control and Prevention,China CDC)根据多年系统的HIV分子流行病学研究,筛选出的CN54(CN97001)HIV-1毒株具有很好的代表性,其基因已被我国和多个国家选作HIV候选疫苗的抗原基因[19]。最近国外学者证明,该疫苗株膜蛋白诱导中和抗体的能力优于他国的HIV疫苗毒株[20]。
我国科学家根据以前HIV疫苗研制的经验和教训,开展了按照马传染性贫血症病毒(equine infectious anemia virus,EIAV)疫苗原理进行HIV抗原改造的原创路线[21],并取得提高中和抗体强度和广度的良好结果[22]。以我国具自主知识产权的天花疫苗天坛株为基础开展的临床前疫苗研究证实,其可保护猴抵御同源猴/人类免疫缺陷嵌合病毒(simian-human immunodeficiency virus,SHIV)的攻击。中国疾病预防控制中心和北京生物制品研究所研制的DNA和重组天坛株HIV-1疫苗已顺利完成Ⅰ期临床试验,正向Ⅱ期临床试验迈进[25]。该疫苗是当前唯一进展到临床试验阶段的复制型病毒载体HIV疫苗。长春百克公司研制的DNA和重组痘苗病毒安卡拉株(modified vaccinia virus Ankara,MVA) HIV-1疫苗已顺利开始Ⅱ期临床试验。目前我国预防性和治疗性HIV疫苗研究的有关情况详见表1[26]。
表1我国部分HIV疫苗研究
Tab.1SelectedHIVvaccineresearchinChina
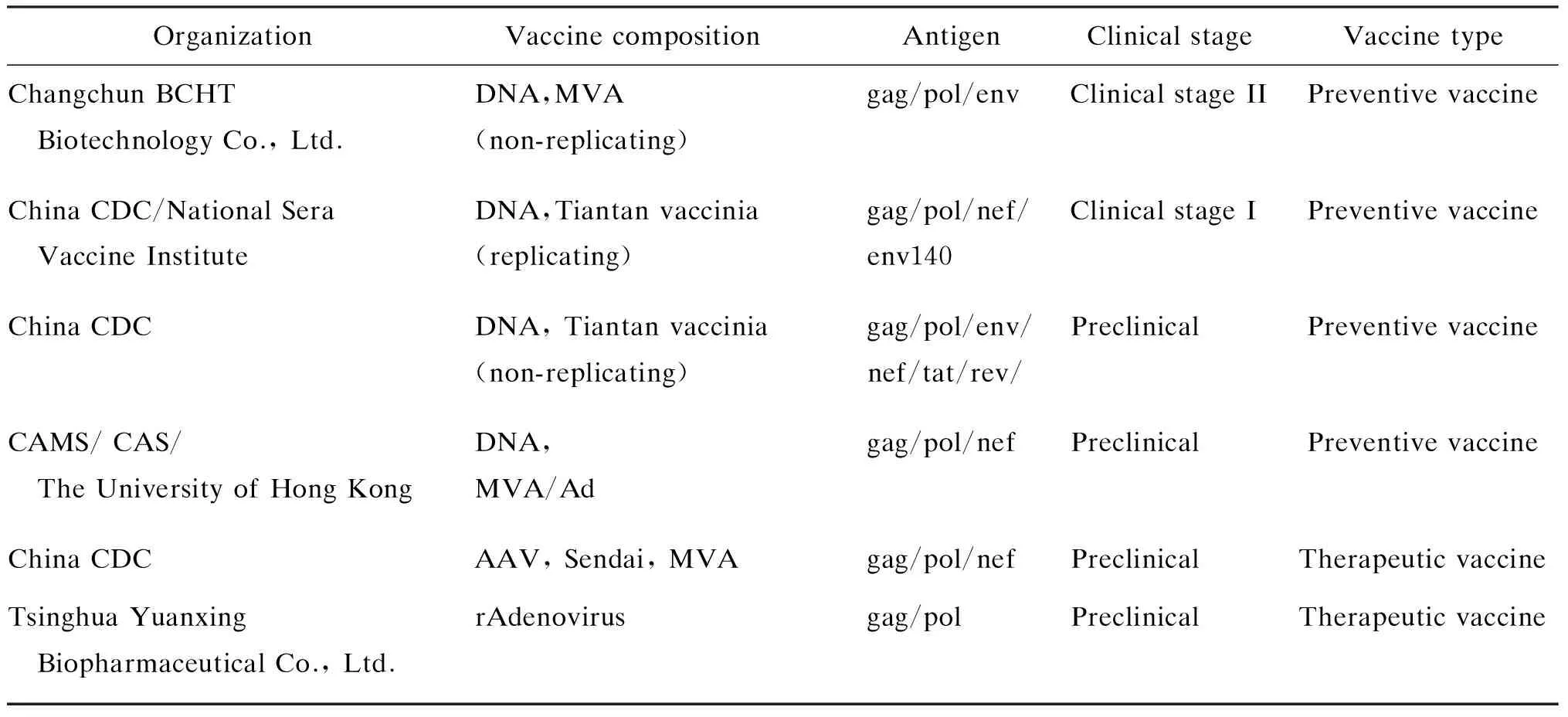
Organization Vaccine compositionAntigenClinical stageVaccine typeChangchun BCHT Biotechnology Co., Ltd.DNA,MVA (non-replicating)gag/pol/envClinical stage II Preventive vaccineChina CDC/National Sera Vaccine InstituteDNA,Tiantan vaccinia(replicating)gag/pol/nef/env140Clinical stage I Preventive vaccineChina CDCDNA, Tiantan vaccinia(non-replicating)gag/pol/env/nef/tat/rev/PreclinicalPreventive vaccineCAMS/ CAS/ The University of Hong Kong DNA,MVA/Adgag/pol/nefPreclinicalPreventive vaccineChina CDCAAV, Sendai, MVAgag/pol/nefPreclinicalTherapeutic vaccineTsinghua Yuanxing Biopharmaceutical Co., Ltd.rAdenovirusgag/polPreclinicalTherapeutic vaccine
4 HIV疫苗发展趋势及我国机遇
成功的HIV疫苗与HIV药物类似,是将不同原理和技术研制出的疫苗按特定免疫程序进行联合应用。任何一个团队甚至一个国家能占有所有种类疫苗的可能性不是很大。西方国家HIV流行近年来持续下降,开展疫苗试验的成本大幅上升,HIV疫苗的研发和临床试验越来越依赖于全球的合作,尤其是发达国家与发展中国家的合作。自一组科学家在Science上呼吁建立全球HIV疫苗企业计划以来[27],国际层面的HIV疫苗研制合作全面展开,盖茨基金为全球HIV疫苗企业计划提供了数亿美元的巨额资助,并成立秘书处,推动全球合作攻关。最近该企业计划发布了未来5年全球HIV疫苗研发的战略规划,提出以平行推进临床试验和跨学科临床前研究为牵引,鼓励企业、青年科学家和发展中国家积极参与,全面推动全球HIV疫苗的研发[28]。当前的重点任务一是在非洲重复RV144试验,以观察其在非洲人群中的保护效果;二是研究RV144疫苗的低保护率相关因素。试验的所有样本对全球科学家开放,但研究方案须经国际科学委员会的审核并通过方可取用)[29];三是大力推动创新型HIV疫苗的基础和临床研究。
2009年初,我国HIV疫苗学者在国家科技重大专项的支持下,结成中国HIV疫苗联盟(China AIDS Vaccine Initiative,CAVI),开展学术交流、资料共享、团结合作、联合攻关。CAVI成立提高了我国HIV疫苗的自主创新能力和国际竞争力,在国际上产生了积极的影响。2009年,WHO、NIH和全球HIV疫苗企业计划与CAVI合作,在北京召开了亚洲HIV疫苗大会,启动了亚太HIV疫苗网络(AIDS Vaccine for Asia Network, AVAN)的筹建工作。2010年AVAN正式成立[26],CAVI被亚洲国家推举为AVAN的秘书处,组织和协调HIV疫苗研发的地区合作。
可以相信,在国家科技重大专项的大力支持下,CAVI的科学家一定可以在完成既定专项研究计划的基础上,积极参与亚太地区和全球层面的HIV疫苗国际合作,抓住机遇,实现中国HIV疫苗的跨越式发展,为HIV疫苗的早日攻克贡献中国科学家的力量。
致谢:
感谢罗振武、郑本峰和滕涛对此文撰写中文献整理和编辑的帮助。
[1] UNAIDS report on the global AIDS epidemic 2010 [R/OL]. http://www.unaids.org/globalreport/Global_report.htm.
[2] 卫生部,UNAIDS, WHO. 2009年中国艾滋病疫情估计工作报告[R/OL]. http://www.moh.gov.cn/publicfiles/business/ cmsresources/mohjbyfkzj/cmsrsdocument/doc9721.pdf.
[3] Flynn NM, Forthal DN, Harro CD, Judson FN, Mayer KH, Para MF, rgp120 HIV Vaccine Study Group. Placebo-controlled phase 3 trial of a recombinant glycoprotein 120 vaccine to prevent HIV-1 infection [J]. J Infect Dis, 2005, 191(5): 654-665.
[4] Pitisuttithum P, Gilbert P, Gurwith M, Heyward W, Martin M, van Griensven F, Hu D, Tappero JW, Choopanya K, Bangkok Vaccine Evaluation Group. Randomized, double-blind, placebo-controlled efficacy trial of a bivalent recombinant glycoprotein 120 HIV-1 vaccine among injection drug users in Bangkok, Thailand [J]. J Infect Dis, 2006, 194(12): 1661-1671.
[5] Buchbinder SP, Mehrotra DV, Duerr A, Fitzgerald DW, Mogg R, Li D, Gilbert PB, Lama JR, Marmor M, Del Rio C, McElrath MJ, Casimiro DR, Gottesdiener KM, Chodakewitz JA, Corey L, Robertson MN, Step Study Protocol Team. Efficacy assessment of a cell-mediated immunity HIV-1 vaccine (the Step Study): a double-blind, randomised, placebo-controlled, test-of-concept trial [J]. Lancet, 2008, 372(9653): 1881-1893.
[6] Fauci AS, Johnston MI, Dieffenbach CW, Burton DR, Hammer SM, Hoxie JA, Martin M, Overbaugh J, Watkins DI, Mahmoud A, Greene WC. HIV vaccine research: the way forward [J]. Science, 2008, 321(5888): 530-532.
[7] Querec TD, Akondy RS, Lee EK, Cao W, Nakaya HI, Teuwen D, Pirani A, Gernert K, Deng J, Marzolf B, Kennedy K, Wu H, Bennouna S, Oluoch H, Miller J, Vencio RZ, Mulligan M, Aderem A, Ahmed R, Pulendran B. Systems biology approach predicts immunogenicity of the yellow fever vaccine in humans [J]. Nat Immunol, 2009, 10(1): 116-125.
[8] Brass AL, Dykxhoorn DM, Benita Y, Yan N, Engelman A, Xavier RJ, Lieberman J, Elledge SJ. Identification of host proteins required for HIV infection through a functional genomic screen [J]. Science, 2008, 319(5865): 921-926.
[9] Pulendran B. Learning immunology from the yellow fever vaccine: innate immunity to systems vaccinology [J]. Nat Rev Immunol, 2009, 9(10): 741-747.
[10] Corey L, Autran B, Picker L. Bridging the gaps between fundamental, preclinical and clinical research: Report from a Global HIV Vaccine Enterprise Working Group [J]. Nat Med, 2010. doi:10.1038/npre.2010.4799.2.
[11] Rerks-Ngarm S, Pitisuttithum P, Nitayaphan S, Kaewkungwal J, Chiu J, Paris R, Premsri N, Namwat C, de Souza M, Adams E, Benenson M, Gurunathan S, Tartaglia J, McNeil JG, Francis DP, Stablein D, Birx DL, Chunsuttiwat S, Khamboonruang C, Thongcharoen P, Robb ML, Michael NL, Kunasol P, Kim JH, MOPH-TAVEG Investigators. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand [J]. N Engl J Med, 2009, 361(23): 2209-2220.
[12] Zhou T, Georgiev I, Wu X, Yang ZY, Dai K, Finzi A, Kwon YD, Scheid JF, Shi W, Xu L, Yang Y, Zhu J, Nussenzweig MC, Sodroski J, Shapiro L, Nabel GJ, Mascola JR, Kwong PD. Structural basis for broad and potent neutralization of HIV-1 by antibody VRC01 [J]. Science, 2010, 329(5993): 811-817.
[13] Calarese DA, Lee HK, Huang CY, Best MD, Astronomo RD, Stanfield RL, Katinger H, Burton DR, Wong CH, Wilson IA. Dissection of the carbohydrate specificity of the broadly neutralizing anti-HIV-1 antibody 2G12 [J]. Proc Natl Acad Sci USA, 2005, 102(38): 13372-13377.
[14] Löwer R, Löwer J, Kurth R. The viruses in all of us: characteristics and biological significance of human endogenous retrovirus sequences [J]. Proc Natl Acad Sci USA, 1996, 93(11): 5177-5184.
[15] Johnson PR, Schnepp BC, Zhang J, Connell MJ, Greene SM, Yuste E, Desrosiers RC, Clark KR. Vector-mediated gene transfer engenders long-lived neutralizing activity and protection against SIV infection in monkeys [J]. Nat Med, 2009, 15(8): 901-906.
[16] Liu J, O’Brien KL, Lynch DM, Simmons NL, La Porte A, Riggs AM, Abbink P, Coffey RT, Grandpre LE, Seaman MS, Landucci G, Forthal DN, Montefiori DC, Carville A, Mansfield KG, Havenga MJ, Pau MG, Goudsmit J, Barouch DH. Immune control of an SIV challenge by a T-cell-based vaccine in rhesus monkeys [J]. Nature, 2008, 457(7225): 87-91.
[17] Corey L, McElrath MJ. HIV vaccines: mosaic approach to virus diversity [J]. Nat Med, 2010, 16(3): 268-270.
[18] Santra S, Liao HX, Zhang R, Muldoon M, Watson S, Fischer W, Theiler J, Szinger J, Balachandran H, Buzby A, Quinn D, Parks RJ, Tsao CY, Carville A, Mansfield KG, Pavlakis GN, Felber BK, Haynes BF, Korber BT, Letvin NL. Mosaic vaccines elicit CD8+T lymphocyte responses that confer enhanced immune coverage of diverse HIV strains in monkeys [J]. Nat Med, 2010, 16(3): 324-328.
[19] Harari A, Bart PA, Stöhr W, Tapia G, Garcia M, Medjitna-Rais E, Burnet S, Cellerai C, Erlwein O, Barber T, Moog C, Liljestrom P, Wagner R, Wolf H, Kraehenbuhl JP, Esteban M, Heeney J, Frachette MJ, Tartaglia J, McCormack S, Babiker A, Weber J, Pantaleo G. An HIV-1 clade C DNA prime, NYVAC boost vaccine regimen induces reliable, polyfunctional, and long-lasting T cell responses [J]. J Exp Med, 2008, 205(1): 63-77.
[20] Smith DH, Winters-Digiacinto P, Mitiku M, O’Rourke S, Sinangil F, Wrin T, Montefiori DC, Berman PW. Comparative immunogenicity of HIV-1 clade C envelope proteins for prime/boost studies [J]. PLoS One, 2010, 5(8): e12076.
[21] Li H, Zhang X, Fan X, Shen T, Tong X, Shen R, Shao Y. A conservative domain shared by HIV gp120 and EIAV gp90: implications for HIV vaccine design [J]. AIDS Res Hum Retrovir, 2005, 21(12): 1057-1059.
[22] Liu L, Wan Y, Wu L, Sun J, Li H, Li H, Ma L, Shao Y. Broader HIV-1 neutralizing antibody responses induced by envelope glycoprotein mutants based on the EIAV attenuated vaccine [J]. Retrovirology, 2010: 7: 71.
[23] Huang X, Lu B, Yu W, Fang Q, Liu L, Zhuang K, Shen T, Wang H, Tian P, Zhang L, Chen Z. A novel replication-competent vaccinia vector MVTT is superior to MVA for inducing high levels of neutralizing antibody via mucosal vaccination [J]. PLoS One, 2009, 4(1): e4180.
[24] Yang GB, Liu Q, Sun Q, Liu Y, Liu Y, Li HJ, Sun MS, Dai JJ, Hong KX, Shao Y. HIV-1 specific humoral, cellular and reminiscent immune responses induced in Chinese rhesus macaques by DNA-tiantan vaccinia combined AIDS vaccine [J]. Antivir Ther, 2006, 11(Suppl 2) : 160.
[25] Shao Y, Li T, Wolf H, Liu Y, Liu Y, Wang H, Zhu H, Lv W, Lin W, Chen J, Liang H, Hong K, Jia M. The safety and immunogenicity of HIV-1 vaccines based on DNA and replication competent vaccinia vector in phase I clinical trial [J]. Retrovirology, 2009, 6(Suppl 3): 404. doi:10.1186/1742-4690-6-S3-P404.
[26] Kent SJ, Cooper DA, Chhi Vun M, Shao Y, Zhang L, Ganguly N, Bela B, Tamashiro H, Ditangco R, Rerks-Ngarm S, Pitisuttithum P, Van Kinh N, Bernstein A, Osmanov S, AIDS Vaccine for Asia Network Investigators and Supporters. AIDS vaccine for Asia Network (AVAN): expanding the regional role in developing HIV vaccines [J]. PLoS Med, 2010, 7(9): e1000331.
[27] Klausner RD, Fauci AS, Corey L, Nabel GJ, Gayle H, Berkley S, Haynes BF, Baltimore D, Collins C, Douglas RG, Esparza J, Francis DP, Ganguly NK, Gerberding JL, Johnston MI, Kazatchkine MD, McMichael AJ, Makgoba MW, Pantaleo G, Piot P, Shao Y, Tramont E, Varmus H, Wasserheit JN. Medicine. The need for a global HIV vaccine enterprise [J]. Science, 2003, 300(5628): 2036-2039.
[28] Council of the Global HIV Vaccine Enterprise. The 2010 scientific strategic plan of the Global HIV Vaccine Enterprise [J]. Nat Med, 2010, 16(9): 981-989.
[29] Grant D, Bass E. Understanding the results of RV144, the Thai prime-boost AIDS vaccine trial [J/OL]. http://www.gmhc.org/files/editor/file/ti-0310.pdf.
[30] Wu X, Yang ZY, Li Y, Hogerkorp CM, Schief WR, Seaman MS, Zhou T, Schmidt SD, Wu L, Longo NS, McKee K, O'Dell S, Louder MK, Wycuff DL, Feng Y, Nason M, Doria-Rose N, Connors M, Kwong PD, Roederer M, Wyatt RT, Nabel GJ, Mascola JR. Rational design of envelope identifies broadly neutralizing human monoclonal antibodies to HIV-1 [J]. Science, 2010, 329(5993): 856-861.

