碱性木聚糖酶产酶菌株—芽胞杆菌M-26的选育
慕 娟,问清江,党 永,吴小杰,李叶昕
(陕西省微生物研究所,陕西西安 710043)
木聚糖是以木吡喃糖为单位的由β-1,4键连接的半纤维素,富含于阔叶树和大多数一年生植物体内,半纤维素在自然界中含量占生物量的30%,仅次于纤维素。木聚糖伴随纤维素存在于造纸工艺过程的纸浆中,对白度等纸张性能产生不良影响。传统的化学漂白法是采用含氯漂白剂,这会使造纸废水中含多种含氯化合物、二恶英和呋喃等剧毒物质。碱性木聚糖酶可以在碱性条件下降解木聚糖,将其用于纸浆生物漂白,可以减少化学药品的用量,从而减少了释放到环境中的有毒氯化物,有利于环境保护。要开发木聚糖酶制剂,首先要进行产酶菌株的选育,本研究从造纸企业的废水采集样品,选育出1株碱性木聚糖酶产酶菌株短小芽胞杆菌M-26,并对其酶学性质和产酶条件进行了初步研究,为进一步开发木聚糖酶制剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂 桦木木聚糖(brichwoodxylan),Sigma公司;3,5-二硝基水杨酸(DNS),化学纯;其他试剂为市售分析纯。
1.1.2 样品 西安市蔡伦造纸厂碱处理废水。
1.1.3 培养基(g/L) ①选择性培养基:蛋白胨10,牛肉膏3,NaCl 5,木聚糖8,琼脂20,pH 8.0;②LB培养基:蛋白胨10,酵母膏5,葡萄糖10,NaCl 5,pH 8.0;③基础产酶培养基:麸皮40,蛋白胨10,MgSO40.1,K2HPO44,pH 8.0。
1.2 方法
1.2.1 菌种初筛 量取50 mL水样置于300 mL三角瓶中煮沸5 min,静置沉降;吸取上清液用无菌水进行10-1~10-5梯度稀释,涂布于选择培养基平板,37℃培养24 h,选择生长状况良好的单菌落挑出,接入选择性培养基斜面培养,作为复筛菌种。
1.2.2 菌种复筛 ①刚果红透明圈染色法筛选:将初筛出的菌种在选择性培养基平板划线,37℃培养48 h;用0.1%的刚果红溶液染色1 h(覆盖整个平板),再用1 mol/L的NaCl溶液脱色1 h;菌落周围出现透明圈的则为木聚糖酶产生菌株,根据透明圈大小及透明圈直径与菌落直径之比大小来确定产酶能力强弱,从而选择产酶菌株;②摇瓶发酵筛选:将刚果红法筛选的菌株接种于LB培养基中,300 mL三角瓶装液量50 mL,37℃摇床培养24 h;以2%接种量接于基础产酶培养基中,37℃摇床培养48 h;将发酵液4 000 r/min离心15 min,取上清液检测木聚糖酶活力,根据活力大小作为筛选依据。
1.2.3 木聚糖酶活力测定 采用DNS法测定木聚糖酶活力。配制1 mg/mL木糖标准溶液,分别量取0.2、0.25、0.3、0.35、0.4 mL木聚糖标准溶液,用蒸馏水补齐1 mL,再加入2 mL DNS,沸水浴2 min,流水冷却后加蒸馏水至10 mL,在540 nm进行光吸收测定,绘制木糖标准曲线,得出回归方程用于酶活测定。发酵液经4 000 r/min离心15 min后取上清,即为粗酶液。将粗酶液经适当稀释后,取0.5 mL酶液加入0.5 mL 1%的木聚糖溶液,50℃准确反应10 min,加入2 mL DNS终止反应,煮沸2 min显色,然后流水冷却至室温,定容至10 mL,以蒸馏水为对照,540 nm测定吸光值,根据回归方程得出水解液中木糖含量,从而确定酶活。酶活单位定义:上述条件下,每分钟释放1μmol还原糖(以木糖计)所需要的酶量定义为1个酶活力单位( IU)。
1.2.4 16S rDNA菌种鉴定 挑取斜面于无菌水中,取10μL,于95℃裂解20 min;扩增体系为10 μL:模版0.5μL;10×buffer 1μL;dNTP 1μL;Pr imer(+)0.5μL;Primer(-)0.5μL;Taq酶0.5μL;H2O 6μL;PCR条件:94℃预变性5 min,94℃变性30 s,40℃退火30 s,72℃延伸1 min,共40个循环,最后72℃延伸10 min;将目的基因连接到T载体上,连接产物转化到感受态细胞中,涂布在含有氨苄青霉素、IPTG、X-gal的LB平板上,37℃培养24 h;挑取白色克隆,接种于含氨苄LB液体培养中,37℃过夜培养,提取质粒,PCR或酶切鉴定。将阳性克隆子送华大基因测序;将序列进行比对和聚类分析,并构建进化树。1.2.5 酶学性质分析 ①木聚糖酶反应的最适pH:用不同pH值的缓冲液适当稀释酶液,使酶反应在不同pH值条件下进行反应,测定酶活力;②木聚糖酶反应的最适温度:适当稀释酶液,分别在45、50、55、60、65℃温度条件下进行反应,测定酶活力;③pH对木聚糖酶稳定性的影响:分别用pH 7.6、8.0、8.6、9.0、9.6的缓冲液适当稀释酶液,4℃,放置24 h,测定其残余酶活力;④温度对木聚糖酶稳定性的影响:酶液分别在50、55、60、65、70℃下放置1 h,并每隔10 min取样,测定其残余酶活力。
2 结果与分析
2.1 刚果红法平板筛选
将选择培养基初筛菌株M-26在选择培养基平板划线,37℃培养48 h,用0.1%的刚果红溶液染色1 h(覆盖整个平板),再用1 mol/L的NaCl溶液脱色1 h,菌落周围有透明圈,测定菌落直径和透明圈直径,由透明圈的大小及两径比可以初步判断菌株的产酶能力,结果见表1。由表1可见,M-26平板上透明圈直径约20 mm,菌落直径约4 mm,两径比约5。这只是平板筛选对菌株产酶活力的粗略的衡量,M-26的产酶能力需要摇瓶进一步的定量确定。
2.2 基础产酶培养基液体发酵筛选
将M-26接种于LB培养基中,300 mL三角瓶装液量50 mL,37℃摇床培养24 h;以2%接种量接于基础产酶培养基中,37℃摇床培养48 h;将发酵液4 000 r/min离心15 min,取上清液检测木聚糖酶活力。进行数批次试验,结果见表2。M-26经过摇瓶筛选,基础培养基产酶活力可达420 IU/mL。

表1 M-26刚果红法平板选育结果Table 1 The congo-red flat breeding result ofM-26
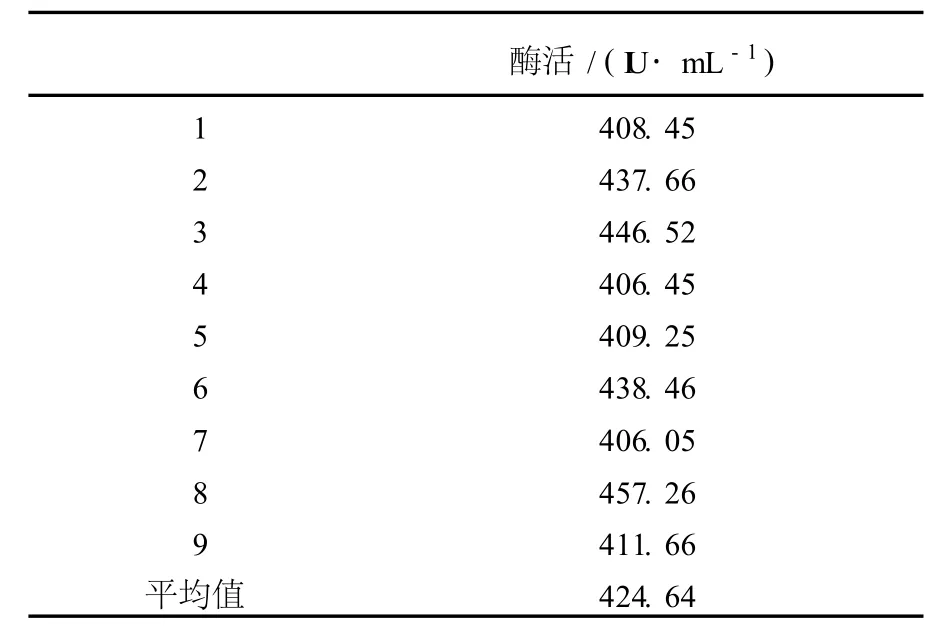
表2 M-26基础产酶培养基发酵选育结果Table 2 The basal medium fermentation breeding result ofM-26
2.3 M-26产木聚糖酶条件优化
对基础产酶培养基进行改良,碳源、氮源、无机盐条件试验。以麸皮(4%、5%、6%)、酵母膏(0.3%、0.5%、0.7%)、氯化铵(0.5%、0.7%、0.9%)、氯化钠(1、3、5 mmol/L)、氯化钙(3、5、7 mmol/L)、硫酸镁(1、3、5 mmol/L)进行6因素3水平的正交试验,结果见表3。从结果极差分析可知,A>B>E>C>D>F,最好的结果为A3B2C3D1E3F1。由于该结果不在表中之列,所以进行验证试验。将表中最高试验号7(A3B1C2D1E3F2)、8(A3B2C3D2E1F3)和A3B2C3D1E3F1进行比较,结果表明:8(A3B2C3D2E1F3)为最佳,产酶发酵培养基:麸皮6%,MgSO43 mmol/L,氯化钠3 mmol/L,氯化钙7 mmol/L,氯化铵0.9%,K2HPO40.4%,酵母膏0.3%,pH调节至8.0。

表3 正交实验结果Table 3 The result of orthogonal experiment
将M-26接种于LB培养基中,300 mL三角瓶装液量50 mL,37℃摇床培养24 h;以2%接种量接于产酶发酵培养基中,37℃摇床培养48 h;将发酵液4 000 r/min离心15 min,取上清液检测木聚糖酶活力。进行数批次试验,结果见表4。经过发酵条件优化后,M-26产酶活力可达625 IU/mL。
2.4 碱性木聚糖酶产酶菌株M-26的16S rDNA鉴定
利用通用引物从M-26染色体DNA中扩增出2.0 kb的rDNA基因片段(图1),将其克隆到pGEM-T Easy载体上,进行序列测定。M-26的16S rDNA基因序列与GenBank中的参考序列进行对比,查找出相关序列,用生物学聚类软件MEGA生成系统发育树(图2)。发现M-26的序列与Bacillus pum ilus具有极高的同源性,结合培养特征、形态特征和生理生化几方面特征,基本可以确定M-26为短小芽胞杆菌(Bacillus pum ilus)。

表4 M-26发酵条件研究结果Table 4 The fer mentation condition result ofM-26

图1 M-26 16S rDNA扩增产物Fig.1 PCR product of 16S r DNA

图2 根据16S rDNA部分基因序列构建的M-26的系统发育树Fig.2 Phylogenetic tree of strainM-26 and related strains based on 16S r DNA
2.5 木聚糖酶酶学性质分析
2.5.1 最适作用温度及温度稳定性 将粗酶液稀释一定的浓度,在不同温度条件下酶促反应,检测木聚糖酶活力,结果见图3。由图3可知,木聚糖酶的最适反应温度为55℃。将粗酶液在不同温度条件下,保温20 min,检测剩余木聚糖酶活力,未经处理酶活力为100,结果见图4。由图4可知,50℃处理剩余酶活达95%以上,55℃处理剩余酶活为80%,60℃处理剩余酶活70%,65℃和70℃剩余酶活均为10%。
2.5.2 最适作用pH及pH稳定性 用不同pH值的缓冲液适当稀释酶液,使酶反应在不同pH值条件下进行反应,测定酶活力,结果见图5。由图5可知,木聚糖酶的最适反应pH为8.0。将粗酶液用不同pH缓冲液适当稀释,4℃,放置24 h,测定其残余酶活力,结果见图6。
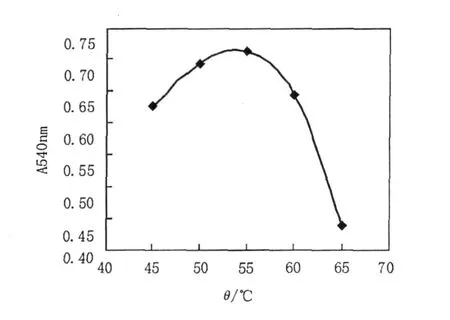
图3 木聚糖酶的最适温度Fig.3 Effect of temperature on the activity of xylanase

图4 木聚糖酶的温度稳定性Fig.4 Temperature stability of xylanase

图5 木聚糖酶的最适作用pHFig.5 Effect of pH on the activity of xylanase

图6 木聚糖酶的pH稳定性Fig.6 pH stability of xylanase
由图6可知,酶液于pH 8.0下,几乎没有酶活损失;在pH 8.6下的残余酶活力约50%;在pH 9.0下,残余酶活力约40%;pH 9.6下,残余酶活力不足10%。结果表明该木聚糖酶为碱性木聚糖酶,且具有一定的耐碱性。
3 讨 论
利用刚果红平板法从造纸企业纸浆碱处理废水中筛选到1株碱性木聚糖酶菌株M-26,对其进行培养特征、生理生化特征及16S r DNA序列分析,初步确定为短小芽胞杆菌。酶学性质研究表明,55℃的最适作用温度,pH 8.0的最适作用pH,一定的耐碱性为M-26所产碱性木聚糖酶的纸浆生物漂白应用提供了技术保障。进行液体发酵条件优化,使其最高产酶活力达到620 IU/mL,传统选育条件下,M-26产酶活力为国内最高水平。M-26发酵制成的酶制剂,酶活可达10 000 IU/g,经检测中无纤维素酶活力;碱性木聚糖酶制剂已进行了纸浆生物漂白条件试验,酶用量为20 IU/g绝干浆,在保证漂白工艺达标的情况下,氯用量可减少30%左右,M-26所产碱性木聚糖酶应用具有良好的前景。
[1] 曹要玲,白晓婷,刘辉,等.1株产碱性木聚糖酶的芽胞杆菌的分离鉴定及其相关研究[J].畜牧与兽医,2006,38(9):11-14.
[2] 江正强,邓伟,翟倩,等.链霉菌D21产木聚糖酶的发酵条件研究[J].林产化学与工业,2007,27(1):52-56.
[3] 税欣,郑连爽.产碱性木聚糖酶细菌的筛选及产酶条件的优化[J].环境科学与技术,2007,30(3):29-31.
[4] 包怡红,刘伟丰,毛爱军,等.耐碱性木聚糖酶产生菌的筛选、产酶条件优化及其在麦草浆生物漂白中的应用[J].农业生物技术学报,2005,13(2):235-240.
[5] Q.K.Berg,M.Kapoor,L.Mahajan,et al.Microbiol Xylanase and their industrial application:a review[J].App Microbio Biotechnol,2001,56:326-338.
[6] Elegir G,Szakacs G,Jeffries T W,et al.Purification,characterization and substrate specificities of multiple xylanases from Streptomyces sp.strain B-12-2[J].Appl Environ Microbiol,1994,60:2609-2615.

