大黄鱼鳍细胞系的建立及久效磷对其毒性作用的研究*
樊廷俊,孙 爱,杨秀霞,姜国建,徐晓辉,郭雪阳
(中国海洋大学海洋生命学院海洋生物系,山东青岛266003)
大黄鱼鳍细胞系的建立及久效磷对其毒性作用的研究*
樊廷俊,孙 爱,杨秀霞,姜国建,徐晓辉,郭雪阳
(中国海洋大学海洋生命学院海洋生物系,山东青岛266003)
为了建立大黄鱼(Pseudosciaena crocea)鳍细胞系,为其细胞毒理学、病毒学与细胞工程等研究奠定基础,本文采用酶消化法使用含有20%胎牛血清(FBS)的DM EM/F12、Leibovitz L-15和DM EM培养液(p H7.2)在22~28℃分别启动了大黄鱼鳍组织的体外培养,通过添加促细胞贴壁和分裂的物质在最适培养条件下对大黄鱼鳍细胞进行了原代培养和继代培养,并研究了久效磷对大黄鱼细胞系鳍细胞的毒性作用。体外培养结果显示,大黄鱼鳍细胞的最适培养液为20%FBS-DM EM/F12,最适培养温度为25℃,体外培养鳍细胞的形态主要为成纤维细胞样,22 d后便可形成汇合细胞单层,经过连续继代培养成功建立了大黄鱼的连续性鳍细胞系,目前已传至第112代;对第60代大黄鱼鳍细胞系细胞的鉴定结果显示,其群体倍增时间为50.96 h,分裂状态十分旺盛,虽然出现了染色体的非整倍性,但其特征性染色体数目仍为48条,并具有正常的6m+6sm+36t二倍体核型,证明所建立的细胞系确为大黄鱼鳍细胞系。不同浓度久效磷处理的检测结果显示,大黄鱼鳍细胞对久效磷敏感,20~160μg/mL久效磷可引起鳍细胞乙酰胆碱酯酶活性的持续性显著降低,引起超氧化物歧化酶和谷胱甘肽-S-转移酶活性的显著升高并随着浓度的升高而逐渐降低,久效磷对该细胞系细胞的48 h半抑制浓度(IC50)为43.05μg/mL,证实久效磷对大黄鱼鳍细胞具有显著的毒性作用。
大黄鱼;鳍细胞;细胞系;久效磷;毒性作用
近年来,海洋环境污染日益严重,给海水养殖业造成了巨大的经济损失[1]。在众多污染物中,作为当今各种农作物病害防治中使用最广谱的有机磷农药对海水的污染日益严重,给各种海洋生物甚至人类健康带来了严重威胁[2-3]。鱼类是海水养殖业的主要养殖种类,也是海水污染监测中研究与应用最广泛的种类之一[4-5]。鱼类细胞系细胞由于具有平行性、均一性好、无个体差异且能够直接、快速、不受其它环境因素影响地真实反映环境污染物的毒性效应,因此鱼类细胞系逐渐发展成为环境污染物检测的一种公认技术,在污染物毒性检测和毒理学研究中发挥着越来越重要的作用[3]。此外,鱼类细胞系还是鱼类环境毒理学、病毒学、细胞生物学、免疫学、遗传学和肿瘤学等的理想的体外研究体系,因此急需建立多种海水鱼类的细胞系[3]。目前已建立的海水鱼类细胞系数量较少,且主要来源于牙鲆[6]、大菱鲆[7-8]、鲈鱼[9]、真鲷[10]、石斑鱼[11-14]等几种经济鱼类。
大黄鱼(Pseudosciaena crocea)隶属于硬骨鱼纲、鲈形目、石首鱼科、黄鱼属,是我国重要的海水养殖品种之一,也面临环境污染、种质退化等严重影响,急需建立其组织细胞系,开展环境污染检测和细胞工程育种等研究,但遗憾的是,至今仍未有成功建立大黄鱼组织细胞系以及有机磷农药对其毒性作用的研究报道。本文旨在建立大黄鱼鳍细胞系,并以其为体外实验体系研究久效磷对鳍细胞的毒性作用,为海水污染物毒性检测、环境毒理学、病毒学、免疫学、细胞工程育种等奠定基础。
1 材料和方法
1.1 材料和试剂
大黄鱼(P.crocea),体质量约500 g,购自青岛市南山水产品市场。
胰蛋白酶、DM EM/F12、L-15、DM EM培养基均为Gibco公司产品;透明质酸酶和Ⅱ型胶原酶为Solarbio公司产品;硫酸软骨素为BB I公司产品;碱性成纤维样生长因子(bFGF)和I型胰岛素样生长因子(IGF-I)为Pep rotech公司产品;胎牛血清(FBS)为Hyclone公司产品;秋水仙素为Fluka公司产品;羧甲基壳寡糖为中国海洋大学海洋生命学院生物化学实验室提供。四甲基偶氮唑盐(M TT)为Sigma公司产品;久效磷(Monocro tophos)由中国海洋大学海洋生命学院环境毒理学实验室友情提供;乙酰胆碱酯酶(ACh E,EC3.1.1.7)检测试剂盒、超氧化物歧化酶(SOD,ECA 001)检测试剂盒和谷胱甘肽-S-转移酶(GST,EC2.5.1.18)检测试剂盒均购自南京建成生物工程研究所。
1.2 大黄鱼鳍组织细胞原代培养的启动及其最适培养基、培养温度的筛选
鲜活大黄鱼于20~22℃高双抗消毒海水(1 000 IU/m L青霉素,1 000μg/m L链霉素)中暂养24 h后无菌取出其鳍组织,用磷酸缓冲液(PBS)漂洗2遍后浸入75%酒精中浸泡1 min,经PBS漂洗2次后置5%FBS-DMEM/F12培养液中剪成约1 mm3碎块,用0.5%透明质酸酶和0.2%Ⅱ型胶原酶联合消化45 m in后离心(1 000 r/min,10 min)收集沉淀,用5%FBSDM EM/F12培养液充分悬浮后均匀接种于25 cm2培养瓶中,正置干贴16 h后,分别加入含有20%FBS的DM EM/F12、Leibovitz L-15和DM EM培养液(p H=7.2),分别置22、25和28℃启动原代培养,观察鳍组织块中细胞的迁出、贴壁及生长分裂情况,筛选出最适培养基和最适培养温度。
1.3 大黄鱼鳍细胞的原代培养与继代培养
对干贴处理后的鳍组织块,通过向含20%FBS的最适培养液中添加100μg/mL羧甲基壳寡糖、40μg/mL硫酸软骨素、10 ng/m L bFGF和40 ng/m L IGF-I,在最适培养温度下启动大黄鱼鳍细胞的原代培养。待细胞形成汇合细胞单层后,按照樊廷俊等[8]的方法进行继代培养,每隔3~5 d更换培养液。当细胞传至第15代以后,培养液中停止添加羧甲基壳寡糖、硫酸软骨素、bFGF和IGF-I。
1.4 大黄鱼鳍细胞系的生长特性分析
按照樊廷俊等[8]的方法进行。取第60代对数期大黄鱼鳍细胞,按1.26×105细胞/孔的量将细胞接种于24孔培养板中,每隔12 h取出3孔细胞分别进行细胞计数,绘制细胞生长曲线,计算群体倍增时间。
1.5 大黄鱼鳍细胞系的染色体分析
染色体标本的制作按照樊廷俊等[8]的方法进行。取第60代对数期鳍细胞,加入终浓度为20μg/mL的秋水仙素处理10 h,按上述方法悬浮并收集细胞,经低渗、固定、滴片、干燥后,进行Giem sa染色,所得染色体标本置显微镜下观察,对至少300个中期染色体进行计数,并按Leven等(1964)的标准进行核型分析。
1.6 大黄鱼鳍细胞系细胞的久效磷处理
取第62代大黄鱼鳍细胞,按上述方法悬浮并收集细胞,细胞计数后将细胞密度调整为1×105/m L,按200μL/孔的量接种于2块96孔板中,置25℃、5%CO2培养箱中培养24 h后,向每个培养孔中加入终浓度分别为5、10、20、40、80和160μg/m L的久效磷溶液(每个浓度设10个平行孔),于CO2培养箱中继续培养24、48、72、96和120 h后,分别取出10个孔的细胞进行毒性检测。分别以不加久效磷的10个平行孔作为阴性对照孔。
1.7 久效磷对大黄鱼鳍细胞系细胞毒性作用的M TT检测
不同浓度久效磷处理鳍细胞48 h后,分别于实验孔和对照孔中按照20μL/孔的量加入5 mg/m L M TT使用液,置25℃继续培养4 h后,轻轻吸出孔中培养液,用PBS轻轻漂洗1次后按照150μL/孔的量加入DM SO溶液,低速震荡10 min后用酶标仪测定490 nm光吸收值(A490)。每个浓度设10个平行孔,按照公式“抑制率=(1-实验组平均OD值/对照组平均OD值)×100%”计算久效磷对细胞的抑制率,用Logit法计算久效磷对细胞的半抑制浓度(IC50)。
1.8 久效磷对大黄鱼鳍细胞系细胞AChE、SOD和GST酶活性的影响
取第65代对数期大黄鱼鳍细胞接种于6孔细胞培养板孔中,分别加入终浓度为20、40、80和160μg/mL的久效磷溶液(每个浓度设3个平行孔),AChE、SOD和GST实验组分别置25℃培养2、2和24 h后分别收集各孔中的细胞,1 000 r/min离心10 min收集细胞沉淀,用PBS重新悬浮后置冰浴中超声波破碎细胞(400A,2 m in),6 000 r/min、4℃离心10 m in收集上清液,分别按照试剂盒操作指南测定AChE、SOD和GST的酶活性,反应液总体积为300μL。ACh E的酶活性以每毫克蛋白37℃保温6 min的反应液中含有1 μmol基质定义为1个酶活力单位(U);SOD的酶活性以每毫克组织蛋白在1 m L反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U);GST的酶活性以每毫克蛋白在37℃反应1 m in使反应液中GSH浓度降低1μmol/L为1个酶活力单位(U)。分别以不加久效磷的3个平行孔为阴性对照。
1.9 数据统计分析
用SPSS 15.0软件分析处理数据。使用t-test进行组间显著性差异分析,实验结果用“平均值±标准误”表示,P<0.05表示显著差异,P<0.01表示极显著差异。
2 结果
2.1 大黄鱼鳍细胞的最适培养基
经透明质酸酶和Ⅱ型胶原酶联合消化后的大黄鱼鳍组织块,在20%FBS-DM EM/F12培养液中启动原代培养7 d后其周围有大量细胞迁出,迁出细胞占瓶底面积的15%以上,且生长分裂速度较快;而在L-15和DM EM培养液中培养的组织块周围细胞迁出的数量较少,迁出细胞占瓶底面积的10%以下,且生长分裂速度较慢(见表1)。可见,20%FBS-DM EM/F12培养液(p H=7.2)更适于大黄鱼鳍细胞的体外培养,即DM EM/F12培养基是大黄鱼鳍细胞的最适培养基。

表1 在不同培养液中培养7 d后大黄鱼鳍组织迁出细胞的数目Table 1 The number of cellsmigrated from fin tissues of large yellow croaker 7 d after cultured in different media
2.2 大黄鱼鳍细胞的最适培养温度
在20%FBS-DM EM/F12培养液中的培养结果显示,大黄鱼鳍组织在25℃培养7 d后其周围迁出细胞的数量最多,细胞生长分裂速度快;而在22℃和28℃培养的组织块周围细胞迁出的数量较少,且生长分裂速度较慢(见表2)。可见,25℃最适于大黄鱼鳍细胞的体外培养,即25℃是大黄鱼鳍细胞的最适培养温度。
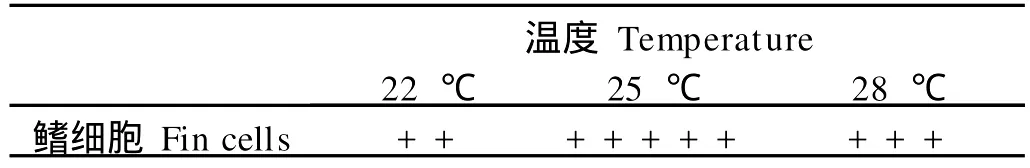
表2 在不同温度下培养7 d后大黄鱼鳍组织迁出细胞的数目Table 2 The number of cellsmigrated from fin tissues of large yellow croaker 7 d after cultured at different temperatures
2.3 大黄鱼鳍细胞的继代培养和细胞系的建立
使用添加有羧甲基壳寡糖、硫酸软骨素、bFGF和IGF I的20%FBS-DM EM/F12培养液于25℃培养的大黄鱼鳍组织,在第3天开始有细胞迁出,细胞为成纤维细胞样,均质透明,生长分裂旺盛(见图1a);到第22 d便可形成汇合的细胞单层(见图1b);在继代培养中5~6 d便可传代1次,大黄鱼鳍细胞现已传至第110代(见图1c)。目前,细胞的生长与分裂状况依然良好,已成功建立了连续性大黄鱼鳍细胞系。
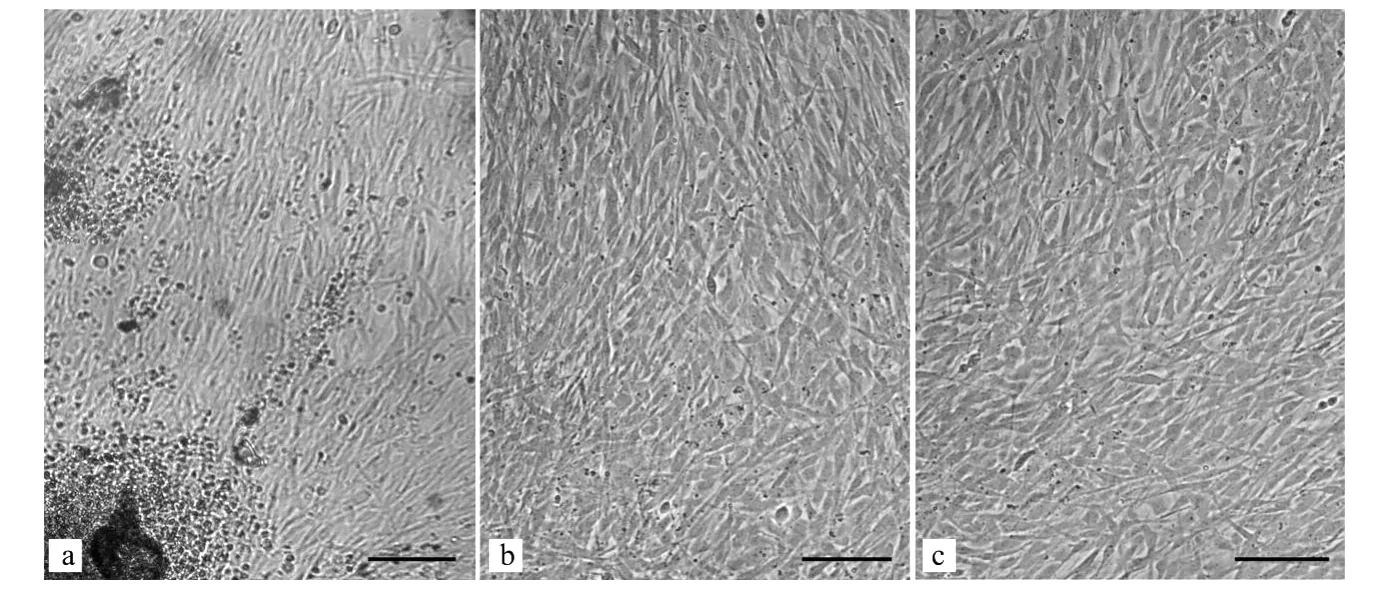
图1 体外培养的大黄鱼鳍细胞Fig.1 In vitro cultured large yellow croaker fin cells
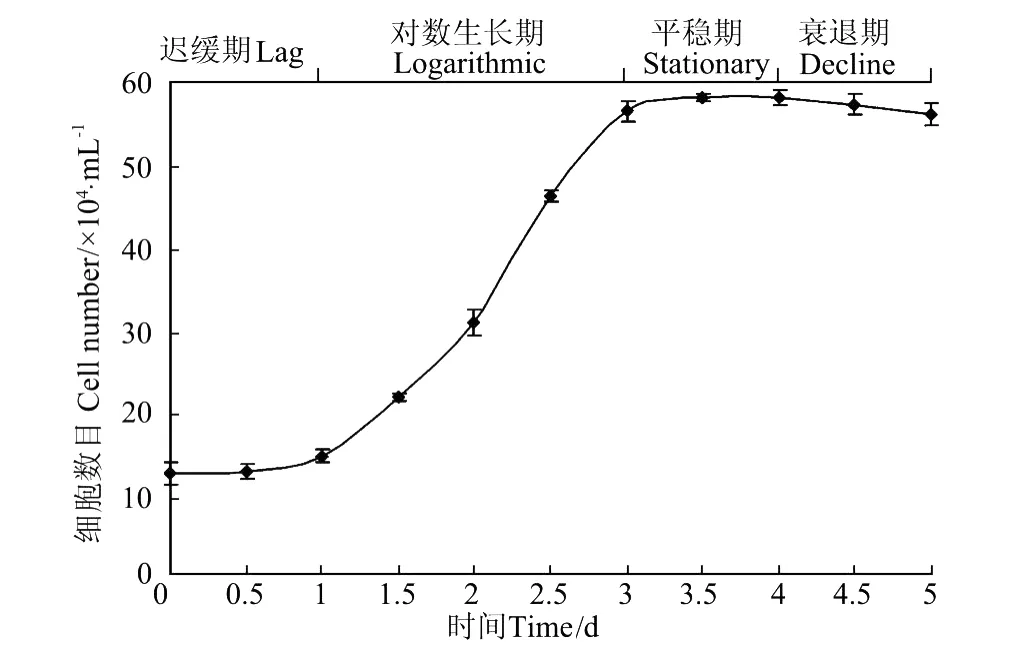
图2 第60代大黄鱼鳍细胞的生长曲线Fig.2 The grow th curve of passage 60 fin cells from large yellow croaker
2.4 大黄鱼鳍细胞的生长特性
第60代大黄鱼鳍细胞的生长曲线如图2所示。细胞生长分裂的前1 d为迟缓期,1~3 d为对数期,3~4 d为平台期,4 d后进入衰退期,大约5 d即可完成一个生长周期。经计算,第60代鳍细胞的群体倍增时间为50.96 h,表明其生长分裂状态十分旺盛。
2.5 大黄鱼鳍细胞系的染色体分析
对第60代大黄鱼鳍细胞系细胞的染色体计数结果显示,虽然该细胞系细胞出现了染色体数目的非整倍性,染色体数目分布在24~64条之间,但其特征性染色体数目仍为48条,约占细胞总数的59%(见图3)。核型分析结果显示,24对染色体中有3对中央着丝粒染色体(m)、3对亚中央着丝粒染色体(sm)和18对端部着丝粒染色体(t),具有典型的大黄鱼二倍体核型特征(6m+6sm+36t,NF=60)。
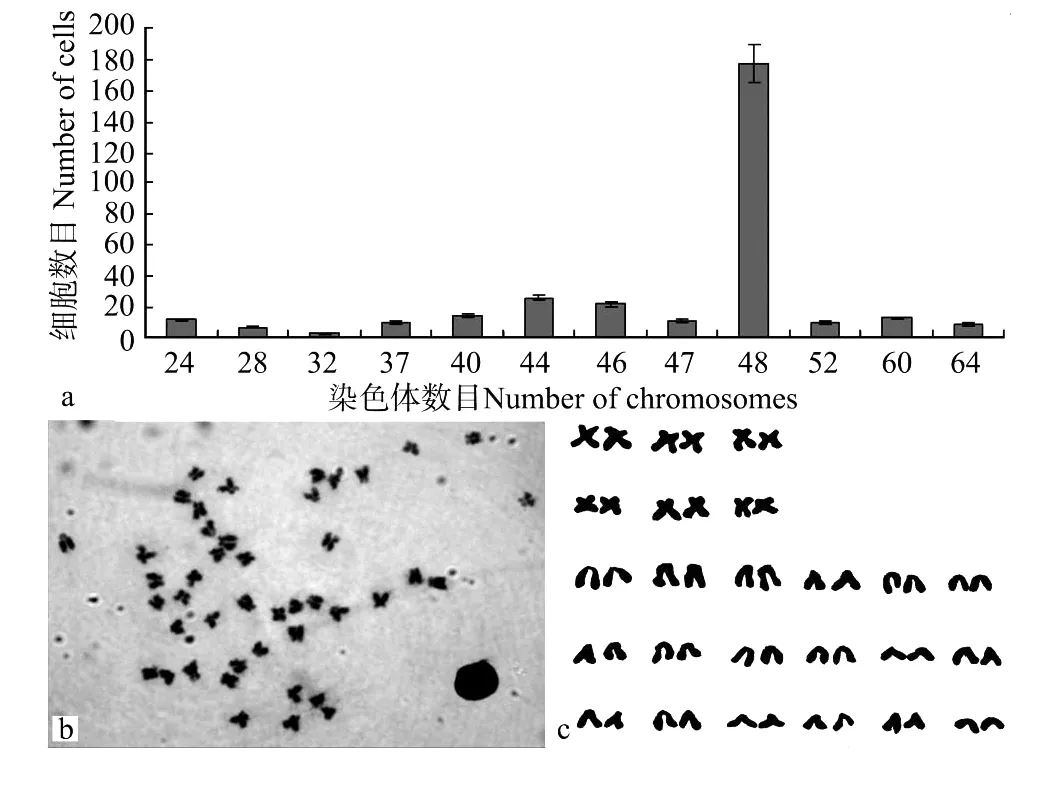
图3 第60代大黄鱼鳍细胞系细胞的染色体Fig.3 Chromosomes of passage 60 fin cells from large yellow croaker
2.6 久效磷对大黄鱼鳍细胞系细胞的毒性作用
M TT检测结果显示,5μg/m L久效磷即可对鳍细胞表现出显著的毒性作用,且在5~160μg/m L的范围内表现出明显的浓度依赖性(见图4)。据剂量-效应曲线计算,久效磷对大黄鱼鳍细胞系细胞48 h的半数抑制浓度分别为43.05μg/m L。
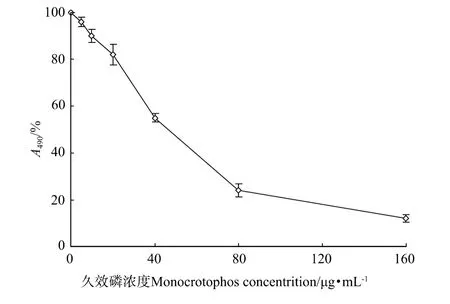
图4 不同浓度久效磷对大黄鱼鳍细胞系细胞毒性作用的M TT检测Fig.4 Cytotoxic effect of monocro tophos to large yellow croaker fin cells by M TT method
不同浓度久效磷处理大黄鱼鳍细胞系细胞的光镜观察结果显示,48 h内鳍细胞在形态上与对照(见图5a)相比没有显著差异。72 h后,160μg/mL久效磷处理的鳍细胞首先出现伸长和空泡化,相邻细胞聚集成片,变圆脱落等现象(见图5b);96 h后,20~160μg/m L久效磷处理的细胞均出现细胞大面积死亡并脱落的现象(见图5c)。120 h后,5~10μg/m L久效磷处理的鳍细胞才开始变圆脱落并死亡。
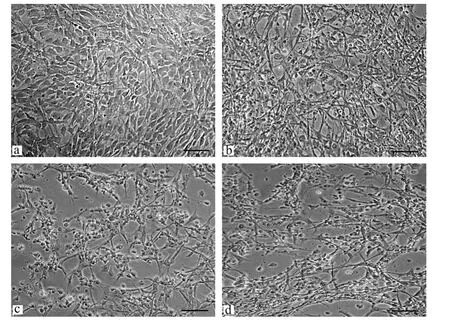
图5 不同浓度久效磷处理的大黄鱼鳍细胞的形态变化Fig.5 Morphological changes of large yellow croaker fin cells treated by monocrotophos
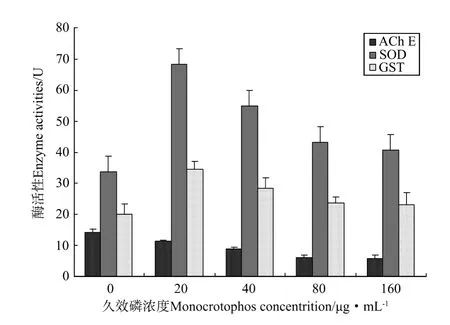
图6 不同浓度久效磷处理大黄鱼鳍细胞的AChE、SOD和GST酶活性Fig.6 Enzymatic activities of AChE,SOD and GST in fin cells treated with different concentration of monocrotophos
2.7 久效磷对大黄鱼鳍细胞系细胞AChE、SOD和GST活性的影响
不同浓度久效磷处理后大黄鱼鳍细胞系细胞酶活性的变化结果见图6。20~160μg/mL久效磷处理2 h鳍细胞的AChE活性显著降低(P<0.05),并具有浓度依赖性;20μg/m L久效磷处理2 h可引起鳍细胞SOD酶活性的极显著升高(P<0.01),随着久效磷浓度的继续升高酶活性便逐渐降低;而20μg/m L久效磷处理24 h可引起鳍细胞GST酶活性的极显著升高(P<0.01),随着久效磷浓度的继续升高酶活性又逐渐降低。
3 讨论
随着有机磷农药在农业生产中的广泛使用,有机磷农药对海洋环境污染日益严重,给我国海水养殖业造成了重大的损失[1-2]。而鱼类细胞系在细胞毒理学及其环境污染物检测研究中发挥着越来越重要的作用[3]。本文旨在建立大黄鱼鳍细胞系,并以此体外实验体系研究有机磷农药对该细胞系细胞的毒性作用。
为了建立大黄鱼组织细胞系,本文利用大黄鱼鳍组织进行了体外培养与建系研究。由于透明质酸酶和Ⅱ型胶原酶为特异性消化酶,能专一性降解鳍组织细胞外基质中的透明质酸和胶原蛋白,可达到使组织疏松有利于细胞迁出的目的,因此许多鱼类细胞原代培养的启动均采用了这2种酶联合消化组织块的方法[8,15-16]。本文为了成功启动大黄鱼鳍组织细胞的原代培养,也采用鳍组织碎块的透明质酸酶和Ⅱ型胶原酶联合消化法。体外培养结果显示,酶消化后的组织碎块迁出细胞的速度快且迁出细胞的数量较多,是本文能成功启动大黄鱼鳍细胞原代培养的关键。该结果与前人对大菱鲆鳍[8]、褐点石斑鱼鳍[15-16]、褐点石斑鱼脾脏[11]等组织细胞的酶消化法相似。
为了确定大黄鱼鳍细胞的最适培养液和最适培养温度,本文将大黄鱼鳍细胞分别用DM EM、DM EM/F12和L-15培养液在22,25和28℃下进行了培养,发现其最适培养液为含有20%FBS的DM EM/F12(p H=7.2),最适培养温度为25℃。本文关于DM EM/F12为大黄鱼鳍细胞最适培养液的结果,与魏云波等[15]对褐点石斑鱼鳍细胞系及Imajoh等[17]对真鲷细胞系的研究报道一致,而不同于其它海水鱼细胞系最适培养液为L-15培养液的研究报道[10-13,18];关于大黄鱼鳍细胞最适培养温度为25℃的结果,与斜带石斑鱼脑组织细胞[12]、罗非鱼神经前体细胞[19]及赤点石斑鱼吻端细胞[13]的最适培养温度相同,而略高于褐点石斑鱼鳍细胞[17]的最适培养温度(24℃),低于斜带石斑鱼眼组织细胞[20]的最适培养温度(28℃)。上述不同鱼类细胞在最适培养液和最适培养温度方面的差异,很可能与不同鱼类的生存环境以及组织细胞种类的不同有关[8,15]。为了促进大黄鱼鳍细胞的贴壁、生长与分裂,本文在最适培养液中还添加了羧甲基壳寡糖、硫酸软骨素、bFGF和IGF-I,发现这些添加物能有效促进大黄鱼鳍细胞的贴壁、生长与分裂,在此条件下启动原代培养的鳍细胞生长分裂旺盛,22 d便可形成汇合的细胞单层,经过连续继代培养已成功建立了大黄鱼连续性鳍细胞系,目前已传至第112代。上述添加物可有效促进细胞贴壁、生长与分裂的结果,与在大菱鲆鳍细胞系[8]、褐点石斑鱼鳍细胞系[17]和真鲷胚胎干细胞系[9]中的研究报道是相似的。
第60代鳍细胞系的生长特性鉴定结果显示,细胞的群体倍增时间为50.96 h,表明其分裂活性十分旺盛。该群体倍增时间与褐点石斑鱼鳍细胞系相似[19],高于金头鲷鳍细胞系[20],低于大菱鲆鳍细胞系[8]。核型分析结果显示,该细胞系细胞虽然部分出现了染色体的非整倍性,但其特征性染色体数目仍为48条,并具有正常的6m+6sm+36t二倍体核型,与前人对大黄鱼核型的研究报道是一致的[21],证明本文所建立的细胞系确为大黄鱼鳍细胞系。
为了利用大黄鱼鳍细胞系建立有机磷农药的体外毒性检测及其监控体系,本文利用M TT与酶活性检测方法研究了久效磷对大黄鱼鳍细胞的毒性作用。光镜观察及M TT测定的结果显示,经久效磷处理后的大黄鱼鳍细胞出现了明显的细胞伸长、空泡化、聚集成片最终变圆脱落与死亡的现象,5~160μg/mL久效磷对大黄鳍细胞均具有显著的细胞毒性。该结果与其他学者对牙鲆鳃细胞系(FG)[22-23]以及活鱼个体水平的研究结果相似[25-26]。酶活性检测结果显示,20~160 μg/m L久效磷处理可浓度依赖性地引起鳍细胞AChE活性的显著降低,可能与久效磷这种磷酸酯类农药不经转化可直接抑制AChE的活性有关[23-26]。20μg/mL久效磷首先引起SOD酶活性显著升高、随后又浓度依赖性地引起酶活性降低的结果,与魏云波[15]对褐点石斑鱼鳔细胞系SOD活性影响和白洁等[26]对中国对虾体内SOD活性的影响研究报道相似。出现该结果的原因可能是鳍细胞可通过自身抗氧化系统清除掉低浓度久效磷产生的活性氧,但其抗氧化系统易被高浓度久效磷损伤,严重时甚至会造成细胞死亡,故其SOD酶活力会随着久效磷浓度的升高而逐渐降低。20μg/m L久效磷首先引起GST酶活性显著升高、随后又浓度依赖性地引起酶活性降低的结果,与魏云波[15]和陈荣等[27]研究结果相似。可见,久效磷对大黄鱼鳍细胞有显著的毒性作用,并能引起细胞AChE、SOD和GST活性的显著变化,暗示大黄鱼鳍细胞有望作为对久效磷敏感的体外检测体系,而AChE、SOD和GST有望作为有机磷农药的生物检测指标。
综上所述,本文成功建立了大黄鱼连续性鳍细胞系,并初步研究了久效磷对该细胞系细胞的毒性作用,不仅为有机磷农药的检测及细胞毒性机理研究奠定了基础,而且对于大黄鱼种质资源保存、病毒疫苗制备、转基因新品种的培育等均具有重要的理论意义和实际应用价值。
[1] 张福绥.近现代中国水产养殖业发展回顾与展望[J].世界科技研究与发展,2003,25(3):5-13.
[2] 杨先乐.有机磷农药对水生生物毒性影响的研究进展[J].上海水产大学学报,2002,11(4):378-382.
[3] Villena A J.Applications and needs of fish and shellfish cell culture for disease control[J].Review s in fish biology and Fisheries,2003,13:111-140.
[4] 孙扬,李永峰,韩博.水污染生物监测现状[J].上海工程技术大学学报,2008,2(2):0152-0156.
[5] 黄玉平,张庆国,吴朝.生物监测及其在水环境污染防治中的应用进展[J].安徽农学通报,2009,15(8):038-041.
[6] Chen SL,Ren GC,Sha Z X,et al.Establishment of a continuous embryonic cell line from Japanese flounder Paralichthys olivaceus for virus isolation[J].Dis Aquat Org,2004,60:241-246.
[7] Chen SL,Ren G C,Sha Z X,et al.Development and characterization of a continuous embryonic cell line from turbot(Scophthalmus maximus)[J].Aquaculture,2005,249:63-68.
[8] 樊廷俊,耿晓芬,丛日山,等.大菱鲆鳍细胞系的建立[J].中国海洋大学学报:自然科学版,2007,37(5):759-766.
[9] Chen S L,Sha Z X,Ye H Q,et al.Pluripotency and chimera competence of an embryonic stem cell line from the sea perch(Lateolabrax japonicus)[J].Mar Biotechnol(N Y),2007,9(1):82-91.
[10] Imajoh M,Ikaw a T,Oshima S.Characterization of a new fibroblast cell line from a tail fin of red sea bream,Pagrusmajor,and phylogenetic relationships of a recent RSIV isolate in Japan[J].Virus Res,2007,126(1-2):45-52.
[11] Qin Q W,Wu T H,Jia T L,et al.Development and characterization of a new tropicalmarine fish cell line from grouper,Epinephelus coioides susceptible to iridovirus and nodavirus[J].J Virol Methods,2006,131(1):58-64.
[12] Wen C M,Lee C W,Wang C S,et al.Development of two cell lines from Epinephelus coioides brain tissue for characterization of betanodavirus and megalocytivirus infectivity and propagation[J].Aquaculture,2008,278:14 21
[13] Lai Y S,John J A,Lin C H,et al.Establishment of cell lines from a tropical grouper,Epinephelus aw oara(Temminck&Schlegel),and their susceptibility to grouper irido- and nodaviruses[J].J Fish Dis,2003,26(1):31-42.
[14] Zhou G Z,Li ZQ,Yuan X P,et al.Establishment,characterization,and virus susceptibility of a new marine cell line from red spotted grouper(Epinephelus akaara)[J].Mar Biotechnol(NY),2007,9(3):370-376.
[15] 魏云波.褐点石斑鱼(Epinephelus fuscoguttatus)三种细胞系的建立及其在鱼类病毒和环境污染物检测中的初步应用.[D].青岛:中国海洋大学,2009.
[16] Wei Y B,Fan T J,Juo G J,et al.Establishment of a novel fin cell line from brow n-marbled grouper,Epinephelus fuscoguttatus(forssk…l),and evaluation of its viral susceptibility[J].Aquaculture Research,2009,40(13):1523-1531.
[17] Imajoh M,Ikawa T,Oshima S.Characterization of a new fibroblast cell line from a tail fin of red sea bream,Pagrusmajor,and phylogenetic relationshipsof a recent RSIV isolate in Japan[J].Virus Res,2007,126(1-2):45-52.
[18] Huang X H,Huang Y H,Sun JJ,et al.Characterization of two grouper Epinephelus akaara cell lines:Application to studies of Singapore grouper iridovirus(SGIV)propagation and virus-host interaction[J].Aquaculture,2009,292:172-179.
[19] Wen Ch M,Cheng Y H,Huang Y F,et al.Isolation and characterization of a neural progenitor cell line from tilapia brain[J].Comparative Biochemistry and Physiology,Part A 2008,11(5):167-180.
[20] Bejar J,Borrego J J,Alvarez M C.A continuous cell line from the cultured marine fish gilt-head seabream(Sparus aurata L.)[J].Aquaculture,1997,150:143-153.
[21] 王德祥,苏永全,王世锋.不同地理种群大黄鱼染色体核型的比较研究[J].海洋学报,2006,28(16):0176-0179.
[22] Li H Y,Zhang S C.In vitro cytotoxicity of the organophosphorus pesticide parathion to FG-9307 cells[J].Toxicology in vitro,2001,15:643-647.
[23] 朱丽岩.几种环境内分泌干扰物对青岛近海常见海洋动物的毒性效应:[D].青岛:中国海洋大学,2005.
[24] 魏渲辉,汝少国,姜明,等.有机磷农药对鱼类的毒性效应及内分泌扰乱作用[J].海洋科学,2002,26(9):27-31.
[25] 闫建国,汝少国,王蔚.久效磷对黄鳝乙酰胆碱酯酶、羧酸酯酶和磷酸酶活性的影响[J].安全与环境学报,2006,6(3):61-63.
[26] 白洁,李岿然,唐学玺,等.久效磷对中国对虾体内SOD活力影响的初步研究[J].海洋通报,1998,17(4):41-45.
[27] 陈荣,刘辉,李东晓,等.水生动物谷胱甘肽硫转移酶研究进展[J].厦门大学学报:自然科学版,2006,42(2):176-184.
Establishment and Identification of a Continuous Fin Cell Line from Large Yellow Croaker,Pseudosciaena crocea and Cytotoxic Effects of Monocrotophos to the Fin Cells
FAN Ting-Jun,SUN Ai,YANG Xiu-Xia,JIANG Guo-Jian,XU Xiao-Hui,GUO Xue-Yang
(Department of Marine Biology,College of M arine Life Sciences,Ocean University of China,Qingdao 266003,China)
For laying a solid foundation for cellular toxicology,virology and cell engineering studies,this article is about establishment and identification of large yellow croaker fin cell line and study of cytotoxic effects of monocrotophos to the fin cells.The fin tissues,digested with hyaluronidase and collagenase II,were cultured in three kinds of media(p H 7.2)at different temperatures supp lemented with 20%fetal bovine serum,carboxymethyl-chitooligosaccharide,chondroitinsulfate,basic fibroblast grow th factor and insulin-like grow th facto r-I to initiate the p rimary culture and subculture.The culture in vitro show ed that the op timum medium and temperature were Dulbecco’s modified Eagle medium/F12 medium(DM EM/F12)and 25℃respectively,and the fibroblastic fin cells grew steadily and fo rmed monolayer 22 days later.The large yellow croaker fin cell line has been sucessfully established and subcultured to passage 112 now.The fin cells at passage 60 had a population doubling time of 50.96 h,indicating that the cells still proliferated actively.Karyotype analysis showed that the cells exhibited chromosomal aneup loidy but had a modal diploid chromosome num ber of 48 with 3 pairs of metacentrics,3 pairs of submetacentrics and 18 pairs of telocentrics.In the monocrotophos treated cells from 20 to 160μg/m L,results show ed that the activities of acetylcholinesterase(AChE)reduced sustainingly and significantly,the activities of superoxide dismutase(SOD)and glutathione S-transferase(GST)increased significantly but later reduced along with increased concentration of monocrotophos and the 48 h-IC50values of monocrotophos to yellow croaker fin cellswere 43.05μg/m L.Results showed thatmonocrotophos have significantly cytotoxic effect to large yellow croaker fin cells.The established continuous large yellow croaker fin cell line has theoretical significance and p ractical value for laying a foundation to detect the organophosphorus pesticide and seting up a rapid effective bioassay system,and studing of cellular toxicology,virology and cell engineering as an ideal in vitro research system.
large yellow croaker;fin cells;cell line;monocrotophos;cytotoxic effect
Q813.1+1
A
1672-5174(2010)12-064-07
国家高技术研究发展计划项目(2006AA 10A 401;2006AA 09Z406)资助
2010-4-28;
2010-06-01
樊廷俊(1964-),男,理学博士,教授,博导,主要研究方向为动物细胞工程与细胞分化。Tel:0532-82031637;E-mail:tjfan@ouc.edu.cn
责任编辑 于 卫

