Li/Fe摩尔比和表面活性剂浓度对水热合成α 2LiFeO2的影响
步明升,毕彩丰,侯 进,范玉华,王 丽
(中国海洋大学1.海洋化学理论与工程技术教育部重点实验室;2.化学化工学院,山东青岛266100)
Li/Fe摩尔比和表面活性剂浓度对水热合成α 2LiFeO2的影响
步明升1,2,毕彩丰1,2,侯 进1,2,范玉华1,2,王 丽1,2
(中国海洋大学1.海洋化学理论与工程技术教育部重点实验室;2.化学化工学院,山东青岛266100)
以α 2FeOOH、LiOH·H2O、十六烷基三甲基溴化铵(CTAB)和十二烷基苯磺酸钠(SDBS)为原料,采用水热法合成了α 2LiFeO2粉体,利用X射线衍射仪(XRD)、冷场发射扫描电子显微镜(SEM)对粉体的物相和微观形貌进行了表征,研究了不同Li/Fe摩尔比及CTAB浓度对α 2LiFeO2物相形成和微观形貌的影响。结果表明:当Li/Fe摩尔比为30∶1,反应温度为210℃,反应时间为6 h时,可得到纯相α 2LiFeO2,随着Li/Fe摩尔比的减少,有杂相α 2Fe2O3和Li0.5Fe2.5O4生成;表面活性剂CTAB和SDBS对水热合成α 2LiFeO2的物相组成没有影响,但对其微观形貌的影响较大。其中,CTAB主要起到了控制粉体粒径大小的作用,而SDBS除了降低粉体粒径外,还影响到了粉体的微观形貌。随着体系SDBS浓度的增大,粉体经历了多面体、层状和类球形3种形貌,并且平均尺寸降至0.3μm左右。
α 2LiFeO2;锂离子电池;水热合成;表面活性剂
自锂离子电池商品化以来,正极材料始终是其能量密度提升和成本降低的关键因素。作为目前最广泛应用于商业化的正极材料,也是目前研究最为深入的正极材料,LiCoO2具有开路电压高、循环寿命长、放电平稳、循环性能好等优点。由于Co资源有限,价格昂贵,而且Co有毒,对环境有污染,因此,人们正在努力研究开发其它价格低廉、环境友好而且性能优良的正极材料,期望能够早日取代或降低目前商业上LiCoO2材料的使用量[1,2]。而α 2LiFeO2由于具备安全、环保、廉价等多种优势而成为近期研究的热点之一,α 2 LiFeO2结构属于立方面心结构体系(Fm3m空间群), Li+和Fe3+任意占据八面体的顶点,理论比容量大约为283 mAh·g-1[3],在熔盐电解质中的稳定性很好,几乎不发生溶解。其电极反应如下:
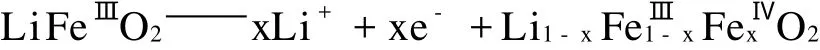
目前,较为常用的制备α 2LiFeO2的方法有高温固相法[4]、低温固相法[3,5]、离子交换法[627]、水热法[8]和喷雾干燥法[9]等。其中以低温固相法为主,J.Morales等人[3,5]在250℃下固相合成了室温下具有良好的循环性能的纯相α 2LiFeO2,其在C/4充放电倍率下,循环50次以后,仍表现出了150 mAh·g-1的容量。研究还发现[10],在充放电过程中,α 2LiFeO2会逐渐向尖晶石结构转变。由于这种相变化最终仍会导致容量的不断衰减,因此防止循环过程中发生相变化,仍需要进一步研究。
本文采用实验成本低,操作简单,粉体生长易于控制的水热法来制备α 2LiFeO2材料,
探讨了Li/Fe(LiOH·H2O与α 2FeOOH的摩尔比)以及表面活性剂CTAB和SDBS浓度对合成α 2 LiFeO2的影响。
1 实验部分
1.1 α 2LiFeO2的制备
以LiOH·H2O(分析纯,国药集团化学试剂有限公司)为锂源,α 2FeOOH(自制)为铁源,表面活性剂CTAB(分析纯,天津市博迪化工有限公司)和SDBS (分析纯,天津市广成化学试剂有限公司)为模板,采用水热法合成α 2LiFeO2。首先称取一定量的表面活性剂加入到40 mL的去离子水中,超声15 min,使之溶解。然后将LiOH·H2O和α 2FeOOH按照一定摩尔比加入到溶解好的表面活性剂溶液中,充分搅拌均匀,得到水热反应前躯体,再用去离子水调节混合溶液的体积至80 mL(反应釜容积的80%),最后将混合溶液加入到聚四氟乙烯内衬的水热反应釜中。在一定的温度下反应一段时间后,随炉冷却至室温,打开反应釜,用去离子水和无水乙醇分别洗涤多次,在60℃下真空干燥6 h,得到欲合成的粉体。
其反应方程式为:
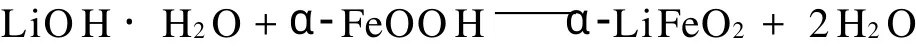
1.2 材料表征
采用日本理学D/max2rB型X射线衍射仪对合成的粉体进行物相结构分析,利用Jade 5.0由XRD数据计算得到材料的晶胞参数以及产物颗粒的平均粒径,所用参数为:Cu靶,管电压40 kV,管电流40 mA,扫描速度0.02(°)/s,扫描范围10(°)~85(°);采用日本日立高新技术株式会社公司生产的S24800型冷场发射扫描电子显微镜对样品的微观形貌、粒度大小及其分布情况进行表征,所用参数为:加速电压为10.0 kV,放大倍率为×5000。
2 结果与讨论
2.1 Li/Fe摩尔比的影响
图1所示是210℃保温6 h在不同的Li/Fe摩尔比且无表面活性剂的条件下水热合成粉体的XRD图。从图中可以看出,利用LiOH·H2O为锂源,α 2FeOOH为铁源合成纯相的α 2LiFeO2,需要将Li/Fe摩尔比控制在较高比例。当Li/Fe摩尔比为10∶1和20∶1时,水热合成粉体的XRD图谱中开始出现α 2Fe2O3和Li0.5Fe2.5O4相的衍射峰。α 2Fe2O3相的衍射峰相对强度较大,说明此时有α 2Fe2O3和Li0.5Fe2.5O4生成,且α 2 Fe2O3相对较多,主要是α 2FeOOH相脱水生成α 2Fe2O3相[11]。当Li/Fe摩尔比为30∶1时,将XRD图谱中衍射峰的位置和相对强度与JCPDS卡片对照,发现粉体的衍射峰位置与标准α 2LiFeO2(JCPDS Card No. 1720938)材料的谱峰峰位相同,峰形尖锐且对称,无杂质峰出现,说明此条件下制得的粉体为纯相α 2LiFeO2,且结晶性好。当Li/Fe摩尔比为40∶1时,其衍射峰位置与标准α 2LiFeO2谱峰峰位相同,与Li/Fe摩尔比为30∶1得到的粉体相比,结晶度有所提高。Sun Y. K.[12]在研究结晶性能对材料的电化学性能的影响时认为,结晶性能越好,结晶度越高的材料稳定性能越好。因为结晶性能好有利于抵抗因锂离子的反复嵌/脱对材料结构的破坏。
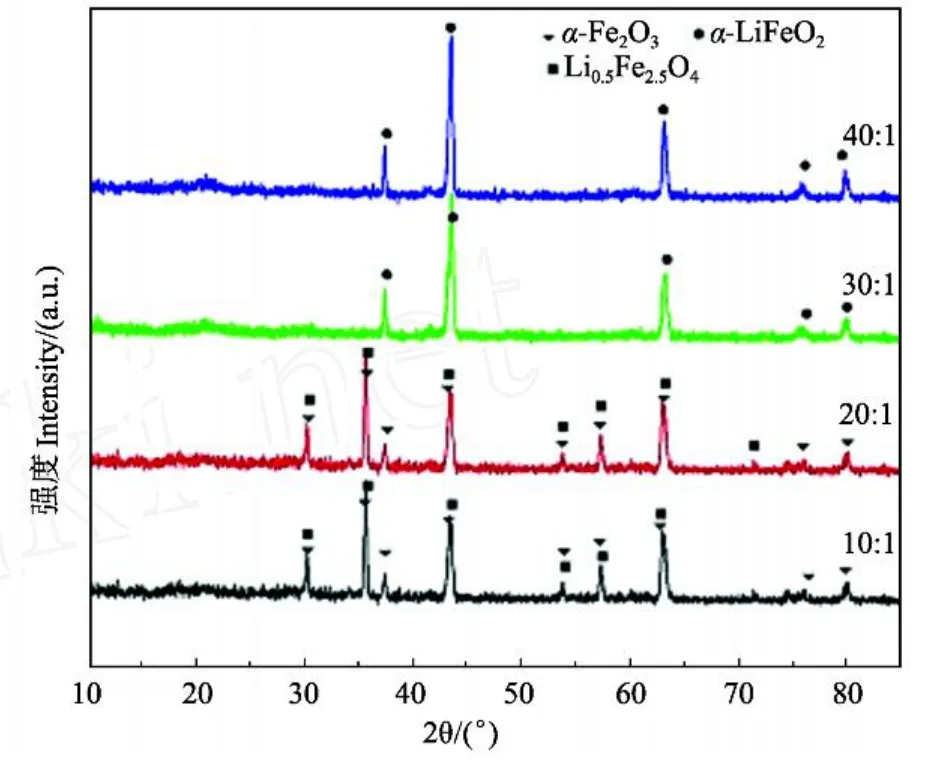
图1 不同Li/Fe摩尔比下粉体的XRD谱图Fig.1 X2ray diffraction patterns of the samples at different Li/Fe molar ratio
图2 为Li/Fe摩尔比为30∶1和40∶1条件下水热合成粉体的SEM照片。由图可知,此条件粉体均呈多面体结构,平均尺寸在2μm左右,且分散性较好,并无严重的团聚现象。

图2 不同Li/Fe摩尔比下粉体的SEM形貌Fig.2 SEM morphologies of the sa mples at different Li/Fe molar ratio
实验表明,Li/Fe摩尔比是水热合成α 2LiFeO2的重要影响因素。过低的Li/Fe摩尔比不利于α 2LiFeO2的生成,只有在Li/Fe摩尔比≥30∶1,即LiOH·H2O过量很多时,才有利于α 2LiFeO2的生成。部分LiOH ·H2O作为反应物,参与了水热合成α 2LiFeO2,其余LiOH·H2O在水热合成过程中,起到了矿化剂的作用。
2.2 CTAB浓度的影响
将表面活性剂浓度分别为0.5,1.0,1.5和2.0 mmol/L条件下制得的粉体依次标记为Ⅰ,Ⅱ,Ⅲ,Ⅳ,其他实验条件均为:210℃保温6 h,Li/Fe摩尔比为40∶1。图3所示为Ⅰ,Ⅱ,Ⅲ,Ⅳ粉体材料的XRD谱图。将图谱中的衍射峰的位置和相对强度与JCPDS卡对照,发现样品的衍射峰位置与标准α 2LiFeO2(JCPDS Card No.1720938)材料的谱峰峰位相同,峰形尖锐且对称,无杂质峰出现,说明此方法制得的α 2LiFeO2粉体纯度高、结晶性好。
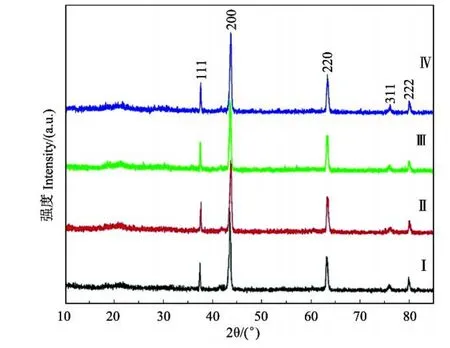
图3 Ⅰ,Ⅱ,Ⅲ,Ⅳ样品的XRD图谱Fig.3 X2ray diffraction patterns of the samplesⅠ,Ⅱ,Ⅲ,Ⅳ

图4 Ⅰ,Ⅱ,Ⅲ,Ⅳ样品的SEM图谱Fig.4 SEM morphologies of the samplesⅠ,Ⅱ,Ⅲ,Ⅳ
图4 所示为Ⅰ,Ⅱ,Ⅲ,Ⅳ样品的SEM图。可以看出,以CTAB为表面活性剂采用水热法所制备的α 2 LiFeO2样品粒径大小均匀,均在1~2μm左右,颗粒分散性好,无明显的团聚现象,但Ⅱ,Ⅲ粉体的粒径相对于Ⅰ,Ⅳ较小,这表明表面活性剂的用量与合成产物的粒径尺度密切相关。同时研究发现,合成产物的粒径并不是简单地随着表面活性剂用量的增加而单调地下降,而是在某特定浓度下有一最小值。这是因为表面活性剂溶于水后,其浓度大于临界胶团浓度(0.80 mmol/L[13])时,即在溶液中形成胶团;若胶团达到饱和,由胶团中反应所生成的微粒为单胶团尺寸,粒径较小;而当胶团浓度达到过饱和时,胶团间相互结合,形成更大的胶团,导致自发形成二次颗粒,使产物粒径增大。
分布均匀的粉体制备的电极具有更好的空隙结构,有利于传质,并且锂离子嵌入和脱出深度较小,行程更短,嵌入和脱出比较容易,有利于提高其比容量,且疏松的表面更有利于电解液的渗透。反之,电池正极材料粒度不均匀,在充放电循环时会造成局部小颗粒过度放电,而大颗粒由于局部成分不均匀则易造成较大内应力,从而致使电池的容量衰减[14]。由此可见,利用水热法制备的样品理论上具备良好的容量保持能力。
2.3 SDBS浓度的影响
同样,固定了其他反应条件,将表面活性剂换为SDBS继续考察表面活性剂浓度对水热合成α 2LiFeO2的影响。图5给出了不同SDBS浓度下水热得到粉体的XRD谱图,其中a,b,c,d分别代表SDBS的浓度为:0,2,4和6 mmol·L-1,从图中可以看出,加入SDBS后,对应产物XRD谱图中(111),(200),(220), (311)和(222)等晶面处均表现出α 2LiFeO2的特征衍射峰。并且可以看出,随着体系中SDBS浓度的增大, (200)和(220)处衍射峰出现了明显的宽化,但衍射强度有所降低,其中d样品降低的最多,这说明,表面活性剂SDBS对水热合成α 2LiFeO2的物相组成没有影响,影响较大的是其粒径大小和结晶度等微观形貌。
图6所示为不同SDBS浓度下水热得到粉体的SEM照片,从图中可以看出,与图6(a)未加表面活性剂SDBS相比,在反应体系中加入SDBS后,对样品的形貌产生了很大的影响。当SDBS浓度为2 mmol·L-1时,从图6(b)可以看出,此时得到的晶体有多面体变为了层状结构,这是由于分子间的强烈耦合力作用可促使表面活性剂分子形成具有规则形状的层状有机晶体所致,平均尺寸较没有添加SDBS时有所减少,大约为1.3μm。当SDBS浓度增大至4 mmol·L-1时,从图6 (c)中可以看出,此时得到的粉体形貌为无规则形貌的颗粒状,平均尺寸在0.6μm左右,并且分散性变差,出现了一定的团聚现象。当SDBS的浓度增加至6 mmol· L-1时,如图6(d)所示,此时得到了近似球形形貌的颗粒,粉体的平均尺寸在0.3μm左右,同时也出现了一定程度的团聚现象。团聚现象的出现一方面是由于在样品处理过程中除去了外表面的表面活性剂分子,容易发生团聚,随着粒子的粒径降低,其比表面积迅速增大,粒子表面能也较高,颗粒间的库仑力或范德华引力使粒子之间趋于团聚,以降低其较高的表面能;另一方面是由于SDBS在体系中更多的是起到了软模板的作用,降低了其分散效果。随着颗粒尺寸的降低,其比表面积增大,这有利于增大锂离子的扩散通量,减少充放电过程中的惰性锂离子而增大放电容量。
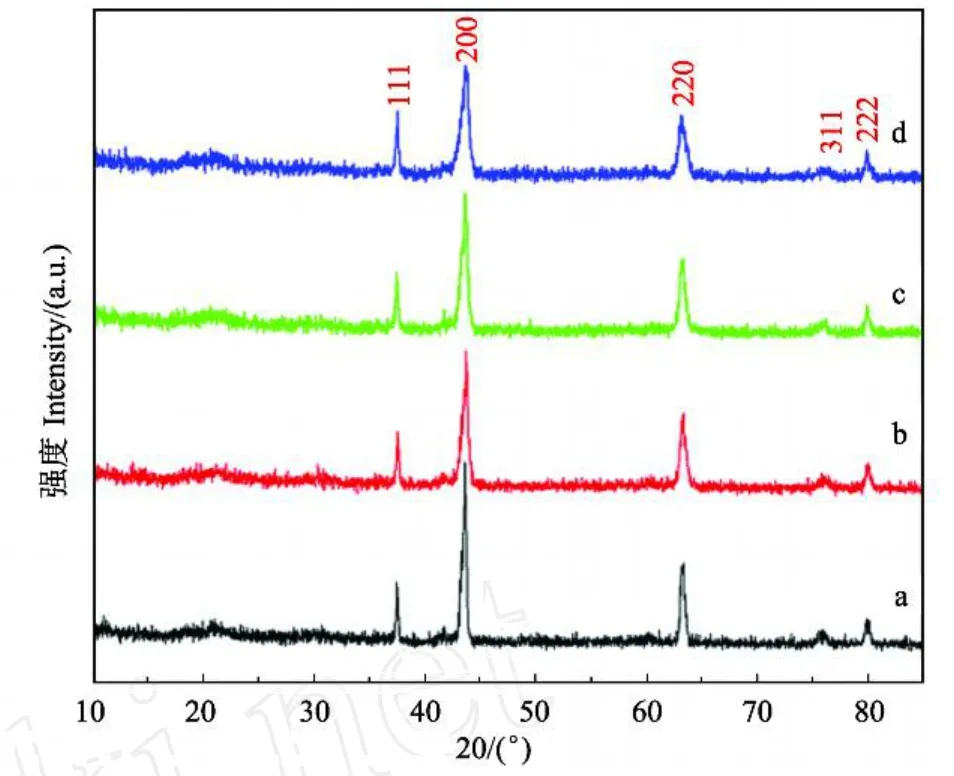
图5 不同SDBS浓度下粉体的XRD图谱Fig.5 XRD patterns of the samples at different concentrations of SDBS

图6 不同SDBS浓度下粉体的SEM图Fig.6 SEM morphologies of the samples at different concentrations of SDBS
3 结论
(1)实验表明:以LiOH·H2O为锂源,α 2FeOOH为铁源,CTAB为表面活性剂,在210℃水热反应6 h可以实现α 2LiFeO2粉体的合成。当Li/Fe摩尔比≥30∶1时有利于纯相α 2LiFeO2粉体的生成,伴随着Li/Fe摩尔比的降低,有杂相α 2Fe2O3和Li0.5Fe2.5O4生成。
(2)表面活性剂CTAB和SDBS对水热合成α 2LiFeO2的物相组成几乎没有影响,但对其微观形貌的影响却比较大。在实验浓度范围内,表面活性剂CTAB主要起到了控制粉体粒径大小的作用,而SDBS除了降低了粉体粒径外,还影响到了粉体的微观形貌。随着体系SDBS浓度的增大,粉体经历了多面体、层状和类球形3种形貌,并且平均尺寸降至0.3μm左右。
参考文献:
[1] 庄大高,赵新兵,曹高劭,等.水热法合成LiFePO4的形貌和反应机理[J].中国有色金属学报,2005,15(12):203422039.
[2] 黄可龙,王兆翔,刘素琴.锂离子电池原理与关键技术[M].北京:化学工业出版社,2007.
[3] J Morales,J Santos2Pena.Highly electroactive nanosizedα 2LiFeO2[J].Electrochemistry Communications,2007,9(8):211622120.
[4] Pier Paolo Prosini,Maria Carewska,Stefano Loreti.Lithium iron oxide as alternative anode for li2ion batteries[J].Inorganic Mate2 rials,2000,2(4):3652370.
[5] J Morales,J Santos2Pena.Insights into the electrochemical activi2 ty of nanosizedα 2LiFeO2[J].Electrochemica Acta,2008,53 (22):636626371.
[6] Wu She2Huang,Liu Hsin2Yen.Preparation ofα 2LiFeO22based cathode materialsbyanionicexchangemethod[J].Power Sources.2007,174(2):7892794.
[7] Y Sakurai,H Arai,S Okada,et al.Low temperature synthesis and electrochemical characteristics of LiFeO2cathodes[J].Power Sources,1997,68:7112715
[8] Mitsuharu Tabuchi,Satoshi Tsutsui,Christian Masquelier.Effect of cation arrangement on the magnetic properties of lithium ferrites (LiFeO2)prepared by hydrothermal reaction and post2annealing method[J].Solid State Chem,1998,140(2):1592167.
[9] 皮雄,席晓丽,聂祚仁,等.喷雾干燥制备铁系锂离子电池正极材料的研究[J].材料导报,2009,23(5):32234.
[10] Y S Lee,S Sato,Y K Sun,et al.A new type of orthorhombic LiFeO2with advanced battery performance and its structural change during cycling[J].Power Sources,2003,1192121:2852 289.
[11] 欧平,徐刚,倪利红,等.α 2Fe2O3的水热法合成及其相形成机理[J].稀土金属材料与工程,2008,37(2):4532455.
[12] Sun Y K,Lee K H.Effect of crystallinity on the electrochemical behavior of spinel Li1.3Mn2O4cathode material[J].Solid State I2 onics,1998,112(324):2372243.
[13] 杨涛,李文娟,周从山.芘荧光探针光谱法测定CTAB临界胶束浓度[J].石化技术与应用,2007,25(1):48250.
[14] 王玉棉,邹杰,侯新港.锂离子电池正极材料尖晶石LiMn2O4的固相合成与表征[J].兰州理工大学学报,2009,35(1):10212.
Effects of Li/Fe Molar Ratio and the Concentration of Surface Active Agent on Hydrothermal Synthesis ofα 2LiFeO2
BU Ming2Sheng1,2,BI Cai2Feng1,2,HOU Jin1,2,FAN Yu2Hua1,2,WANG Li1,2
(Ocean University of China 1.Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education;2.Col2 lege of Chemistry Chemical Engineering,Qingdao 266100,China)
α 2LiFeO2was obtained by hydrothermal synthesis involving the reaction between goethite, lithium hydroxide monohydrate,CTAB and SDBS.The structure and morphology of the materials were characterized by XRD and TEM for investigating the effects of different Li/Fe molar ratio,the concentra2 tion of CTAB and SDBS.It was shown that pure phaseα 2LiFeO2could be successfully synthesized via hy2 drothermal processing with Li/Fe=30∶1 at 210℃for 6 h.With the decrease of Li/Fe molar ratio,α 2Fe2O3and Li0.5Fe2.5O4were generated.The CTAB played a major role in controlling the particle size ofα 2 LiFeO2,while the SDBS not only had the ability to reducing the particle size,but also affected the micro2 structure of the powders.With the increase of SDBS,the samples showed three kinds of morphology, such as polyhedron,layered and spherical,and the average size dropped to about 0.3μm.
α 2LiFeO2;lithium ion batteries;hydrothermal synthesis;surface active agent
book=2010,ebook=21
O647.2
A
167225174(2010)122121205
责任编辑 徐 环
2009212231;
2010206203
步明升(19832),男,硕士生。E2mail:bumingsheng1983@163.com

