在探究性实验中培养学生的创新能力
黄彩斌
化学实验的功能和探究性学习的特征决定了化学实验必然是探究性学习的重要途径。化学探究实验是指探索研究对象的未知性质,了解它具有怎样的组成,有哪些属性和变化特征,以及与其他对象或现象联系的一种实验。下面从四个方面浅谈怎样在探究性实验中培养学生的创新能力。
一、实验方法
对于一些课堂演示实验,遇到实验现象不明显,操作复杂且安全性较差时,要求教师善于引导学生发现课本演示实验的不足之处,还要善于启发学生大胆设想、敢于创新、改进实验,设计合理的方案,这样使学生在巩固已学知识的基础上,还会进一步完善并有所突破和创新。比如,在学习浓硫酸稀释实验时,为了说明向浓硫酸中滴水的危险性,按教科书所设计的方案实验,沸腾现象不易被观察,原因是水滴沸腾飞溅起的液滴非常小,并且持续时间很短,因此学生不易观察到实验现象,使实验失去说服力。为此,可启发学生进行改进创新,如图:

用铁丝绷住几条湿润的石蕊试纸,穿过导管悬挂于锥形瓶内,并接近浓硫酸液面。打开分液漏斗的活塞,水滴落在浓硫酸液面上,立即沸腾,溅起的酸液落在试纸上,出现红色的斑点。宏观的现象证明了水沸腾有酸液溅起。如果实验不是在密闭容器内进行,硫酸溅到衣服上、皮肤上,后果不堪设想。通过这一实验的改进足以引起学生对浓硫酸稀释操作的重视。虽然学生的设计还不够完善,但体现了学生敢于设想、敢于创新的精神。
二、实验原理
在复习卤素中溴水褪色问题时提出:镁粉可使溴水褪色,其反应原理是怎样的?在要求学生提出实验方案前,引导分析溴水的成份,与镁反应时可能产生的现象,然后帮助设计实验方案,即教给学生在已知和未知之间如何架设桥梁去进行探究。
第一步:制定设想提出实验方案,进行实验验证
例如溴水中含溴、氢溴酸、次溴酸、水等成分。
Br2+ H20=HBr+HBrO则可能有Mg+Br2=MgBr2(A)
Mg+2H+=Mg2++ H2↑ (B)
两个反应均可能使溴水褪色,故反应原理有三种可能即只发生(A)反应或只发生(B)反应或(A)(B)反应同时发生。那么只需在溴水中加入镁粉振荡,观察现象——有无气泡产生,即可初步确定为哪一种情形了。实验验证后得知:溴水褪色过程中只是一开始产生极少量的气泡。排除了(A)(B)单独发生的情形。
第二步:分析总结获取新知,提出新问题
若(A)反应单独发生,应无气泡。若反应(B)单独发生,气泡应连续产生直至溴水褪色。而实验表明气泡只是一开始产生少量,所以结论是(A)(B)反应同时发生,并以(A)为主。在成功体验的基础上,此时再追问学生:“怎样确证反应是以(A)为主呢?”以激发学生继续进行深入的探究,培养创新能力。
三、物质性质
认识身边一些物质的性质是高中化学的重要内容,运用探究实验的方法可以加深对物质性质的认识、了解和掌握。
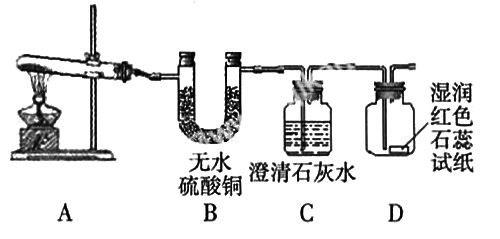
如对家庭中使用的碳铵化肥(NH4HCO3)分解产物的探究,用下图实验装置来探究其性质,对A加热一段时间后,发现B中白色粉末变蓝色,C中出现浑浊,D中湿润的石蕊试纸变蓝色。通过观察实验现象,学生讨论碳铵化肥(NH4HCO3)分解的产物,再根据分解的产物,由学生自己设计实验装置,验证分解的产物。
四、物质的成分
在学习《化学必修1》氯气溶于水时,为了弄清楚氯水中存在的微粒,可以设计这样一个探究性实验:将新制的氯水分别加到紫色石蕊试液、FeCl2、Na2CO3和AgNO3等溶液中观察有何现象,写出有关的离子方程式。首先让学生自己进行实验,然后再组织学生讨论、交流,让学生各抒已见,发现问题,讨论问题,相互启发,教师再巡回点拨,最后在广纳众议的基础上得出结论。这种实验方法,活跃了课堂气氛,调动了学生参与实验的积极性,效果较好。同时提高学生观察实验现象的能力、发现问题分析问题的能力、文字表达能力,还挖掘出学生潜在的创新能力。在实验过程中,教师起着引导、指导、点拨、评价的主导作用。学生通过实验,亲自去发现问题,使动手能力和观察能力得到了培养,学生的自学能力、分析综合能力得到有效锻炼与提高。
责任编辑潘孟良

