不同培养基对Beagle犬骨髓基质细胞增殖与分化的影响
黄永玲 闫福华 钟泉 赵欣
·论著·
不同培养基对Beagle犬骨髓基质细胞增殖与分化的影响
黄永玲 闫福华 钟泉 赵欣
目的研究α-MEM、DMEM-LG、RPMI 1640三种培养基对Beagle犬骨髓基质细胞(Bone marrow stromal cells,BMSCs)体外培养生物学行为的影响,为BMSCs的培养寻找合适的培养基。方法取6只Beagle犬的BMSCs,分别用α-MEM、DMEM-LG、RPMI 1640三种培养基进行培养,比较3组细胞的贴壁、增殖及矿化等方面的差异。结果α-MEM组24 h内贴壁的细胞数目最多;消除贴壁差异后,α-MEM和DMEM-LG促增殖作用相近;α-MEM组碱性磷酸酶(Alkaline phosphatase,ALP)表达量最高,但矿化结节形成数目较少,DMEM-LG组矿化结节形成个数最多。结论DMEM-LG培养基较适合BMSCs的培养。
骨髓基质细胞组织工程培养基增殖分化
BMSCs是成体干细胞之一,具有多向分化潜能,在不同环境和细胞因子作用下,能向骨、软骨、肌肉和神经等中胚层或外胚层组织细胞分化[1-2]。由于骨髓中BMSCs含量极少,建立高效快捷的体外扩增技术已成为BMSCs应用过程中迫切需要解决的问题之一。在体外培养扩增的研究中,培养基是构成细胞体外培养环境的重要因素,通过改善培养环境,可在较短时间内提高扩增倍数,减少扩增过程中的分化与老化[3]。目前常用的培养基有α-MEM、DMEM-LG和RPMI 1640,但不同培养基对种子细胞的增殖与分化作用的报道较少。本实验通过比较这三种培养基对BMSCs生物学行为的影响,为牙周组织工程中种子细胞的培养寻找合适的培养基。
1 材料和方法
1.1 实验动物
雄性Beagle犬6只,体重约10 kg(购自四川省医学科学院实验动物研究所),圈养于中国人民解放军南京军区福州总医院比较医学科。
1.2 实验试剂与主要仪器
DMEM-LG培养基(Gibco,美国),RPMI 1640培养基(Gibco,美国),α-MEM培养基(Gibco,美国),新生牛血清(Gibco,美国),胰蛋白酶(Sigma,美国),MTT(Sigma,美国),L-谷氨酰胺(Sigma,美国),ALP检测试剂盒(南京建成生物工程研究所),生物安全柜(上海力申科学仪器有限公司),CO2培养箱(Heraeus,德国),FACSCalibur流式细胞仪(BD,美国),荧光倒置相差显微镜(Olympus,日本),酶标仪(Human,德国)。
1.3 方法
1.3.1 细胞培养观察
参照文献[4]的方法,采用全骨髓培养法培养BMSCs。以氯胺酮全麻,从6只Beagle犬股骨近端各抽取骨髓15 mL,在无菌条件下注入含20 mL无血清培养基的离心管中,1 000 rmp离心5 min(2次),弃上清液,均分成3份,置于100 mm培养皿中进行培养。分别加入8 mL含10%新生牛血清的α-MEM、DMEM-LG和RPMI 1640培养基,于37℃、5%CO2、饱和湿度下培养,2 d时半量换液,5 d时全量换液。以后每隔3 d换液,倒置显微镜下观察细胞形态及生长状况。待细胞生长融合后,用2.5 g/L胰蛋白酶+1 g/L EDTA消化传代。
1.3.2 贴壁状况
取传代培养的第6代细胞,调整细胞密度至2.5×104cells/mL,每孔200 μL,接种到96孔板中。分别在2 h、7 h、10 h、24 h时以MTT法测定A492。
1.3.3 细胞增殖
1.3.3.1 MTT法检测
取第4代细胞,细胞密度为1.0×104cells/mL,每孔200 μL,接种到96孔板中。采用其中一种培养基接种24 h后,消除贴壁差异,再分别更换不同培养基进行培养。MTT法测定接种后1~7 d的A492,结果取平均值。其余两组检测方法同上。
1.3.3.2 集落形成
取传代培养的第4代细胞,以1.0×105cells/mL接种至100 mm培养皿,分别用DMEM-LG、RPMI 1640、α-MEM培养基进行培养,1周后行结晶紫染色,观察集落形成情况。
1.3.3.3 细胞周期
取3种培养基培养的第3代细胞,调整密度至1.0×106cells/mL,70%乙醇固定,流式细胞仪检测。
1.3.4 矿化能力
1.3.4.1 ALP含量测定
选取第3代细胞,以5.0×104个/孔接种于24孔板,每组6孔,每隔3 d换液,分别在接种后4 d、6 d、8 d、10 d、12 d、14 d取出。吸弃孔内培养液,PBS漂洗3次,加入50 μL 1%TritonX-100,4℃冰箱过夜,用ALP检测试剂盒进行测定。
1.3.4.2 Von Kosssa染色
选取第3代细胞,以5.0×104个/孔接种于24孔板,每组6孔,每隔3 d换液,连续培养至出现肉眼可见的白色结节,行Von Kosssa染色,在倒置显微镜下观察矿化结节形成情况。
1.4 统计学方法
应用SPSS 13.0进行统计学处理,对ALP活性、贴壁状况检测结果采用单因素方差分析,P<0.05为有显著性差异。
2 结果
2.1 细胞培养观察
接种初始,皿底沉淀有大量血细胞,无法观察到细胞贴壁情况。5 d时全量换液,可见大部分细胞呈梭形,少数呈圆形或多角形,α-MEM组细胞与其他两组相比数量较多(图1)。DMEM-LG和RPMI 1640组培养10~12 d可达90%融合,即可进行消化传代。α-MEM组至7 d时应及时传代,否则易覆层生长并形成膜状物漂浮于培养基中。
2.2 贴壁状况
随着培养时间延长,细胞贴壁数逐渐增多。α-MEM组2 h时,贴壁的细胞数显著高于其余两组(P<0.05),7 h时细胞已大部分贴壁,而7 h和10 h、24 h间差异无显著性(P>0.05)。DMEM-LG组和RPMI 1640组24 h时才大部分贴壁,此两组间差异无显著性(P>0.05)(图2)。
2.3 细胞增殖
2.3.1 MTT法检测
消除贴壁差异后,比较3组细胞增殖情况:α-MEM组和DMEM-LG组细胞生长无显著性差异(P>0.05),但和RPMI 1640组间有显著性差异(P<0.05)(图3)。
2.3.2 集落形成情况
结晶紫染色观察集落形成情况,可见RPMI 1640组形成集落个数少且较细小,DMEM-LG组适中,α-MEM组形成的集落个数最多且较粗大(图4)。
2.3.3 细胞周期
α-MEM组、DMEM-LG组、RPMI 1640组中S期细胞分别35.08%、22.70%、6.69%,G1期细胞分别为53.23%、66.08、92.03%(图5)。
2.4 矿化能力检测
2.4.1 ALP含量测定
不同培养基培养的细胞的ALP含量,均随培养时间的延长而增加。α-MEM组ALP含量明显高于其余两组(P<0.05),在第8天时含量显著增加。DMEM-LG组从第6天开始,ALP含量逐渐高于RPMI 1640组,在第12天和第14天时差异有显著性(P<0.05)(图6)。
2.4.2 Von Kosssa染色
α-MEM组增殖速度快,自身复层生长,约7 d时形成类似组织团块样结构,只在培养皿边缘存在少量矿化结节。DMEM-LG组约6~7 d有结节形成,RPMI 1640组约10~12 d形成结节。Von Kosssa染色可见:DMEM-LG组形成的结节数目较多且较大,散状分布;RPMI 1640组形成的结节数目较少且较小,大多分布于培养皿边缘(图7)。
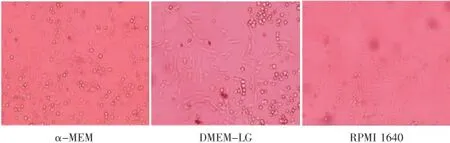
图1 原代细胞的增殖状况(100×)

图2 BMSCs在三种不同培养基中的贴壁情况
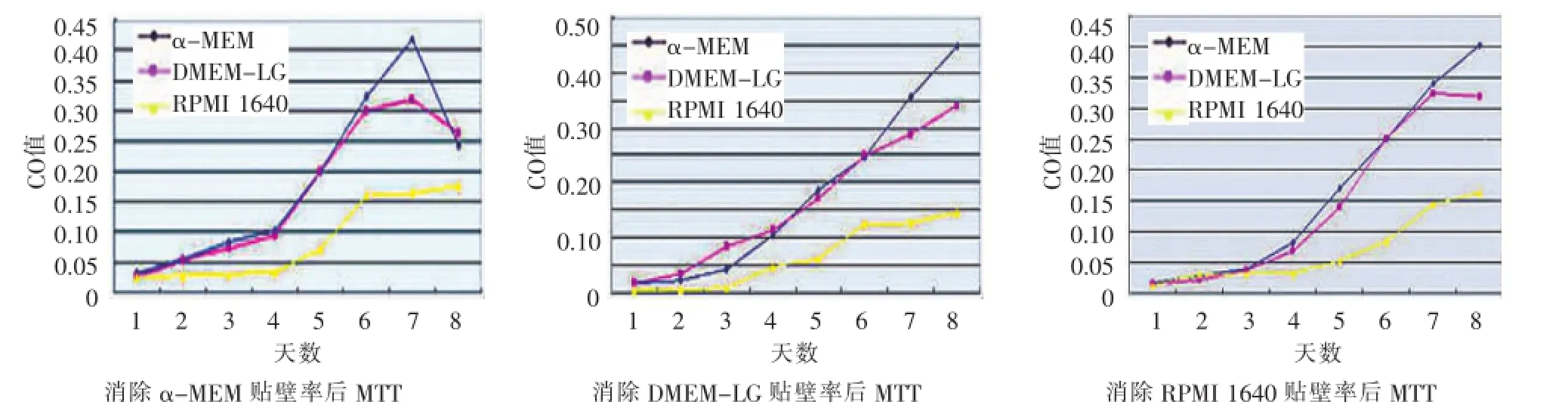
图3 消除贴壁差异的生长曲线(MTT法)

图4 集落形成情况

图5 细胞周期检测
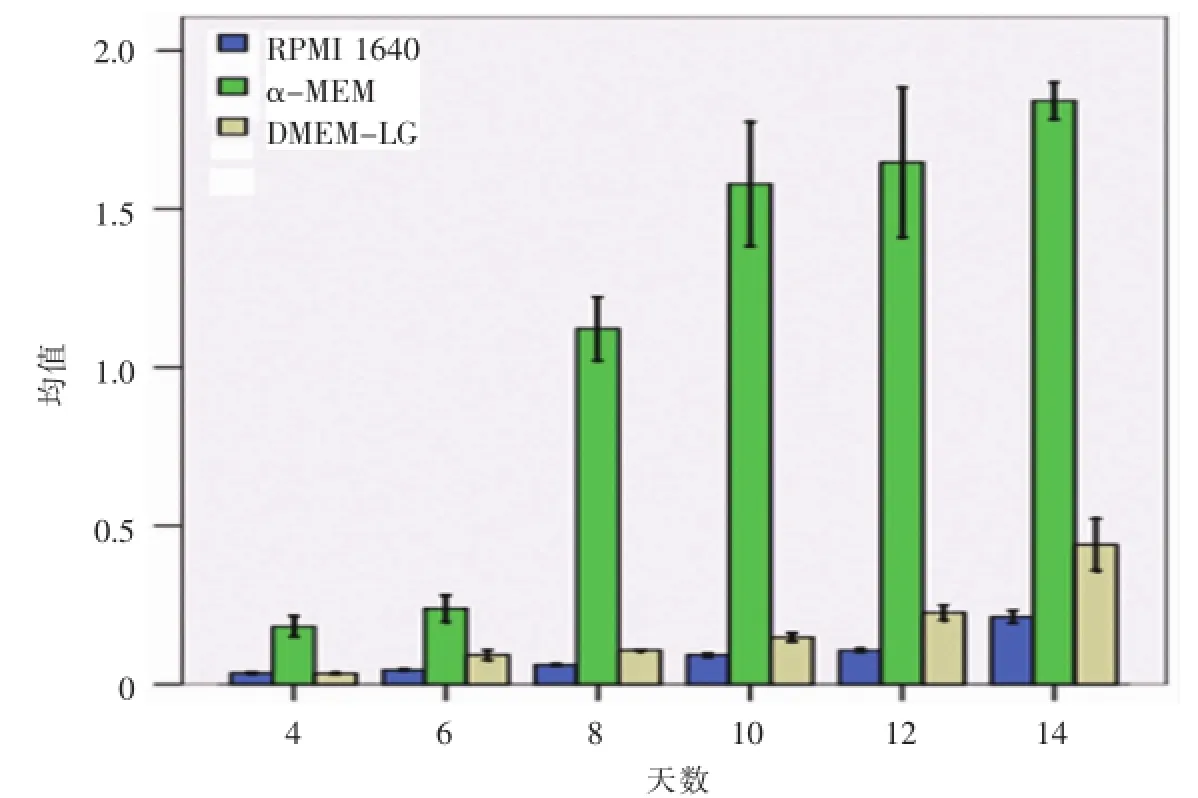
图6 三种培养基ALP活性测定
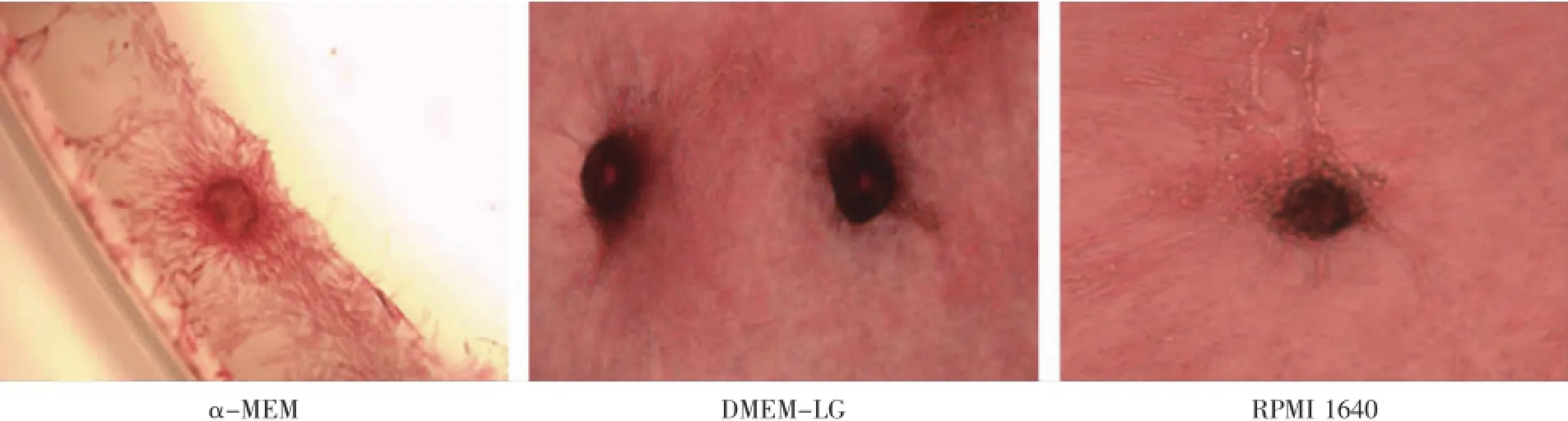
图7 Von Kosssa染色(100×)
3 讨论
BMSCs是目前组织工程中主要的种子细胞之一,具有多向分化潜能,但其在体内数量较少,并且BMSCs的成骨能力随着年龄的增加而逐渐减弱[5-7]。因此,如何改善体外培养环境,使BMSCs能在较短时间内迅速扩增,并减少扩增过程中的分化与老化现象以维持干细胞的功能,这一系列问题成为体外培养研究中的重点。
培养基是构成细胞体外培养环境的重要因素,目前BMSCs体外培养大多采用α-MEM、DMEMLG和RPMI 1640培养基。α-MEM含有附加氨基酸、维生素以及核苷酸和脂肪酸等,可广泛应用于各种类型细胞的体外培养。DMEM-LG是Dulbecco改良的Eagle培养基,营养成分丰富,常用于贴壁细胞培养。RPMI 1640培养基最初是针对淋巴细胞设计的,具有成分简单、氨基酸含量较高等特点,能适用于多种细胞的培养[8]。
研究表明,不同培养基对BMSCs[3]、牙髓细胞[9]、牙周韧带细胞[10]、骨膜细胞[11]的增殖、分化作用是不同的。但哪种是BMSCs体外培养的最适培养基,各学者所得出的结论不尽相同。Javazon等[12]培养鼠BMSCs发现,α-MEM中的细胞扩增倍数是DMEM的2倍。Majumdar等[13]研究表明,α-MEM较DMEM-LG更能促进人BMSCs的增殖。然而,Coelho等[14]发现,α-MEM和DMEM-LG对人BMSCs增殖没有显著差异,但α-MEM有助于人BMSCs成骨能力的维持。本实验通过比较α-MEM、DMEM-LG和RPMI 1640三种培养基对BMSCs贴壁、增殖和分化方面的影响,为BMSCs的培养寻找合适的培养基。
贴壁是体外培养BMSCs的主要过程之一,是BMSCs生长的必要条件。本实验发现,α-MEM组24 h贴壁的细胞数明显高于DMEM-LG组和RPMI 1640组,此结果和须珏华等[3]的研究结论一致。研究表明,影响细胞贴壁的主要因素有:血清[15]、贴壁介质表面特性[16]和pH值[17]等。本实验通过比较三种培养基,发现三者之间pH值相差约0.3~0.4。动物细胞大多数需要在轻微的碱性条件下生长,α-MEM与其余两种相比呈偏碱性,因而我们推断三种培养基中不同的pH值影响了BMSCs的贴附。
本研究发现在消除贴壁差异后,α-MEM和DMEM-LG促增殖作用相近,α-MEM略高于DMEM-LG;RPMI 1640促增殖作用明显不如α-MEM和DMEM-LG。有研究发现,培养基中的多种成分能影响细胞的增殖。Lopez等[10]和Maeno等[18]的研究表明,增加一定量的钙浓度可促进成骨细胞增殖。比较三组钙浓度:α-MEM为200 mg/L,DMEMLG为265 mg/L,RPMI 1640无氯化钙成分[9]。此外,有研究表明,糖浓度也是影响细胞增殖的要素之一。比较三种培养基成分发现,RPMI 1640中葡萄糖含量是α-MEM和DMEM-LG的2倍。Stolzing等[19]发现,较低的葡萄糖浓度能减少细胞凋亡,促进细胞增殖。Tennant等[20]认为,高浓度葡萄糖代谢产生较多乳酸,可抑制细胞生长。因此,我们推测培养基中钙和糖浓度均可能影响细胞的增殖,究竟哪种成分作用更强,尚有待进一步的研究。
BMSCs在三种培养基中,均可向成骨方向诱导。本实验结果表明,α-MEM组中ALP含量明显高于其余2组,但矿化结节形成的个数最少;DMEMLG组ALP含量低于α-MEM组,但形成的矿化结节个数最多。Maeno等[18]报道,ALP阳性细胞率与钙浓度的增加成正相关。Lopez等[10]也报道ALP表达与培养基中钙浓度的相对增加有关。本实验单从ALP检测结果上看与其相符,但Von Kosssa染色结果却与其不一致。Goshima等[21]的研究表明,细胞数量过多,容易造成细胞堆积,不利于细胞伸展和成骨潜能的发挥。因而我们推测造成此结果的原因可能是α-MEM组中细胞贴壁率高且增殖速度快,造成细胞基数大,相应分泌的ALP也比较高,但其成骨潜能方面受到了抑制。
综上所述,本实验结果表明,培养基α-MEM促进BMSCs的增殖,但矿化能力方面较弱;DMEM-LG培养基促进细胞增殖和分化,较适合BMSCs的体外培养。
[1]Bianco P,Riminucci M,Gronthos S,et al.Bone marrow stromal stem cells:nature,biology,and potential applications[J].Stem Cells, 2001,19(3):180-192.
[2]杨琴,曾志磊,谢鹏,等.体外培养大鼠骨髓基质细胞生物学特性研究[J].重庆医科大学学报,2007,32(9):926-929.
[3]须珏华,胡静波,周燕,等.培养基对兔骨髓间充质干细胞扩增与分化的影响[J].中国组织工程研究与临床康复,2007,11(3):467-470.
[4]闫福华,刘崇武,周广武.骨髓基质细胞在三种可吸收生物膜上附着及增殖的比较[J].福建医科大学学报,2002,36(1):10-13.
[5]Tuli R,Seghatoleslami MR,Tuli S,et al.A simple,high-yield method for obtaining multip-otential mesenchymal progenitor cells from trabecular bone[J].Mol Biotechnol,2003,23(1):37-49.
[6]Zhou S,Greenberger JS,Epperly MW,et al.Age-related intrinsic changes in human bone marrow-derived mesenchymal stem cells and their differentiation to osteoblasts[J].NIH Public Access Author Manu-script,2008,7(3):335-343.
[7]Kretlow JD,Jin YQ,Liu W,et al.Donor age and cell passag affects differentiation pote-ntial of murine bone marrow-derived stem cells [J].BMC Cell Biol,2008,9:60.
[8]司徒镇强,吴军正.细胞培养[M],第2版.西安:世界图书出版西安公司,2007:43-45.
[9]Lopez-Cazaux S,Bluteau G,Magne D,et al.Culture medium modulates the behaviour of human dental pulp-derived cells:technical note [J].European Cells and Materials,2006,11:35-42.
[10]Hou LT,Li TI,Liu CM,et al.Modulation of osteogenic potential by recombinant human bone morphogenic protein-2 in human periodontal ligament cells:effect of serum,culture medium,and osteoinductive medium[J].J Periodontal Res,2007,42(3):244-252.
[11]Wu X,Lin M,Li Y,et al.Effects of DMEM and RPMI 1640 on the biological behavior of dog periosteum-derived cells[J].Cytotechnology, 2009,59(2):103-111.
[12]Javazon EH,Colter DC,Schwarz EJ,et al.Rat marrow stromal cells are more sensitive to plating density and expand more rapidly from single-cell-derived colonies than human marrow stromal cells[J]. Stem Cells,2001,19(3):219-225.
[13]Majumdar MK,Banks V,Peluso DP,et al.Isolation,characterization, and chondrogenic potential of human bone marrow-derived multipotential stromal cells[J].J Cell Physiol,2000,185(1):98-106.
[14]Coelho MJ,Cabral AT,Fernande MH.Human bone cell cultures in biocompatibility testing.Part I:osteoblastic differentiation of serially passaged human bone marrow cells cultured in alpha-MEM and in DMEM[J].Biomaterials,2000,21(11):1087-1094.
[15]Ohnishi K.Serum levels of thrombomodulin,intercellular adhesion molecule-1,vascular cell adhesion molecule-1,and E-selectin in the acute phase of Plasmodium vivax malaria[J].Am J Trop Med Hyg,1999,60(2):248-250.
[16]Boateng SY,Lateef SS,Mosley W,et al.RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes [J].Am J Physiol Cell Physiol,2005,288(1):C30-38.
[17]Willett RL,Baldwin KW,West KW,et al.Differential adhesion of amino acids to inorg-anic surfaces[J].Proc Natl Acad Sci USA, 2005,102(22):7817-7822.
[18]Maeno S,Niki Y,Matsumoto H,et al.The effect of calciumion concentration on osteoblast viability,proliferation and differentiation in monolayer and 3D culture[J].Biomaterials,2005,26(23):4847-4855.
[19]StolzingA,ColemanN,ScuttA.Glucose-inducedreplicativesenescence in mesenchymal stem cells[J].Rejuvenation Res,2006,9(1):31-35. [20]Tennant GB,Truran LN,Bailey-Wood R,et al.Control of pH in human long-term bone marrow cultures with low-glucose medium containing zwitterion buffer lengthens the period of haemopoietic activity[J].Br J Haematol,2000,109(4):785-787.
[21]Goshima J,Goldberg VM,Caplan AI.The osteogenic potential of culture-expanded rat marrow mesenchymal cells assayed in vivo in calcium phosphate ceramic blocks[J].Clin Orthop Relat Res,1991, 262:298-311.
Effects of Media on the Proliferation and Differentiation of Bone Marrow Stromal Cells in Beagle Dogs
ObjectiveTo investigate the effects of different media:α-MEM,DMEM-LG and RPMI 1640 on the biological behavior of bone marrow stromal cells(BMSCs)in Beagle dogs,and provide the more ideal culture medium for BMSCs.MethodsBMSCs derived from 6 Beagle dogs were harvested and grown in α-MEM,DMEM-LG and RPMI 1640 media respectively.The proliferation,attachment rate and mineralized nodules of the cells were observed and compared.ResultsCells cultured by α-MEM showed the highest attachment rat.After eliminating the difference of adherent rate,there was no obvious difference in the proliferation between α-MEM and DMEM.In α-MEM group,the expression of alkaline phosphate (ALP)was the highest,while the number of mineralized nodules was the least.DMEM group exhibited the most mineralized nodules.ConclusionAs a culture medium DMEM-LG may be more suitable for BMSCs of dogs in vitro.
Bone marrow stromal cells;Tissue engineering;Media;Proliferation;Differentiation
Q813.1+1
A
1673-0364(2009)04-0181-05
2009年5月27日;
2009年7月1日)
10.3969/j.issn.1673-0364.2009.08.001
国家自然科学基金(30471892)、福建省自然科学基金(2008J0085)、福建医科大学附属口腔医院重点学科建设学术发展基金[闽医大口腔(2008)39号]。
350004福建省福州市福建医科大学口腔医学院,福建医科大学口腔组织工程研究室。
闫福华。
HUANG Yongling,YAN Fuhua,ZHONG Quan,ZHAO Xin.
School of Stomatology,Tissue Engineering Research Center of Stomatology, Fujian Medical University,Fuzhou 350004,China.Corresponding author:YAN Fuhua.

