大鼠睾丸间质细胞体外培养不同时间3β-羟基类固醇脱氢酶的表达
毕宏达 王晓云 周广东 刘 伟 李 鸣 邢 新
大鼠睾丸间质细胞体外培养不同时间3β-羟基类固醇脱氢酶的表达
毕宏达 王晓云 周广东 刘 伟 李 鸣 邢 新
目的探讨通过差速贴壁法获得的7天龄、3周龄大鼠睾丸间质内细胞的细胞群体构成、体外培养不同时间3β-羟基类固醇脱氢酶(3β-HSD)的表达水平变化,以及细胞睾酮分泌功能变化。方法联合应用胶原酶消化、不锈钢滤网过滤及差速贴壁法获得7天龄、3周龄雄性Wistar大鼠睾丸间质组织内细胞,贴壁细胞以DMEM/F12培养液培养,分别对原代培养2 h、4 d细胞进行3β-HSD免疫化学染色及流式细胞分析,原代培养细胞同时给予人绒毛膜促性腺激素(HCG)刺激,测定HCG刺激组和非刺激组各代细胞培养液上清中睾酮水平及其对HCG刺激的反应。结果7天龄、3周龄鼠差速贴壁法获得的睾丸间质内细胞群经流式细胞鉴定,3β-HSD阳性细胞所占比例分别为(5.4±1.2)%、(59.2±3.2)%;培养4 d后,两组3β-HSD阳性细胞比例分别为(93.6±1.2)%、(95.4±3.2)%。两组原代培养细胞均有睾酮生成功能,在HCG刺激下睾酮分泌均明显上升,7天龄组培养细胞睾酮分泌高峰迟于3周龄组。结论差速贴壁法获得的7天龄、3周龄大鼠睾丸间质细胞群中均含有部分Leydig干细胞(Stem Leydig cells,SLCs),SLCs在体外培养过程中逐渐分化,表达3β-羟基类固醇脱氢酶,并产生睾酮。
睾丸间质细胞差速贴壁法睾酮3β-羟基类固醇脱氢酶组织工程
因创伤、肿瘤等导致的睾丸缺失临床上并不少见。随着现代社会生活节奏加快、环境污染、人口老龄化等原因,雄激素缺乏症呈逐年上升的趋势。采用组织工程技术构建具有生物学活性的雄激素分泌组织,有望成为治疗上述疾病的理想治疗途径。但是,传统的Leydig细胞分离技术主要采用胶原酶消化、Percoll密度梯度离心等一系列复杂方法,细胞得率低、活力差,使种子细胞的来源问题成为困扰组织工程化雄激素分泌组织研究的瓶颈。在前期研究中,我们发现Leydig细胞在大鼠睾丸分离细胞中具有贴壁迅速的特点,据此建立了一种简易快速的Leydig细胞分离技术。与传统的Leydig细胞分离方法相比,差速贴壁法分离的Leydig细胞得量大、纯度较高、细胞活力良好,初步解决了组织工程技术构建雄激素分泌组织种子细胞来源的问题。用该方法获得的Leydig细胞所构建的组织工程化雄激素分泌组织能在较长时期维持睾酮分泌功能[1-2]。
但是,差速贴壁法所获得的Leydig细胞具体的细胞成分目前还不清楚,其中是否含有Leydig干细胞(Stem Leydig cells,SLCs)成分尚不肯定;对不同鼠龄的大鼠采用差速贴壁法获得的Leydig细胞成分是否完全一致仍不明确。本研究中,我们选择两种不同鼠龄的大鼠,以差速贴壁法获取睾丸间质Leydig细胞进行体外培养,通过不同培养阶段对Leydig细胞标志物3β-羟基类固醇脱氢酶(3β-HSD)的检测,深入研究经差速贴壁法获得大鼠睾丸间质细胞具体成分,探讨所获得细胞在体外培养中的转化过程,以进一步优化雄激素分泌组织的种子细胞构成。
1 材料与方法
1.1 睾丸间质细胞获取
出生后7天龄、3周龄雄性Wistar大鼠(中科院上海实验动物中心提供)脱颈法处死,无菌取睾丸,PBS冲洗后,冰上剥离白膜及较大的血管。将0.25%胶原酶NB4(Serva,德国)与组织量按1:1比例,37℃、100次/分钟振荡消化至睾丸组织形状刚好消失,曲细精管间组织松散,但曲细精管连续而无明显断裂时,加入2倍于消化悬液体积的培养液或PBS终止消化,以直径为30 μm的不锈钢滤网过滤,滤液经1500 r/min离心5 min,所得细胞计数后以2.5×106cell/cm2的密度进行接种。37℃、5%CO2、95%O2和100%湿度下,以无血清的DMEM/F12(1:1)培养液培养。2 h后吸弃培养液中未贴壁的悬浮细胞,以PBS漂洗后加入DMEM/F12培养液培养。
1.2 原代及培养4 d后细胞成分分析
1.2.1 3β-HSD免疫细胞化学鉴定
原代细胞贴壁分离后即刻行3β-HSD免疫化学染色。以4%多聚甲醛固定10 min,PBS冲洗,1.25%Triton-X 100破膜,正常羊血清封闭非特异性反应位点,滴加兔抗人3β-HSD特异性多克隆抗体、4℃过夜,PBS冲洗一抗,滴加羊抗兔IgG第二抗体,37℃反应30 min,DAB显色,苏木素核衬染,镜下观察。原代细胞培养4 d后重复上述实验。
1.2.2 3β-HSD免疫细胞化学流式细胞仪检测鉴定
原代细胞贴壁分离后即刻,以0.25%胰蛋白酶-0.02%EDTA消化,收集待测细胞,PBS冲洗,4%多聚甲醛固定,1%Triton-BSA进行细胞膜穿孔,标记兔抗人3β-HSD特异性多克隆抗体(1:100,Santa Cruz,美国)及FITC标记的羊抗兔IgG(1:1 000,DAKO,美国),流式细胞仪(Beckman Coulter,USA)进行3β-HSD阳性鉴定,检测阳性细胞百分比。原代细胞培养4 d后重复上述实验。
1.3 原代培养细胞睾酮分泌功能检测
原代细胞按每孔1.0×105个接种于24孔板上,每天收集原代细胞HCG刺激组和无刺激组培养液上清,经Access全自动免疫分析系统(RIA,微粒子发光原理)(Beckman Coulter,USA)测定睾酮水平。
2 实验结果
2.1 差速贴壁法获得睾丸间质内细胞
7天龄的Wistar大鼠睾丸去除白膜后,湿重为(0.081±0.023)g;3周龄大鼠睾丸去白膜后湿重为(1.67±0.49)g。采用差速贴壁法,7天龄大鼠每克睾丸组织湿重可获得(0.06±0.004)×106个细胞,3周龄大鼠睾丸每克湿重收获细胞数为(1.4±0.6)×106个。
2.2 原代培养细胞形态改变
原代培养2 h后,7天龄、3周龄大鼠睾丸间质细胞均为圆形,未铺展(图1-A、D)。原代培养12 h,7天龄大鼠睾丸间质细胞多数为长梭形,镜下观察具有高折光性,细胞聚集为条索状,呈特征性的六边形排列(图1-B);培养4 d后,多数细胞完全铺展,呈拉网样生长(图1-C)。3周龄鼠睾丸间质内细胞原代培养12 h后细胞开始铺展,呈拉网样生长,其中部分细胞呈长梭形(图1-E),培养过程中细胞形态无显著改变(图1-E、F)。
2.3 培养细胞成分分析
7天龄大鼠差速贴壁法获得的睾丸间内细胞绝大多数3β-HSD免疫化学染色阴性(图2-A),体外培养4 d后绝大多数细胞表达3β-HSD(图2-B);经流式细胞分析,贴壁分离即刻(5.4±1.2)%细胞3β-HSD阳性,原代培养4 d后3β-HSD阳性细胞比例为(93.6±1.2)%(图3-A、B)。3周龄大鼠大部分原代细胞表达3β-HSD(图3-C),培养4 d后,绝大多数梭形细胞及铺展细胞均表达3β-HSD(图3-D);经流式细胞分析,贴壁分离即刻(59.2±3.2)%细胞3β-HSD阳性,原代培养4 d后3β-HSD阳性细胞比例为(95.4±3.2)%(图3-C、D)。
2.4 培养细胞睾酮分泌功能检测
7天龄鼠睾丸间质细胞在培养中睾酮分泌能力逐渐增强,第5天达到高峰(图4);3周龄鼠睾丸间质细胞在培养第2天睾酮分泌功能达到高峰,其后逐渐下降(图5)。两组培养的睾丸间质细胞均对HCG刺激有反应,在HCG作用下睾酮分泌增加。
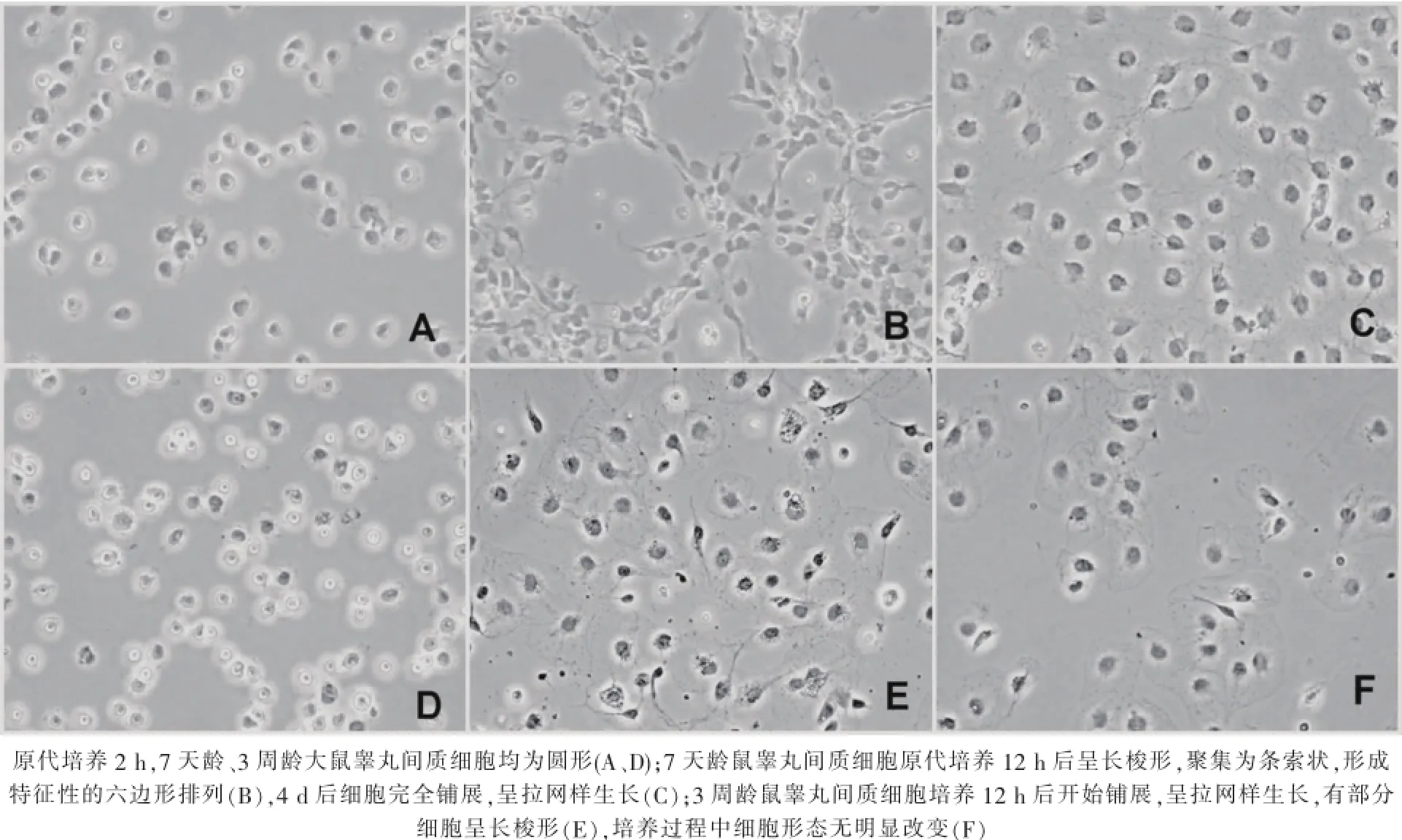
图1 原代培养细胞形态变化
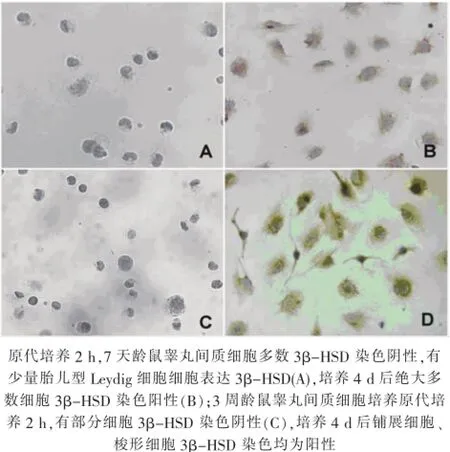
图2 培养细胞3β-HSD免疫组织化学染色
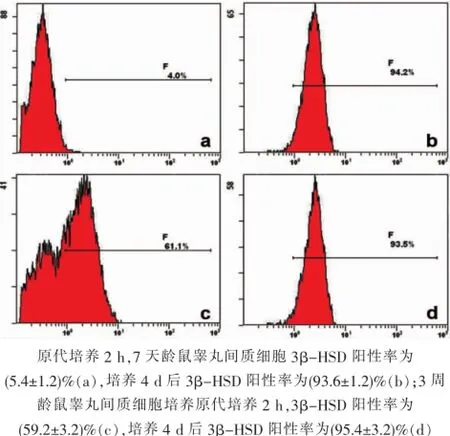
图3 培养细胞3β-HSD流式细胞学分析
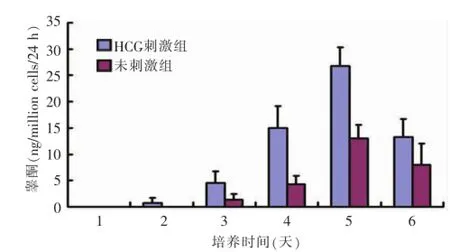
图47 天龄大鼠睾丸间质细胞睾酮分泌能力检测
3 讨论
组织工程技术的发展可能为睾丸缺失、雄激素缺乏性疾病的治疗提供理想的治疗手段。作为组织工程化雄激素分泌组织的重要种子细胞,睾丸Leydig细胞的获取一直是限制该研究深入的瓶颈。传统的Leydig细胞收获技术,是基于细胞密度差异基础上、以Percoll密度梯度离心为主要手段的一系列复杂分离过程,细胞获得量少、流失量大且活力低。本课题组在前期研究中采用差速贴壁的方法收获Leydig细胞,初步解决了雄激素分泌组织构建的种子细胞来源问题。但对于差速贴壁法获得的Leydig细胞具体细胞成分了解尚少。本研究中,我们采用差速贴壁法收获7天龄、3周龄大鼠睾丸间质内细胞,通过细胞培养观察、免疫组织细胞化学染色、流式细胞术分析以及细胞生物学活性检查等方法,证实了经差速贴壁法,从不同鼠龄的大鼠睾丸内获得的Leydig细胞中均含有一定比例的SLCs,不同鼠龄大鼠睾丸Leydig细胞群中干细胞比例是不同的,但在体外培养过程中所获得的SLCs均逐渐分化,获得3β-HSD酶活性。
睾丸SLCs是具有向Leydig成体细胞定向分化能力的间充质来源干细胞,大鼠的SLCs在出生后第2周(有报道最早于出生后第10天)开始向成体细胞分化,形成Leydig前体细胞(Progenitor Leydig cells,PLCs)。3β-HSD的表达与否,是SLCs与PLCs区别的重要标志[3-4]。本研究中,我们在体外培养的不同时段对两组培养细胞进行3β-HSD免疫化学染色鉴定及流式细胞分析,原代培养4 d后的检测结果,证实了所获得的细胞为纯化的Leydig系细胞。而在培养初期(贴壁2 h),两组均有部分细胞为3β-HSD阴性,培养4 d后细胞3β-HSD阳性率明显升高。我们在培养过程中没有观察到细胞增殖现象,不存在阳性细胞增殖导致培养细胞3β-HSD阳性率升高的可能。因此可以肯定,培养初期的3β-HSD阴性细胞在培养过程中发生了转化,获得了3β-HSD活性。上述结果表明,差速贴壁法能够获得的7天龄、3周龄大鼠睾丸Leydig系细胞中,都含有一定比例的SLCs。但是,在DMEM/F12培养液培养条件下,所获得的SLCs很快发生了分化。
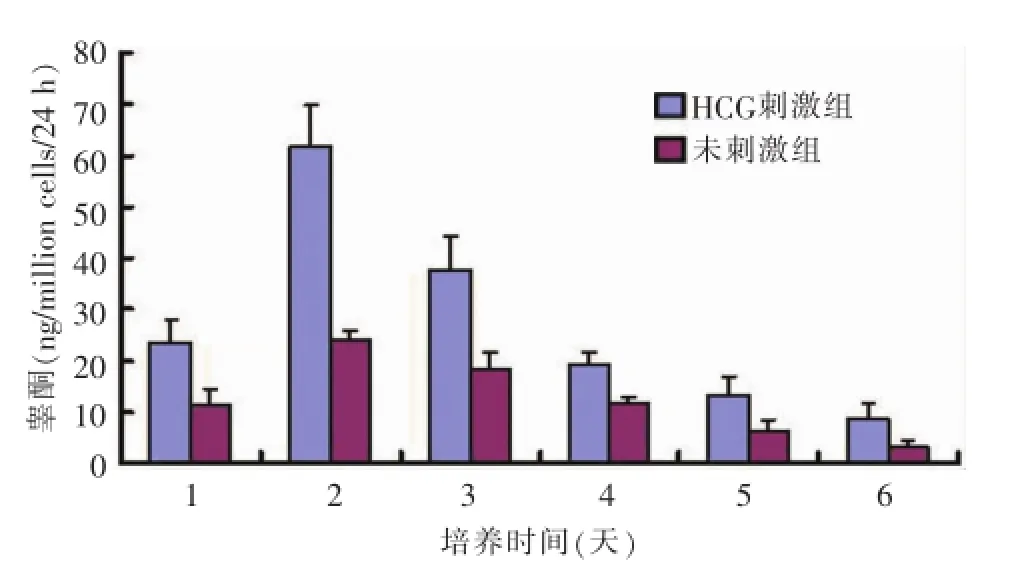
图53 周龄大鼠睾丸间质细胞睾酮分泌能力检测
不同鼠龄的大鼠,经差速贴壁法获得的Leydig细胞中干细胞所占的比例存在较大差异,这种差异与大鼠睾丸Leydig细胞发育的阶段特点是一致的。睾丸SLCs向成体细胞分化开始于出生后第10天,7天龄大鼠睾丸间质内SLCs尚处于未分化状态,仅有少量的胎儿型Leydig细胞存在[5]。自出生后第10天开始,SLCs大量增殖、分化,产生成体Leydig细胞,SLCs在睾丸间质内的比例随着Leydig细胞的发育成熟逐渐下降[6]。我们通过差速贴壁法获得的睾丸间质细胞,在7天龄大鼠组以睾丸间质干细胞为主,在3周龄大鼠组Leydig前体细胞、成体细胞占到了较高的比例,反映了SLCs在睾丸组织内所占比例的变化规律。
两组大鼠Leydig细胞在培养过程中都检测到睾酮分泌功能,在HCG刺激下睾酮分泌能力均明显提高,但睾酮分泌功能变化不完全一致。3周龄组细胞中因成体细胞占到了一定比例,早期即表现出睾酮分泌能力,在培养第2天达到睾酮分泌高峰后逐渐下降;7天龄组最初睾酮分泌水平较低,在培养过程中细胞逐渐获得睾酮分泌活性,分泌高峰出现在培养第5天。上述结果说明,SLCs有助于睾丸Leydig细胞维持睾酮分泌的持续时间。在成年动物体内,雄激素来源主要依赖于睾酮分泌功能最旺盛的成体Leydig细胞,而成体Leydig细胞为终末分化细胞,不具备增殖能力,其数量的稳定依靠SLCs维持。我们以前构建的雄激素分泌组织在较长时间(6个月)内维持睾酮分泌能力,与差速贴壁法获得的Leydig细胞中含有一定量的SLCs不无关系。
纯化的SLCs在特殊设计的培养体系内能够维持细胞表型稳定,持续增殖[6]。本研究中,我们获得的SLCs未出现增殖现象,并且细胞在培养过程中很快出现分化。一方面是由于目前的培养体系不利于细胞扩增;另一方面,差速贴壁法获得的细胞群中,各级Leydig细胞成分混杂在一起,细胞共培养通常会促使干细胞分化。通过改善细胞培养体系、细胞纯化等措施,有望实现差速贴壁法获得的SLCs的稳定体外扩增,并通过调节种子细胞中干细胞比例的方式,优化雄激素分泌组织种子细胞的构成,实现组织工程化雄激素分泌组织维持长期、稳定的睾酮分泌功能。
综上所述,经差速贴壁法获得的睾丸间质细胞群中含有一定比例的SLCs,其比例随着动物年龄的不同而存在一定差异,体外培养过程中SLCs能够分化为有睾酮分泌功能的成体细胞,有助于差速贴壁法获得的细胞群睾酮分泌功能的持续。但是,差速贴壁法获得的睾丸Leydig系各种细胞成分的纯化、增殖,仍需进一步深入研究。
[1]王晓云,邢新,周广东.简易快速获得大量高纯度大鼠Leydig细胞[J].中华泌尿外科杂志,2007,28:86-90.
[2]王晓云,邢新,周广东.共培养大鼠睾丸体细胞组织工程技术构建雄激素分泌组织[J].中华医学杂志,2007,87(31):2223-2227.
[3]Chamindrani SML,Handagama M,Siril HB,et al.Differentiation of the adult Leydig cell population in the postnatal rat testis[J]. Bio Repro,2001,65:660-671.
[4]Davidoff MS,Middendorff R,Enikolopov G,et al.Progenitor cells of the testosterone-producing Leydig cells revealed[J].J Cell Biology,2004,167(5):935-944.
[5]Siril HB,Chamindrani SML,Handagama M,et al.Studies on the onset of Leydig precursor cell differentiation in the prepubertal rat testis[J].Bio Repro,2000,63:165-171.
[6]Teerds KJ,Rijntjes E,Veldhuizen-Tsoerkan MB,et al.The development of rat Leydig cell progenitors in vitro:howessential is luteinising hormone[J]?J Endocrinology,2007,194:579-593.
[7]Ge RS,Dong Q,Sottas CM,et al.In search of rat stem Leydig cells: Identification,isolation,and lineage-specific development[J]. PNAS,2006,103(8):2719-2724.
Expression of 3β-Hydroxysteroid Dehydrogenase in Rat Leydig Cells Cultured by Differential Adhesion In Vitro
BI Hongda1,WANG Xiaoyun1,ZHOU Guangdongi2,LIU Wei2,LI Ming1,XING Xin1.
1 Department of Plastic Surgery, Changhai Hispital,Second Military Medical University,Shanghai 200433,China.2 Shanghai Laboratory of Tissue Engineering, Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding auther:XING Xin.
ObjectiveTo investigate the constitution of cells population,changes in 3β-hydroxysteroid dehydrogenase (3β-HSD)expression and androgen productivity in rat Leydig cells cultured by differential adhesion during 4 days primary culture.MethodsTestes from 7 days and 3 weeks old rats were harvested,then Leydig cells were isolated by using collagenase dispersion,stainless steel mesh infiltration and differential adhesion.3β-HSD expression in cultured cells was observed by immunohistochemistry and flow Cytometry analysis immediately after cell isolation and 4 days later.Testosterone level in isolated Leydig cells with or without HCG stimulation was also tested.ResultsIn 7 days group and 3 weeks old group 3β-HSD positive rates in cultured cells were 5.4±1.2%and 59.2±3.2%respectively after isolation immediately.4 days affer culture,most of the cultured cells(93.6±1.2%in 7 days old group,95.4±3.2%in 3 weeks old group)became 3β-HSD positive.Testosterone level,increased by HCG stimulation,in cultured cells from both groups.ConclusionLeydig cells obtained by differential adhesion from 7 days and 3 weeks old rats consist Stem Leydig cells(SLCs).These SLCs were differentiated and gained 3β-HSD activity during cell culture.
Leydig Cell;Differential Adhesion;Testosterone;3β-hydrosteroid dehydrogenase;Tissue Engineering
Q813.1+1
A
1673-0364(2009)-01-0007-05
2008年12月11日;
2009年1月14日)
10.3969/j.issn.1673-0364.2009.01.003
200433上海市第二军医大学长海医院整形外科(毕宏达,王晓云,李鸣,邢新);200011上海市上海交通大学医学院附属第九人民医院,上海组织工程重点实验室(周广东,刘伟)。
邢新。

