Ⅰ期子宫内膜癌预后简易评分系统的建立
【摘 要】目的:构建Ⅰ期子宫内膜癌预后简易评分系统为临床提供参考工具。方法:回顾性收集2014年至2021年于重庆医科大学附属第一医院接受了手术治疗的Ⅰ期子宫内膜癌患者的病例资料,通过单因素及多因素Cox回归分析筛选与患者复发及死亡相关的影响因子。基于多因素分析结果,构建简易评分系统,利用受试者工作特征(receiver operating characteristic,ROC)曲线及其曲线下面积(area under the curve,AUC)比较评分系统和单一预测因子对患者预后的预测准确度。利用X-title软件确定评分系统的截值点并对患者进行风险分组,比较不同分组患者预后分布情况。结果:多因素分析结果提示,患者年龄(复发:Wald χ2=4.482,P=0.034;死亡:Wald χ2=8.401,P=0.004)、病理分型(复发:Wald χ2=6.692,P=0.010;死亡:Wald χ2=4.222,P= 0.040)、肌层浸润情况(复发:Wald χ2=6.372,P=0.034;死亡:Waldχ2=7.183,P=0.007)、淋巴脉管间隙侵犯(lymphovascular space invasion,LVSI)(复发:Wald χ2=13.396,P<0.001;死亡:Wald χ2=8.449,P=0.004)、雌激素受体(estrogen receptor,ER)表达(复发:Wald χ2=7.679,P=0.006;死亡:Wald χ2=8.532,P=0.003)及P53表达(复发:Wald χ2=7.886,P=0.005;死亡:Wald χ2=7.174,P= 0.007)均是患者复发及死亡的影响因素。基于以上6个因素成功构建评估患者预后的简易评分系统,ROC曲线显示评分系统的AUC值大于单一预测因子。X-title软件确定了评分系统的截值点并自动将患者分为低风险组(0~1分)、中风险组(2~3分)及高风险组(4~6分),3组患者之间总体预后水平差异有统计学意义(P<0.001)。结论:本研究构建的简易评分系统对Ⅰ期子宫内膜癌患者预后评估有一定价值。
【关键词】Ⅰ期;子宫内膜癌;预后;评分系统
【中图分类号】R711.74【文献标志码】A【收稿日期】2023-08-10
基金项目:2022年重庆市科卫联合资助项目(编号:2023MSXM116)。
Establishment of a simple prognostic scoring system for stage Ⅰ endometrial carcinoma
Ding Shanshan,Jiang Peng,Yuan Rui,Hu Zhuoying
(Department of Gynecology,The First Affiliated Hospital of Chongqing Medical University)
【Abstract】Objective:To establish a simple prognostic scoring system for stage Ⅰ endometrial carcinoma,and to provide a reference tool for clinical practice. Methods:A retrospective analysis was performed for the case data of the patients with stage Ⅰ endometrial carcinoma who received surgical treatment in The First Affiliated Hospital of Chongqing Medical University from 2014 to 2021,and univariate and multivariate Cox regression analyses were used to identify the influencing factors for recurrence and death. A simple scoring system was established based on the results of the multivariate analysis,and the receiver operating characteristic(ROC)curve and the area under the ROC curve(AUC)were used to compare the accuracy of the scoring system versus each single predictive factor in predicting the prognosis of patients. X-title software was used to determine the cut-off value of the scoring system and divide the pa? tients into different risk groups,and then the prognosis distribution of patients was compared between groups. Results:The multivariate analysis showed that age(recurrence:Wald χ2=4.482,P=0.034;death:Wald χ2=8.401,P=0.004),pathological type(recurrence:Waldχ2=6.692,P=0.010;death:Wald χ2=4.222,P=0.040),myometrial invasion(recurrence:Wald χ2=6.372,P=0.034;death:Wald χ2=7.183,P=0.007),lymphovascular space invasion(recurrence:Wald χ2=13.396,P<0.001;death:Wald χ2=8.449,P=0.004),the expression of estrogen receptor(recurrence:Wald χ2=7.679,P=0.006;death:Wald χ2=8.532,P=0.003),and P53 expression(recurrence:Wald χ2= 7.886,P=0.005;death:Wald χ2=7.174,P=0.007)were influencing factors for recurrence and death. A simple scoring system was suc? cessfully established for the prognosis of patients based on the above six factors,and the ROC curve analysis showed that the scoring system had a larger AUC than each predictive factor alone. The cut-off value of the scoring system was determined by X-title software,and the patients were divided into low-risk group(0-1 points),intermediate-risk group(2-3 points),and high-risk group(4-6 points); there was a significant difference in overall prognosis be? tween the three groups(P<0.001). Conclusion:The simple scoring system established in this study has a certain value in assessing the prognosis of patients with stage I endometrial carcinoma.
【Key words】stage I;endometrial carcinoma;prognosis;scoring sys? tem
子宫内膜癌是妇科常见恶性肿瘤,好发于绝经后女性[1]。就子宫内膜癌流行病学而言,由于Ⅰ期子宫内膜癌患者的比例达到了70%以上,因此患者总体预后较好[2]。但近年来,研究表明子宫内膜癌患者有年轻化趋势,且发病率和死亡率也逐年升高,即使是Ⅰ期子宫内膜癌,仍有不少患者发生了复发,从而导致患者死亡[3-4]。如何从看似“低风险”的Ⅰ期患者中筛选出潜在的复发和死亡高风险患者是当前研究努力的一个方向。尽管目前已开发出了许多用于预测子宫内膜癌复发或死亡的预后模型或风险分层系统,但这类预后模型或风险分层系统大多太过繁复难懂,不易于临床推广,且由于纳入研究的对象往往是所有分期的子宫内膜癌患者,因此对Ⅰ期子宫内膜癌患者的预后评估作用具有一定的局限性[5]。基于上述情况,本研究目的是通过纳入Ⅰ期子宫内膜癌患者队列,构建Ⅰ期子宫内膜癌预后简易评分系统,为Ⅰ期子宫内膜癌患者的预后管理提供简便且易在临床推广应用的辅助参考工具。
1 资料与方法
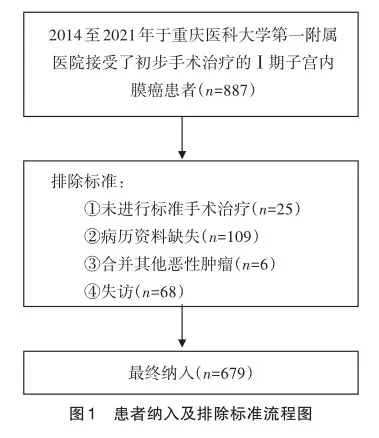
1.1 研究对象
回顾性收集2014年至2021年于重庆医科大学附属第一医院接受了手术治疗的Ⅰ期(2009版FIGO分期)子宫内膜癌患者的病例资料[6],包括患者年龄、体质指数(body mass index,BMI)、手术程序、术后病检结果(肿瘤大小、肿瘤组织学类型和分级、肿瘤肌层浸润深度等)、免疫组化参数(雌激素受体、孕激素受体及P53蛋白)表达结果。患者纳入及排除标准见图1。本研究获得了重庆医科大学附属第一医院伦理委员会的批准(伦理审批号:2020192)。
1.2 治疗及随访
纳入本研究的所有患者均接受了至少全子宫切除术+双侧输卵管卵巢切除术±前哨淋巴结活检±盆腔淋巴结切除术±腹主动脉旁淋巴结切除术,术后根据病检结果并结合相应国际指南建议患者是否需要接受辅助治疗(放疗、化疗或放化疗)[7]。从手术当天开始,前2年每3个月随访1次,后3年每6个月随访1次,此后每年随访1次[8]。随访方案包括妇科查体、血清学肿瘤标志物检查及必要的影像学检查(妇科B超、盆腔计算机断层扫描、盆腔磁共振成像及正电子发射计算机断层显像等)等[5]。随访期间患者是否复发由2名以上妇科肿瘤学专家通过查体结果、血清学肿瘤标志物结果、影像学结果及活检结果等进行综合评估,并尽可能取得病理学结果支持。无复发生存期(recurrence-free survival,RFS)定义为患者手术当天至患者被确诊为复发当天之间的时间,总生存期(overall survival,OS)定义为患者手术当天至患者死亡之间的时间[8]。
1.3 术后组织病理学检查及免疫组化分析
患者大体标本离体后立即予以福尔马林组织固定液固定,并在30 min内送至重庆医科大学病理实验研究中心按照统一的步骤进行包埋、切片、苏木精伊红染色及免疫组化分析等。免疫组化分析通过免疫组织化学自动染色仪(Leica Bond-Max,英国米尔顿凯恩斯)进行,即用型抗体ER(clone SP1),PR(clone MX009)和P53(clone MX008)(均购自中国福州迈新生物科技公司)用于免疫组织化学染色,具体免疫组织化学染色步骤见先前已发表的参考文献[9-10]。
病理结果(肿瘤大小,侵犯范围,肿瘤组织学类型及分级等)及免疫组化结果由病理实验中心初级医师进行判读,并由上级医师进行复核。子宫内膜癌病理Ⅰ型定义为1级和2级子宫内膜样腺癌,Ⅱ型定义为3级子宫内膜样腺癌和非子宫内膜样癌,包括浆液性癌、透明细胞癌和其他组织类型[11]。免疫组化结果判读主要从染色强度(弱阳性、中等阳性及强阳性)和染色比例(0%~100%)进行评估[9,12]。雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)的免疫组化结果被定义为阴性表达(细胞核强阳性染色肿瘤细胞比例<1%)和阳性表达(细胞核强阳性染色肿瘤细胞比例≥1%)[13]。P53免疫组化结果被定义为异常表达(突变型表达)和正常表达(野生型表达)[9,14]。
1.4 统计学方法
使用SPSS 26.0统计学软件对数据进行处理。计量资料以均数±标准差(x±s)或Md(P25,P75)表示,组间比较采用t检验或秩和检验;计数资料以例(%)表示,组间比较采用卡方检验。通过单因素及多因素Cox回归分析(单因素分析P<0.05的因素纳入多因素分析)筛选与患者复发及死亡相关的影响因子。基于多因素分析结果,构建简易评分系统,利用受试者工作特征(receiver operating characteristic,ROC)曲线及其曲线下面积(area under the curve,AUC)比较评分系统和单一预测因子对患者预后的预测准确度。利用Xtitle软件(版本3.6.1,https://medicine.yale.edu/lab/rimm/re? search/software/)确定评分系统的截值点并对患者进行风险分组,利用Kaplan-Meier生存曲线和log-rank检验比较不同分组患者预后分布情况。检验水准α=0.05。
2 结 果
2.1 患者基线特征
如表1所示,通过纳入及排除标准,最终共有679例患者纳入到本研究中,患者平均年龄为(53.61±9.34)岁,平均BMI为(24.61±3.64) kg/m2。大部分患者(496例,73.00%)病理分型为Ⅰ型,分别有571(84.10%)例和542(79.80%)例患者ER和PR阳性表达,但有254(37.40%)例患者P53异常表达。患者中位随访时间为49.00(40.00,65.00)个月,随访期间共有71(10.50%)例患者考虑复发,而有57(8.40%)例患者死亡。
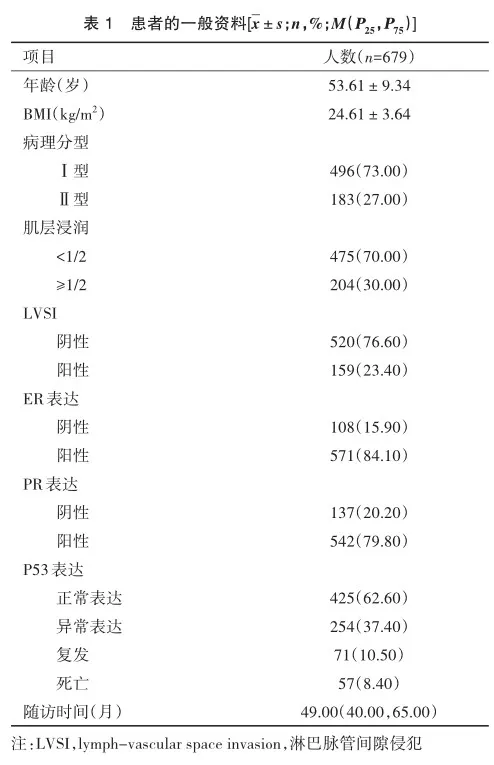
2.2 与子宫内膜癌预后(复发及死亡)相关的单因素及多因素Cox回归分析
如表2和表3所示,单因素Cox回归分析发现,患者年龄(复发:Wald χ2=18.096,P<0.001;死亡:Wald χ2=22.178,P< 0.001)、病理分型(复发:Wald χ2=48.207,P<0.001;死亡:Wald χ2=32.325,P<0.001)、肌层浸润深度(复发:Wald χ2= 29.265,P<0.001;死亡:Wald χ2=26.393,P<0.001)、LVSI(复发:Wald χ2=38.093,P<0.001;死亡:Wald χ2=23.915,P< 0.001)、ER表达(复发:Wald χ2=62.055,P<0.001;死亡:Waldχ2=43.818,P<0.001)、PR表达(复发:Wald χ2=44.915,P< 0.001;死亡:Wald χ2=26.228,P<0.001)及P53表达(复发:Wald χ2=12.031,P=0.001;死亡:Wald χ2=10.827,P=0.001)与患者复发和死亡均明显相关。进一步多因素分析发现,除PR表达外,其余6个预后因素包括年龄(复发:Waldχ2= 4.482,P=0.034;死亡:Wald χ2=8.401,P=0.004)、病理分型(复发:Wald χ2=6.692,P=0.010;死亡:Wald χ2=4.222,P= 0.040)、肌层浸润深度(复发:Wald χ2=6.372,P=0.034;死亡:Wald χ2=7.183,P=0.007)、LVSI(复发:Wald χ2=13.396,P< 0.001;死亡:Wald χ2=8.449,P=0.004)、ER表达(复发:Waldχ2=7.679,P=0.006;死亡:Wald χ2=8.532,P=0.003)及P53表达(复发:Wald χ2=7.886,P=0.005;死亡:Wald χ2=7.174,P= 0.007)仍与患者复发和死亡显示出了明显相关性。
2.3 Ⅰ期子宫内膜癌预后简易评分系统的建立
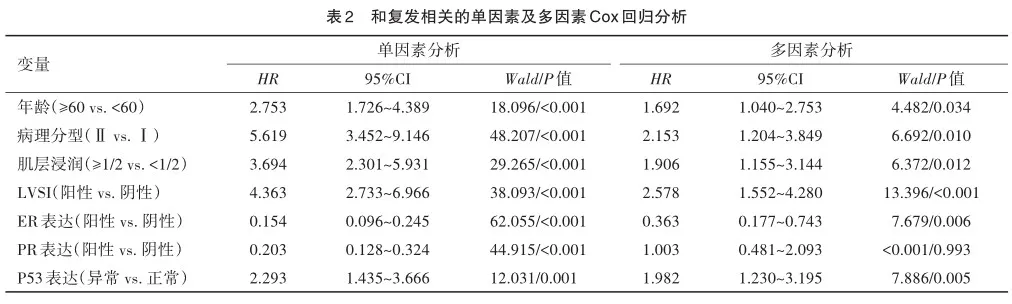
基于2.2中与子宫内膜癌复发及死亡相关的多因素分析结果,本研究以患者年龄、病理分型、肌层浸润深度、LVSI、ER表达及P53表达为评价指标,构建了简易评分系统。如图2所示,简而言之,任一评价指标的二分类情况均以0分或1分表示,累计总分为0~6分。
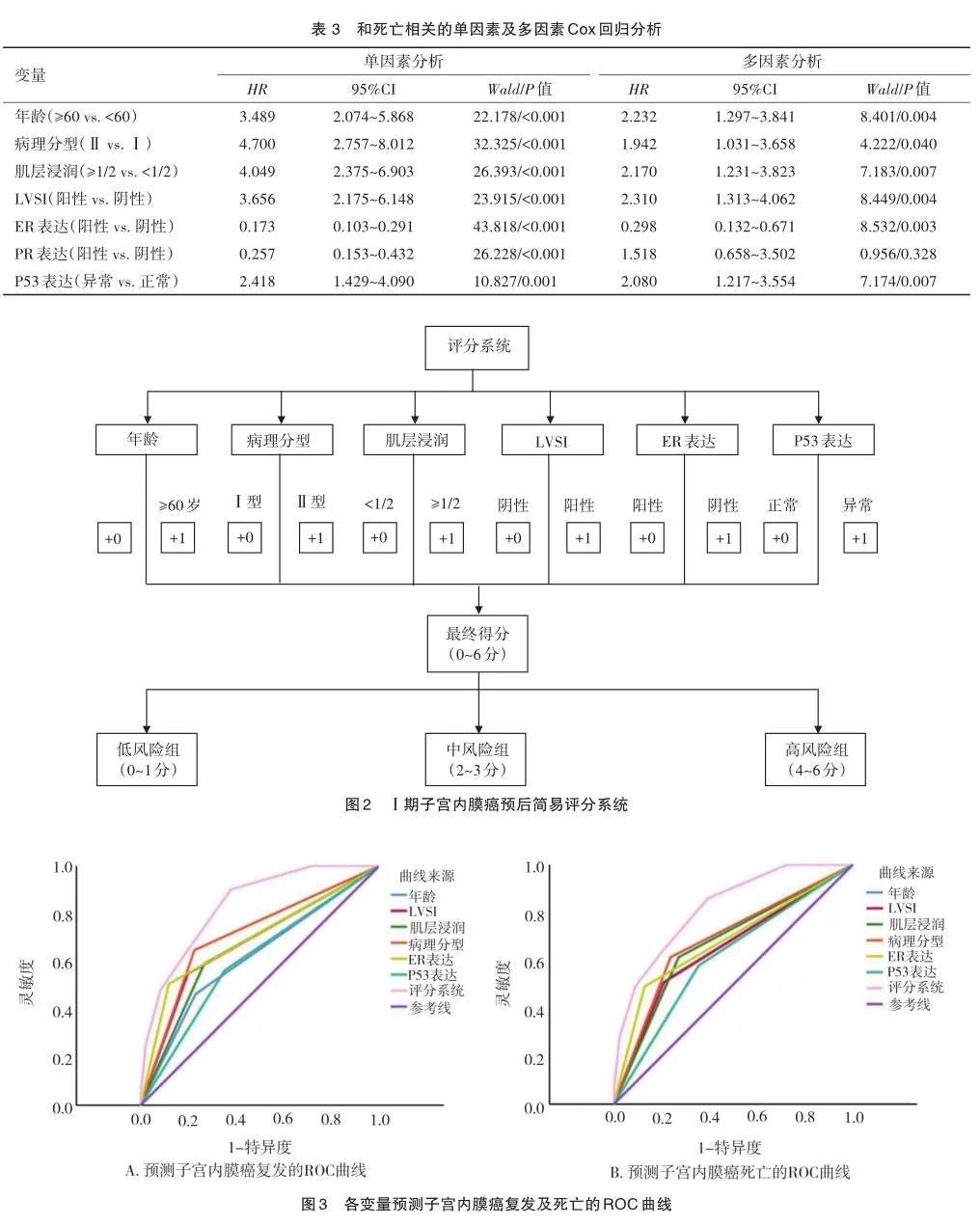
ROC曲线显示,评分系统用于预测患者复发及死亡的AUC分别为0.835(95%CI=0.792~0.879)和0.819(95%CI= 0.766~0.872),优于其他单一预测因子,包括年龄、病理分型、肌层浸润深度、LVSI、ER表达及P53表达(图3及表4)。
2.4 基于评分系统的风险分组
基于2.3中构建的评分系统,对每个患者进行预后评分,图4显示了患者评分分布情况,其中评分为1分的患者数量最多(214例,31.50%),其次是评分为0分的患者(171例,25.20%),占比最少的为评分为6分的患者(5例,0.70%)。
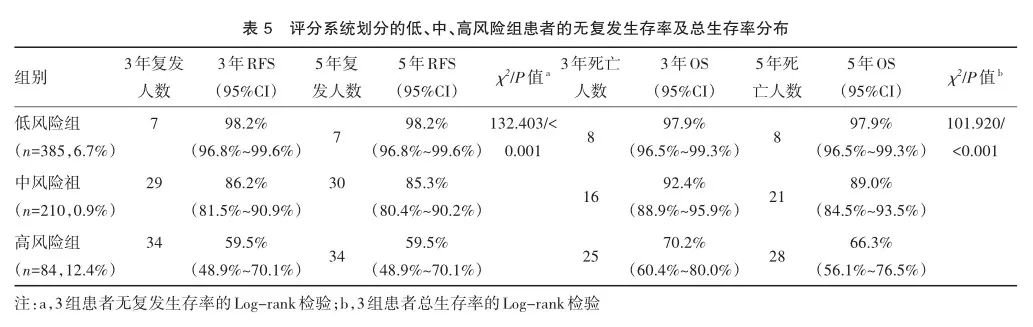
分别以复发和死亡为结局变量,通过X-title软件自动确定评分系统最佳截值点并将患者进行分组。如图5所示,无论是以复发或是死亡为结局变量,X-title确定的评分系统的截值点都是一致的,患者均被划分为了3组,即低风险组(0~1分),中风险组(2~3分),高风险组(4~6分)(图5A和 5C)。3组患者预后具有明显差异(RFS:χ2=132.403,P< 0.001;OS:χ2=101.920,P<0.001),其中低风险组患者预后最佳,3年及5年无复发生存率和总生存率均在98%左右,其次是中风险组,预后一般,而高风险组预后极差,3年及5年无复发生存率和总生存率均低于75%(图5B、5D及表5)。

3 讨 论
尽管肿瘤分期是影响子宫内膜癌患者预后的最直接相关因素,但并不是唯一因素,实际上即使在早期患者中,也有不少高危因素易导致患者预后结局不良[15]。比如,在本研究中通过单因素及多因素分析筛选出的与Ⅰ期子宫内膜癌患者预后结局显著相关的6个影响因素,包括患者年龄、病理分型、肌层浸润深度、LVSI、ER表达及P53表达。其中患者年龄、病理分型、肌层浸润深度以及LVSI是较为经典的临床病理参数,已被多个研究证实与子宫内膜癌预后密切相关[16]。而ER和P53作为分子标志物近年来被研究证明具有独立于临床病理参数的预后价值[17]。ER表达的缺失与患者不良预后关系密切,且ER表达缺失往往伴随PR表达缺失,这类患者对激素治疗往往不敏感[18]。同样,P53表达在本研究中也表现出了与子宫内膜癌预后的强烈相关性。值得一提的是,P53蛋白异常表达已被定义为4个分子分型亚组中预后最差的一个分子亚组[19]。本研究先前的研究也发现,P53异常表达的患者相较于P53正常表达的患者通常伴有不良临床病理特征,且更易发生远处转移和术后复发[20]。
基于上述多因素分析结果,本研究进一步建立了一个Ⅰ期子宫内膜癌预后评分系统。该评分系统具有一定临床应用价值,能够对患者预后进行评分,患者评分越高,说明合并的高危因素个数越多,高评分患者预后总体而言低于低评分患者,且ROC曲线提示,评分系统预测患者复发和死亡的预测准确度(AUC)都在0.8以上,这说明运用该评分系统能够帮助临床医生较为方便、快速及较为准确地对患者进行一个预后初评估。进一步地,本研究基于评分系统的不同截值点将患者分为了低、中及高风险3组。3组患者表现出了明显的预后差异,因此,本研究认为对评分不同的患者可能需要制定不同的预后管理方案。对于低风险组患者而言,患者总体预后较好,可进行严密的随访观察而不进行过度治疗。值得一提的是,某些患者可能由于仅仅合并了较差的病理分型(无其他高危因素)而被纳入到低风险组中,传统意义而言,较差的病理分型可能导致不良的预后,但实际上合并POLE突变分子分型的患者即使病理分型较差,这类患者预后仍十分良好,因此对于低风险组中合并较差病理分型的患者可建议其进行基因检测以明确其分子分型状态[19,21]。对于中高风险组患者而言,应重视患者的预后管理,根据指南制定相应的辅助治疗方案,尤其对于高风险组患者而言,可能需要在原有辅助治疗方案基础上,适当增加其治疗周期,进行更加严密的术后随访,尝试更加多样化的治疗方案(如靶向治疗或免疫治疗)等[8]。
本研究最大的优势在于研究总体样本量相对较大,较为充分地保证了统计效能。其次,本研究建立的简易评分系统所需要的参考指标能够轻松从临床中获取,因此能够较为方便地在临床中被应用。当然,本研究最大的局限性在于本研究是一项单中心回顾性研究,所建立的评分系统可能需要进一步地通过前瞻性患者队列进行验证[8]。
总而言之,本研究构建了一个Ⅰ期子宫内膜癌预后简易评分系统。基于该评分系统,能够对患者进行较为个性化预后评分,并对患者进行风险分组,对Ⅰ期子宫内膜癌患者预后评估有一定价值。
参考文献
[1] Morice P,Leary A,Creutzberg C,et al. Endometrial cancer[J]. Lan? cet,2016,387(10023):1094-1108.
[2] Salani R,Nagel CI,Drennen E,et al. Recurrence patterns and sur? veillance for patients with early stage endometrial cancer[J]. Gynecol Oncol,2011,123(2):205-207.
[3] Siegel RL,Miller KD,Goding Sauer A,et al. Colorectal cancer sta? tistics,2020[J]. CA Cancer J Clin,2020,70(3):145-164.
[4] Francis SR,Ager BJ,Do OA,et al. Recurrent early stage endome? trial cancer:patterns of recurrence and results of salvage therapy[J]. Gy? necol Oncol,2019,154(1):38-44.
[5] Jiang P,Huang J,Deng Y,et al. Predicting recurrence in endome? trial cancer based on a combination of classical parameters and immuno? histochemical markers[J]. Cancer Manag Res,2020,12:7395-7403.
[6] Pecorelli S. Revised FIGO staging for carcinoma of the vulva,cer? vix,and endometrium[J]. Int J Gynaecol Obstet,2009,105(2):103-104.
[7] Colombo N,Creutzberg C,Amant F,et al. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer:diagnosis,treatment and follow-up[J]. Ann Oncol,2016,27(1):16-41.
[8] Jiang P,Jia MZ,Hu J,et al. A nomogram model involving immuno? histochemical markers for predicting the recurrence of stage I-II endo? metrial cancer[J]. Front Oncol,2020,10:586081.
[9] Jiang P,Wang JY,Gong CX,et al. A nomogram model for predicting recurrence of stage Ⅰ-Ⅲ endometrial cancer based on inflammationimmunity-nutrition score(IINS)and traditional classical predictors[J]. J Inflamm Res,2022,15:3021-3037.
[10] Jiang P,Huang YZ,Tu Y,et al. Combining clinicopathological pa? rameters and molecular indicators to predict lymph node metastasis in endometrioid type endometrial adenocarcinoma[J]. Front Oncol,2021,11:682925.
[11] Takahashi K,Yunokawa M,Sasada S,et al. A novel prediction score for predicting the baseline risk of recurrence of stage I-II endome? trial carcinoma[J]. J Gynecol Oncol,2019,30(1):e8.
[12] Jiang P,Yuan R. Analysis of factors related to lymph node metas? tasis in early-stage type 1 endometrial cancer:verifying the clinical value of positive threshold of the immunohistochemical parameter Ki67[J]. Cancer Manag Res,2021,13:6319-6328.
[13] 《乳腺癌雌、孕激素受体免疫组织化学检测指南》编写组. 乳腺癌雌、孕激素受体免疫组织化学检测指南[J]. 中华病理学杂志,2015,44(4):237-239. The Editorial Board of the “Guidelines for Immunohistochemical Detec? tion of Estrogen and Progesterone Receptors in Breast Cancer”. Guide? lines for immunohistochemical detection of estrogen and progesterone re? ceptors in breast cancer[J]. Chin J Pathol,2015,44(4):237-239.
[14] K?bel M,Ronnett BM,Singh N,et al. Interpretation of P53 immu? nohistochemistry in endometrial carcinomas:toward increased reproduc? ibility[J]. Int J Gynecol Pathol,2019,38(Iss 1 Suppl 1):S123-S131.
[15] 朱梦秋,易倩琳,蒋 鹏. 低危子宫内膜癌淋巴结转移相关因素分析[J]. 第三军医大学学报,2021,43(16):1581-1586. Zhu MQ,Yi QL,Jiang P. Related factors for lymph node metastasis in low-risk endometrial cancer:analysis of 409 cases[J]. J Third Mil Med Univ,2021,43(16):1581-1586.
[16] Concin N,Matias-Guiu X,Vergote I,et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma[J]. Int J Gynecol Cancer,2021,31(1):12-39.
[17] Huang YZ,Jiang P,Kong W,et al. Comprehensive assessment of ERα,PR,Ki67,P53 to predict the risk of lymph node metastasis in lowrisk endometrial cancer[J]. J Invest Surg,2023,36(1):2152508.
[18] Li N,Jiang P,Huang YZ,et al. Estrogen receptor- and progester? one receptor-positive thresholds in predicting the recurrence of early low-risk endometrial cancer[J]. Clin Med Insights Oncol,2022,16:11795549221103200.
[19] Raffone A,Travaglino A,Mascolo M,et al. TCGA molecular groups of endometrial cancer:Pooled data about prognosis[J]. Gynecol Oncol,2019,155(2):374-383.
[20] Jia MZ,Jiang P,Hu J,et al. The optimal cut-off value of immuno? histochemical parameter P53 for predicting recurrence of endometrial cancer[J]. Int J Gynaecol Obstet,2021,153(2):344-350.
[21] León-Castillo A,Gilvazquez E,Nout R,et al. Clinicopathological and molecular characterisation of ‘multiple-classifier’ endometrial car? cinomas[J]. J Pathol,2020,250(3):312-322.
(责任编辑:李青颖)
本文引用格式:
丁珊珊,蒋 鹏,袁 瑞,等. Ⅰ期子宫内膜癌预后简易评分系统的建立[J]. 重庆医科大学学报,2025,50(2):210-216.

