转移性前列腺癌的临床危险因素分析
【摘 要】目的:探寻转移性前列腺癌的临床危险因素。方法:回顾2019年1月至2024年3月于川北医学院附属医院泌尿外科首次入院后病理检查诊断为前列腺癌的180例患者的临床资料,收集患者年龄、体质指数、Gleason评分、术前游离前列腺特异性抗原(free prostate-specific antigen,FPSA)/总前列腺特异性抗原(total prostate-specific antigen,TPSA)比值(F/T比值)、血浆纤维蛋白原、中性粒细胞、血小板、淋巴细胞、单核细胞、中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板-淋巴细胞比值(platelet to lymphocyte ratio,PLR)、单核细胞计数与淋巴细胞计数比值(monocyte-lymphocyte count ratio,MLR)、全身免疫炎症指数(systemic immune-inflammation index,SII),前列腺体积、TPSA,碱性磷酸酶、吸烟史、饮酒史。根据诊断分为局限性前列腺癌组99例和转移性前列腺癌组81例,采用Mann-Whitney U检验、χ2检验和多因素logistic回归分析分别对变量进行分析,探寻转移性前列腺癌的临床危险因素。结果:单因素分析结果显示,患者体质指数(U=-2.456,P<0.014)、Gleason评分(U=6.801,P=0.000)、血浆纤维蛋白原(U=3.360,P=0.001)、淋巴细胞(U=-2.963,P=0.003)、NLR(U=2.096,P=0.036)、PLR(U= 2.503,P=0.012)、MLR(U=2.434,P=0.015),TPSA(χ2=30.462,P=0.000),碱性磷酸酶(χ2=36.719,P=0.000)比较差异有统计学意义。将有统计学意义的指标纳入多因素logistic回归分析,结果显示:体质指数降低、Gleason评分升高、TPSA>20 ug/L,碱性磷酸酶≥90 ng/mL是转移性前列腺癌的独立危险因素。结论:对于初次入院诊断为前列腺癌的患者,发现其体质指数低,Gleason评分高,TPSA>20 ug/L,碱性磷酸酶≥90 ng/mL的患者应该进一步评估病情的严重程度,以明确是否发生转移。
【关键词】转移性前列腺癌;临床;危险因素
【中图分类号】R737.25【文献标志码】A【收稿日期】2024-03-05
An analysis of clinical risk factors for metastatic prostate cancer
Li Junyang,Yu Xiaodong,Lü Zongying,Chen Guiyuan,Hu Anneng,Zhu Xiaole,Lin Yuhang,Zheng Yongbo
(Department of Urology,Affiliated Hospital of North Sichuan Medical College)
【Abstract】Objective:To explore clinical risk factors for metastatic prostate cancer. Methods:We retrospectively analyzed the clinical data of 180 patients with prostate cancer diagnosed with pathological examination during their first hospitalization in the Department of Urology of the Affiliated Hospital of North Sichuan Medical College from January 2019 to March 2024,involving the patients’ age,body mass index,Gleason score,and preoperative parameters including the ratio of free prostate-specific antigen(FPSA) to total prostate-specific antigen(TPSA),plasma fibrinogen level,neutrophil count,platelet count,lymphocyte count,monocyte count,neutrophil-to-lymphocyte ratio(NLR),platelet-to-lymphocyte ratio(PLR),monocyte-to-lymphocyte ratio(MLR),the systemic immune-inflammation index(SII),prostate volume,TPSA level,alkaline phosphatase level,and smoking and alcohol drinking history. Among the patients,99 were diagnosed as localized prostate cancer,and 81 were diagnosed as metastatic prostate cancer. The MannWhitney U test,χ2 test,and multivariable logistic regression analysis were performed to determine clinical risk factors for metastatic prostate cancer. Results:The univariable analyses detected significant differences in the body mass index(U=-2.456,P<0.014),Gleason score(U=6.801,P<0.001),plasma fibrinogen level(U=3.360,P=0.001),lymphocyte count(U=-2.963,P=0.003),NLR(U= 2.096,P=0.036),PLR(U=2.503,P=0.012),MLR(U=2.434,P=0.015),TPSA level(χ2=30.462,P<0.001),and alkaline phosphatase level(χ2=36.719,P<0.001). The multivariable logistic regression analysis incorporating these significant indicators showed that a de? creased body mass index,an increased Gleason score,TPSA level >20 ug/L,and alkaline phosphatase level ≥90 ng/mL were indepen? dent risk factors for metastatic prostate cancer. Conclusion:For newly diagnosed patients with prostate cancer,those with a low body mass index,a high Gleason score,TPSA level >20 ug/L,and alka? line phosphatase level ≥90 ng/mL should be further evaluated to de? termine whether metastasis occurs.
【Key words】metastatic prostate cancer;clinical;risk factor
前列腺癌的发病率逐年升高,已成为全球男性泌尿生殖系统发病率与病死率最高的肿瘤[1]。通过早期筛查提高了无症状前列腺癌的诊断率和存活率[2],但最近的研究显示,患有转移性前列腺癌的男性中有一半以上最初被诊断为局限性前列腺癌[3],转移性前列腺癌患者的5年生存率比局限性前列腺癌患者降低了70%[4]。前列腺癌最常发生骨转移,全身骨扫描是目前最常用的诊断前列腺癌骨转移的有效方法,但费用昂贵[5]。李伟等[6]的研究表明血浆纤维蛋白原浓度越高,前列腺癌患者骨转移风险越大。李轩宇等[7]的研究证实血小板-淋巴细胞比值(platelet to lymphocyte ratio,PLR)可以预测前列腺骨转移。韩皓名[8]的研究表明全身免疫炎症指数(systemic immune-inflammation index,SII)是预测前列腺癌的独立危险因素,尚未有研究表明SII与转移性前列腺的相关性。吴庭纯等[9]的研究显示体质指数、前列腺体积与前列腺癌的进展密切关联,未探究在转移性前列腺癌中的价值。多项研究已证明前列腺特异性抗原(prostate-specific antigen,PSA)、Gleason评分、碱性磷酸酶是前列腺发生骨转移的独立危险因素[10-11]。因此本文结合以上研究结果及尚未探索的结果,通过多种标志物联合检测来早期发现转移性前列腺癌对患者预后具有重要意义。本研究通过回顾2019年1月至2024年3月于川北医学院附属医院泌尿外科首次入院经穿刺活检或术后病理检查诊断为前列腺癌的180例患者的临床资料,分析转移性前列腺癌的影响因素。
1 资料与方法
1.1 一般资料
回顾2019年1月至2024年3月于本院泌尿外科首次入院经穿刺活检或术后病理检查诊断为前列腺癌的180例患者的临床资料。纳入标准:①病例资料、检验检查完整;②入院前均未行前列腺癌内分泌治疗;③均为首次入院诊断为前列腺癌患者;④前列腺穿刺活检或术后病理明确诊断为前列腺癌。排除标准:①入院诊断为前列腺炎或尿路感染或全身性炎症疾病;②行前列腺电切手术;③存在其他肿瘤病史或其他原发性癌症者;④血液系统疾病者。结合影像学检查、手术记录和出院诊断分为:局限性前列腺癌(任意T、N0、MO)和转移性前列腺癌(任意T、任意N,M1)2组。
1.2 观察指标
记录患者的姓名、年龄、身高、体质量、有无吸烟史、有无饮酒史、有无糖尿病病史,同时收集Gleason评分资料、术前游离前列腺特异性抗原(free prostate-specific antigen, FPSA)/总前列腺特异性抗原(total prostate-specific antigen,TPSA)比值(F/T比值)、TPSA、碱性磷酸酶、血浆纤维蛋白原、中性粒细胞、血小板、淋巴细胞、单核细胞、前列腺影像学检查。然后,计算出体质指数、前列腺体积、中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板-淋巴细胞比值PLR、单核细胞计数与淋巴细胞计数比值(monocyte-lymphocyte count ratio,MLR)、全身免疫炎症指数SII的值。
1.3 统计学方法
使用统计学软件SPSS 25.0进行相关数据的分析。非正态分布的计量资料以用中位数(四分位间距)[Md(P25,P75)]表示,用Mann-Whitney U检验。计数资料以例数及率(%)表示,组间比较采用χ2检验。多因素采用logistic回归分析,检验水准α=0.05。
2 结 果
2.1 一般资料描述
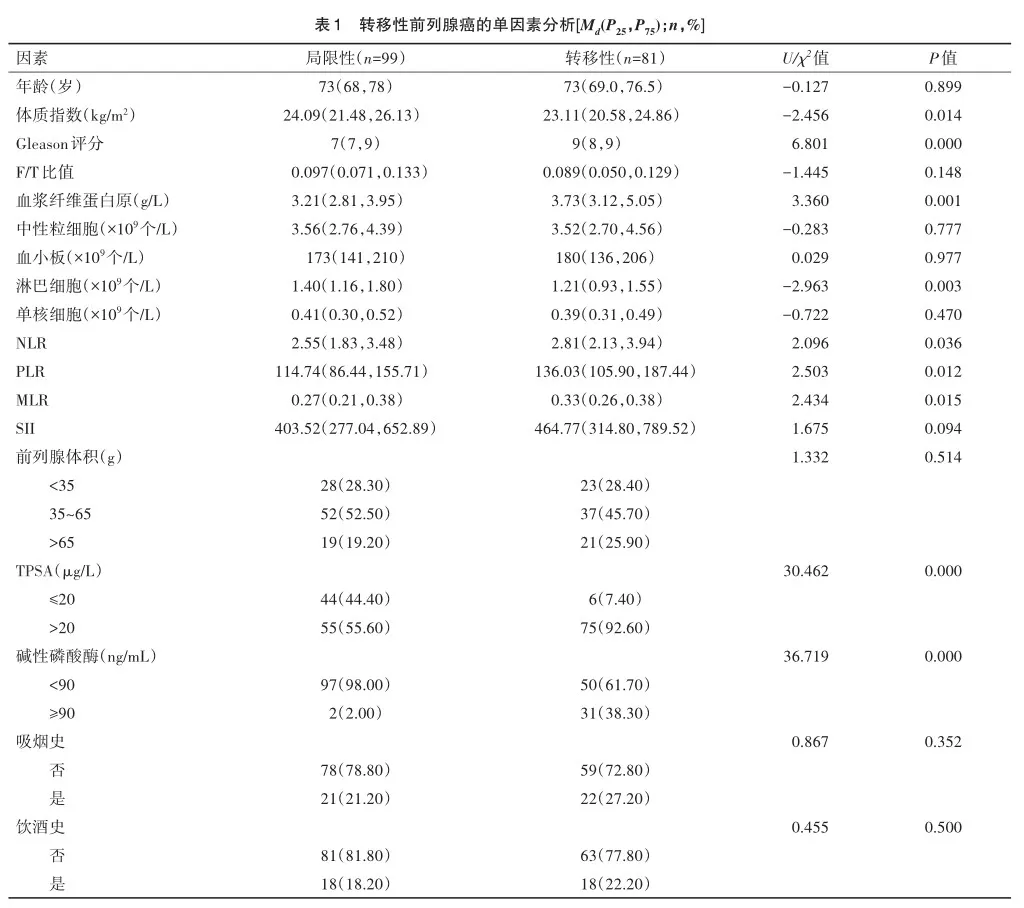
对所有纳入本研究的180例患者分为2组,其中局限性前列腺癌组99例,转移性前列腺癌组81例。其中局限性前列腺癌组患者的平均年龄为 73(68,78)岁,体质指数24.09(21.48,26.13)kg/m2,Gleason评分7(7,9) 分,F/T比值为0.097(0.071,0.133),血浆纤维蛋白原为3.21(2.81,3.95)g/L,中性粒细胞为3.56(2.76,4.39)×109个/L,血小板为173(141,210)×109个/L,淋巴细胞为1.40(1.16,1.80)×109个/L,中位单核细胞为0.41(0.30,0.52)×109个/L,NLR为2.55(1.83,3.48),PLR为114.74(86.44,155.71),MLR为0.27(0.21,0.38),SII为 403.52(277.04,652.89);前列腺体积(g):≤35共28例(28.30%),35~65共52例(52.50%),≥65共19例(19.20%);TPSA(μg/L):≤20共44例(44.40%),>20共55例(55.60%);碱性磷酸酶(ng/mL):<90共97例(98.00%),≥90共2例(2.00%);无吸烟史患者78例(78.80%),有吸烟史患者21例(21.20%);无饮酒史患者81例(81.80%),有饮酒史患者18例(18.20%)。转移性前列腺癌组患者的中位年龄为 73岁(69~76.5),体质指数为23.11(20.58,24.86)kg/m2,Gleason评分为9分(8,9),中位F/T比值为0.089(0.050,0.129),中位血浆纤维蛋白原为3.73(g/L)(3.12,5.05),中位中性粒细胞为3.52×109个/L(2.70,4.56),中位血小板为180×109个/L(136,206),中位淋巴细胞为1.21×109个/L(0.93,1.55),中位单核细胞为0.39×109个/L(0.31,0.49),中位NLR为2.81(2.13,3.94),中位PLR为136.03(105.90,187.44),中位MLR为0.33(0.26,0.38),中位SII为464.77(314.80,789.52);前列腺体积(g):≤35共23例(28.4%),35~65共37例(45.70%),≥65共21例(25.90%);TPSA(μg/L):≤20共6例(7.40%),>20共75例(92.60%);碱性磷酸酶(ng/mL):<90共50例(61.70%),≥90共31例(38.30%)无吸烟史患者59例(72.80%),有吸烟史患者22例(27.20%);无饮酒史患者63例(77.80%),有饮酒史患者18例(22.20%)。
2.2 单因素分析
单因素分析结果显示:年龄(U=-0.127,P=0.899)、F/T比值(U=-1.445,P=0.148)、中性粒细胞(U=-0.283,P=0.777)、血小板(U=0.029,P=0.977)、单核细胞(U=-0.722,P=0.470)、SII(U=1.675,P=0.094)、前列腺体积(χ2=1.332,P=0.514)、吸烟史(χ2=0.867,P=0.352)、饮酒史(χ2=0.455,P=0.500)比较差异无统计学意义。患者体质指数(U=-2.456,P<0.014)、Gleason评分(U=6.801,P<0.001)、血浆纤维蛋白原(U= 3.360,P=0.001)、淋巴细胞(U=-2.963,P=0.003)、NLR(U= 2.096,P=0.036)、PLR(U=2.503,P=0.012)、MLR(U=2.434,P= 0.015),TPSA(χ2=30.462,P<0.001),碱性磷酸酶(χ2=36.719,P=0.000)差异有统计学意义。见表1。
2.3 多因素logistic回归分析
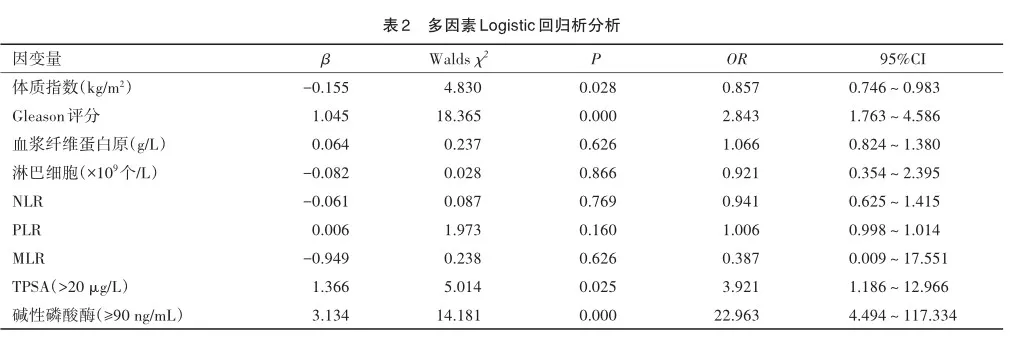
将单因素中P<0.05的因素代入多因素分析,并赋值TPSA(μg/L)(≤20=0,>20=1)、碱性磷酸酶ng/mL(<90=0,≥90=1)、(局限性=0,转移性=1),进行多因素logistic回归分析,结果显示:体质指数降低、Gleason评分升高、TPSA>20μg/L,碱性磷酸酶≥90 ng/mL是转移性前列腺癌的独立危险因素(P<0.05)。Hosmer-Lemeshow拟合度检验(χ2=6.176,P> 0.05)说明本次模型通过Hosmer-Lemeshow检验,模型拟合优度较好。见表2。
3 讨 论
前列腺癌是男性第二大常见癌症,通过筛查,早诊断、早期治疗能够明显降低前列腺癌的死亡率[12]。但我国前列腺癌筛查和早期诊断尚不普及,且前列腺发病隐匿,部分患者确诊时已经处于转移阶段,而骨骼是前列腺癌最主要的转移部位[13]。骨扫描费用高,具有一定的放射性,诊断骨转移前列腺癌灵敏度高但缺乏特异性[14]。碱性磷酸酶是预测前列腺癌骨转移的重要因子,但碱性磷酸酶有多种同工酶,肝胆系统疾病也会引起其水平升高[11]。尚未有研究证明PSA对诊断转移性前列腺癌具有高敏感度和特异性,PSA联合Gleason对转移性前列腺癌有较好的预测价值[15]。由于单一标志物的敏感度和特异性不高,具有一定的局限性,因此多种标志物联合检测值得进一步研究。转移性前列腺癌的5年生存率明显低于局限性前列腺,且转移性前列腺癌死亡风险更高[16]。因此通过比较局限性和转移性前列腺癌的临床危险因素,来提高转移性前列腺癌的诊断率,具有重要临床意义。
经单因素分析发现2组年龄(U=-0.127,P= 0.899)、F/T比值(U=-1.445,P=0.148)、中性粒细胞(U=-0.283,P=0.777)、血小板(U=0.029,P=0.977)、单核细胞(U=-0.722,P=0.470)、SII(U=1.675,P= 0.094)、前列腺体积(χ2=1.332,P=0.514)、吸烟史(χ2= 0.867,P=0.352)、饮酒史(χ2=0.455,P=0.500)比较差异无统计学意义。Merdan S等[17]发现前列腺骨转移患者的年龄偏大,而林军明等[11]认为年龄小于71.5岁的前列腺癌患者更容易发生骨转移。本研究中年龄在局限性和转移性前列腺癌中无差异,提示年龄与前列腺癌转移无关。王永祥等[18]发现SII是前列腺癌骨转移的独立危险因素。Ozcan L等[19]的研究表明SII与前列腺的进展有关,本研究中在两组间未见明显差异。Al-Khalil S等[20]发现前列腺体积与前列腺癌的发病率和侵袭性之间可能存在关联,前列腺体积<35 g的前列腺癌患者Gleason评分越高,前列腺体积>65 g的前列腺癌,Gleason评分越低,故本研究将前列腺体积分组,未发现2组之间存在差异。
而患者体质指数(U=-2.456,P<0.014)、Gleason评分(U=6.801,P=0.000)、血浆纤维蛋白原(U= 3.360,P=0.001)、淋巴细胞(U=-2.963,P=0.003)、NLR(U=2.096,P=0.036)、PLR(U=2.503,P=0.012)、MLR(U=2.434,P=0.015),TPSA(χ2=30.462,P= 0.000),碱性磷酸酶(χ2=36.719,P=0.000)比较差异有统计学意义。Hurwitz LM等[21]的最新的研究显示,高体质量指数与转移性前列腺癌存在负相关。Dickerman BA等[22]的研究发现体质指数<27 kg/m2的男性中,与晚期前列腺强相关。本研究中也发现,体质量指数在多因素logistic回归分析中,与转移性前列腺癌呈负相关。即体质指数越高的患者,诊断为转移性前列腺癌的风险越低。这一结果可能与晚期癌症患者体内消耗增加和进食减少有关。Gleason评分系统是目前最常用前列腺癌的组织学分级系统,Gleason评分越高,前列腺癌的风险分层就越高,预后更差,总生存率更低[23-25]。
血浆纤维蛋白原与前列腺癌密切相关,多项研究表明血浆纤维蛋白原与前列腺抗原、Gleason评分呈正相关[26],高水平的血浆纤维蛋白原可能会促进前列腺癌骨转移[27]。全身炎症指数被证明与前列腺癌相关,Bailey-Whyte M等[28]的研究发现NLR与前列腺癌患者死亡率显著相关,Zhang JY等[29]的研究发现在和无骨转移前列腺癌患者比较,骨转移前列腺癌患者NLR、PLR明显升高。李轩宇等[7]发现PLR与骨转移呈正相关。本研究中单因素结果显示血浆纤维蛋白原、淋巴细胞、NLR、PLR、MLR的中位数在转移性前列腺癌患者中显著更高,提示血浆纤维蛋白原和全身炎症指数增高时,本研究也需要警惕前列腺癌转移的可能性。而多因素Logistic回归分析中差异无统计学意义,本研究为单中心回顾性研究,样本量较少,存在一定的选择偏倚和失访偏倚,具有一定局限性。尚需进行多中心、大样本、前瞻性研究进一步证实。
TPSA检验快捷方便,广泛应用于前列腺癌的筛选、诊断和随访。《NCCN前列腺癌临床实践指南》将TPSA>20 μg/L分为高风险组[30]。碱性磷酸酶可以预测转移性前列腺癌患者的总生存期[31],高水平的碱性磷酸酶与骨骼并发症和生存率下降相关[32]。谢喜[33]将90 U/L设为碱性磷酸酶的临界值,灵敏度、准确度和特异性较好。而本研究中多因素logistic回归分析结果显示体质指数、Gleason评分、TPSA> 20 μg/L,碱性磷酸酶≥90 ng/mL这4个变量最终可以明显影响因变量转移性前列腺癌,所以多种指标联合检查具有一定的临床意义。
综上所述,单因素分析中体质指数、Gleason评分、血浆纤维蛋白原、淋巴细胞、NLR、PLR、MLR、TPSA、碱性磷酸酶在局限性和转移性前列腺癌患者中存在差异。其中体质指数降低、Gleason评分升高、TPSA>20 μg/L,碱性磷酸酶≥90 ng/mL是转移性前列腺癌的独立危险因素。提示对于初次入院诊断为前列腺癌的患者,发现其体质量指数低,Gleason评分高,TPSA>20 μg/L,碱性磷酸酶≥90 U/L的患者应该进一步评估病情的严重程度,完善骨扫描、正电子发射断层扫描-计算机断层扫描等检查,以明确是否发生转移,来提高转移性前列腺癌的诊断率。使得患者在转移早期可以进行有效治疗,从而改善患者预后。
参 考 文 献
[1] Siegel RL,Giaquinto AN,Jemal A. Cancer statistics,2024[J]. CA Cancer J Clin,2024,74(1):12-49.
[2] Wolf AMD,Wender RC,Etzioni RB,et al. American Cancer Soci? ety guideline for the early detection of prostate cancer:update 2010[J]. CA Cancer J Clin,2010,60(2):70-98.
[3] Devasia TP,Mariotto AB,Nyame YA,et al. Estimating the number of men living with metastatic prostate cancer in the United States[J]. Cancer Epidemiol Biomarkers Prev,2023,32(5):659-665.
[4] Bekelman JE,Rumble RB,Chen RC,et al. Clinically localized prostate cancer:ASCO clinical practice guideline endorsement of an American urological association/american society for radiation oncology/ society of urologic oncology guideline[J]. J Clin Oncol,2018,36(32):3251-3258.
[5] Han S,Oh JS,Seo SY,et al. Performance of deep learning models for response evaluation on whole-body bone scans in prostate cancer[J]. Ann Nucl Med,2023,37(12):685-694.
[6] 李 伟,宋 娟,常钰玲,等. 前列腺癌患者发生骨转移的危险因素及血浆纤维蛋白原诊断前列腺癌骨转移的价值[J]. 中国当代医药,2023,30(22):124-127. Li W,Song J,Chang YL,et al. Risk factors for bone metastasis in pros? tate cancer patients and the value of plasma fibrinogen in diagnosing bone metastasis of prostate cancer[J]. China Mod Med,2023,30(22):124-127.
[7] 李轩宇,胡 彬,马伟立,等. PLR、NLR、MLR、PDW与前列腺癌骨转移及相关临床特征的关系研究[J]. 中国现代医药杂志,2023,25(9):66-69. Li XY,Hu B,Ma WL,et al. Study on the relationship between PLR,NLR,MLR and PDW and bone metastasis and related clinical character? istics of prostate cancer[J]. Mod Med J China,2023,25(9):66-69.
[8] 韩皓名. 系统免疫炎症指数在前列腺癌诊断中的应用研究[D].开封:河南大学,2023. Han HM. Application of Systemic Immune-inflammation Index in the Diagnosis of Prostate Cancer[D]. Kaifeng:Henan University,2023.
[9] 吴庭纯,蒋鑫滢,袁晓亮,等. 前列腺癌进展外源性危险因素的相关分析[J]. 泌尿外科杂志(电子版),2023,15(4):17-20. Wu TC,Jiang XY,Yuan XL,et al. Correlation analysis of exogenous fac? tors in the progression of prostate cancer[J]. J Urol Clin Electron Ver? sion,2023,15(4):17-20.
[10] Yu ZW,Yuan MX,Chen GJ. The clinical association between co? agulation indexes,platelet-related parameters,and bone metastasis of newly diagnosed prostate cancer[J]. Eur J Med Res,2023,28(1):587.
[11] 林军明,刘家明,周 扬,等. 前列腺癌骨转移的特点及其相关危险因素分析[J]. 解放军医学杂志,2017,42(8):707-711. Lin JM,Liu JM,Zhou Y,et al. Risk factors and characteristics of pros? tate cancer bone metastases[J]. Med J Chin People’s Liberation Army,2017,42(8):707-711.
[12] Bergengren O,Pekala KR,Matsoukas K,et al. 2022 update on prostate cancer epidemiology and risk factors-a systematic review[J]. Eur Urol,2023,84(2):191-206.
[13] 中国抗癌协会泌尿男生殖系肿瘤专业委员会前列腺癌学组.前列腺癌骨转移多学科诊疗专家共识(2020版)[J]. 肿瘤防治研究,2020,47(7):479-486. Group PC,Chinese Anticancer Association Genitourinary Oncology Committee. Expert consensus of multidisciplinary treatment on bone me? tastasis of prostate cancer(version 2020)[J]. Cancer Res Prev Treat,2020,47(7):479-486.
[14] 胡珍国,乐官明,邱思煌. 关于骨扫描和MRI诊断前列腺癌骨转移的临床价值探讨[J]. 现代医用影像学,2022,31(6):1051-1053. Hu ZG,Le GM,Qiu SH. Clinical value of bone scanning and MRI in the diagnosis of bone metastasis of prostate cancer[J]. Mod Med Imageology,2022,31(6):1051-1053.
[15] Rani E,Nibhoria S,Nagpal N. Outlook of Gleason score in pros? tate carcinoma and correlation with PSA levels:a study in a tertiary care hospital[J]. J Cancer Res Ther,2023,19(5):1305-1310.
[16] Weiner AB,Li EV,Desai AS,et al. Cause of death during pros? tate cancer survivorship:a contemporary,US population-based analysis[J]. Cancer,2021,127(16):2895-2904.
[17] Merdan S,Womble PR,Miller DC,et al. Toward better use of bone scans among men with early-stage prostate cancer[J]. Urology,2014,84(4):793-798.
[18] 王永祥,赵兴华,许长宝,等. 初诊前列腺癌骨转移的危险因素分析及预测模型建立[J]. 医学信息,2023,36(11):16-20. Wang YX,Zhao XH,Xu CB,et al. Risk factors analysis and prediction model establishment of bone metastasis in newly diagnosed prostate can? cer[J]. J Med Inf,2023,36(11):16-20.
[19] Ozcan L,Omur M,Polat EC,et al. Systemic inflammatory index:a novel biomarker for predicting the progression in active surveillance in patients with prostate cancer[J]. J Coll Physicians Surg Pak,2023,33(11):1278-1282.
[20] Al-Khalil S,Ibilibor C,Cammack JT,et al. Association of pros? tate volume with incidence and aggressiveness of prostate cancer[J]. Res Rep Urol,2016,8:201-205.
[21] Hurwitz LM,Dogbe N,Barry KH,et al. Obesity and prostate can? cer screening,incidence,and mortality in the Prostate,Lung,Colorectal,and Ovarian Cancer Screening Trial[J]. J Natl Cancer Inst,2023,115(12):1506-1514.
[22] Dickerman BA,Torfadottir JE,Valdimarsdottir UA,et al. Body fat distribution on computed tomography imaging and prostate cancer risk and mortality in the AGES-Reykjavik study[J]. Cancer,2019,125(16):2877-2885.
[23] Srigley JR,Delahunt B,Samaratunga H,et al. Controversial is? sues in Gleason and International Society of Urological Pathology(ISUP) prostate cancer grading:proposed recommendations for interna? tional implementation[J]. Pathology,2019,51(5):463-473.
[24] Abudoubari S,Bu K,Mei YJ,et al. Prostate cancer epidemiology and prognostic factors in the United States[J]. Front Oncol,2023,13:1142976.
[25] Wang FM,Xing NZ. Systemic coagulation markers especially fi? brinogen are closely associated with the aggressiveness of prostate can? cer in patients who underwent transrectal ultrasound-guided prostate bi? opsy[J]. Dis Markers,2021,2021:8899994.
[26] 冷 区. 血浆纤维蛋白原水平与前列腺癌临床病理特征的关系研究[D]. 广州:南方医科大学,2020. Leng Q. Relationship between plasma fibrinogen level and clinicopatho? logical features of prostate cancer[D]. Guangzhou:Southern Medical University,2020.
[27] 朱 惠,陶吴东,黄 彬,等. 血浆纤维蛋白原与前列腺癌骨转移的相关性及诊断价值研究[J]. 中华腔镜泌尿外科杂志(电子版),2021,15(2):135-138. Zhu H,Tao WD,Huang B,et al. Correlation and diagnostic value of plasma fibrinogen with bone metastasis in prostate cancer patients[J]. Chin J Endourol Electron Ed,2021,15(2):135-138.
[28] Bailey-Whyte M,Minas TZ,Dorsey TH,et al. Systemic inflamma? tion indices and association with prostate cancer survival in a diverse pa? tient cohort[J]. Cancers,2023,15(6):1869.
[29] Zhang JY,Ge P,Zhang PY,et al. Role of neutrophil to lympho? cyte ratio or platelet to lymphocyte ratio in prediction of bone metastasis of prostate cancer[J]. Clin Lab,2019,65(5):10.
[30] Mohler JL, Antonarakis ES, Armstrong AJ,et al. Prostate cancer,version 2.2019,NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw,2019,17(5):479-505.
[31] Guinney J,Wang T,Laajala TD,et al. Prediction of overall sur? vival for patients with metastatic castration-resistant prostate cancer:de? velopment of a prognostic model through a crowdsourced challenge with open clinical trial data[J]. Lancet Oncol,2017,18(1):132-142.
[32] Brown JE,Cook RJ,Major P,et al. Bone turnover markers as pre? dictors of skeletal complications in prostate cancer,lung cancer,and other solid tumors[J]. J Natl Cancer Inst,2005,97(1):59-69.
[33] 谢 喜. 前列腺癌骨转移患者血清ALP、ICTP、TGF、VEGF、IL-6检测及其诊断分析[J]. 湖南师范大学学报(医学版),2020,17(6):89-92. Xie X. Detection and diagnostic analysis of serum ALP,ICTP,TGF,VEGF and IL-6 in patients with bone metastases from prostate cancer[J]. J Hunan Norm Univ Med Sci,2020,17(6):89-92.
(责任编辑:李青颖)
本文引用格式:
李俊洋,余晓东,吕宗应,等. 转移性前列腺癌的临床危险因素分析[J].重庆医科大学学报,2025,50(2):204-209.

