多组学分析揭示SPAST在肝细胞癌的潜在临床预后价值与免疫治疗特性







摘要:目的" 探究痉挛素蛋白(SPAST)在肝细胞癌(HCC)中的表达及其预后价值。方法" 通过分析肿瘤基因组图谱(TCGA)数据库和GEO数据库HCC患者RNA表达数据,探索SPAST在mRNA的表达与预后价值,评估SPAST和免疫浸润的关系,然后进行qRT-PCR验证SPAST在细胞和组织中的表达情况。结果" SPAST在肝癌、肺癌、结直肠癌等多数肿瘤中高表达(Plt;0.001);在HCC的非配对样本中SPAST表达量较正常组织显著升高(Plt;0.001);SPAST在HCC中作为潜在独立预后因素与治疗结局相关(Plt;0.001);SPAST高表达组患者的总生存期要低于低表达组(P=0.006),且ROC曲线表明SPAST预测预后的准确性较高(AUC=0.836,95%CI=0.793~0.879);SPAST表达与免疫细胞浸润密切相关。体外实验证实SPAST在HCC细胞、肝癌组织中表达水平升高。干预SPAST表达能影响HCC细胞增殖、迁移和侵袭能力。结论" SPAST在HCC中高表达且可能与患者的预后密切相关,有望成为HCC患者预后标志物之一。
关键词:痉挛素蛋白;肝细胞癌;生存预后;免疫浸润;分子对接;生物信息学
中图分类号:R735.7" " " " " " " " " " " " " " " " "文献标识码:A" " " " " " " " " " " " " " " " "DOI:10.3969/j.issn.1006-1959.2025.01.001
文章编号:1006-1959(2025)01-0001-09
Multi-omics Analysis Reveals the Potential Clinical Prognostic Value and Immunotherapy Characteristics of SPAST in Hepatocellular Carcinoma
LI Yanjuan, LI Xueyu, CHEN Wanlun, WEI Liuting, TANG Yanping, RONG Minhua, CAO Ji
(Department of Experimental Research, Cancer Hospital, Guangxi Medical University, Nanning 530021, Guangxi, China)
Abstract: Objective" To investigate the expression and prognostic value of Spasmosin (SPAST) in hepatocellular carcinoma (HCC). Methods" By analyzing the RNA expression data of HCC patients in The Cancer Genome Atlas (TCGA) database and GEO database, the expression of SPAST in mRNA and its prognostic value were explored, and the relationship between SPAST and immune infiltration was evaluated. Then qRT-PCR was used to verify the expression of SPAST in cells and tissues. Results" SPAST was highly expressed in most tumors such as liver cancer, lung cancer and colorectal cancer (Plt;0.001). The expression of SPAST in unpaired samples of HCC was significantly higher than that in normal tissues (Plt;0.001). SPAST as a potential independent prognostic factor in HCC was associated with treatment outcome (Plt;0.001). The overall survival of patients in the SPAST high expression group was lower than that in the low expression group (P=0.006), and the ROC curve showed that the accuracy of SPAST in predicting prognosis was higher (AUC=0.836, 95%CI=0.793-0.879). SPAST expression was closely related to immune cell infiltration. In vitro experiments confirmed that the expression level of SPAST was increased in HCC cells and liver cancer tissues. Intervention of SPAST expression could affect the proliferation, migration and invasion of HCC cells. Conclusion" SPAST is highly expressed in HCC and may be closely related to the prognosis of patients. It is expected to be one of the prognostic markers of HCC patients.
Key words:Spasmosin; Hepatocellular carcinoma; Survival prognosis; Immune infiltration; Molecular docking; Bioinformatics
肝细胞癌(hepatocellular carcinoma, HCC)是肝癌的主要组织学类型,是全球癌症相关死亡的第三大原因[1]。在我国,HCC发病率和死亡率已经跃居癌症第3位[2]。虽然通过手术、化疗、生物制剂等方式,肝癌治疗已取得重要的进展,但对于大多数患者,在确诊时已处于癌症晚期阶段,并且术后远处转移和肿瘤复发率高,对常规化疗和放疗不敏感[3, 4]。因此仍需深入探索其机制,寻求新的预测指标及治疗靶点。痉挛素是一种参与微管动力学和膜运输的蛋白质。在运动皮层的锥体神经元和永生化的运动神经元中,痉挛素定位于突触末梢和生长锥[5]。Dráberová E等[6]团队研究首次报道了SPAST在脑胶质瘤表达上调,过度表达的SPAST有助于胶质母细胞瘤的迁移和侵袭能力。此外,SPAST在其他癌症研究中也被发现扮演重要角色,例如在前列腺癌[7]中作为癌症促进因子,影响癌症发生发展。但在HCC中SPAST的相关研究仍较少。本研究通过分析SPAST在HCC中的表达及其临床预后价值,挖掘其可能相关信号通路,并从细胞和组织层面验证SPAST的表达情况,旨在探讨SPAST与HCC发生发展的关系,为研究SPAST在HCC中的作用机制奠定基础。
1材料与方法
1.1材料" 正常肝细胞(MIHA)及2种HCC细胞株(Huh-7、SK-hep-1)均来自广西医科大学附属肿瘤医院实验研究部。DMEM培养基、MEM培养基、澳洲胎牛血清、0.25%含EDTA胰蛋白酶均购于Gibco公司;100×青链霉素混合液购于索莱宝公司;Trizol购于Applied Biosystems公司;逆转录试剂盒,SYBR Green RCP购于Takara公司;PCR引物由Sangon Biotech公司合成。
1.2临床资料" 15对人肝癌组织及其对应癌旁组织均来自于2018年1月-12月在广西医科大学附属肿瘤医院住院手术的HCC患者,全部病例均经术后病理确诊为HCC。本研究已经过广西医科大学附属肿瘤医院临床伦理委员会批准,所有患者均签署了知情同意书。
1.3方法
1.3.1 SPAST在肿瘤中的表达" 使用Timer 2.0在线数据库(https:// http://timer.cistrome.org/)比较SPAST在各个癌种及其癌旁组织间的差异表达。
1.3.2 SPAST在肝癌中表达" 从TCGA数据库(https://portal.gdc.cancer.gov)下载并整理TCGA-LIHC(肝细胞肝癌)项目STAR流程的424例HCC患者和50例正常组织的RNA-seq及临床预后相关数据提取FPKM格式的数据;GEO高通量基因表达数据库(https://www.ncbi.nlm.nih.gov/gds)下载人源肝癌样本数据芯片集芯片集GSE39791利用R(4.2.1)分析SPAST mRNA在肝癌中差异表达,使用R包ggplot2[3.3.6], stats[4.2.1], car对结果进行可视化。CPTAC数据库(https://proteomics.cancer.gov/programs/cptac)在线分析SPAST在HCC中蛋白表达差异。
1.3.3甲基化和突变分析" 使用cBioPortal for Cancer Genomics(http://www.cbioportal.org/)平台对SPAST在HCC中的突变和拷贝数变异(CNV)和甲基化情况进行分析。从LinkedOmics数据库(http://www.linkedomics.org/login.php)收集SPAST的甲基化数据,通过Spearman相关系数计算SPAST表达与甲基化之间的关系。
1.3.4 KEGG和 GO分析" 利用R(4.2.1)从选择的TCGA-LIHC公共数据中提取SPAST对应数据,按照SPAST表达量分为高低表达组(低表达组:0~50%;高表达组:50%~100%;参考组:Low),利用R包DESeq2[1.36.0], edgeR[3.38.2]对选择的公共数据的原始Counts矩阵进行差异分析[8,9]。获得单基因差异列表后进一步筛选差异基因集(Plt;0.05,logFCgt;1.5或logFClt;-1.5)获得差异基因列表,对输入的分子列表进行ID转换后,用clusterProfiler包进行富集分析[10]。使用ggplot2包对富集分析结果进行可视化。
1.3.5 GSEA分析" 利用R(4.2.1)提取单基因差异列表,利用R包clusterProfiler[4.4.4]进行GSEA分析,以条件FDR(qvalue)lt;0.25 amp; p.adjustlt;0.05,参考基因集:c2.cp.all.v2022.1.Hs.symbols.gmt和c5.go.v7.4.symbols.gmt;通过R包ggplot2[3.3.6]进行结果可视化[11]。
1.3.6免疫浸润" 使用TIMER2.0数据库(http://timer.cistrome.org/)计算Spearman’s相关系数,探讨HCC中SPAST表达与肿瘤纯度及肿瘤浸润免疫细胞之间的关系。使用R(4.2.1)计算SPAST与免疫相关检查点的关联性。使用计cibersort算法计算SPAST与免疫浸润之间的关系。结果通过R包ggplot2[3.3.6]进行结果可视化[12,13]。
1.3.7单多因素COX分析与生存分析" 在R(4.2.1)中,提取TCGA-LIHC数据,用COX回归分析SPAST的表达与患者临床预后的关系。采用Kaplan-Meier方法绘制癌症患者的生存曲线。使用pROC[1.18.0]进行对数据进行ROC分析。survival[3.3.1]包进行比例风险假设检验并进行拟合生存回归,使用survminer包中surv_cutpoint函数进行最佳分组cut-off筛选,以Plt;0.05为显著性结果。用survminer包以及ggplot2包进行可视化[14]。
1.3.8 SPAST的表达差异与临床参数分析" 使用R(4.2.1)根据TCGA数据库中HCC患者SPAST表达值进行最佳分组,结合对应临床参数(TNM分期、临床分期、年龄、性别)进行统计分析。
1.3.9药物敏感性分析" 使用pRRophetic包从300多种HCC高、低风险组患者的药物中选择潜在敏感的药物,敏感性指标表示为IC50值对SPAST进行药物敏感性分析。
1.3.10分子对接" 通过PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/),确定小分子化合物的名称、分子量和三维结构。在 RCSB PDB 数据库(https://www.rcsb.org/)中下载了SPAST基因对应的三维结构。利用AutoDock Vina 软件(http://vina.scripps.edu/)准备配体和蛋白质进行分子对接。对于SPAST,其晶体结构需要预处理,包括去除水分子、氢化水分子、氢化、修改氨基酸、优化能量和调整力场参数。最后,使用Autodock 1.5.6 和 Vina 软件进行SPAST结构和小分子药物结构对接最后,Pymol来显示结果。
1.3.11 RNA提取、逆转录及荧光定量PCR" TRIzol法提取细胞和组织RNA。SYBR Green荧光染料法进行扩增,SPAST为目标基因,上游引物序列为:5’-GCGTCCGAGTCTTCCACAAAC-3’,下游引物序列为:5’-GCTTGCTCCTTCTGTCCTTTCTC-3’。GAPDH为内参,上游引物序列为:5’-AGTTCAACGGCACAGTCAAGGC-3’,下游引物序列为:5’- CGACATACTCAGCACCAGCATCAC-3’。使用2-△△CT法计算目的基因的相对表达量。
1.4统计学方法" 使用Wilcoxon秩和检验和配对样本t检验分析SPAST在33种常见肿瘤及HCC的非配对样本中的表达。选择χ2检验、Fisher’s精确检验及Wilcoxon秩和检验分析SPAST mRNA表达量与临床病理特征之间的关系。采用Kaplan-Meier方法绘制生存曲线,并进一步Log-rank检验评估两组间的差异。使用Spearman和Pearson相关系数分析免疫细胞浸润、DNA甲基化与SPAST表达的相关性。通过R(4.2.1版本)及SPSS(24.0版本)对以上数据进行分析,以Plt;0.05为差异有统计学意义。
2结果
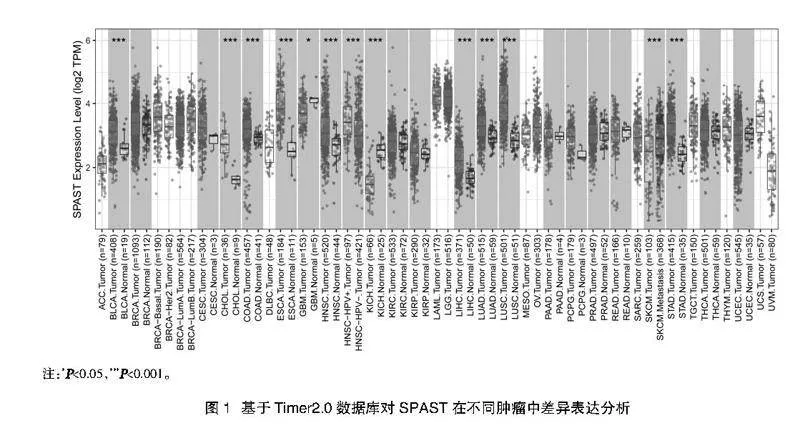
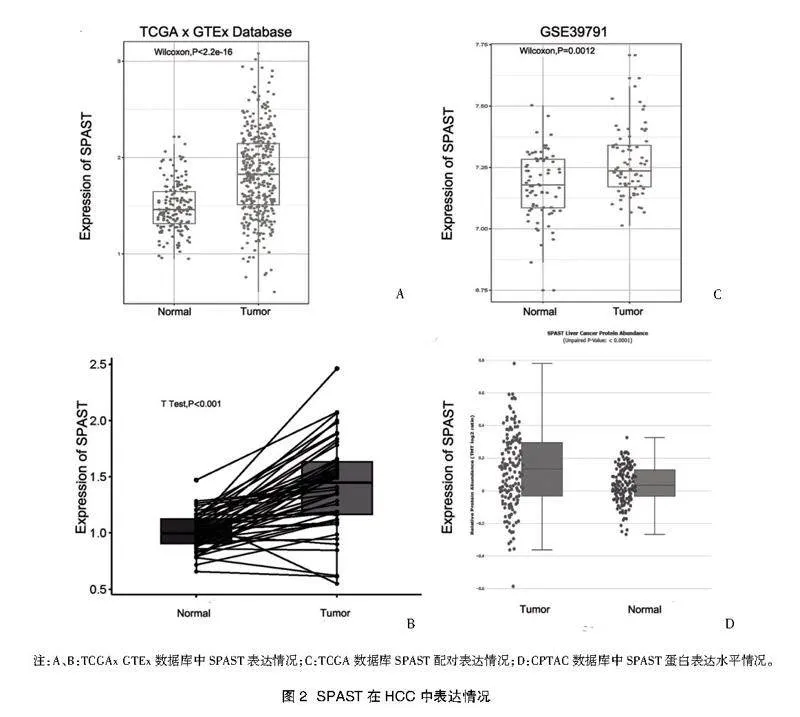
2.1 SPAST在癌症组织中的表达情况" 通过Timer2.0在线数据库,分析SPAST在33种常见癌种中表达情况。与正常组织相比,SPAST在肺癌、乳腺癌等10种癌种中高表达(图1)。对TCGA数据库和GTEx中HCC和正常肝组织样本进行非配对差异分析,结果显示HCC组织中SPAST的表达水平明显高于正常组织,与配对差异分析结果一致(图2A、图2B)。GEO数据库基因芯片数据GSE39791,结果显示HCC组织中SPAST表达水平较癌旁组织明显升高(图2C)。CPTAC蛋白数据库显示,SPAST在HCC中蛋白水平显著升高(图2D)。
2.2 SPAST突变及甲基化分析" "通过cBioportal数据库,首先评估了SPAST mRNA表达与CNV的相关性,结果显示SPAST在拷贝数轻度扩增型的表达量最高,其次是扩增型、二倍体型、拷贝数轻度丢失型(图3A)。HCC患者SPAST突变与SPAST mRNA表达量直接的关系分析结果显示,无突变型的HCC样本的平均表达量最高,其次是错义型(图3B)。最后通过LinkedOmics数据库分析了SPAST mRNA表达与甲基化之间的关系,结果显示SPAST mRNA表达与甲基化存在负相关性(Spearman:r=-0.16,P=0.0022,图4)。
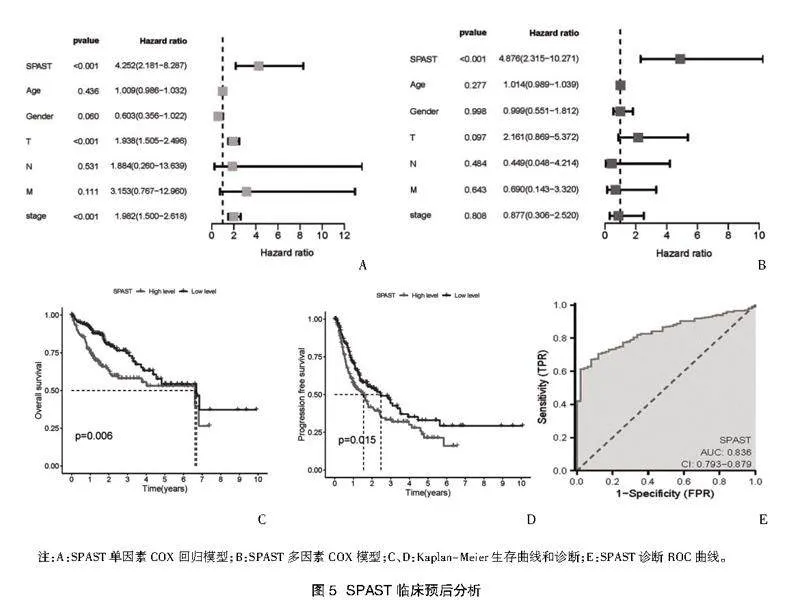
2.3 SPAST临床预后分析" 为了探索SPAST与临床预后的相关性,构建了单因素和多因素COX回归模型。单因素COX回归模型显示:SPAST与较差的总生存率、T分期、病理分期存在关联(图5A),多因素COX回归模型结果显示SPAST可能作为HCC预后标志物(图5B)。同时Kaplan-Meier生存曲线分析也提示SPAST表达越高,HCC患者生存率越低(图5C,图5D),最后为了评估SPAST的诊断价值,绘制了ROC曲线,结果显示SPAST具有很强的诊断应用潜力(图5E)。这些研究数据表明,SPAST在HCC可能作为独立预后因素且具有一定作为诊断标志物的潜力。
2.4 SPAST功能富集分析" 为了进一步了解SPAST在HCC中的功能作用,对SPAST进行GO、KEGG和GSEA分析。根据差异基因表达量中位数,将差异基因分为高、低表达两组,GO富集分析结果显示:SPAST主要参与核分裂、通道活动跨膜转运过程有关(图6A)。接着KEGG通路分析结果显示,SPAST和神经活性配体-受体相互作用、cAMP信号通路有关(图6B)。最后,对SPAST进行了GSEA分析。结果显示:在SPAST高表达组中,SPAST的KEGG项主要参与嗅觉传导。在SPAST低表达组中,KEGG项主要参与补体和凝血级联反应(图6C、图6D)。
2.5 SPAST表达与免疫浸润相关性分析" SPAST和免疫浸润以及常见免疫检查点之间的相关性(图7A,图7B)结果显示,SPAST与免疫浸润有关,同时和CD48、CD160、CD276等多个免疫检查点之间存在相关性。免疫细胞作为TME的重要组成部分,对TME的稳态维持起到关键性作用。
2.6 SPAST药物敏感性分析" 将SPAST分为高、低表达两组,使用pRRophetic包对SPAST进行药物敏感性关联分析。结果显示,在符合差异筛选条件内(Plt;0.05),一共有107种药物组间敏感性差异大,见图8A~图8F。
2.7分子对接" 对SPAST行药物敏感性分析发现,在pRRophetic包中,BI-2536和NPK76-II-72-1与SPAST存在药物敏感性关联。因此,通过计算机模拟SPAST与药物进行分子对接结果见图9A、图9B。
2.8 SPAST在HCC中mRNA和蛋白水平表达验证" 为了进一步验证SPAST在HCC中的差异表达情况,选取了正常肝细胞(MIHA)及2种HCC细胞株(Huh-7、SK-hep1)同时对15对人肝癌组织及其癌旁组织进行qRT-PCR。实验结果显示,SPAST在HCC中mRNA水平和蛋白水平呈高水平表达,与公共数据库结果一致(图10A、图10B)。
3讨论
HCC一直是威胁人类健康的恶性肿瘤,长期占据各大癌症死亡率前三位。尽管各种内分泌药物、化疗药物、分子靶向药物和免疫治疗能在不同程度上改善HCC患者的预后情况,但HCC晚期患者的生存率和临床预后仍不容乐观[15]。因此,探索具有特异性和高效性的全新分子治疗靶点的任务变得非常重要。
本研究通过多组学联合分析,揭露了SPAST在不同组学中差异表达情况对于HCC恶性进程的影响,通过TCGA数据库和GEO数据库下载的HCC患者RNA测序数据进行分析,获得了SPAST在HCC中的表达情况与临床预后评估价值。研究结果证明SPAST在许多常见癌种包括HCC中高表达,这与先前研究报道一致[6,7]。同时,利用细胞和组织在转录水平进行SPAST表达的验证实验,结果显示,SPAST在肝癌细胞与肝癌组织中表达水平上调,这与公共数据库数据分析结果一致。SPAST高表达组的患者生存期明显较短,SPAST高表达提示HCC患者预后不良。
为了探究SPAST在HCC中的功能作用,对SPAST进行了富集分析,结果显示SPAST可能参与离子通道活性激活和DNA结合转录过程。同时,SPAST在cAMP信号通路和钙信号通路上可能发挥作用。已有研究证实[16,17],cAMP可以激活的环核苷酸门控离子通道蛋白包括HCN2/4和CNGC。环核苷酸门控离子通道是一类由环核苷酸激活的跨膜蛋白构成的通道,在激活状态时可以允许阳离子非选择性通过。环核苷酸门控离子通道由1个通道孔和4个亚基构成(α或β亚基)。该类通道可以分为两类:环核苷酸门控离子通道(CNG)和超极化激活的环核苷酸门控(HCN)通道[18]。同时,研究证明,CNGC离子通道的激活主要依赖于钙离子的浓度。通过激活Calm(钙调蛋白)和CamKs(钙/钙调蛋白依赖性蛋白激酶),从而调节下游通路[16],本研究富集分析的结果与之一致。因此推测SPAST可能参与cAMP通路影响HCC的恶性生物学行为的产生。
肿瘤微环境(TME)在调控恶性肿瘤发展进程和调节肿瘤治疗效果中发挥关键作用。近期研究表明,针对性靶向TME成为一种很有前景的治疗肿瘤的方法[19]。免疫细胞和免疫相关检查点基因作为TME的重要组成部分,对TME的稳态维持起到关键性作用。
肿瘤免疫浸润与HCC患者的预后和免疫治疗反应密切相关。研究报道[20-22],HCC免疫细胞浸润与预后不良呈正相关,免疫细胞浸润导致HCC预后不佳。本研究分析了SPAST与免疫浸润的关系,结果显示SPAST与免疫浸润存在关联,这为HCC患者的免疫治疗研究提供新思路。
通过对基因表达和药物敏感性的相关性分析发现小分子药物BI-2536、NPK76-Ⅱ-72-1的药物敏感性在低表达组更为明显。虽然小分子药物的靶点已相对确定,但不排除其结构也可能与其他蛋白质有稳定的结合位点。已有相关研究报道[23],BI-25636可以降低吉非替尼肝毒性,进而提高吉非替尼对于癌症的治疗效果。本研究通过计算机模拟药物分子对接,探究了上述药物与SPAST可能存在强关联对接位点,这表明它们可能通过SPAST为靶点对HCC患者进行抗癌治疗。
综上所述,研究团队分析了SPAST在HCC中的表达与临床预后、免疫检查点、功能富集和药物敏感性之间的关系并通过基础实验,验证了PSMC6在HCC中呈高水平表达,与公共数据库分析结果一致。SPAST在HCC中呈高表达水平,与HCC不良预后有关联。SPAST可作为影响HCC患者预后的独立因素;SPAST与肿瘤免疫浸润过程相关;SPAST可能作为新的药物靶点,为治疗HCC患者提供新的思路。但其在HCC中的具体调控机制不明,有待进一步研究。
参考文献:
[1]Iarc.IARC Biennial Report 2020-2021[R].IARC Biennial Reports,2021.
[2]Zheng R,Zhang S,Zeng H,et al.Cancer incidence and mortality in China,2016 [J].Journal of the National Cancer Center,2022,2(1):1-9.
[3]Cheng K,Cai N,Zhu J,et al.Tumor-associated macrophages in liver cancer: Frommechanisms to therapy[J].Cancer Commun (Lond),2022,42(11):1112-1140.
[4]Anwanwan D,Singh SK,Singh S,et al.Challenges in liver cancer and possible treatment approaches[J].Biochim Biophys Acta Rev Cancer,2020,1873(1):188314.
[5]Claudiani P,Riano E,Errico A,et al.Spastin subcellular localization is regulated through usage of different translation start sites and active export from the nucleus[J].Exp Cell Res,2005,309(2):358-369.
[6]Dráberová E,Vinopal S,Morfini G,et al.Microtubule-severing ATPase spastin in glioblastoma: increased expression in human glioblastoma cell lines and inverse roles in cell motility and proliferation[J].J Neuropathol Exp Neurol,2011,70(9):811-826.
[7]Schlick B,Massoner P,Lueking A,et al.Serum Autoantibodies in Chronic Prostate Inflammation in Prostate Cancer Patients[J].PLoS One,2016,11(2):e0147739.
[8]Cui Z,Zou F,Wang R,et al.Integrative bioinformatics analysis of WDHD1:a potential biomarker for pan-cancer prognosis,diagnosis,and immunotherapy[J].World J Surg Oncol,2023,21(1):309.
[9]Wang YC,Tian ZB,Tang XQ.Bioinformatics screening of biomarkers related to liver cancer[J].BMC Bioinformatics,2021,22(Suppl 3):521.
[10]Song X,Du R,Gui H,et al.Identification of potential hub genes related to the progression and prognosis of hepatocellular carcinoma through integrated bioinformatics analysis[J].Oncol Rep,2020,43(1):133-146.
[11]Cao J,Zhang C,Jiang GQ,et al.Identification of hepatocellular carcinoma-related genes associated with macrophage differentiation based on bioinformatics analyses[J].Bioengineered,2021,12(1):296-309.
[12]Liu J,Sun G,Pan S,et al.The Cancer Genome Atlas (TCGA) based m6 A methylation-related genes predict prognosis in hepatocellular carcinoma[J].Bioengineered,2020,11(1):759-768.
[13]Chen D,Liu J,Zang L,et al.Integrated Machine Learning and Bioinformatic Analyses Constructed a Novel Stemness-Related Classifier to Predict Prognosis and Immunotherapy Responses for Hepatocellular Carcinoma Patients[J].Int J Biol Sci,2022,18(1):360-373.
[14]Xu Z,Peng B,Liang Q,et al.Construction of a Ferroptosis-Related Nine-lncRNA Signature for Predicting Prognosis and Immune Response in Hepatocellular Carcinoma[J].Front Immunol,2021,12:719175.
[15]Yang C,Zhang H,Zhang L,et al.Evolving therapeutic landscape of advanced hepatocellular carcinoma[J].Nat Rev Gastroenterol Hepatol,2023,20(4):203-222.
[16]Duszyn M,Swiezawska B,Szmidt-Jaworska A,et al.Cyclic nucleotide gated channels (CNGCs) in plant signalling-Current knowledge and perspectives[J].J Plant Physiol,2019,241:153035.
[17]Spinelli V,Sartiani L,Mugelli A,et al.Hyperpolarization-activatedcyclic-nucleotide-gated channels: pathophysiological, developmental, and pharmacological insights into their function in cellular excitability[J].Can J Physiol Pharmacol,2018,96(10):977-984.
[18]Kaupp UB,Seifert R.Cyclic nucleotide-gated ion channels[J].Physiol Rev,2002,82(3):769-824.
[19]Bejarano L,Jordao MJC,Joyce JA.Therapeutic Targeting of the Tumor Microenvironment[J].Cancer Discov,2021,11(4):933-959.
[20]Ma H,Kang Z,Foo TK,et al.Disrupted BRCA1-PALB2 interaction induces tumor immunosuppression and T-lymphocyte infiltration in HCC through cGAS-STING pathway[J].Hepatology,2023,77(1):33-47.
[21]Wang X,Zhou T,Chen X,et al.System analysis based on the cancer-immunity cycle identifies ZNF207 as a novel immunotherapy target for hepatocellular carcinoma[J].J Immunother Cancer,2022,10(3):e004414.
[22]Hu B,Yu M,Ma X,et al.IFNalpha Potentiates Anti-PD-1 Efficacy by Remodeling Glucose Metabolism in the Hepatocellular Carcinoma Microenvironment[J].Cancer Discov,2022,12(7):1718-1741.
[23]Luo P,Yan H,Du J,et al.PLK1 (polo like kinase 1)-dependent autophagy facilitates gefitinib-induced hepatotoxicity by degrading COX6A1 (cytochrome c oxidase subunit 6A1)[J].Autophagy,2021,17(10):322.
收稿日期:2023-12-29;修回日期:2024-01-29
编辑/肖婷婷
基金项目:国家自然科学基金(编号:82060431)
作者简介:李炎娟(1998.6-),女,广西玉林人,硕士研究生,主要从事肝细胞癌基础研究及生物信息学可视化方向研究
通讯作者:曹骥(1981.4-),男,广西南宁人,硕士,研究员,主要从事癌症早诊早治,癌症基础研究和肝癌病因学研究

