不同菜用甘薯品种茎尖代谢产物鉴定及途径分析


摘要:为研究代谢产物对甘薯生长发育的影响,以甘薯茎尖为研究对象,利用液相色谱-质谱联用(liquidchromatograph-mass spectrometer,LC-M)分离鉴定南宁菜、福菜薯18号、桂菜薯1号、桂菜薯2号、福薯7-6和台农71共6种菜用甘薯的差异代谢产物,探讨代谢途径的差异。结果表明,6个甘薯品种共得到差异代谢物4 210种,其中上调2 229种,下调1 981种,表明不同甘薯品种间存在显著差异。差异代谢物涉及的代谢途径主要包括初级胆汁酸生物合成、吲哚生物碱生物合成、黄酮和黄酮醇生物合成和色氨酸代谢,且不同品种间差异代谢物的积累和代谢途径也存在较大差异。因此,推测差异代谢物的积累和代谢途径的差异对甘薯品质起着关键作用。以上研究结果为进一步分析不同品种甘薯品质差异的机制奠定了基础。
关键词:菜用甘薯;茎尖;代谢产物;代谢途径doi:10.13304/j.nykjdb.2024.0371
中图分类号:S531;Q591 文献标志码:A 文章编号:1008‐0864(2025)02‐0062‐08
甘薯是我国重要的食品和工业原料作物,在国民经济中占有重要地位[1]。尽管储藏根是其主要食用部位,但甘薯的茎叶也被视为绿色蔬菜,并因其丰富的营养成分和健康益处而备受关注。然而对于不同品种菜用甘薯的代谢特征和代谢通路差异了解尚不充分[2-3]。
甘薯茎叶富含维生素、矿物质、叶酸、蛋白质等营养成分以及多酚、绿原酸、黄酮等有益健康的功能成分,这不仅使其成为重要的蔬菜、饲料来源,也将使其成为加工利用的新对象[4]。绿原酸是甘薯中酚酸类物质的主要成分,具有抗氧化、抗诱变和清除自由基等抗氧化特性[5],意味着食用甘薯茎叶具有多种健康益处,如抗衰老、抗癌、抗菌、抗炎、抗高血压和抗糖尿病(Ⅱ型)作用[6]。目前,消费者对甘薯茎叶的营养成分、生物活性和潜在健康益处越来越关注。研究表明,在甘薯中鉴定出的主要酚类化合物是酚酸和黄酮类化合物,其组成和含量因甘薯种类而存在差异[7]。刘主等[6]通过对糖尿病鼠进行试验发现,甘薯中的糖蛋白具有降血糖作用。曾果等[7]通过生物强化技术培育的高β-胡萝卜素甘薯品种具有为儿童补充维生素A的作用。有关甘薯中酚类化合物的特征已有研究,然而关于甘薯中这些化合物的定量和表征信息有限。代谢组学研究能够全面地揭示生物体内代谢物的变化[8-9],但在菜用甘薯方面的应用尚未充分展开。本研究以6种菜用甘薯的茎尖为研究对象,通过主成分(principa component,PC)分析、偏最小二乘判别分析(orthogonal partial leastsquares discriminant analysis,OPLS-DA)等多元统计分析方法分析不同品种间的差异代谢产物和代谢通路,从而为菜用甘薯的品质改良和优化提供理论依据。
1 材料与方法
1.1 试验地概况
试验于2022年在广西壮族自治区农业科学院明阳基地 (22°27′18″—22°36′29″N,108°2′—108°18′E) 温室大棚进行,土壤为赤红壤。甘薯株行距为20 cm×20 cm,栽插密度为250 500株·hm−2,田间管理同当地水平。栽插后30 d,摘取茎尖,样品储藏在−80 ℃冰箱备用,每品种6个生物学重复用于代谢产物测定。
1.2 试验材料
选取南宁菜(NNC)、福菜薯18号(FCS18)、桂菜薯1 号(GCS1) 、桂菜薯2 号(GCS2) 、福薯7-6(FS7-6)和台农71(TN71)共6个甘薯品种。南宁菜株型匍匐型,顶芽和顶叶黄绿色,成叶墨绿色,叶心形或心形带齿,叶脉、叶脉基部、叶柄、柄基及茎均为绿色,叶片较大,茎直径较粗,分枝数中等,味甜、软滑,且叶片较耐煮、不烂,食味好。福菜薯18 号株型短蔓半直立,萌芽性能好,叶心形,带齿,茎尖无茸毛;植株生长旺盛,腋芽再生能力强;中抗甘薯根腐病、甘薯茎线虫病,感甘薯黑斑病;耐湿耐水肥。桂菜薯1号株型表现为直立或半直立,茎端无茸毛,叶形深裂复缺刻,顶叶绿色或黄绿色,茎色绿,无茸毛,烫后颜色绿,有香味、甜味和滑腻感。桂菜薯2号株型表现为直立或半直立,茎端无茸毛,叶形深裂复缺刻,顶叶黄绿色或绿色,成叶深绿色,茎绿色,茎尖烫熟后颜色绿色,有香味和甜味,无涩味。福薯7-6株型短蔓半直立,顶叶、成叶、叶脉、叶柄和茎蔓均为绿色。叶脉基部淡紫色,叶心形,茎尖绒毛少,食味清甜,无苦涩味,适口性好。台农71株型短蔓半直立,基部分枝多,顶叶、成叶、叶脉、叶柄、茎蔓均为绿色,叶心形,茸毛少,口感鲜嫩滑爽。
1.3 试验方法
1.3.1 菜用甘薯样品预处理 选取完整、成熟的甘薯茎尖,放入研钵研磨,将研磨好的粉末样品储存于−80 ℃ 冰箱备用。
1.3.2 代谢产物提取 取 100 mg 研磨样本,置于 EP 管中,加入500 μL 的 80%甲醇水溶液;涡旋振荡,冰浴静置 5 min,4 ℃、15 000 r·min−1离心20 min;取一定量的上清加质谱级水稀释至甲醇含量为53%;4 ℃、15 000 r·min−1离心20 min,收集上清,进行液相色谱− 质谱联用仪(liquidchromatograph mass spectrometer,LC-MS)分析[10]。
1.3.3 LC-MS 分析 ①色谱条件。在LC-MS 系统,分析条件如下:取5 μL提取物进行色谱分离,色谱柱(100 mm×2.1 mm,1.7 μm, Waters,USA)柱温为40 ℃,流速为0.35 mL·min−1,其中流动相包括水和 0.1%甲酸溶液(溶剂A)、5%乙腈溶液(溶剂B)。 洗脱梯度程序:以5%溶剂B为起始条件,保持1 min;并将5%~100% B 保持8.0 min;随后在 9.0—12.0 min使用100%溶剂B;最后在12.0—15.0 min使用5%溶剂B。
②质谱条件。在Q ExactiveTM HF-X质谱仪上进行质量采集,该系统在电喷雾电离正负模式下运行,设置如下:一级离子扫描m/z范围:80~1 200,分辨率 70 000,二级打碎片离子分辨率 17 500,能量梯度为 20/50;在正、负模式下,喷雾电压分别为:3.50、3.00 kV,离子源温度为300 ℃。
1.4 数据分析
将质谱分析采集得到的原始数据经过Compound Discoverer 2.1(Thermo Fisher Scientific)软件处理,获得整理好的数据后,将其导入MetaboAnalyst 进行主成分(PC)分析、正交偏最小二乘法判别分析(OPLS-DA),以筛选不同甘薯品种的差异代谢物,并进行KEEG(kyoto encyclopedia ofgenes and genomes)通路分析和代谢通路分析。
2 结果与分析
2.1 主成分分析和偏最小二乘法判别分析
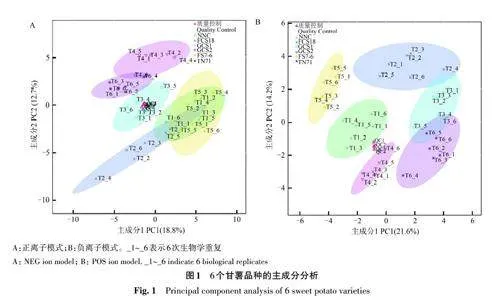
为比较不同甘薯品种的代谢物组成,通过非靶向LC-MS获得的数据进行主成分(PC)分析,结果(图1)表明,正离子模式下,PC1和PC2的贡献率分别为18.8% 和12.7%,累计贡献率为31.5%;负离子模式下,PC1和PC2的贡献率分别为21.6%和14.2%,累计贡献率为35.8%。不同品种间较分散,而同一品种的不同生物学重复聚集在一起。同时样本均分布在95%置信区间,表明分析结果可靠,不同甘薯品种的代谢物存在差异。
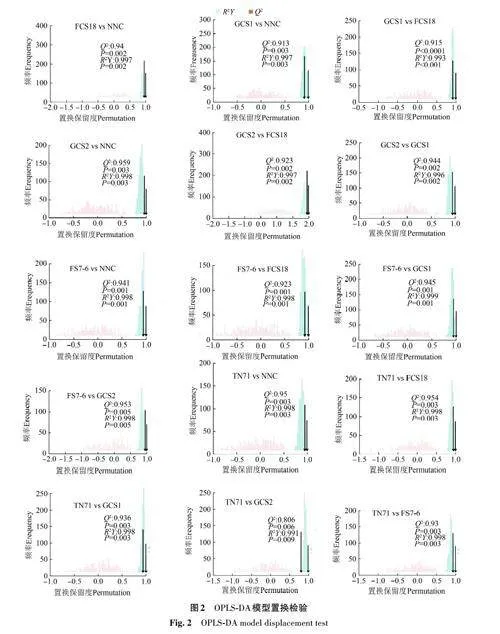
OPLS-DA结果(图2)表明,R2 和Q2 值均大于0.9,说明模型有效,预测能力好。通过置换检验对模型有效性做进一步的检验,结果表明,6个甘薯品种之间有显著性差异(Plt;0.05),说明模型稳健性好,不存在过拟合现象。福菜薯18号与南宁菜、桂菜薯1 号与南宁菜、桂菜薯1 号与福菜薯18号、桂菜薯2号与南宁菜、桂菜薯2号与福菜薯18号、桂菜薯2号与桂菜薯1号、福薯7-6与南宁菜、福薯7-6 与福菜薯18 号、福薯7-6 与桂菜薯1号、福薯7-6与桂菜薯2号、台农71与南宁菜、台农71与福菜薯18号、台农71与桂菜薯1号、台农71与桂菜薯2号、台农71与福薯7-6样品间差异较大,说明不同甘薯品种存在差异,而同一品种内的6次生物学重复较集中,即组内差异较小。
2.2 不同甘薯品种间差异代谢物的筛选
将变量投影重要性(variable importance inprojection, VIP)≥1、Plt;0.05 和倍数变化(foldchange,FC) ≥ 2的差异代谢物定义为显著性差异代谢物。由表1可知,福菜薯18号和南宁菜之间有314 种显著差异代谢物,其中189 种上调,125种下调;桂菜薯1号和南宁菜之间有304种显著差异代谢物,其中166种上调,138种下调;桂菜薯1号和福菜薯18号之间有253种显著差异代谢物,其中138种上调,115种下调;桂菜薯2号和南宁菜之间有300种显著差异代谢物,其中148种上调,152种下调;桂菜薯2号和福菜薯18号之间有311种显著差异代谢物,其中155种上调,156种下调;桂菜薯2号和桂菜薯1号之间有292种显著差异代谢物,其中132种上调,160种下调;福薯7-6和南宁菜之间有287种显著差异代谢物,其中162种上调,125种下调;福薯7-6和福菜薯18号之间有254 种显著差异代谢物,其中116 种上调,138种下调;福薯7-6和桂菜薯1号之间有276种显著差异代谢物,其中126种上调,150种下调;福薯7-6和桂菜薯2号之间有315种显著差异代谢物,其中154种上调,161种下调;台农71和南宁菜之间有331种显著差异代谢物,其中185种上调,146种下调;台农71和福菜薯18号之间有272种显著差异代谢物,其中146 种上调, 126 种下调;台农71和桂菜薯1号之间有209种显著差异代谢物,其中119种上调,90种下调;台农71和桂菜薯2号之间有209种显著差异代谢物,其中132种上调,77种下调;台农71和福薯7-6之间有283种显著差异代谢物,其中162种上调,122种下调。在福菜薯18号和南宁菜中检测到的上调差异代谢物最多,而在台农71和桂菜薯2号最少。在台农71和福薯7-6中检测到的下调差异代谢物数量最高,在台农71和桂菜薯2号最少。各品种间的差异代谢物均有所不同,呈现出显著差异,推测6种甘薯品种的差异是由于代谢物差异所致。综上,南宁菜和福菜薯18 号、桂菜薯1 号、桂菜薯2号、福薯7-6、台农71间的代谢物谱差异较大。
2.3 差异代谢富集分析
KEGG 富集分析结果表明,福菜薯18 号、桂菜薯1 号、桂菜薯2 号、福薯7-6、台农71 与南宁菜的差异代谢物分别涉及72、81、80、60、63条通路,主要通路如图3 所示。福菜薯18 号与南宁菜的差异代谢物主要富集在色氨酸代谢、吲哚生物碱生物合成,其中注释到色氨酸代谢途径的差异代谢物最多,其次是次生代谢物的生物合成途径。值得注意的是,生物碱合成相关的代谢途径包括吲哚生物碱生物合成、莽草酸途径生物碱的生物合成、萜类化合物和聚酮类生物碱的生物合成、皂苷生物碱的生物合成、组氨酸和嘌呤生物碱的生物合成萜烯和聚酮生物碱的生物合成,这些生物合成通路上富集的差异基因在桂菜薯1号和南宁菜数量较多;除莽草酸途径生物碱的生物合成外,桂菜薯2号与南宁菜中还显著富集了与类固醇激素生物合成有关的代谢途径。在福薯7-6 与南宁菜的差异代谢物富集分析中,主要是次生代谢物合成的途径,次生代谢过程被认为是植物在长期进化中对生态环境适应的结果,在植物适应生态环境中起重要作用。台农71与南宁菜的差异代谢物富集的代谢通路主要为次生胆汁酸生物合成、黄酮和黄酮醇生物合成[10]、初级胆汁酸生物合成。
3 讨论
本研究对6个不同甘薯品种的茎尖进行了非靶向代谢组学检测,PC分析表明,不同甘薯品种间差异较大。与南宁菜相比,福菜薯18号、桂菜薯1号、桂菜薯2号、福薯7-6和台农71茎尖中的上调代谢物数量分别为189、166、148、162和185种,下调代谢物数量分别为125、138、152、125、146种,在这些差异代谢物中,仅有46种相同,表明6个甘薯品种的代谢物谱存在显著差异。Tan等[11]分析不同基因型甘薯的代谢组学显示,不同基因型之间存在显著的代谢差异。这与本研究结果一致,进一步验证了甘薯不同品种间代谢特征的差异性。福菜薯18号与南宁菜差异代谢物的富集分析表明,色氨酸代谢途径被显著富集,注释到色氨酸代谢途径的差异基因最多,其次是次生代谢物生物合成途径。色氨酸可通过一系列酶催化反应转化为多种次生代谢产物,如植物激素生长素、色素类黄酮和类黄酮醇等[12]。桂菜薯1 号与南宁菜的差异代谢物也富集在色氨酸代谢途径,同时还显著富集于次生胆汁酸生物合成、组氨酸代谢、Ⅱ型聚酮产品的生物合成、初级胆汁酸生物合成;桂菜薯2 号与南宁菜的差异代谢物富集在初级胆汁酸生物合成、次生胆汁酸生物合成、类固醇激素生物合成、碳水化合物的消化和吸收; 台农71与南宁菜的差异代谢物主要富集在次生胆汁酸生物合成、黄酮和黄酮醇的生物合成、初级胆汁酸生物合成。由此表明,南宁菜、福菜薯18号、桂菜薯1号、桂菜薯2号、福薯7-6和台农71的代谢途径存在显著差异。色氨酸还参与植物光合作用的调节,光合作用是植物能量的主要来源,而色氨酸在光合作用中扮演重要角色,它通过调控光合作用,影响光合作用的速率和效率[13] 。生长素可调节光合作用相关酶的活性,从而影响光合作用的速率和产物的积累,色氨酸的存在和调控为植物的能量供给提供了重要保障。色氨酸还可增强植物对各种胁迫的耐受性,包括干旱、高温、低温、盐胁迫等,其通过调节植物生长素、抗氧化酶活性以及相关基因的表达等途径发挥作用。在高粱拔节期喷施色氨酸能显著提高籽粒产量、千粒重、茎粗和穗长,同时降低株高、减轻倒伏的风险,这一措施还有助于提高高粱植株的SPAD 值和净光合速率,增加籽粒千粒重,从而达到增产增收效果[14]。本研究也发现,差异代谢物显著富集于色氨酸代谢,因此,南宁菜、福菜薯18号和桂菜薯1号光合作用的增强可能与色氨酸及其产物的增加有关,通过进一步探究甘薯色氨酸代谢的调节机制,或许能够发现类似的促生长效果,从而为甘薯产量和质量的改良提供新途径。同时,色氨酸还可通过合成次生代谢产物的方式,增强植物的抗逆能力。将代谢组学和转录组学相结合,深入理解植物代谢调控机理,对深入解析作物高产、优质的调控机制提供了新的方向。
参考文献
[1] LI C, KOU M, SONG W H,et al .. Comparative analysis of
saccharification characteristics of different type sweetpotato
cultivars [J/OL]. Foods,2023,12(20):3785 [2024-04-10]. https://
doi.org/10.3390/foods1220785.
[2] JING X J, CHEN P R, JIN X J, et al .. Physiological,
photosynthetic,and transcriptomics insights into the influence
of shading on leafy sweet potato [J/OL]. Genes, 2023, 14(12):
2112 [2024-04-10]. https://doi.org/10.3390/genes14122112.
[3] YU Y, ZHANG Q, LIU S, et al .. Effects of exogenous
phytohormones on chlorogenic acid accumulation and pathwayassociated
gene expressions in sweetpotato stem tips [J]. Plant
Physiol. Biochem., 2021, 164: 21-26.
[4] 傅玉凡. 甘薯茎叶研究与发展专题[J]. 西南大学学报(自然
科学版), 2023, 45(10): 1.
[5] 毕洪娟,靳晓杰,雷剑,等.甘薯茎叶生物活性成分及其保健
功效研究进展[J].江苏农业学报,2022,38(6):1702-1708.
BI H J, JIN X J, LEI J, et al ..Progress of bioactive components
and their health function in sweetpotato stems and leaves [J].
Jiangsu J. Agric. Sci., 2022, 38(6): 1702-1708.
[6] 刘主,朱必凤,彭凌,等. 甘薯糖蛋白降血糖与抗氧化作用研
究[J]. 食品科学. 2008, 29(11): 582-584.
LIU Z, ZHU B F, PENG L, et al .. Study on hypoglycemic
effect and antioxidation of sweet potato glycoprotein [J]. Food
Sci., 2008, 29(11):582-584.
[7] 曾果,林黎,刘祖阳,等. 生物强化高β-胡萝卜素甘薯对儿童
维生素A营养干预研究[J]. 营养学报. 2008, 30(6): 575-579.
ZENG G, LIN L, LIU Z Y, et al .. Study on the nutritional
intervention of biofortified beta-carotene rich sweet potato on
vitamin A status of children [J]. Acta Nutr. Sin., 2008, 30(6):
575-579.
[8] 唐毓玮,李佳慧,毛立彦,等. 基于代谢组学技术分析睡莲花
朵不同组织的代谢产物差异[J]. 西南农业学报, 2022, 35(7):
1657-1664.
TANG Y W, LI J H, MAO L Y, et al .. Analysis of metabolites
in different tissues of water lily flowers based on metabonomics
[J]. Southwest China J. Agric. Sci., 2022, 35(7): 1657-1664.
[9] 王卫华,杨晓琴,桑正林,等. 比较代谢组学揭示不同生长期
筇竹笋的代谢物差异[J]. 食品科学. 2023, 44(14): 237-244.
WANG W H, YANG X Q, SANG Z L, et al .. Comparative
metabolomics revealed metabolite differences in bamboo
shoots (Chimonobambusa tumidissinoda Hsueh amp; T. P. Yi ex
Ohrnberger) at different growth stages [J]. Food Sci., 2023,44
(14): 237-244.
[10] 唐雪妹,赵晓丽,高毓文,等. 基于UPLC-Q-orbitrap-MS的非
靶向代谢组学用于不同橄榄品种差异代谢物分析[J]. 热带
作物学报, 2021, 42(12): 3416-3423.
TANG X M, ZHAO X L, GAO Y W, et al .. Untargeted
metabolomics analysis of different olive varieties by UPLC-Qorbitrap-
MS Mass Spectrometry [J]. Chin. J. Trop. Crops, 2021,
42(12): 3416-3423.
[11] TAN W Q, GUO X B, WANG Z Y, et al .. Metabolic profiles
and morphological characteristics of leaf tips among different
sweet potato (Ipomoea batatas Lam.) varieties [J]. J. Integr.
Agric., 2024, 23(2): 494-510.
[12] 时羽杰,李兴龙,唐媛,等.基于GC-MS分析两地白色藜麦种
子的代谢差异[J].浙江农业学报,2019,31(6):869-877.
SHI Y J, LI X L, TANG Y, et al .. Study on metabolic
differences of white quinoa from two areas based on GC-MS [J].
Acta Agric. Zhejiangensis, 2019, 31(6): 869-877.
[13] 黄亚成,任东立,何斌,等.转录组学和代谢组学在植物非生
物胁迫中的研究进展[J].江苏农业科学,2023,51(22):1-7.
[14] 李俊志,王晓东,窦爽,等. 低氮条件下L-色氨酸对高粱生长
发育的影响[J]. 作物杂志, 2024(5): 175-180.
LI J Z, WANG X D, DOU S, et al .. Effects of L-tryptophan on
growth and development of Sorghum under low nitrogen
condition [J]. Crops, 2024(5): 175-180.

