异质生境下山东银莲花的转录组分析及EST-SSR分子标记开发




摘 要: "为探究稀有物种山东银莲花在全光照的山顶灌丛和阴暗的针阔混交林下两种不同生境中的生态适应机制,并开发其EST-SSR分子标记,该研究利用Illumina高通量测序技术对开花期的山东银莲花叶片进行转录组测序,获取其功能注释和差异表达基因(DEGs)。结果表明:(1)转录组测序共得到53 536条Unigenes序列,其中27 448条成功获得注释。(2)差异表达基因5 635个,1 600个在山顶灌丛的山东银莲花中上调表达,其余4 035个下调表达。有2 460个差异表达基因注释到GO数据库2 533个三级条目中,1 051个差异表达基因注释到KEGG数据库的113条代谢通路中。(3)山东银莲花适应于异质生境的代谢通路主要涉及光合作用-天线蛋白通路和类黄酮生物合成通路,光合作用-天线蛋白通路中lhca5基因上调表达,lhcb1、lhcb2和lhcb3基因下调表达,类黄酮生物合成通路中chs、c4h、f3′h、f3h、fls、ans、chi、ccoaomt和hct基因均上调表达。(4)从山东银莲花转录组数据中共获得7 146个SSR位点分布于6 006条Unigenes序列中,共计106种重复基序,优势重复基序为单核苷酸重复。设计合成100对EST-SSR引物中共有68对引物具有有效性,其中11对具有多态性,共扩增24个多态性片段。该研究首次开发了山东银莲花EST-SSR分子标记,为山东银莲花的保护和利用提供了重要的分子标记资源。
关键词: 异质生境, 山东银莲花, 转录组, EST-SSR, 生态适应机制
中图分类号: "Q943
文献标识码: "A
文章编号: "1000-3142(2025)01-0095-13
基金项目: "国家自然科学基金面上项目(31971546)。
第一作者: 单筱涵(1998—),硕士研究生,研究方向为植物生物学,(E-mail)shanxiaohan0920@163.com。
*通信作者: "卞福花,博士,教授,研究方向为植物生物学,(E-mail)fh_bian@163.com。
Transcriptome analysis and development of EST-SSR
molecular markers in Anemone shikokiana under
heterogeneous habitats
SHAN Xiaohan, AN Kang, ZHOU Chunxia, ZHANG Xin,
PANG Yujuan, LI Lixia, BIAN Fuhua
( College of Life Sciences, Yantai University, Yantai 264005, Shandong, China )
Abstract: "In order to explore, the ecological adaptation mechanisms of Anemone shikokiana in two distinct habitats, namely full-light hilltop scrub and shady mixed broadleaved-coniferous forest, and to develop its molecular markers, Illumina high-throughput sequencing technology for leaves of A. shikokiana collected during the flowering stage to obtain functional annotation and differentially expressed genes (DEGs). The results were as follows: (1) A total of 53 536 Unigenes sequences were obtained, of which 27 448 were successfully annotated. (2) A total of 5 635 DEGs were obtained, 1 600 up-regulated and 4 035 down-regulated genes comparing A. shikokiana in full-light hilltop scrub and in shady mixed coniferous forest. A total of "2 460 DEGs were annotated to 2 533 tertiary entries in GO database. In addition, 1 051 DEGs were involved in 113 KEGG pathways. (3) The metabolic pathways adapted to heterogeneous habits in A. shikokiana mainly involved photosytheis-antenna protein pathway and flavonoid biosynthesis pathway. In the "photosynthesis-antenna protein pathway, the expression of lhca5 was up-regulated, while the
expressions of lhcb lhcb2 and lhcb3 were "down-regulated. Meanwhile, in the flavonoid biosynthesis pathway, the expressions of chs, c4h, f3′h, f3h, fls, ans, chi, ccoaomt and hct were all up-regulated. (4) A total of 6 006 Unigenes containing 7 146 SSRs were obtained from the transcriptome data of A.shikokiana. In the identified SSRs, the dominant repeat motifs were single nucleotide repeats in 106 repetitive motif types. Among the 100 pairs of EST-SSR primers, a total of 68 pairs were effective and 11 pairs with polymorphism, and 24 polymorphic fragments were amplified. Overall, in this paper, "for the first time EST-SSR molecular markers were developed, which would provide important molecular marker resource for the conservation and utilization of A. shikokiana.
Key words: heterogeneous habitat, Anemone shikokiana, transcriptome, EST-SSR, ecological adaptation mechanisms
山东银莲花(Anemone shikokiana)是毛茛科银莲花属(Anemone)的多年生草本植物,间断分布于中国胶东半岛和日本四国岛(王鸷等,2014)。在中国被列入《世界自然保护联盟濒危物种红色名录》(IUCN)易危(VU)等级,为典型的稀有物种(陈春利等,2018)。其根可入药,有清热解毒、止血除湿的功效(刘琼,2014);因其株型优美、花大、花期长,在园艺上具有潜在的开发价值(侯元同和刘冰,2010)。
山东银莲花生长在海拔600 m以上的山顶灌丛和针阔混交林下两种异质生境中,山东灌丛常年全光照,土壤是以碎石、沙粒为主的砂质性土壤;而针阔混交林下阴暗潮湿,土壤为营养丰富且疏松的腐殖土(Pang et al., 2020)。岳喜元等(2023)研究表明,黄河三角洲的芦苇通过调整个体大小与叶性状适应异质生境下水分条件变化,王妍方等(2023)通过木棉表型可塑性探究其适应干热河谷和热带雨林两种极端环境的机制。山东银莲花则通过改变叶片、根系的形态结构及生理等策略适应完全不同的生长环境(于文英等,2019;Pang er al., 2020;逄玉娟等,2022)。然而,至今对该种适应异质生境的分子机制尚不清楚。植物适应环境的本质是基因特异性表达的结果,基因的特异性表达在一定程度上由转录水平进行调控(张椿雨等,2007)。转录组作为特定组织或细胞在某一发育阶段或功能状态下所有mRNA的集合,是研究基因功能与结构的有效手段(鲁艳辉等,2021)。运用Illumina高通量测序技术对植物转录组进行测序分析,可高效、精准地获得大量特定组织或细胞中表达的基因序列,实现在无参考基因组的基础上进行分析(郭连安等,2021)。同时,转录组分析应用于两色金鸡菊(孙浩男等,2024)、直立型扁蓿豆(乌日娜等,2022)等多种植物,并且已广泛应用于探究不同生境下植物的适应性(周春苗等,2022;韦陈彬等,2022)。
分子标记可用于植物的系统进化分析、功能基因标记和分子辅助育种等,随着高通量测序技术的发展,由转录组测序得到的EST-SSR分子标记被作为最常用的分子标记技术之一。其操作简单,具有共显性遗传、稳定性好和准确度高等优于其他分子标记的特点(岳远灏等,2022)。EST-SSR标记开发成本低,适用于无参考基因组的物种,可有效地推动分子标记技术在植物遗传多样性分析、指纹图谱构建、种质资源保护、品种鉴定等方面的应用(杨雄等,2021),目前已在大麻(边境等,2023)、辣椒(田怀志等,2023)、枫香(李辉等,2023)等植物中开发与应用。然而,关于山东银莲花分子标记的报道尚不多见,未见公开报道的可利用 SSR 标记,使得山东银莲花在分子标记方面的研究难以深入。
本研究以异质生境下山东银莲花为研究对象,利用Illumina高通量测序技术获取其转录组数据,并进行组装和功能注释,得到其差异表达基因和大量丰富的SSR位点,随后进行EST-SSR引物设计并加以验证,以期探讨山东银莲花在异质生境中的生态适应机制,并开发适用的EST-SSR分子标记,填补山东银莲花在以上两方面的研究空白,为今后其遗传多样性分析、种质资源评价、功能基因标记和分子辅助育种等研究奠定基础,进一步实现物种的保护与利用。
1 材料与方法
1.1 实验材料
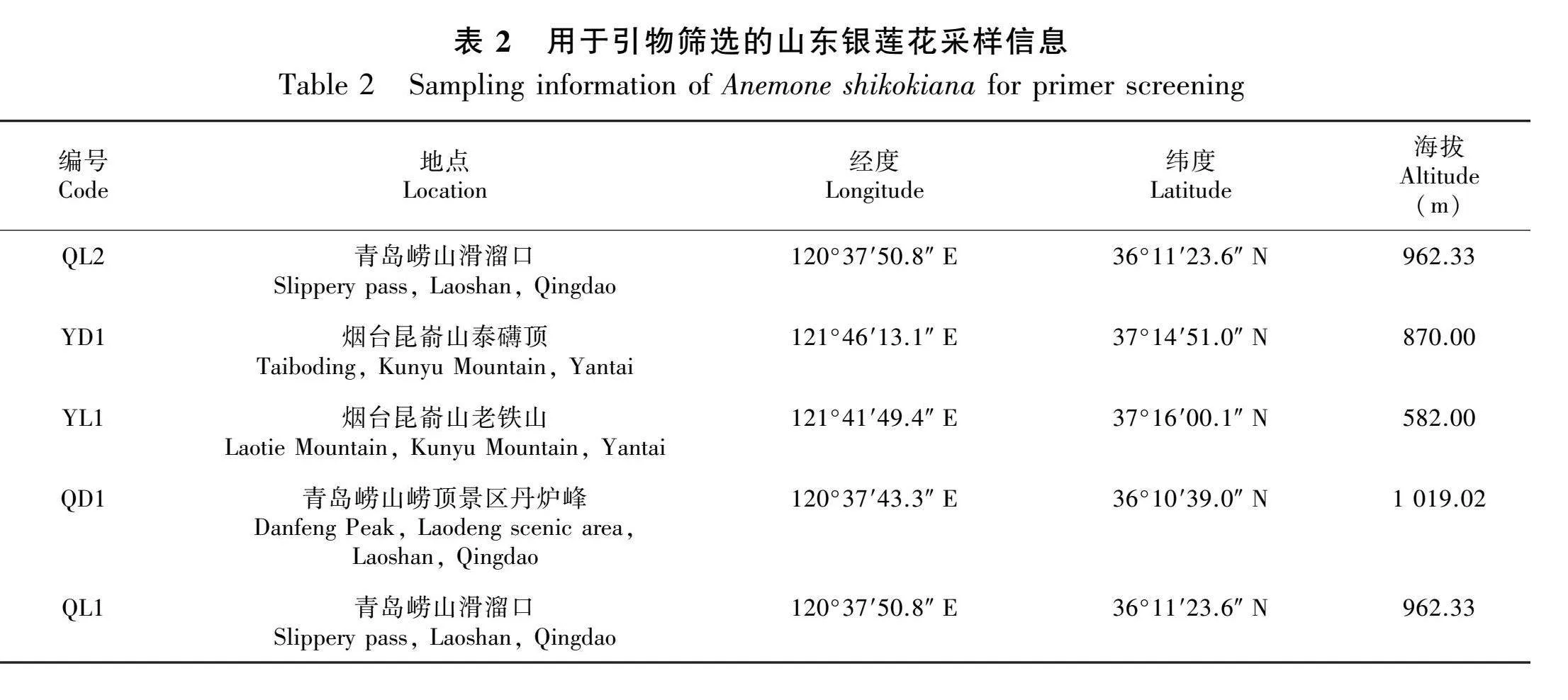
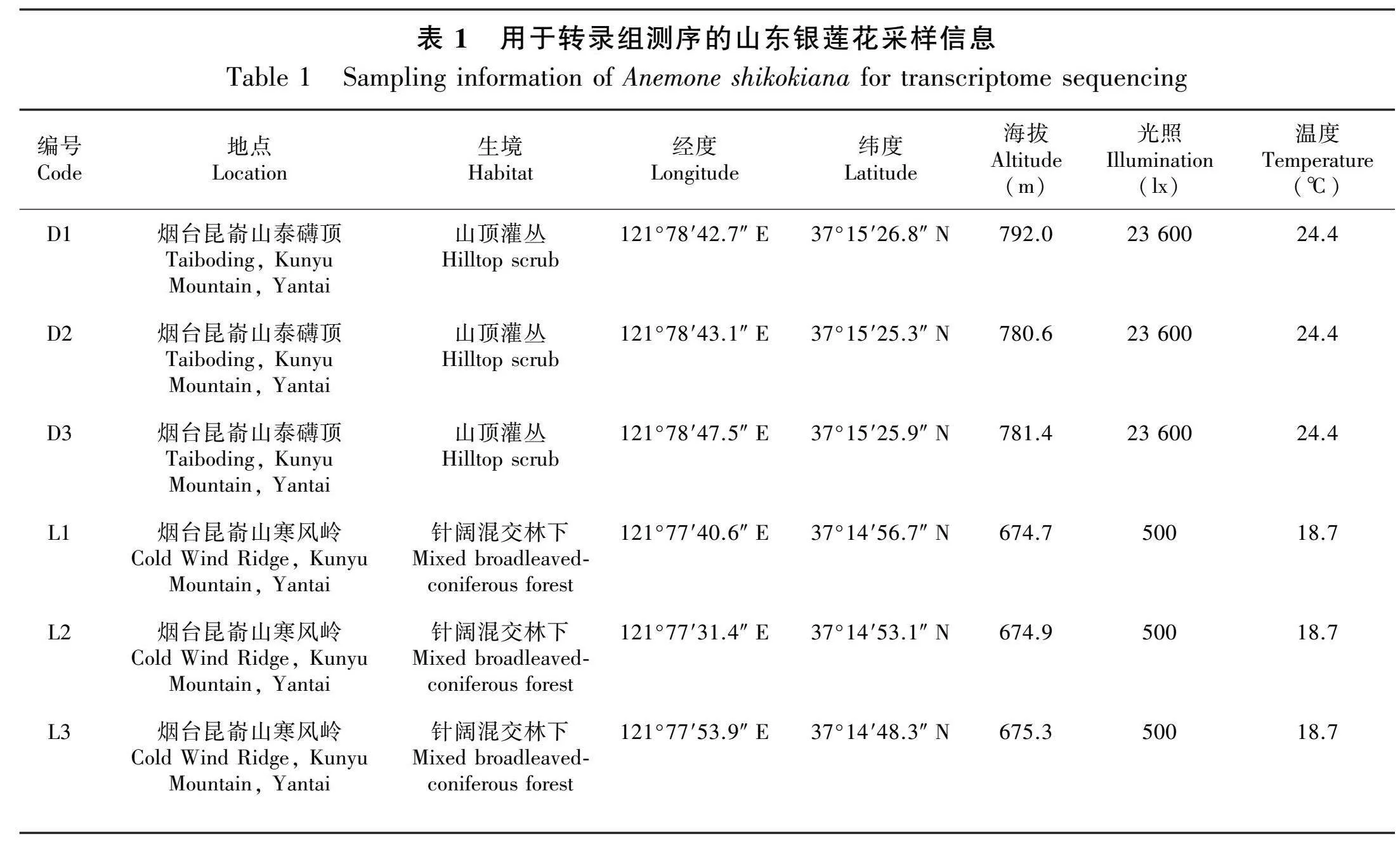
本研究所用实验材料均为开花期的山东银莲花叶片,其中转录组测序材料于2021年6月取自山东省烟台市昆嵛山国家级自然保护区的泰礴顶和寒风岭(表1),引物筛选材料于2021年9月取自青岛崂山和烟台昆嵛山(表2)。采集后用蒸馏水清洗干净,立即放入液氮中冷冻。转录组测序由上海欧易生物医学科技有限公司完成,引物筛选材料带回实验室后采用改良的CTAB法(闫苗苗等,2008)提取DNA,并利用1%琼脂糖凝胶电泳对所提取的DNA进行检测,将检测合格的DNA统一稀释至20 ng·μL-1,放入-20 ℃冰箱中保存备用。
1.2 转录组分析
De novo拼接:使用Trinity(Manfred et al., 2011)软件paired-end的拼接方法得到Transcript序列,根据序列相似性以及长度,挑选出最长的一条作为Unigene,之后再利用CD-HIT软件聚类去冗余得到一套最终的Unigene,以此作为后续分析的参考序列。
功能注释:利用DIAMOND(Buchfink et al., 2014)软件将Unigenes比对到NR、KOG、GO、Swiss-Prot、eggNOG、KEGG数据库以及利用HMMER软件比对Pfam数据库来进行Unigenes的功能分析。
差异表达基因筛选:利用DESeq(Anders amp; Huber, 2012)软件对各个样本基因的Counts数目进行标准化处理,采用BaseMean值来估算表达量,计算差异倍数,并采用NB(负二项分布检验的方式)对Reads数进行差异显著性检验,以差异倍数|log2FoldChange|gt;1及差异显著性检验结果Plt;0.05为标准筛选差异表达基因。
1.3 引物设计与筛选
基于山东银莲花转录组测序结果,使用软件MISA(Beier et al., 2017)进行SSR预测,设置重复基序的长度为1、2、3、4、5和6,最小重复次数为10次、6次、5次、5次、5次和5次;两个微卫星之间的序列长度不超过100 bp即被认定为复合微卫星。SSR作为一种用途广泛的分子标记,其多态性水平越高则应用价值越大(郑燕等,2012)。当SSR长度≥20 bp时可显示出较高的多态性,长度在12~20 bp之间相对较低,在12 bp以下则很低(Temnykh et al., 2001)。根据SSR长度≥20 bp、去除复合型SSR位点和容易与多腺苷化作用相混杂的A/T重复基序的原则,将所有SSR位点进行初步筛选后随机选择100对SSR位点利用软件Primer3(Rozen amp; Skaletsky, 2000)进行引物设计,命名为ANS001-ANS100,送至北京六合华大基因科技有限公司合成。
利用青岛崂山滑溜口所采集样品通过1%琼脂糖凝胶电泳对100对引物进行筛选,以检测引物有效性。PCR扩增体系为20 μL:2×Master Mix 4 μL、上下游引物(10 μmol·L-1)各2 μL、DNA模板2 μL和ddH2O10 μL。反应程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火35 s,72 ℃延伸60 s,35个循环;72 ℃终延伸10 min,4 ℃保存。随后将无法正确扩增或扩增产物大小与预期不符的引物筛除,可正确扩增的引物利用样品YD1(烟台昆嵛山泰礴顶)、YL1(烟台昆嵛山老铁山)、QD1(青岛崂山崂顶景区丹炉峰附近)、QL1(青岛崂山滑溜口)通过8%非变性聚丙烯酰胺凝胶电泳和银染显色的方法进行目的条带的分离和检测,筛选出具有多态性的EST-SSR引物。
2 结果与分析
2.1 转录组数据分析
2.1.1 总体特征 对山东银莲花进行无参转录组分析,共获得 42.34 G的Clean Data,各样本的有效数据量分布在6.98~7.10 G,Q30碱基分布在93.68%~94.20%之间,证明本次测序数据准确性良好,可用于后续分析。利用De novo拼接出Unigenes 53 536条,总长度为57 909 453 bp,最长Unigene为15 502 bp,最短Unigene为301 bp,平均长度为1 081.69 bp。用皮尔逊相关系数表示D和L样品间基因表达水平相关性(低于0.8表示相关性较差),D组间生物学重复的相关性均大于0.868 9,L组间生物学重复之间相关性均大于0.831 8,表明样品组间相关性较高,可以此作为后续分析的参考序列。
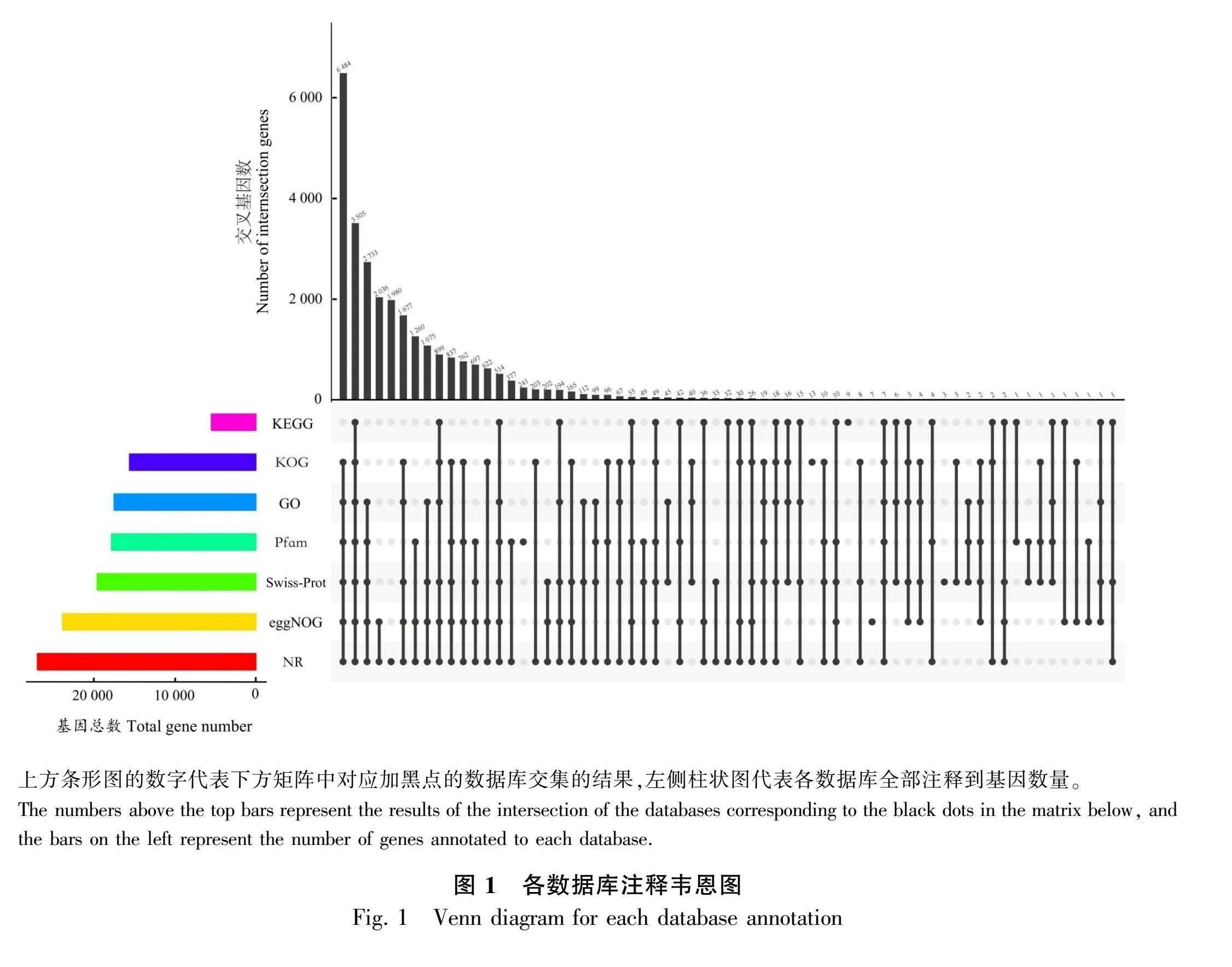
2.1.2 功能注释 对拼接组装的53 536条Unigenes进行常见功能数据库注释,在7个数据库中均注释成功的Unigenes有3 505条,占总数的6.55%,至少在1个数据库中注释成功的Unigenes有27 448条,占总数的51.27%(图1)。在NR数据库中成功注释的条数最多,共有27 044条,占总数的50.52%,其余分别为eggNOG 库(23 934,44.71%)、Swiss-Prot 库(19 637,36.68%)、Pfam 库(17 859,33.36%)、GO 库(17 540,32.76%)、KOG 库(5 481,29.19%)和KEGG 库(5 48 10.23%)。按照NR数据库中山东银莲花的Unigenes与其他物种匹配可得,相似程度最高的物种为耧斗菜(Aquilegia coerulea,56.72%),其他按匹配度由高到低依次为博落回(Macleaya cordata,6.08%)、鸦片罂粟(Papaver somniferum,4.06%)、莲(Nelumbo nucifera,3.29%)、葡萄(Vitis vinifera,1.92%)、欧洲栓皮栎(Quercus suber,0.94%)、月季花(Rosa chinensis,0.9%)、Sphaerulina musiva SO2202(0.73%)、中华猕猴桃(Actinidia chinensis var. chinensis,0.58%)、向日葵(Helianthus annuus,0.55%)和其他物种(24.24%)。
2.2 差异表达Unigene分析
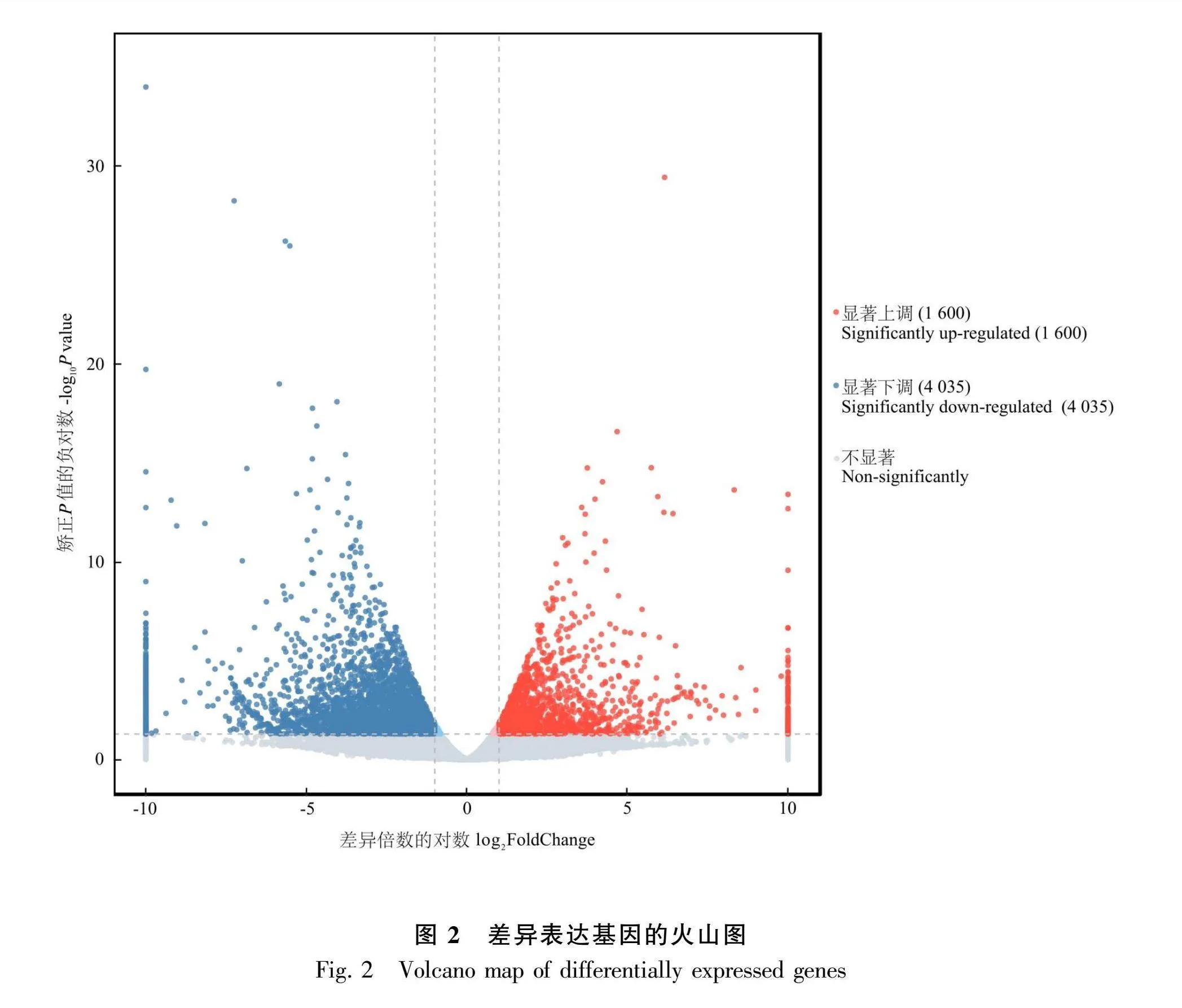
2.2.1 差异表达Unigene筛选 对山东银莲花的转录组数据进行筛选,共挖掘差异表达Unigenes 5 635个,数量较多,其中与林下(L)的山东银莲花相比,山顶(D)的山东银莲花中有上调基因1 600个,下调基因4 035个(图2),说明不同生长环境对山东银莲花基因表达影响较大。
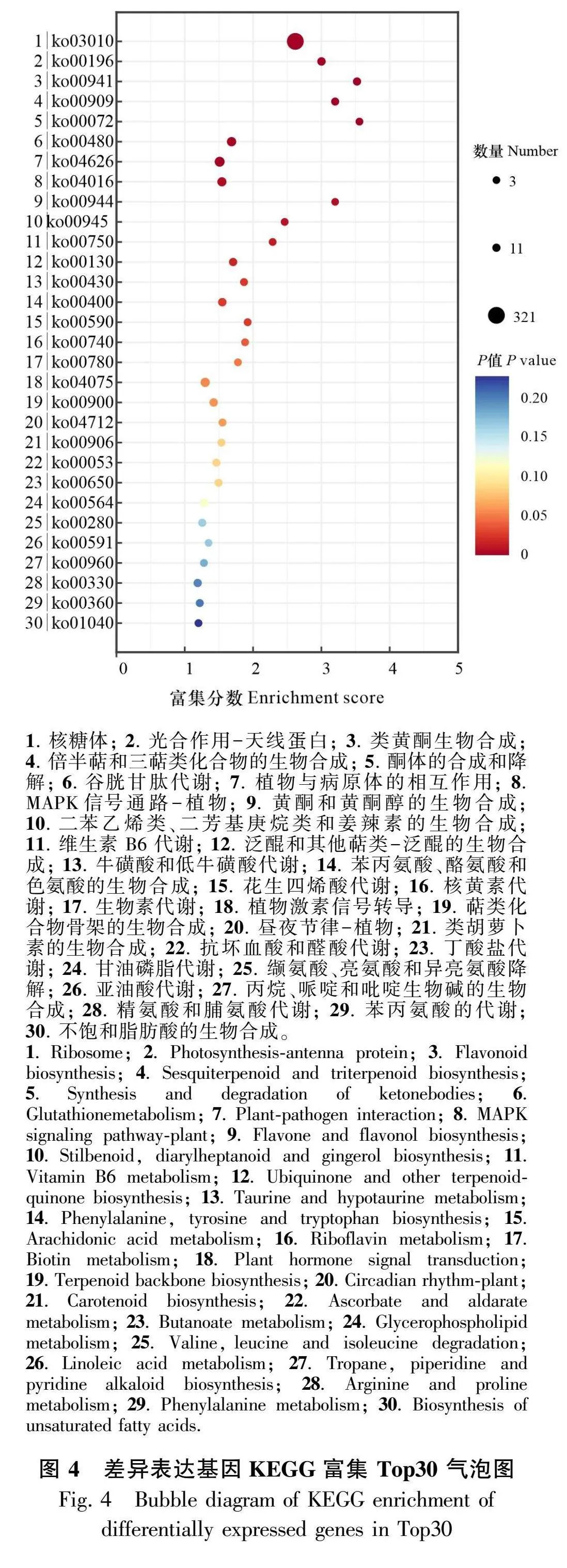
2.2.2 差异表达Unigene富集分析 将山东银莲花的差异表达Unigenes进行GO(图3)和KEGG富集分析(图4),结果显示共有2 460个差异表达基因被注释到GO数据库2 533个三级条目中,共有1 051个差异表达基因被注释到KEGG数据库的113条代谢通路中。
根据GO数据库一级条目生物学过程、细胞成分和分子功能的不同,筛选3种分类中对应差异基因数目大于2的GO二级条目,按照每个条目对应的P值由小到大排序可得前10个富集分类,山东银莲花的差异表达基因主要显著富集在脱落酸代谢过程、薄荷醇生物合成过程、硫脂生物合成过程等生物学过程中,胞质大核糖体亚基、胞质小核糖体亚基、核糖体等细胞成分中,芳醇脱氢酶(NADP+)活性、异戊烯醇脱氢酶活性、卡维醇脱氢酶活性等分子功能中。
将山东银莲花的差异表达基因比对到KEGG数据库的参考代谢通路中,可划分到6个类别中,其中与代谢相关通路的Unigenes数量最多,有480个,占比45.67%;其次遗传信息加工相关通路的Unigenes有425个,占比40.44%;与环境信息处理相关通路的Unigenes有58个,占比5.52%;与生物系统相关通路的Unigenes有50个,占比4.76%;与细胞过程相关通路的Unigenes有37个,占比3.52%。共有10条KEGG通路达到极显著水平(Plt;0.01),分别为核糖体、光合作用-天线蛋白、类黄酮生物合成、倍半萜和三萜生物合成、酮体的合成与降解、谷胱甘肽代谢、植物-病原互作、MAPK信号通路-植物、黄酮和黄酮醇的生物合成、二苯乙烯类、二芳基庚烷类和姜辣素的生物合成。
2.2.3 关键差异表达Unigene信息 从众多通路中筛选出与山东银莲花适应于异质生境的主要通路(表3),其中15个差异表达Unigene属于光合作用-天线蛋白通路,分别为1个上调基因lhca5(light-harvesting complex I chlorophyll a/b binding protein 5)、7个下调基因lhcb1(light-harvesting complex Ⅱ chlorophyll a/b binding protein 1)、6个下调基因lhcb2(light-harvesting complex Ⅱ chlorophyll a/b binding protein 2)、1个下调基因lhcb3(light-harvesting complex Ⅱ chlorophyll a/b binding protein 3);11个差异表达Unigene属于类黄酮生物合成通路,分别为1个chs(chalcone synthase)、1个c4h(trans-cinnamate 4-monooxygenase)、2个f3′h(flavonoid 3′-monooxygenase)、1个f3h(naringenin 3-dioxygenase)、1个fls(flavonol synthase)、1个ans(anthocyanidin synthase)、1个chi(chalcone isomerase)、1个ccoaomt(caffeoyl-CoA O-methyltransferase)、2个hct(shikimate O-hydroxycinnamoyltransferase),以上基因皆为上调表达。
2.3 SSR位点分析与引物开发
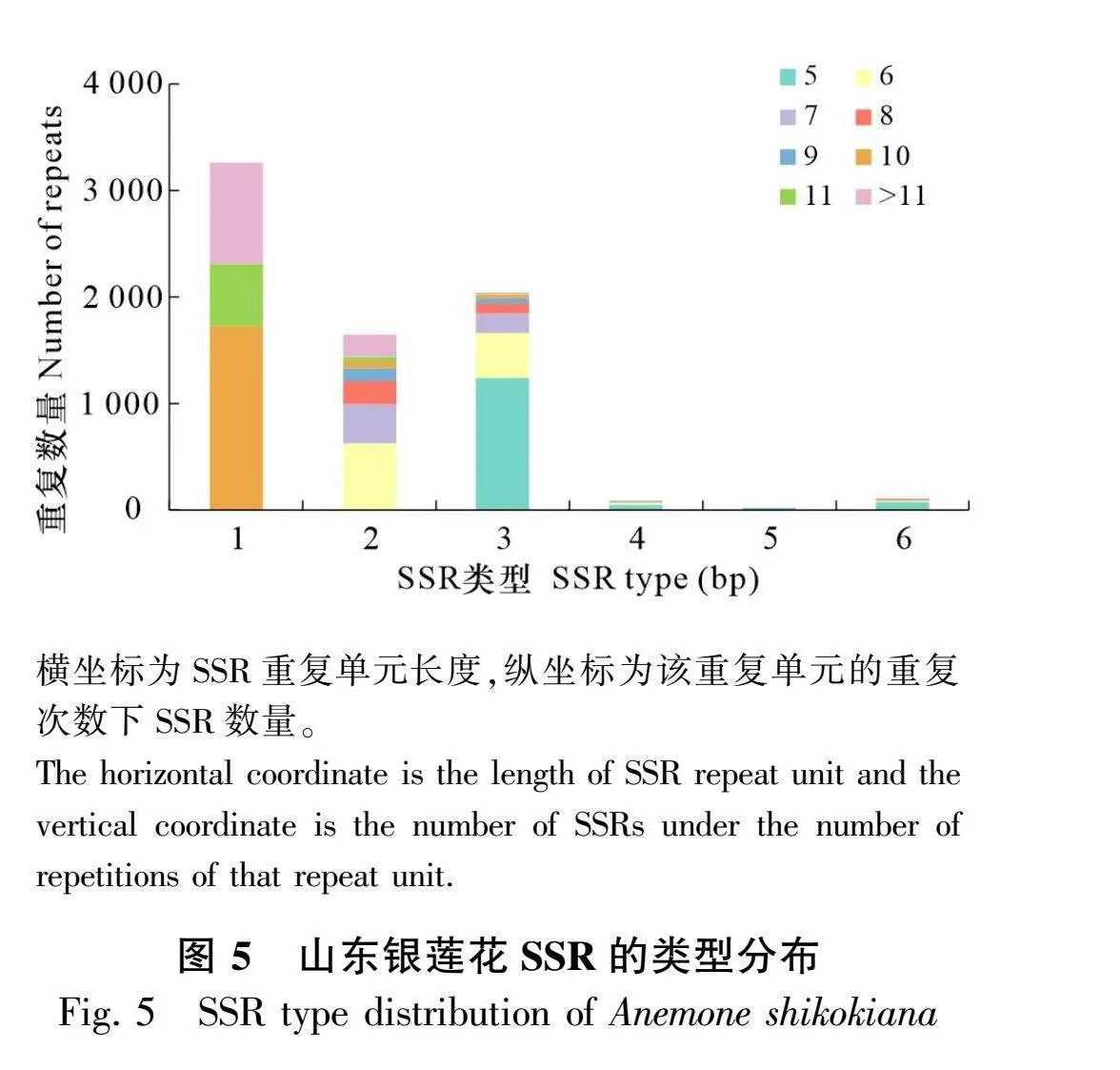
2.3.1 SSR位点总体特点 对山东银莲花转录组的53 536条Unigenes序列进行搜索,共检出6 006条Unigenes序列中含有7 146个SSR位点,平均分布距离为8.1 kb,SSR长度在10~225 bp之间,SSR出现频率(=SSR个数/总Unigene数)为13.35%,SSR发生频率(=含SSR的Unigene数/总Unigene数)为11.22%。山东银莲花含有2个及以上的SSR位点的序列有907条,占全部序列的1.68%,含有复杂重复类型的SSR位点的序列有420条,占全部序列的0.78%。山东银莲花SSR类型较为丰富,共计106种重复基序(表4),优势重复基序为单核苷酸重复(3 248,45.59%),其次分别为三核苷酸重复(2 041,28.56%)、二核苷酸重复(1 645,23.02%)、六核苷酸重复(101,1.41%)、四核苷酸重复(81,1.13%)、五核苷酸重复(20,0.28%)(图5)。
2.3.2 EST-SSR引物的开发与筛选 利用1%琼脂糖凝胶电泳对从山东银莲花转录组数据中挑选的100对EST-SSR引物进行检验,可得68对有效扩增引物。为探究68对EST-SSR引物的多态性,采用8%非变性聚丙烯酰胺凝胶电泳检验来源于烟台昆嵛山泰礴顶(YD1)、烟台昆嵛山老铁山(YL1)、青岛崂山崂顶景区丹炉峰附近(QD1)、青岛崂山滑溜口(Q L1)的山东银莲花DNA扩增结果,68对EST-SSR引物均能在上述材料中扩增得到清晰条带,其中有11对EST-SSR引物具有多态性(表5),共扩增24个多态性片段。以上结果表明,基于山东银莲花转录组数据开发EST-SSR引物是一种经济、可行的方法,可通过简单的PCR扩增效果验证得出EST-SSR引物的稳定性、可重复性和多态性。
3 讨论与结论
3.1 异质生境中山东银莲花的适应机制分析
高通量测序技术能全面快速地获得植物的转录本序列信息,为植物基因发掘和次生代谢物调控等研究提供了巨大便利(Lu et al., 2010)。本研究利用高通量测序技术对异质生境中的山东银莲花进行转录组测序,通过对其差异表达基因进行富集分析,发现山东银莲花适应两种异质生境的机制主要表现在光合作用和类黄酮生物合成两方面。光合作用作为植物生长和一切代谢活动的生理基础,受光照、水分、温度等不同环境因子的影响(Fang et al., 2022),在其调控过程中捕光复合物Ⅱ叶绿素a/b结合蛋白(light-harvesting complex Ⅱ chlorophyll a/b binding protein, LHC)发挥重要作用。LHC由核基因(lhc)编码,具有迅速将光能传到PSⅠ和PSⅡ反应中心使光能转化为化学能的作用,可以促进光合作用进行(Sapeta et al., 2023)。lhc基因家族主要包含lhca和lhcb两个进化类群,前者编码植物光系统I中的LHCⅠ膜蛋白,捕光截面较大且可同时捕获光谱中不同波长的光(Mozzo et al., 2010),后者编码植物光系统Ⅱ中的LHCⅡ膜蛋白,可结合类囊体膜上50%的色素形成叶绿体类囊体中含量最丰富的捕光天线蛋白(王云鹤,2020)。本研究发现,相比针阔混交林下生长的山东银莲花,山顶灌丛中的山东银莲花中lhca5显著上调,与Ganeteg等(2004)研究表明lhca5在强光条件下表达水平显著提高的研究结果一致。此外,本研究还发现山顶的山东银莲花中lhcb1、lhcb2和lhcb3显著下调,蒋倩(2019)研究发现在干旱胁迫下水芹的lhcb基因表达下调可阻止叶绿体接收过多光能,使光合作用减弱,Rahele等(2022)的研究也表明lhcb基因表达量的减少导致番茄叶绿素含量降低以响应干旱胁迫。因此,可推测lhcb1、lhcb2和lhcb3的下调可减少捕光天线蛋白的合成,减弱光合作用,减少水分的消耗,从而降低干旱对山东银莲花自身产生的影响。山顶灌丛与针阔混交林下比较,光照强、土壤湿度小是最明显的不利于山东银莲花生存的逆境因素。本研究表明,lhca和lhcb两类基因的上调和下调很巧妙地解决了这一难题,适应了山顶灌丛不利的环境,实现非生物胁迫响应。
类黄酮是植物体内广泛存在的次生代谢物质,可吸收280~315 nm波长的紫外光,保护植物体器官,尤其是光合组织免受或少受辐射伤害(邹凤莲等,2004),在植物生长发育和热胁迫等非生物胁迫响应过程中发挥多种生理功能(Chen et al., 2023;Guo et al., 2023;Zhuang et al., 2023)。类黄酮生物合成的前体物质来自于苯丙烷代谢,并受一系列关键酶的调控,如查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄酮醇合成酶(FLS)、黄酮3-羟基化酶(F3H)、黄酮3′-羟化酶(F3′H)、花色素合成酶 (ANS)等(Xiong et al., 2016;Shen et al., 2022;戴明洁,2022)。本研究发现山顶灌丛的山东银莲花中编码相关酶的基因均较林下显著上调,肖韵铮等(2020)研究表明chs和chi基因表达水平与类黄酮含量呈显著正相关,表明山顶灌丛中的山东银莲花在生长过程中可以合成较多的类黄酮。山顶灌丛中的强光照,除了可见光,还包括紫外光,同时伴随着午间的高温,长时间的紫外光照射会造成植物DNA及其他结构的破坏(Batschauer, 1993),加上高温的影响,对植物将造成重大伤害甚至死亡。本研究中,山顶灌丛山东银莲花大量类黄酮的合成,可吸收多余的紫外光,减少紫外光对植株的破坏,同时缓解短时间的高温,以适应不良的生活环境。
3.2 山东银莲花的SSR位点分析与引物开发
山东银莲花的SSR类型相对丰富,从单核苷酸重复序列到六核苷酸重复序列不等。研究表明三核苷酸基序中AAG/CTT是主要的基序(Xiang et al., 2023), 与本研究中山东银莲花SSR位点分析结果一致,说明EST-SSR在其发生和进化过程中具有高度保守性。EST-SSR分子标记源于功能基因表达序列,具有保守程度高、种间及属间通用性好等优点(娄永峰等,2022)。本研究基于拼接质量较高的转录组数据,利用SSR位点设计并合成100对引物,其中有68对引物可以实现有效扩增,有11对引物在不同地域的山东银莲花材料中表现出多态性,具有多态性的EST-SSR分子标记可用于遗传多样性分析与分子标记辅助育种。因为国内山东银莲花材料稀缺,获取日本四国岛的山东银莲花材料受限,所以在本研究中未进行相关聚类分析以及系统进化树的构建,后续将通过银莲花属植物对本研究所得的山东银莲花EST-SSR多态性引物的通用性进行验证,同时利用挖掘的差异表达基因设计EST-SSR引物用于区分不同生境的山东银莲花居群,为其进化研究和种质资源保护奠定基础。
综上所述,本研究对山顶灌丛和针阔混交林下山东银莲花的转录组进行分析,表明其通过调控光合作用途径和类黄酮生物合成途径涉及的基因以适应异质生境, 并首次开发多态性较好的EST-SSR分子标记,填补山东银莲花在此方面的空白,对其保护与利用具有重要意义。
参考文献:
ANDERS S, HUBER W, 2012. BioC 2012: Differential expression of RNA-Seq data at the gene level "[J]. EMBL. https://www.bioconductor.org/help/course-materials/2012/BioC2012/DESeq.pdf.
BATSCHAUER A, 1993. A plant gene for photolyase: An enzyme catalyzing the repair of UV-light-induced DNA damage [J]. The Plant Journal, 4(4): 705-709.
BEIER S, THIEL T, MNCH T, et al., 2017. MISA-web: a web server for microsatellite prediction [J]. Bioinformatics, 33(16): 2583-2585.
BIAN J, WANG XN, CAO K, et al., 2023. Genetic structure analysis and fingerprint construction of hemp by EST-SSR analysis [J]. Journal of "Plant Genetic Resources, 24(6): 1794-1808. "[边境, 王晓楠, 曹焜, 等, 2023. 大麻EST-SSR遗传结构分析及指纹图谱构建 [J]. 植物遗传资源学报, 24(6): 1794-1808.]
BUCHFINK B, XIE C, HUSON DH, 2014. Fast and sensitive protein alignment using DIAMOND [J]. Nature Methods, 12(1): 59-60.
CHEN LC, GU DZ, LIU Y, et al., 2018. Establishment of tissue culture regeneration system of Anemone shikokiana [J]. Jiangsu Agricultural Sciences, 46(24): 47-50. "[陈春利, 顾德政, 刘毓, 等, 2018. 山东银莲花组织培养植株再生体系的建立 [J]. 江苏农业科学, 46(24): 47-50.]
CHEN YY, LU HQ, JIANG KX, et al., 2023. The flavonoid biosynthesis and regulation in Brassica napus: A review [J]. International Journal of "Molecular Sciences, 24: 357.
DAI MJ, 2022. Molecular cloning and functional analysis of CHIL and F3H in flavonoid biosynthesis pathway in mulberry [D]. Zhenjiang: Jiangsu University of Science and Technology. "[戴明洁, 2022. 桑树类黄酮合成途径关键基因CHIL和F3H的分子克隆及功能分析 [D]. 镇江: 江苏科技大学.]
FANG L, MARTRE P, JIN K, et al., 2022. Neglecting acclimation of photosynthesis under drought can cause significant errors in predicting leaf photosynthesis in wheat [J]. Global Change Biology, 29: 505-521.
GANBARI MSR, TOHIDFAR M, AHMADIKHAH A, 2022. Gene profile analysis and molecular-physiological evaluation of tomato genotypes under drought stress [J]. Journal of Applied Biotechnology Reports, 9(3): 74.
GANETEG U, KIMMEK F, JANSSON S, 2004. Lhca5-an LHC-type protein associated with photosystem I [J]. Plant Molecular Biology, 54(5): 641-651.
GHANBARI MSR,TOHIDFAR M, AHMADIKHAH A, 2022. Gene profile analysis and molecular-physiological evaluation of tomato genotypes under drought stress [J]. Journal of "Applied Biotechnology Reports, 9(3): 747-62.
GUO LA, MO RY, TAN J, et al., 2021. Analysis on differential expressed genes in the transcriptome of Atractylodes macrocephalafrom different producing areas [J]. Chinese Medicinal Materials, 44(12): 2787-2792. "[郭连安, 莫让瑜, 谭均, 等, 2021. 不同产地白术转录组差异表达基因分析 [J]. 中药材, 44(12): 2787-2792.]
GUO LA, TAN J, DENG XS, et al., 2023. Integrated analysis of metabolome and transcriptome reveals key candidate genes involved in flavonoid biosynthesis in Pinellia ternata under heat stress [J]. Journal of Plant Research, 136(3): 359-369.
HOU YT, LIU B, 2010. Anemone shikokiana(Makino) Makino [J]. Encyclopedia of "Knowledge (12): 40. "[侯元同, 刘冰, 2010. 山东银莲花 [J]. 百科知识 (12): 40.]
JIANG Q, 2019. Genomic analysis and response factors under abiotic stress in Oenanthe javanica [D]. Nanjing: Nanjing Agricultral University. "[蒋倩, 2019. 水芹基因组研究及非生物胁迫下的响应因子分析 [D]. 南京: 南京农业大学.]
LI H, FENG YH, TANG SS, et al., 2023. Development and validity evaluation of Liquidambar formosana EST-SSR primers based on transcriptome sequencing [J]. Guihaia, 43(2): 327-335. "[李辉, 冯源恒, 唐生森, 等, 2023. 基于转录组测序的枫香EST-SSR引物开发及有效性评价 [J]. 广西植物, 43(2): 327-335.]
LIU Q, 2014. Research on genetic diversity of Anemone shikokiana [D]. Jinan: Shandong Normal University. "[刘琼, 2014. 山东银莲花的遗传多样性研究 [D]. 济南: 山东师范大学.]
LOU YF, GAN R, ZHU CL, et al., 2022. Development and application of EST-SSR markers based on transcriptome of Phyllostachys vivax McClure f. aureocaulis N. X. Ma [J]. Plant Science Journal, 40(3): 355-364. "[娄永峰, 甘然, 朱成磊, 等, 2022. 黄秆乌哺鸡竹转录组EST-SSR分子标记开发与应用 [J]. 植物科学学报, 40(3): 355-364.]
LU YH, YU FB, GUO JH, et al., 2021. Analysis of transcriptomic differences between winged and wingless bird cherry-oat aphid Rhopalosiphum padi on wheat [J]. Journal of Plant Protection, 48(6): 1303-1309. "[鲁艳辉, 虞飞博, 郭嘉雯, 等, 2021. 有翅型和无翅型小麦禾谷缢管蚜转录组差异分析 [J]. 植物保护学报, 48(6): 1303-1309.]
LUCINSK R, JACKOWSKI G, 2006. The structure, functions and degradation of pigment-binding proteins of Photosystem II [J]. Acta Biochimica Polonica, 53 (4): 693-708.
LU TT, LU GJ, FAN DL, et al., 2010. Function annotation of the rice transcriptome at single-nucleotide resolution by RNA-Seq [J]. Genome Research, 20(9): 1238-1249.
MANFRED G, BRIAN J, MORAN Y, et al., 2011. Trinity: reconstructing a full-length transcriptome without a genome from RNA-Seq data [J]. Nature Biotechnology, 29(7): 644.
MOZZO M, MANTELLI M, PASSARINI F, et al., 2010. Functional analysis of Photosystem I light-harvesting complexes (Lhca) gene products of Chlamydomonas reinhardtii [J]. Biochimic Biophysica Acta, 1797(2): 212-221.
PANG YJ, LI LX, BIAN FH, 2020. Photosynthetic and ultrastructural adaptability of Anemone shikokiana leaves to heterogeneous habitats [J]. Brazilian Journal of "Botany, 43: 979-988.
PANG YJ, SUN W, WANG XS, et al., 2022. Influence of soil heterogeneity on root structure of Anemone shikokiana [J]. Journal of "Yantai University, 35(1): 28-34. "[逄玉娟, 孙维, 王行松, 等, 2022. 土壤异质性对山东银莲花根结构的影响 [J]. 烟台大学学报, 35(1): 28-34.]
ROZEN S, SKALETSKY H, 2000. Primer3 on the WWW for general users and for biologist programmers [J]. Bioinformatics Methods and Protocols, 132: 365-86.
SAPETA H, YOKONO M, TAKABAYASHI A, et al., 2023. Reversible down-regulation of photosystems I and II leads to fast photosynthesis recovery after long-term drought in Jatropha curcas [J]. Journal of "Experimental Botony, 74(1): 336-351.
SHEN N, WANG TF, GAN Q, et al., 2022. Plant flavonoids: Classification, distribution, biosynthesis, and antioxidant activity [J]. Food Chemistry, 383: 132531.
SUN HN, LIU DY, LI MY, et al., 2024. Transcriptome data analysis of Coreopsis tinctoria based on high-throughput sequencing [J]. Molecular Plant Breeding, 22(20): 6683-6697. "[孙浩男, 刘冬云, 李明阳, 等, 2024. 基于高通量测序的两色金鸡菊转录组数据分析 [J]. 分子植物育种, 22(20): 6683-6697.]
TEMNYKH S, DECLERCK G, LUKASHOVA A, 2001. Computational and experimental analysis of microsatellites in rice (Oryza sativa L.): Frequency, length variation, transposon associations, and genetic marker potential [J]. Genome Research, 11(8): 1441-1452.
TIAN HZ, GUO H, TIAN H, et al., 2023. Transcriptome characteristics analysis and EST-SSR marker development of capsicum annuum under waterlogging stress [J]. Guihaia, 43(11): 2052-2064. [田怀志, 郭豪, 田浩, 等, 2023. 水涝胁迫下辣椒转录组特征分析及 EST-SSR 标记开发 [J]. 广西植物, 43(11): 2052-2064.]
WANG YF, ZHU RJ, CHENG XP, 2023.Research on phenotypic plasticity of different diameter class Bombax ceiba in heterogeneous habitats [J]. Ecological Science, 42(3): 61-66. "[王妍方, 朱润军, 程希平, 2023. 异质生境下不同径级木棉的表型可塑性研究 [J]. 生态科学, 42(3): 61-66.]
WANG YH, 2020. Identification and expression profiling of Lhc genes in Ramie [D]. Wuhan: Huazhong Agricultural University. "[王云鹤, 2020. 苎麻Lhc基因的鉴定和表达模式研究 [D]. 武汉: 华中农业大学.]
WANG Z, PANG YJ, LIU CL, et al., 2014. Distribution pattern and analysis of influencing factors of rare plant Anemone shikokiana (Makino) Makino [J]. Bulletin of Botanical Research, 34(4): 440-445. "[王鸷, 逄玉娟, 刘传林, 等, 2014. 稀有植物山东银莲花(Anemone shikokiana (Makino) Makino)的分布格局及影响因子分析 [J]. 植物研究, 34(4): 440-445.]
WEI CB, GU W, TIAN R, et al., 2022. Transcriptomic data analysis of Alisma orientale tubers grew in different ecological environments by high-throughput sequencing [J]. Modern Chinese Medicine, 24(12): 2342-2349. "[韦陈彬, 谷巍, 田荣, 等, 2022. 基于高通量测序的不同生态环境东方泽泻块茎转录组分析 [J]. 中国现代中药, 24(12): 2342-2349.]
WU RN, XU B, SHI FL, 2022. Analysis of SSR characteristics for Medicago ruthenica ‘Zhilixing’ based on transcriptome data [J]. Journal of "Northwest A amp; F University (Natural Science Edition), 50(5): 1-8. "[乌日娜, 徐舶, 石凤翎, 2022. 基于转录组数据的直立型扁蓿豆SSR序列特征分析 [J]. 西北农林科技大学学报(自然科学版), 50(5): 1-8.]
XIANG NY, LU BJ, YUAN T, et al., 2023. De Novo transcriptome assembly and EST-SSR marker development and application in Chrysosplenium macrophyllum [J]. Genesis, 14: 279.
XIAO YZ, HAN SM, QIN Z, et al., 2020. Analysis of transcriptome sequencing and related genes of flavonoids biosynthesis from Polygonatum kingianum [J]. Journal of "Henan Agricultural University, 54(6): 931-940. "[肖韵铮, 韩世明, 秦昭, 等, 2020. 滇黄精转录组测序及类黄酮合成相关基因的分析 [J]. 河南农业大学学报, 54(6): 931-940.]
XIONG S, TIAN N, LONG JH, et al., 2016. Molecular cloning and characterization of a flavanone 3-hydroxylase gene from Artemisia annua L. [J]. Plant Physiology and Biochemistry, 105(5): 29-36.
YAN MM, WEI GC, PAN XH, et al., 2008. A method suitable for extracting genomic DNA from animal and plant —— modifed CTAB Method agricultural [J]. Journal of "Anhui Agricultural Science, 36(20): 8488+8558. "[闫苗苗, 魏光成, 潘效红, 等, 2008. 一种适用于动物与植物总DNA提取的方法——改良CTAB法 [J]. 安徽农业科学, 36(20): 8488+8558.]
YANG X, YANG N, YUAN QH, et al., 2021. Development and application of EST-SSR molecular markers in Pinus bungeana [J]. Journal of "Beijing Forestry University, 43(7): 1-11. "[杨雄, 杨宁, 袁启华, 等, 2021. 白皮松 EST-SSR 分子标记的开发及应用 [J]. 北京林业大学学报, 43(7): 1-11.]
YU WY, GAO Y, PANG YJ, et al., 2019. Response of leaf morphology and structure of Anemone shikokiana to heterogeneous habitats and altitude changes [J]. Acta Ecologica Sinica, 39 (12): 4413-4420. "[于文英, 高燕, 逄玉娟, 等, 2019. 山东银莲花叶片形态结构对异质生境和海拔变化的响应 [J]. 生态学报, 39(12): 4413-4420.]
YUE XY, YUE W, YAN K, 2023. Adaptation of functional traits of Phragmites australis to different water Habitats in the Yellow River Delta [J]. Journal of Northeast Forestry University, 51(3): 18-21. "[岳喜元, 岳伟, 严宽, 2023. 黄河三角洲芦苇功能性状对不同水分生境的适应性 [J]. 东北林业大学学报, 51(3): 18-21.]
YUE YH, YAN LJ, HUANG X, et al., 2022. Development EST-SSR markers based on transcriptome sequences of Tilia miqueliana Maxim [J]. Molecular Plant Breeding: 1-18 [2023-10-20]. http://kns.cnki.net/kcms/detail/46.1068.S.20220715.1525.008.html. [岳远灏, 严灵君, 黄犀, 等, 2022. 基于全长转录组测序的南京椴EST-SSR标记开发 [J]. 分子植物育种: 1-8 [2023-10-20]. http://kns.cnki.net/kcms/detail/46.1068.S.20220715.1525.008.html. ]
ZHANG CY, LONG Y, FENG J, et al., 2007. Transcriptional regulation of plant genes and its significance in biology [J]. Hereditas (7): 793-799. ""[张椿雨, 龙艳, 冯吉, 等, 2007. 植物基因在转录水平上的调控及其生物学意义 [J]. 遗传 (7): 793-799.]
ZHENG Y, JIN GL, WU WR, 2012. Relationship between sequence completeness and polymorphism of microsatellites [J]. Genomics and Applied Biology, 31(6): 587-591. "[郑燕, 金谷雷, 吴为人, 2012. 微卫星序列完整性与多态性的关系 [J]. 基因组学与应用生物学, 31(6): 587-591.]
ZHOU CM, JIANG LP, DONG GQ, et al., 2022. Analysis of differential expression genes of Chrysanthemum indicum var. aromaticum associated with different altitude habitats using RNA-seq technology [J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 24(4): 1356-1368. "[周春苗, 蒋莉萍, 董刚强, 等, 2022. 基于转录组测序研究不同海拔生境神农香菊的基因表达差异 [J]. 世界科学技术-中医药现代化, 24(4): 1356-1368.]
ZHUANG WB, LI YH, SHU XC,et al., 2023. The classification, molecular structure and biological biosynthesis of flavonoids, and their roles in biotic and abiotic stresses [J]. Molecules, 28(8): 3599.
ZOU FL, SHOU SY, YE WZ, et al., 2004. Advances in the research on flavonoid biosynthesis and plant stress response [J]. Chinese Journal of "Cell Biology, 26(1): 39-44. "[邹凤莲, 寿森炎, 叶纨芝, 等, 2004. 类黄酮化合物在植物胁迫反应中作用的研究进展 [J]. 细胞生物学学报, 26(1): 39-44.]
(责任编辑 李 莉 王登惠)

