白头翁皂苷D通过多靶点和多途径抑制三阴性乳腺癌侵袭转移

摘要:目的 采用网络药理学和计算机模拟探讨白头翁皂苷D(PSD)抑制三阴性乳腺癌(TNBC)侵袭转移的作用机制,并进行实验验证。方法 运用Super-PRED、Swiss Target Prediction、PharmMapper、STITCH和BATMAN-TCM数据库收集PSD潜在靶点,利用GeneCards和OMIM数据库获得TNBC侵袭转移靶点,将两者相交获得药物-疾病交集靶点,利用Cytoscape3.10.1软件绘制“PSD-靶点-疾病”互作网络。运用Cytoscape3.10.1中的Centiscape2.2插件设定阈值并获得核心靶点,使用String数据库进行蛋白质互作(PPI)分析,通过David数据库对核心靶点进行KEGG通路和GO功能富集分析。最后将核心靶点依次与PSD进行分子对接。通过Transwell和Western blotting法对PSD的作用及机制进行验证。结果 网络药理学结果显示,共筛选出PSD潜在靶点285 个及药物与疾病核心靶点26 个。GO分析获得175 个条目,涉及生物大分子(蛋白质、DNA、RNA)的结合、酶活性、基因转录调控等方面。KEGG分析获得46个条目,涉及癌症途径、化学致癌-受体活化、癌症中的微小RNA、化学致癌-活性氧、癌症中PD-L1 表达和PD-1 检查点通路等。分子对接显示,PSD与MTOR、HDAC2、ABL1、CDK1、TLR4、TERT、PIK3R1、NFE2L2、PTPN1 有较高的结合性。Transwell 和Western blotting 结果显示,PSD抑制TNBC细胞侵袭迁移且降低其MMP2、MMP9、N-cadherin 及关键蛋白p-mTOR、ABL1、TERT、PTPN1、HDAC2、PIK3R1、CDK1、TLR4 和细胞核内NFE2L2 的表达(Plt;0.05),PSD可通过这些靶点阻碍TNBC侵袭转移。结论 PSD通过多靶点和多途径抑制TNBC侵袭转移,为后续深入的机制研究提供前期基础,为TNBC药物研发提供新思路。
关键词:白头翁皂苷D;网络药理学;分子对接;三阴性乳腺癌;侵袭;转移
三阴性乳腺癌(TNBC)是一种高度分化的乳腺癌亚型,占乳腺癌的10%~20%,表现为人表皮生长因子受体2、雌激素受体和孕激素受体表达缺失[1]。高度侵袭转移和药物靶点缺乏一直是影响TNBC 患者预后的重要因素[2]。TNBC转移后,患者术后中位无进展生存期不足2 年,3 年生存率仅为16.7%[3]。近来,临床上常使用化疗药物、抗体偶联药物、免疫和靶向药物治疗TNBC,但患者仍会出现疗效甚微、耐药及严重毒副作用[4-10]。
中药及其活性成分因其低毒、高效、多靶点等特性,近年来被广泛用于抗肿瘤药物研究,具有非常重要的临床应用价值。白头翁为毛茛科多年生草本植物,主要分布于我国吉林、辽宁、内蒙古、河北、安徽、河南等地,最早记载于张仲景的《伤寒论》中,该药取自其干燥的根,用于治疗肠道阿米巴病、细菌性痢疾、疟疾、细菌感染等已有数千年历史[11]。现代药理学研究表明,白头翁皂苷是其治疗的主要活性成分[12]。前期研究发现,白头翁皂苷D(PSD)对宫颈癌、肺癌、胃癌和胶质母细胞瘤细胞等具有显著的细胞毒作用[13-16]。此外,PSD还协同抑制喜树碱介导的乳腺癌细胞增殖[17]。但PSD对TNBC侵袭转移的作用机制尚未阐明。本研究运用网络药理学和分子对接等分析工具从靶点和信号通路的视角预测其分子机制,并进行体外实验验证,为深入的实验研究提供参考。
1 材料和方法
1.1 材料
人三阴性乳腺癌MDA-MB-231 和HS-578T 细胞(中国科学院上海细胞库)。PSD(南京春秋生物工程有限公司),胎牛血清和青霉素-链霉素溶液(×100,斯博利康生物公司),DMEM培养基(Gibco)。Omni-Easy 一步法PAGE凝胶快速制备试剂盒(12.5%,上海雅酶生物医药科技有限公司),MMP2、MMP9、N-cadherin、NFE2L2/NRF2、GADPH 一抗及相应二抗(CellSignaling Technology),P-mTOR、mTOR、CDK1 一抗(Proteintech),ABL1、TLR4、TERT、HDAC2、PTPN1、PIK3R1、Lamin B1一抗(Affinity Biosciences),BCA蛋白定量试剂盒(Thermo Fisher),PVDF膜(Bio-Rad),甲醇(成都市科隆化学品有限公司),Transwell 嵌套(Corning),细胞核蛋白与细胞浆蛋白抽提试剂盒(碧云天生物技术公司)。
1.2 方法
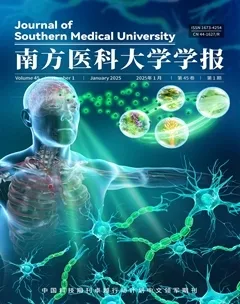
1.2.1 PSD作用靶点的筛选 通过小分子化学成分信息检索数据库(Pubchem)网站检索“Pulsatilla saponin D”及“68027-15-6”获得PSD 的SMILES 和其化学结构SDF 文件。将其导入Super-PRED、Swiss TargetPrediction、PharmMapper、STITCH 和BATMAN-TCM数据库,获得PSD对应的作用靶点。
1.2.2 TNBC 侵袭转移相关靶点的筛选 以“triplenegative breast cancer”、“invasion”、“metastasis”为关键词分别在GeneCards和OMIM数据库中检索TNBC侵袭转移相关靶点,选择Relevance score>1的靶点,将疾病靶点合并去重,导入UniProt网站获得TNBC侵袭转移对应靶基因。
1.2.3“ PSD-靶点-疾病”网络的构建及可视化 将PSD作用靶点与TNBC侵袭转移相关靶点相交,并用Venn图展示交集靶点,运用Cytoscape 3.10.1 软件绘制PSD抑制TNBC侵袭转移的“PSD-靶点-疾病”互作网络。
1.2.4 蛋白质相互作用(PPI)网络的构建 运用Cytoscape 3.10.1 软件的Centiscape2.2 插件通过设定Closeness unDir、Betweenness unDir和Degree unDir阈值,筛选交叉靶点中的核心靶点。将核心靶点上传至String 数据库进行PPI 分析,选择“Multiple proteins”和“Homo sapiens”,导出“string_interactions_short.tsv”文件,并用Cytoscape 3.10.1软件可视化PPI网络图。
1.2.5 KEGG通路和GO功能富集分析 在David 数据库输入核心靶点,依次选择“OFFICAL GENESYMBOL”、“Homo sapiens”、“Gene List”,并在弹出的网页中选择“Functional Annotation Clustering”,选中Gene_Ontology 和Pathways 项,点击FunctionalAnnotation Chart下载相关文件。运用“clusterProfiler”R语言包进行KEGG/GO富集分析。GO注释主要分析以下3个术语:细胞组成(CC)、生物过程(BP)和分子功能(MF)。
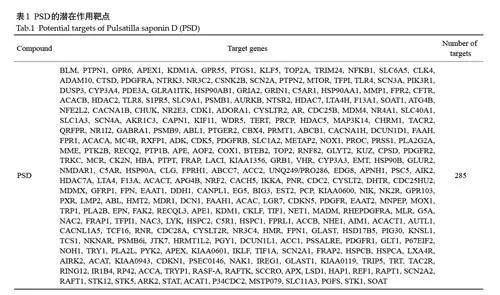
1.2.6 分子对接 从RCSB PDB数据库获取TNBC侵袭转移靶蛋白对应的晶体结构。对蛋白质晶体采用薛定谔软件的Protein Preparation Wizard 模块分别进行protein preprocess、regenerate states of native ligand、Hbondassignment optimization, protein energyminimization 和remove waters 处理。采用薛定谔中LigPrep模块进行处理PSD的2D sdf结构文件,生成其所有的3D手性构象。采用薛定谔SiteMap模块预测最佳的结合位点,再采用Receptor Grid Generation模块设置最合适的Enclosing box将预测出来的结合位点完美包裹,并在此基础上获取上述靶蛋白的活性位点。将处理好的配体化合物PSD与上述靶蛋白活性位点分别进行分子对接并计算MM-GBSA结合自由能。结合自由能值低于0 表明配体能够与受体结合,且自由能越低,配体-受体结合越稳定。在本研究中,选取结合自由能lt;-17 kcal/mol 作为药物作用靶点筛选的前提条件,并将配体化合物PSD与相应的受体蛋白进行可视化分析。
1.2.7 Transwell 检测细胞侵袭迁移 将MDA-MB-231和HS-578T细胞分别种于含有基质胶的Transwell小室的上室,下室中加入0~1.5 μmol/L的PSD处理24 h,取下小室,固定、结晶紫染色,光镜下定量侵袭细胞数并拍照。细胞迁移实验不铺设基质胶,方法同上。
1.2.8 Western blotting检测关键靶蛋白及侵袭迁移相关蛋白表达 上述细胞经0~1.5 μmol/L PSD作用24 h后,裂解并定量细胞,经12.5% SDS-聚丙烯酰胺凝胶电泳分离蛋白,甲醇活化PVDF膜,恒压100 V条件转模2 h,5%脱脂牛奶封闭1 h 后,再用p-mTOR(1∶2000)、mTOR(1∶2000)、ABL1(1∶1000)、TLR4(1∶1000)、TERT(1∶1000)、HDAC2(1∶1000)、PTPN1(1∶1000)、CDK1(1∶2000)、PIK3R1(1∶1000)、NFE2L2/NRF2(1∶1000)、MMP2(1∶1000)、MMP9(1∶1000)、N-cadherin(1∶2000)、GADPH(1∶10 000)一抗于4 ℃孵育过夜及对应二抗(1∶3000)于室温孵育1 h,使用蛋白显影仪可视化蛋白条带并用ImageJ软件分析结果。
1.2.9 统计学分析 采用SPSS13.0软件进行统计分析。计量资料以均数±标准差表示。在细胞实验中,数据如果满足方差齐性,采用单因素方差分析和LSD's posthoc 检验进行多组间比较;否则,采用Dunnett's T3检验进行组间比较。以Plt;0.05表示差异有统计学意义。所有实验均独立重复3次。
2 结果
2.1 PSD抑制TNBC侵袭转移的潜在靶点预测
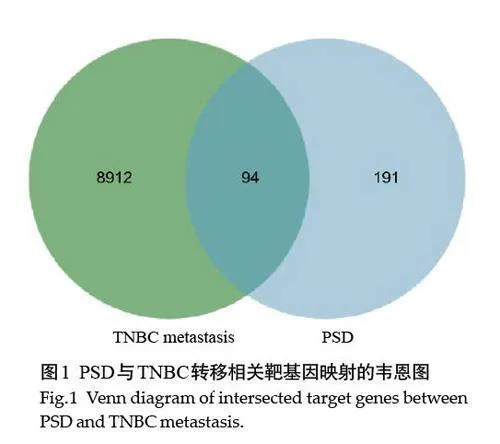
已获得PSD潜在靶点285个(表1)和TNBC侵袭转移相关靶点9006个,及其共有靶点94个(图1)。
2.2“ PSD-靶点-疾病”网络的构建及其可视化
化合物PSD可能作用于“PSD-靶点-疾病”网络中的NFKB1、PIK3R1、HSP90AB1、PDGFRA、PDGFRB、NOX1、ABL1、TLR4、HSP90AA1、AR、CDC25B、HDAC2、MTOR、MMP1、CDK1、GRIA2、TERT、NFE2L2、PTPN1、CAPN1、MME、FPR2、PTK2B、ABCB1等靶基因影响TNBC侵袭转移(图2)。
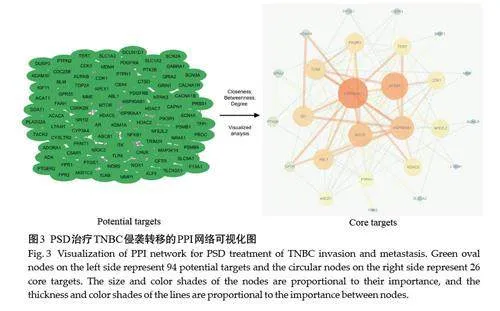
2.3 PSD治疗TNBC侵袭转移PPI网络的构建
共筛选出26个核心靶点(图3),主要包括:热休克蛋白90α家族A类成员1(HSP90AA1 或HSP90A)、热休克蛋白90α家族B类成员1(HSP90AB1或HSP90B)、核因子κB 亚基1(NFKB1)、雷帕霉素机能靶点(MTOR)、组蛋白去乙酰化酶2(HDAC2)、ABL原癌基因1(ABL1)、细胞周期素依赖性激酶1(CDK1)、Toll样受体4(TLR4)、端粒酶反转录酶(TERT)、磷酸肌苷-3-激酶调控亚基1(PIK3R1)、NFE2 样BZIP 转录因子2(NFE2L2)、赖氨酸特异性去甲基化酶1(LSD1 或KDM1A)、蛋白酪氨酸磷酸酶非受体1型基因(PTPN1)等(表2)。
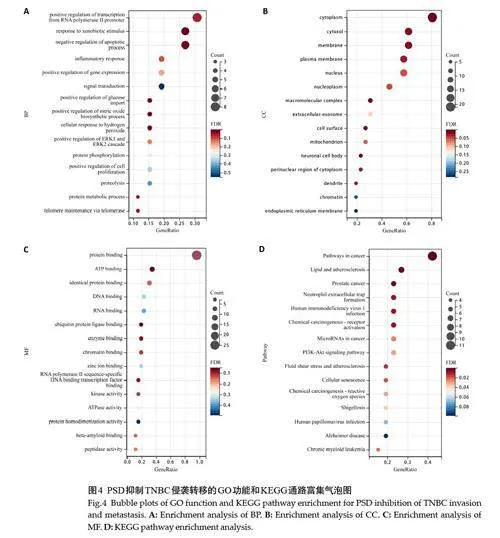
2.4 PSD抑制TNBC侵袭转移的GO功能和KEGG通路富集分析
共获GO功能条目175条,主要涉及到生物大分子(蛋白质、DNA、RNA)的结合、酶活性、基因转录调控等方面(图4A~C)。其中,分子功能术语中富集的功能主要以蛋白质结合、ATP结合、DNA和RNA结合、泛素蛋白连接酶结合、酶结合、染色质结合、锌离子结合、RNA聚合酶II序列特异性DNA结合转录因子结合等的作用为主。
最终获得46条通路富集条目(表3),主要包括:癌症途径、化学致癌-受体活化、癌症中的微小RNA、化学致癌-活性氧、癌症中PD-L1表达和PD-1检查点通路等肿瘤相关通路(图4D)。
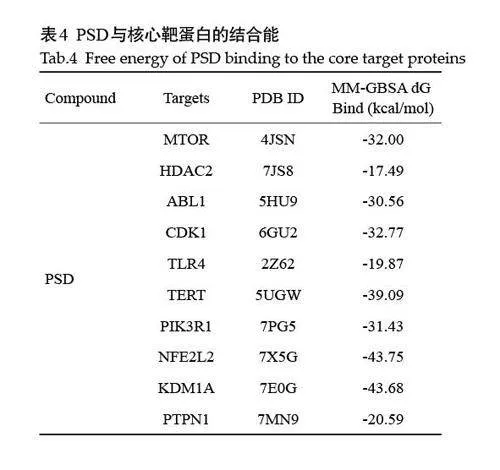
2.5 PSD治疗TNBC侵袭转移的分子对接评估
PSD与核心靶点MTOR、HDAC2、ABL1、CDK1、TLR4、TERT、PIK3R1、NFE2L2、KDM1A、PTPN1 的分子对接结果均lt;-17 kcal/mol(表4、图5)。
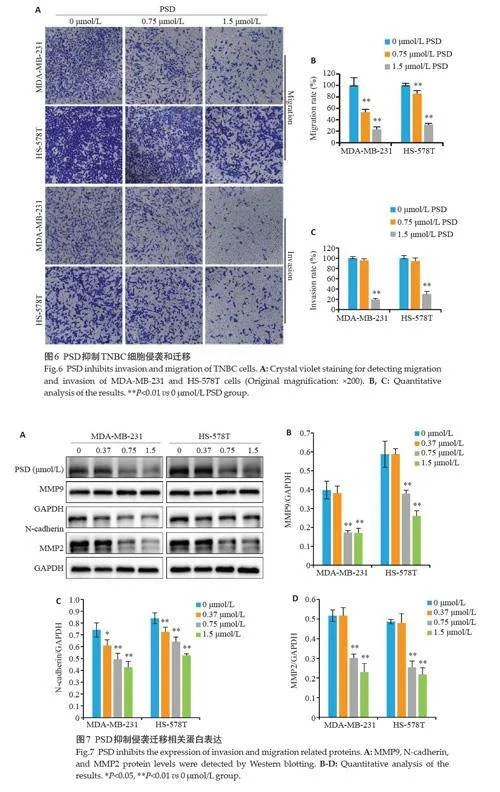
2.6 PSD对TNBC细胞侵袭和迁移的作用
Transwell结果显示,相比于对照组,0.75~1.5 μmol/L的PSD剂量依赖地抑制了MDA-MB-231 和HS-578T细胞的迁移(图6A、B)和侵袭(图6A、C)水平,差异有统计学意义(Plt;0.05)。
2.7 PSD对侵袭转移相关蛋白表达的影响
Western blotting结果显示,相比于对照组,PSD剂量依赖地降低了MDA-MB-231 和HS-578T 细胞中MMP9、MMP2 和N-cadherin 侵袭转移相关蛋白表达,差异有统计学意义(Plt;0.05,图7)。
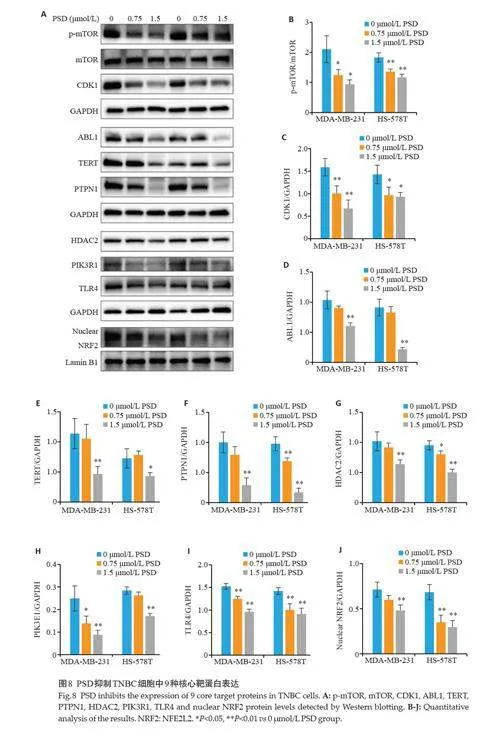
2.8 PSD抑制TNBC细胞中核心靶蛋白表达
Western blotting 结果显示,PSD 处理的MDAMB-231 和HS-578T 细胞中p-mTOR、ABL1、TERT、PTPN1、HDAC2、PIK3R1、CDK1、TLR4 蛋白表达水平相较对照组明显降低,差异有统计学意义(Plt;0.05,图8A~I)。另外,PSD剂量依赖地降低了两种TNBC细胞核内NFE2L2蛋白水平,差异有统计学意义(Plt;0.05,图8A、J)。
3 讨论
白头翁是清热解毒类中药,具有广泛的抗肿瘤活性。白头翁皂苷是其治疗作用的主要活性成分[12]。许多白头翁皂苷均具有抗肿瘤活性[18],而PSD是中药白头翁皂苷及其他活性成分中抗肿瘤效价最强的中药单体之一,也是近来抗肿瘤中药研究的热点[12]。既往研究表明,PSD显著抑制宫颈癌、乳腺癌、肺癌、胃癌、胶质母细胞瘤细胞生长和血管生成[13-17]。与既往研究不同,本研究专注于TNBC这一更具侵袭性和转移潜力的乳腺癌亚型,旨在探索PSD在该类型肿瘤侵袭转移中的潜在治疗机制。
TNBC侵袭转移机制非常复杂,与多靶点和多信号通路密切相关[19]。本研究通过网络药理学分析,获得PSD抑制TNBC侵袭转移可能的核心靶点为MTOR、HDAC2、ABL1、CDK1、TLR4、TERT、PIK3R1、NFE2L2、PTPN1 等,并且这些靶点在分子对接中均与PSD有较高的结合性,为开发针对TNBC侵袭转移的新型治疗策略提供了理论基础,这可能在临床实践中具有重要的应用价值[20]。研究发现,MTOR和PIK3R1均是细胞信号通路中的关键分子,在肿瘤侵袭迁移中扮演重要角色。PIK3R1通过PI3K/Akt信号调节mTOR活性,PI3K/Akt 信号的异常激活导致mTOR 信号通路的激活,从而协同促进肿瘤侵袭迁移[21]。HDAC2是一种重要的表观遗传调节因子,它通过去除组蛋白乙酰基团来调控染色质结构和基因表达。上皮-间充质转化(EMT)是肿瘤侵袭迁移的关键过程,在此过程中,上皮细胞失去其细胞极性和粘附性,并获得间充质细胞的侵袭迁移特性。HDAC2可通过调节与EMT相关的转录因子(如Twist等)的表达促进EMT的进程[22]。ABL1 是一种原癌基因,编码的蛋白是一种非受体酪氨酸激酶,它能够调节细胞-细胞间、细胞-细胞外基质间的粘附,影响细胞迁移[23]。CDK1作为一种关键的细胞周期调节因子,能够通过调节EMT、G2/M相变和泛凋亡成为肿瘤治疗的潜在靶点[24]。TLR4是肿瘤治疗的潜在靶点,通过抑制TLR4信号通路有可能减少肿瘤侵袭迁移,为肿瘤治疗提供新策略[25]。TERT的表达可能影响肿瘤微环境,包括促进肿瘤相关巨噬细胞的极化,以及促进肿瘤血管生成,这些都有助于肿瘤的侵袭和转移[26]。NFE2L2又称为NRF2,是一种关键的转录因子。研究表明,NRF2过度激活或异常表达可能与肿瘤侵袭和预后不良有关[27],因此抑制NRF2 活性可能有助于抑制肿瘤的侵袭和转移。PTPN1 是一种广泛表达的蛋白质酪氨酸磷酸酶,它与多种信号通路交叉,包括PI3K/Akt、Ras/MAPK等,这些通路在肿瘤侵袭迁移中起重要作用[28]。尽管早期研究中PSD通过调节RAS 相关C3 肉毒素底物3 和c-Met、自噬-溶酶体功能和p62介导的泛素化蛋白聚集及ERK/mTOR/p70S6K 信号通路发挥多种抗肿瘤作用[13-15, 17],这可能涉及肿瘤分子特征和病理进程上的差异、基因表达谱差异等;但在TNBC中,本研究揭示了它与mTOR、HDAC2等多个核心靶点的新结合模式,这表明其在不同肿瘤类型中可能具有不同的作用机制,在不同类型乳腺癌中的作用机制可能更为复杂。
通过对核心靶点进行KEGG通路和GO功能富集分析,本研究发现PSD抑制TNBC侵袭转移的作用可能与癌症途径、化学致癌-受体活化、化学致癌-活性氧、癌症中的微小RNA、癌症中PD-L1表达和PD-1检查点通路等调控相关。癌症途径主要包括HIF-1信号通路、VEGF 信号通路、PI3K/Akt 信号通路等。HIF1 信号通路在肿瘤细胞适应缺氧环境、促进肿瘤侵袭转移中起关键作用。在TNBC中,HIF1α可促进糖酵解、血管生成、细胞侵袭和EMT,从而增强TNBC转移潜能[29]。TNBC中的VEGF高表达与肿瘤远端转移相关,抑制VEGF与neuropilin-2结合可增强TNBC的化疗敏感性并抑制转移[30]。PI3K/Akt信号通路是细胞转移的关键调节因子,有助于TNBC细胞侵袭和迁移[31]。化学致癌物质能够导致基因突变,从而激活相关受体。EGFR等受体的活化促进TNBC肿瘤干细胞聚集和肺转移[32]。活性氧能够通过氧化应激损害细胞DNA、蛋白质,导致基因突变和细胞功能障碍。活性氧的产生与TNBC肿瘤干细胞特征和EMT相关[33]。微小RNA是一类非编码RNA,通过调节基因表达影响肿瘤的发展和转移。一些微小RNA,如miR-21、miR-193等被发现通过靶向抑癌基因或促进转移相关基因表达影响TNBC细胞侵袭转移[34, 35]。PD-1与其配体PD-L1在肿瘤免疫逃逸中起着重要作用。在TNBC中,PD-L1的表达与肿瘤侵袭性和预后不良有关[36]。总之,通过KEGG通路富集分析可知,这些信号通路可能是PSD作用于TNBC侵袭转移的主要通路,且已筛选的上述核心靶点与这些通路有关,表明PSD对TNBC侵袭转移具有多靶点和多途径的作用。
基于此,本研究选择这些核心靶点进行体外实验验证。PSD对TNBC细胞侵袭迁移的作用结果显示,PSD浓度依赖地降低了TNBC细胞侵袭和迁移水平。研究表明,MMP2 和MMP9 作为基质金属蛋白酶有助于恶性肿瘤转移及血管生成,而N-cadherin作为肿瘤中上皮间质转化标志物则与肿瘤细胞间粘附有关[37]。这3 种蛋白均是反映肿瘤细胞侵袭转移的关键蛋白。本研究发现MMP2、MMP9、N-cadherin 蛋白在PSD 处理的TNBC细胞中显著降低,说明PSD确实具有抑制TNBC细胞侵袭和迁移的作用。针对核心靶点的体外实验显示,PSD 可抑制TNBC 细胞p-mTOR、ABL1、TERT、PTPN1、HDAC2、PIK3R1、CDK1、TLR4蛋白表达,且降低TNBC细胞核内NFE2L2 蛋白水平,具有剂量依赖性。相较既往有关PSD抗肿瘤单一靶点的作用研究,PSD多靶点作用特性使其能够针对TNBC的多个关键路径进行干预,这种特性在宫颈癌、乳腺癌、肺癌、胃癌、胶质母细胞瘤治疗中并未被揭示。
综上所述,本研究采用网络药理学、分子对接和体外实验初步证明PSD可通过抑制癌症途径、化学致癌-受体活化、化学致癌-活性氧、癌症中的微小RNA、癌症中PD-L1 表达和PD-1 检查点通路中的p-mTOR、ABL1、TERT、PTPN1、HDAC2、PIK3R1、CDK1、TLR4表达及下调细胞核内NFE2L2 表达发挥抑制TNBC细胞侵袭转移的作用。本研究的发现不仅为TNBC侵袭转移的治疗提供新的靶点,而且有助于开发更有效的治疗方案,以克服该类型肿瘤耐药问题。
参考文献:
[1] Adrada BE, Moseley TW, Kapoor MM, et al. Triple-negative breast
cancer: histopathologic features, genomics, and treatment[J].
Radiographics, 2023, 43(10): e230034.
[2] Lin SY, Mo HN, Li YQ, et al. Clinicopathological characteristics and
survival outcomes in patients with synchronous lung metastases
upon initial metastatic breast cancer diagnosis in Han population[J].
BMC Cancer, 2021, 21(1): 1330.
[3] 尹海庆, 苏 莉, 陈万贞, 等. 术后首发肺转移的三阴性乳腺癌临床病
理特点及预后因素分析[J]. 现代肿瘤医学, 2019, 27(16): 2872-6.
[4] Yang R, Shi YY, Han XH, et al. The impact of platinum-containing
chemotherapies in advanced triple-negative breast cancer: metaanalytical
approach to evaluating its efficacy and safety[J]. Oncol
Res Treat, 2021, 44(6): 333-43.
[5] Mason SR, Willson ML, Egger SJ, et al. Platinum-based
chemotherapy for early triple-negative breast cancer[J]. Cochrane
Database Syst Rev, 2023, 9(9): CD014805.
[6] McGuinness JE, Kalinsky K. Antibody-drug conjugates in
metastatic triple negative breast cancer: a spotlight on sacituzumab
govitecan, ladiratuzumab vedotin, and trastuzumab deruxtecan[J].
Expert Opin Biol Ther, 2021, 21(7): 903-13.
[7] Mediratta K, El-Sahli S, D’Costa V, et al. Current progresses and
challenges of immunotherapy in triple-negative breast cancer[J].
Cancers, 2020, 12(12): 3529.
[8] Li LY, Zhang F, Liu ZY, et al. Immunotherapy for triple-negative
breast cancer: combination strategies to improve outcome[J].
Cancers, 2023, 15(1): 321.
[9] Ye F, Dewanjee S, Li YH, et al. Advancements in clinical aspects of
targeted therapy and immunotherapy in breast cancer[J]. Mol
Cancer, 2023, 22(1): 105.
[10]Lev S. Targeted therapy and drug resistance in triple-negative breast
cancer: the EGFR axis[J]. Biochem Soc Trans, 2020, 48(2): 657-65.
[11] Li YH, Zou M, Han Q, et al. Therapeutic potential of triterpenoid
saponin anemoside B4 from Pulsatilla chinensis[J]. Pharmacol Res,
2020, 160: 105079.
[12]Fang YY, Hu DY, Li HL, et al. Synthesis, biological evaluation, and
mode of action of Pulsatilla saponin D derivatives as promising
anticancer agents[J]. Front Pharmacol, 2019, 10: 1208.
[13]Zhang YL, Bao JL, Wang K, et al. Pulsatilla saponin D inhibits
autophagic flux and synergistically enhances the anticancer activity
of chemotherapeutic agents against HeLa cells[J]. Am J Chin Med,
2015, 43(8): 1657-70.
[14]Hong SW, Jung KH, Lee HS, et al. SB365, Pulsatilla saponin D,
targets c-Met and exerts antiangiogenic and antitumor activities[J].
Carcinogenesis, 2013, 34(9): 2156-69.
[15]Lu YY, He WB, Huang XX, et al. Pulsatilla saponin D regulates rasrelated
C3 botulinum toxin substrate 3 (RAC3) to overcome
resistance to paclitaxel in lung adenocarcinoma cells[J]. BMC
Cancer, 2024, 24(1): 55.
[16]Lim JH, Jung KH, Kim MS, et al. SB365 induces apoptosis and
suppresses proliferation of glioblastoma cells[J]. Indian J
Pharmacol, 2020, 52(2): 102-7.
[17]Wang K, Tu YB, Wan JB, et al. Synergistic anti-breast cancer effect
of pulsatilla saponin D and camptothecin through interrupting
autophagic-lysosomal function and promoting p62-mediated
ubiquitinated protein aggregation[J]. Carcinogenesis, 2020, 41(6):
804-16.
[18]Zhong JM, Tan LH, Chen MW, et al. Pharmacological activities and
molecular mechanisms of Pulsatilla saponins[J]. Chin Med, 2022,
17(1): 59.
[19]Bryan S, Witzel I, Borgmann K, et al. Molecular mechanisms
associated with brain metastases in HER2-positive and triple
negative breast cancers[J]. Cancers, 2021, 13(16): 4137.
[20]江远玲, 冯 楠, 邵欣宇, 等. 黄芪的现代药理作用研究进展[J]. 西南
医科大学学报, 2023, 46(5): 456-60, 封3.
[21]Tewari D, Patni P, Bishayee A, et al. Natural products targeting the
PI3K-Akt-mTOR signaling pathway in cancer: a novel therapeutic
strategy[J]. Semin Cancer Biol, 2022, 80: 1-17.
[22]Zheng YY, Dai MR, Dong Y, et al. ZEB2/TWIST1/PRMT5/NuRD
Multi complex Contributes to the Epigenetic Regulation of EMT and
Metastasis in Colorectal Carcinoma[J]. Cancers, 2022, 14(14):
3426.
[23]Bradley WD, Koleske AJ. Regulation of cell migration and
morphogenesis by Abl-family kinases: emerging mechanisms and
physiological contexts[J]. J Cell Sci, 2009, 122(Pt 19): 3441-54.
[24]Ren LW, Yang YH, Li W, et al. CDK1 serves as a therapeutic target
of adrenocortical carcinoma via regulating epithelial-mesenchymal
transition, G2/M phase transition, and PANoptosis[J]. J Transl Med,
2022, 20(1): 444.
[25]Kashani B, Zandi Z, Pourbagheri-Sigaroodi A, et al. The role of tolllike
receptor 4 (TLR4) in cancer progression: a possible therapeutic
target[J]? J Cell Physiol, 2021, 236(6): 4121-37.
[26]Zhou Q, Xue CQ, Man JW, et al. Correlation of tumor-associated
macrophage infiltration in glioblastoma with magnetic resonance
imaging characteristics: a retrospective cross-sectional study[J].
Quant Imaging Med Surg, 2023, 13(9): 5958-73.
[27]Lin L, Wu Q, Lu FF, et al. Nrf2 signaling pathway: current status and
potential therapeutic targetable role in human cancers[J]. Front
Oncol, 2023, 13: 1184079.
[28]Sivaganesh V, Sivaganesh V, Scanlon C, et al. Protein tyrosine
phosphatases: mechanisms in cancer[J]. Int J Mol Sci, 2021, 22
(23): 12865.
[29]Liu Q, Guan CC, Liu C, et al. Targeting hypoxia-inducible factor-
1alpha: a new strategy for triple-negative breast cancer therapy[J].
Biomed Pharmacother, 2022, 156: 113861.
[30]Xu ZW, Goel HL, Burkart C, et al. Inhibition of VEGF binding to
neuropilin-2 enhances chemosensitivity and inhibits metastasis in
triple-negative breast cancer[J]. Sci Transl Med, 2023, 15(694):
eadf1128.
[31]Wu TQ, Song HM, Xie D, et al. Silencing of ASPP2 promotes the
proliferation, migration and invasion of triple-negative breast cancer
cells via the PI3K/AKT pathway[J]. Int J Oncol, 2018, 52(6):
2001-10.
[32]Liu X, Adorno-Cruz V, Chang YF, et al. EGFR inhibition blocks
cancer stem cell clustering and lung metastasis of triple negative
breast cancer[J]. Theranostics, 2021, 11(13): 6632-43.
[33]Liu T, Li KD, Zhang ZX, et al. Tetrandrine inhibits cancer stem cell
characteristics and epithelial to mesenchymal transition in triplenegative
breast cancer via SOD1/ROS signaling pathway[J]. Am J
Chin Med, 2023, 51(2): 425-44.
[34]Fang H, Xie JP, Zhang M, et al. miRNA-21 promotes proliferation
and invasion of triple-negative breast cancer cells through targeting
PTEN[J]. Am J Transl Res, 2017, 9(3): 953-61.
[35]Xu JH, Zhao JX, Jiang MY, et al. MiR-193 promotes cell
proliferation and invasion by ING5/PI3K/AKT pathway of triplenegative
breast cancer[J]. Eur Rev Med Pharmacol Sci, 2020, 24
(6): 3122-9.
[36]Chen CH, Li SH, Xue JL, et al. PD-L1 tumor-intrinsic signaling and
its therapeutic implication in triple-negative breast cancer[J]. JCI
Insight, 2021, 6(8): e131458.
[37]Bacci M, Lorito N, Ippolito L, et al. Reprogramming of amino acid
transporters to support aspartate and glutamate dependency sustains
endocrine resistance in breast cancer[J]. Cell Rep, 2019, 28(1): 104-
18.e8.
(编辑:郎 朗)