基于PE-CycleGAN网络的鼻咽癌自适应放疗CBCT-sCT生成研究




摘要:目的 探索基于PE-CycleGAN方法从锥形束CT(CBCT)合成高质量CT(sCT),用于鼻咽癌自适应放疗(ART)。方法 提出感知增强的CycleGAN模型(PE-CycleGAN),引入判别器双重对比度损失、生成器多感知损失和改进的U-Net结构。采用80例鼻咽癌患者的CBCT 和CT 作为训练集,7 例为测试集。通过量化sCT 与参考CT 的平均绝对误差(MAE)、峰值信噪比(PSNR)、结构相似性指标(SSIM)以及sCT与参考CT剂量gamma 通过率、靶区和危及器官(OAR)相对剂量偏差,评估sCT图像质量和剂量计算精度。结果 PE-CycleGAN生成sCT与对应标准CT的MAE为56.89±13.84 HU,较CBCT的81.06±15.86 HU降低约30%(Plt;0.001)。PE-CycleGAN 的PSNR 和SSIM(26.69±2.41 dB,0.92±0.02)高于CBCT(21.54±2.37 dB,0.86±0.05)(Plt;0.001)。在与计划CT剂量gamma 分析中,在2 mm/2%标准下,PE-CycleGAN的sCT剂量比对通过率(90.13±3.75)%高于CBCT的(81.65±3.92)% (Plt;0.001)和CycleGAN的(87.69±3.50)% (Plt;0.05)。在3 mm/3%标准下,PE-CycleGAN 的sCT通过率(97.20±2.52)%同样优于CBCT的(86.92±3.51)% (Plt;0.001)和CycleGAN的(94.58±2.23)% (Plt;0.01)。sCT相比计划CT的靶区和OAR 相对剂量偏差均值除Lens Dmax(Gy)为3.38%(P=0.09)外都在±3%范围内(Pgt;0.05),PTVnx HI、PTVnd HI、PTVnd CI、PTV1 HI、PRV_SC、PRV_BS、Parotid、Larynx、Oral、Mandible、PRV_ON相对剂量偏差均值都小于±1%(Pgt;0.05)。结论 PE-CycleGAN能从CBCT快速合成高质量sCT,可用于鼻咽癌的CBCT引导ART。
关键词:锥形束CT;合成CT;自适应放疗;深度学习;生成对抗网络
精准放疗是鼻咽癌的主要治疗手段,但患者在治疗过程中的解剖结构变化可能导致剂量分布偏离原定计划[1, 2]。自适应放疗(ART)通过动态调整计划来解决这一问题,但传统ART依赖于反复进行计算机断层扫描(CT),这增加了患者的辐射剂量和治疗时间[3, 4]。
为克服这一难点,研究者尝试利用放疗设备自带的锥形束CT(CBCT)进行ART。然而,CBCT的图像质量不足,特别是在软组织对比度和CT值准确性方面,难以直接用于高精度剂量计算[5-7]。为解决这一问题,研究者提出了多种方法,如CBCT图像后处理校正[8]和基于配准的合成CT(sCT)[9]。然而,这些方法在处理复杂解剖结构和大幅度形变时准确性有限,且计算效率较低,难以满足临床的需求。
近年来,深度学习方法,特别是生成对抗网络(GAN)在医学图像处理领域取得了快速发展[10, 11]。Kida 等[11]提出的循环生成对抗网络(CycleGAN)在无需配对数据的情况下实现了CBCT到CT的转换,为解决配对训练数据不足的问题提供了新思路。然而,传统CycleGAN模型架构简单,损失函数单一,在医学影像保持精细纹理细节、抑制噪声和伪影、捕捉复杂解剖结构等方面仍存在不足[12-14]。
针对上述问题,本研究创新性提出了一种感知增强CycleGAN 模型(PE-CycleGAN):引入多感知损失函数,全面提升sCT的逼真度和细节保真度;改进生成器结构,采用基于U-Net的设计并融入残差连接,同时增强对噪声和伪影的抑制能力,提高模型捕捉和重建复杂解剖结构的能力;应用双重对比度损失,增强模型的判别及引导能力。该模型旨在提升sCT的图像质量和剂量计算精度,为CBCT引导的鼻咽癌自适应放疗提供新的解决方案。
1 资料和方法
1.1 数据采集与预处理
回顾性纳入南方医科大学中西医结合医院2020~2023年接受调强放疗(IMRT)的87例鼻咽癌患者。纳入标准:病理确诊、年龄18~70 岁、Karnofsky 功能状态评分≥70分、治疗前行增强CT定位和首次CBCT扫描、签署知情同意书。排除标准:复发或转移性肿瘤、放化疗同期进行、严重副反应、资料缺失等。本研究已通过伦理审批。
所有患者均行SIMENS CT(120 kV,200 mA,3 mm层厚,0.97 mm像素间距,512×512矩阵)和CBCT扫描(120 kV,20 mA,25 cm视野,3 mm层厚,0.97 mm像素间距,512×512 矩阵)。将CBCT配准至CT,选择80 个鼻咽癌患例共6510对CT-CBCT切片构成训练集,7例共680对切片作为测试集。图像预处理包括归一化、去除伪影、数据增强等。
1.2 PE-CycleGAN模型
1.2.1 网络结构 PE-CycleGAN 模型在传统CycleGAN[11]的基础上进行了创新性改进,如(图1)所示。模型主要由两个生成器(GCT to CBCT、GCBCT to CT)和两个判别器(DCT、DCBCT)组成,GCT to CBCT和GCBCT to CT均采用了基于U-Net[15]的改进结构。如(图1)左下方所示,生成器包含编码器、解码器和跨层连接。编码器通过下采样逐步提取多尺度语义特征,解码器则通过上采样恢复图像细节。跨层连接使编码器的特征图直接传递到解码器对应层,有效融合了局部和全局信息。此外,引入ResNet[16]式的残差块(图中的\"Res Block\"),有效缓解深层网络中的梯度消失问题。另一个改进是生成器引入多感知损失。图1 左下方\"Generator Architecture\"所示,生成器的多元化的损失函数设计能够从像素级、结构级和感知级多个层面优化生成图像的质量。判别器也创新采用了双对比度损失机制(图1),DCT不仅区分真实CT 和sCT,通过引入CBCT 为负样本,强制性使得sCT特征推离CBCT特征(Push Away 箭头),还将会使sCT的特征拉近真实CT的特征空间,增强了sCT与真实CT的相似性(Pull Close箭头)。这种双重约束显著增强了模型对不同图像域特征的辨识能力和生成能力,使得生成的sCT在保持CT图像特征的同时,有效减少了CBCT 的噪声和伪影。判别器基于PatchGAN[17]结构,在局部图像块上进行判别和引导,进一步提高了生成图像的细节真实度和准确性。
1.2.2 损失函数 PE-CycleGAN对判别器和生成器损失函数进行了改进:
1.2.3 参数设置与训练细节 PE-CycleGAN 在Tensorflow框架下实现。网络权重采用高斯分布(μ=0,σ=0.02)初始化。Adam优化器的学习率设为0.0002,动量参数β1和β2分别取0.5和0.999。训练400个epochs,批大小为2。为防止过拟合,间隔20个训练epoch结束,在测试集上评估模型性能,连续5个epoch无明显提升时,则停止训练,训练中生成器和判别器的更新次数比为1∶1。推断阶段,对单张CBCT切片的sCT合成时间约为1 s。
1.3 评价指标
1.3.1 图像质量评估 采用MAE、PSNR、SSIM等指标评估sCT相对参考CT的图像质量。MAE反映灰度值HU偏差,PSNR、SSIM则从感知相似性角度度量[20-22]。公式定义如下:
并且为评估sCT的灰度值HU精确性,提取穿过骨骼和软组织区域的剖面线,绘制CBCT、sCT 和CT 的HU值曲线[23-25]。此外,生成sCT 和CBCT 相对CT 的HU热差异图,直观展示HU值偏差分布。
1.3.2 剂量比对评估 以计划CT剂量为参考,采用3Dgamma 分析比较sCT、CBCT 剂量分布的空间一致性[26]。计算体模内γlt;1的体素百分比作为通过率,分别取3 mm/3%、2 mm/2%进行统计。进一步通过剂量体积直方图(DVH)参数分析计划CT 和sCT 在靶区和危及器官(OAR)上的剂量差异[27-29]。统计学分析采用SPSS 16.0软件进行。计量资料以均数±标准差表示,组间比较采用配对t检验,Plt;0.05为差异有统计学意义。
2 结果
2.1 sCT的合成质量评估
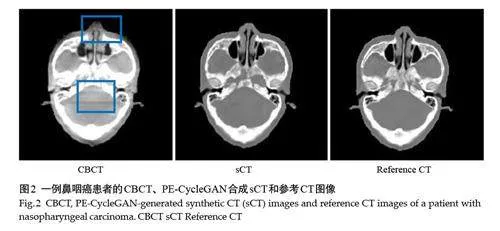
CBCT、sCT(PE-CycleGAN)和参考CT 的横断面图像中可见PE-CycleGAN 生成的sCT 成功去除了CBCT中的散射、条纹伪影,在软组织结构、骨骼边缘等解剖细节上与CT高度一致(图2)。
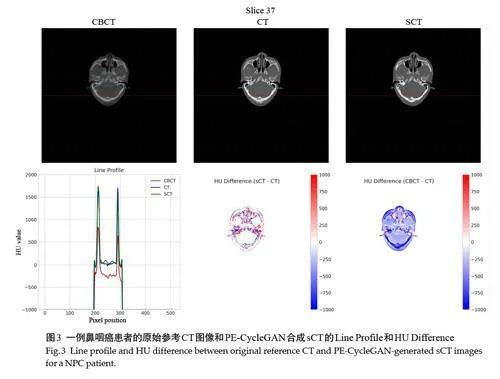
CBCT、sCT和CT的HU值曲线可见,sCT的曲线形态与CT高度重合,骨骼边缘锐利,软组织区域平滑;而CBCT曲线则起伏较大,骨骼边缘模糊,软组织区域噪声明显。这表明sCT不仅在解剖结构上与CT一致,而且在CT 值分布上也更接近CT,纹理细节更逼真。sCT和CBCT相对CT的HU热差异图显示,sCT的整体偏差更小,再次证实了PE-CycleGAN所合成sCT的灰度HU值准确性(图3)。
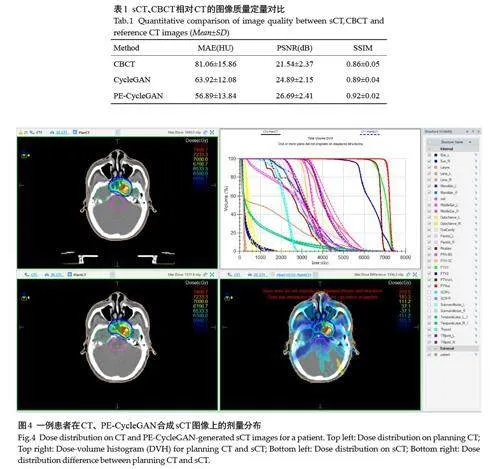
定量比较sCT、CBCT 相对CT 的图像质量。PECycleGAN的MAE较CBCT降低约30%(Plt;0.001),相比常规Cyclegan 也有改善(P=0.31);PE-CycleGAN的PSNR 和SSIM 高于CBCT(Plt;0.001),相比常规Cyclegan 的PSNR、SSIM也都有相应的提升(表1)。PE-CycleGAN能有效提高CBCT成像质量,在CT值准确性、图像信噪比等客观评价指标上优于原始CBCT和常规CycleGAN。
2.2 sCT的剂量计算精度评估
图4 展示了1 例患者在sCT和CT上的剂量分布。视觉上CT剂量与sCT剂量吻合良好,剂量差异分布较低,DVH曲线无明显差异。
表2 列出了sCT、CBCT 在不同gamma 判据下的剂量通过率。在2 mm/2%标准下,PE-CycleGAN的sCT通过率高于CBCT(Plt;0.001)和CycleGAN(Plt;0.05);3 mm/3%标准下,PE-CycleGAN的sCT通过率分别为(97.20±2.52)% 也显著高于CBCT(Plt;0.001)和CycleGAN(Plt;0.01)。这些结果验证了PE-CycleGAN所合成sCT的剂量计算优势。
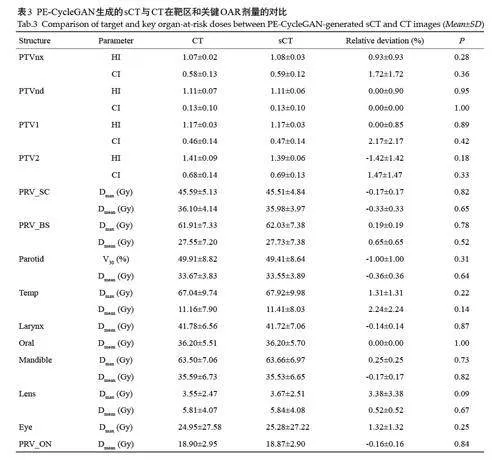
表3详细展示了PE-CycleGAN生成的sCT与计划CT在关键剂量体积参数上的对比。对于靶区覆盖,包括PTVnx、PTVnd、PTV1 和PTV2,sCT 在均匀性指数(HI)和适形度指数(CI)上与CT的相对偏差均控制在±2.2%以内(Pgt;0.05)。对于OAR,如PRV_SC、PRV_BS和Parotid,sCT在Dmax和Dmean上的偏差通常小于±1%,最大不超过±2.24% (Pgt;0.05)。值得注意的是,对于某些小体积结构如晶体,Dmax的相对偏差达到了(3.38±3.38)%,这是所有参数中最大的偏差,但差异无统计学意义(P=0.09)。
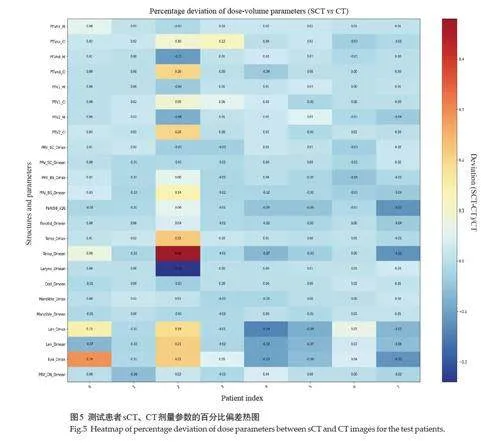
通过热图直观地展示了sCT相对于CT的各项剂量参数的百分比偏差。绝大多数参数的偏差都集中在±3%范围内,很多甚至小于±1%。然而也显示了个别患者(如第3号患者)在某些参数上存在较大偏差,特别是在颞叶的Dmean上,偏差达到48%。尽管如此,颞叶Dmean的整体相对偏差为(2.24±2.24)%(P=0.14,图5)。
3 讨论
获得高质量的三维剂量计算图像是实施精准自适应放疗的前提,将sCT技术引入CBCT引导的在线ART流程,可大大简化操作步骤[30, 31]。sCT与当前CBCT解剖结构完全匹配,无需变形配准,可直接用于靶区、OAR勾画和剂量验证。同时sCT与CT在密度值、组织分辨力等方面高度一致,可作为高精度剂量计算的替代,为快速、可靠的自适应计划提供依据[10]。
本研究创新性地提出PE-CycleGAN 模型,从CBCT 直接合成高保真度的sCT。数据表明PECycleGAN在CBCT合成sCT方面具有优势:区别于传统Cyclegan的[0,1]二分类,创新引入判别器双重对比度损失[18],有助于sCT在保持解剖结构同时纹理细节更接近CT而远离CBCT的分布;传统CycleGAN依赖对抗损失和循环一致性损失,而PE-CycleGAN生成器损失融合MAE、SSIM等多元相似性度量,使sCT在像素级内容和感知特征上与CT 更为一致[20-22];传统CycleGAN 使用简单的卷积网络作为生成器,而PECycleGAN采用U-Net 结构和残差块改善了sCT 的解剖结构保真度[15,16]。这些创新使PE-CycleGAN在sCT合成的解剖结构、纹理细节、CT值准确性等实现了多方位提升。
与直接使用CBCT 或常规CycleGAN 相比,PECycleGAN在图像质量和剂量计算精度方面都取得了显著提升。PE-CycleGAN的MAE为56.89±13.84 HU,较CBCT、常规CycleGAN 的81.06±15.86、63.92±12.08 HU 明显改善。gamma 分析结果显示,PECycleGAN在3 mm/3%和2 mm/2%标准下的通过率分别达到97.20%和90.13%,远高于CBCT 的86.92%和81.65% 和常规Cyclegan 的(94.58±2.23)%、(87.69±3.50)%。
本研究的纳入87例患者,其中80例作为训练集,7例作为测试集,客观验证了PE-CycleGAN的性能。同时综合考量了MAE、PSNR、SSIM等图像质量客观指标,gamma pass rate、DVH参数等剂量学指标,辅以视觉评估,综合性的评估sCT的临床应用效果,统计学检验进一步确保了结果的可信度。
虽然本研究提出的PE-CycleGAN模型在图像质量和剂量精度都有显著的优越性,然而,本研究仍存在一些局限性:样本量相对有限,且集中于鼻咽癌单一部位,可能影响PE-CycleGAN模型的泛化性能。未来计划纳入更多病例,覆盖不同分期、病理类型乃至其他部位肿瘤,全面评估模型的鲁棒性[4]。另外,在某些小体积结构如晶状体的剂量评估中,我们观察到了相对较大的偏差,这提醒仍需实行人工审核确认流程,确保安全性。
综上所述,本研究提出的PE-CycleGAN模型在鼻咽癌CBCT合成sCT用于自适应放疗方面展现了优秀的性能,为CBCT引导的自适应放疗提供了一种高效、低辐射的新解决方案,有望提高治疗精度,减少副作用[32, 33]。通过快速生成高质量的sCT,PE-CycleGAN可以显著简化ART工作流程,减少患者额外的CT扫描次数,同时保证剂量计算的精确性。
参考文献:
[1] 吴伟伟, 李韶今, 尹 慧, 等. 局部晚期鼻咽癌调强放疗中解剖结构改
变及剂量分布变化研究[J]. 中华放射医学与防护杂志, 2017, 37
(11): 826-31.
[2] Zhao SH, Han J, Yang ZY, et al. Anatomical and dosimetric
variations during volumetric modulated arc therapy in patients with
locally advanced nasopharyngeal carcinoma after induction therapy:
implications for adaptive radiation therapy[J]. Clin Transl Radiat
Oncol, 2024, 49: 100861.
[3] Liu YZ, Lei Y, Wang TH, et al. CBCT-based synthetic CT generation
using deep-attention cycleGAN for pancreatic adaptive radiotherapy
[J]. Med Phys, 2020, 47(6): 2472-83.
[4] Liang X, Chen LY, Nguyen D, et al. Generating synthesized
computed tomography (CT) from cone-beam computed tomography
(CBCT) using CycleGAN for adaptive radiation therapy[J]. Phys
Med Biol, 2019, 64(12): 125002.
[5] Chen LY, Liang X, Shen CY, et al. Synthetic CT generation from
CBCT images via deep learning[J]. Med Phys, 2020, 47(3):
1115-25.
[6] 全科润, 程品晶, 陈榕钦, 等. 基于循环生成对抗网络的鼻咽癌
CBCT图像修正[J]. 中国医学物理学杂志, 2021, 38(5): 582-6.
[7] 亓孟科, 李永宝, 吴艾茜, 等. 基于生成对抗网络的鼻咽癌患者伪CT
合成方法研究[J]. 中华放射肿瘤学杂志, 2020, 29(4): 267-72.
[8] Hansen DC, Landry G, Kamp F, et al. ScatterNet: a convolutional
neural network for cone-beam CT intensity correction[J]. Med
Phys, 2018, 45(11): 4916-26.
[9] 周 琼, 李永武, 王 奇, 等. 基于形变配准和伪CT的鼻咽癌自适应放
疗剂量评估[J]. 中国医学物理学杂志, 2019, 36(8): 892-7.
[10]Rusanov B, Hassan GM, Reynolds M, et al. Deep learning methods
for enhancing cone-beam CT image quality toward adaptive
radiation therapy: a systematic review[J]. Med Phys, 2022, 49(9):
6019-54.
[11]Kida S, Kaji, Nawa K, et al. Visual enhancement of Cone-beam CT
by use of CycleGAN[J]. Med Phys, 2020, 47(3): 998-1010.
[12]Liu JW, Yan H, Cheng HL, et al. CBCT-based synthetic CT
generation using generative adversarial networks with disentangled
representation[J]. Quant Imaging Med Surg, 2021, 11(12): 4820-34.
[13]Wang TH, Lei Y, Fu YB, et al. Machine learning in quantitative PET:
a review of attenuation correction and low-count image
reconstruction methods[J]. Phys Med, 2020, 76: 294-306.
[14]潘 丹, 贾龙飞, 曾 安. 生成式对抗网络在医学图像处理中的应用
[J]. 生物医学工程学杂志, 2018, 35(6): 970-6.
[15]Ronneberger O. Invited talk: U-net convolutional networks for
biomedical image segmentation[M]//Informatik aktuell. Berlin,
Heidelberg: Springer Berlin Heidelberg, 2017: 3.
[16]He KM, Zhang XY, Ren SQ, et al. Deep residual learning for image
recognition[C]//2016 IEEE Conference on Computer Vision and
Pattern Recognition (CVPR). June 27-30, 2016. Las Vegas, NV,
USA. IEEE, 2016: 770-8.
[17] Isola P, Zhu JY, Zhou T, et al. Image-to-image translation with
conditional adversarial networks[J]. IEEE TPAMI, 2021, 43(12):
4254-67.
[18]Wang R, Wu ZX, Weng ZJ, et al. Cross-domain contrastive learning
for unsupervised domain adaptation[J]. IEEE Trans Multimedia,
2023, 25: 1665-73.
[19]Wang Z, Bovik AC, Sheikh HR, et al. Image quality assessment:
from error visibility to structural similarity[J]. IEEE Trans Image
Process, 2004, 13(4): 600-12.
[20] Galić I, Habijan M, Leventić H, et al. Machine learning empowering
personalized medicine: a comprehensive review of medical image
analysis methods[J]. Electronics, 2023, 12(21): 4411.
[21]Huynh E, Hosny A, Guthier C, et al. Artificial intelligence in
radiation oncology[J]. Nat Rev Clin Oncol, 2020, 17(12): 771-81.
[22]Wendling M, Morrow A, Hoggarth M, et al. An efficient protocol for
radiotherapy quality control with machine learning[J]. Med Phys,
2020, 47(4): 1526-34.
[23]Lei Y, Tang XY, Higgins K, et al. Learning-based CBCT correction
using alternating random forest based on auto-context model[J].
Med Phys, 2019, 46(2): 601-18.
[24] Jiang J, Sharfo AWM, Mak RH, et al. Development and validation of
an MRI‐only synthetic CT generation method using cycle‐consistent
generative adversarial networks for prostate radiotherapy[J]. Med
Phys, 2021, 48(1): 416-29.
[25]Thummerer A, Zaffino P, Meijers A, et al. Comparison of CBCT
based synthetic CT methods suitable for proton dose calculations in
adaptive proton therapy[J]. Phys Med Biol, 2020, 65(9): 095002.
[26]Pulliam KB, Huang JY, Howell RM, et al. Comparison of 2D and 3D
gamma analyses[J]. Med Phys, 2014, 41(2): 021710.
[27]孙鸿飞, 倪昕晔, 杨建华. 基于深度学习方法的伪CT图像合成技术
研究及在放疗中的应用进展[J]. 中华放射医学与防护杂志, 2021,
41(3): 222-8.
[28]Lei Y, Harms J, Wang TH, et al. MRI-only based synthetic CT
generation using dense cycle consistent generative adversarial
networks[J]. Med Phys, 2019, 46(8): 3565-81.
[29]Liu Y, Lei Y, Wang Y, et al. Evaluation of a deep learning-based
synthetic CT generation method for MRI-only breast radiotherapy
[J]. Phys Med Biol, 2020, 65(8): 085020.
[30]Maspero M, Savenije MHF, Dinkla AM, et al. Dose evaluation of
fast synthetic-CT generation using a generative adversarial network
for general pelvis MR-only radiotherapy[J]. Phys Med Biol, 2018,
63(18): 185001.
[31]Kim J, Park S, Yu H, et al. Deep learning-based synthetic CT
generation from MR images for PET attenuation correction: A
systematic review and meta-analysis[J]. IEEE T Radiat Plasma,
2022, 6(3): 273-287.
[32]Sonke JJ, Aznar M, Rasch C. Adaptive radiotherapy for anatomical
changes[J]. Semin Radiat Oncol, 2019, 29(3): 245-57.
[33]Dona Lemus OM, Cao MS, Cai B, et al. Adaptive radiotherapy: nextgeneration
radiotherapy[J]. Cancers, 2024, 16(6): 1206.
(编辑:余诗诗)