大豆异黄酮对幼年小鼠肝肾组织结构及抗氧化的影响






摘要:以3周龄C57BL/6小鼠为研究对象,分析大豆异黄酮(soybean isoflavones, SI)处理后肝肾组织形态、抗氧化和凋亡情况,探讨SI对幼年小鼠肝、肾发育的影响.结果表眀,随着SI剂量的增加,雌性小鼠体重增长百分比呈增加趋势(P<0.05),雄性小鼠体重增长百分比呈减少趋势(P<0.01).对雌性小鼠,SI处理提高了肝脏和肾脏的抗氧化损伤能力(P<0.05),减轻了肝脏和肾脏的组织损伤;对雄性小鼠,SI处理降低了肝脏抗氧化损伤的能力(P<0.01),但增加了肾脏抗氧化损伤能力(P<0.05);肝脏发生了病理性损伤,肾脏无组织损伤.研究结果提示幼年雄性个体摄入SI剂量需谨慎.
关键词:大豆异黄酮;幼年小鼠;肝肾;组织结构;抗氧化能力
中图分类号:Q 256""" 文献标志码:A""" 文章编号:1001-988Ⅹ(2025)01-0028-07
DOI:10.16783/j.cnki.nwnuz.2025.01.006
收稿日期:20240626;修改稿收到日期:20240908
基金项目:国家重点研发计划项目(2018YFC1003601)
作者简介:许文达(1996—),男,江苏无锡人,硕士研究生.主要研究方向为发育与生殖毒理.
Email:594994263@qq.com
*通信联系人,女,副教授,博士,硕士研究生导师.主要研究方向为男性生殖发育与毒理.
Email:shihui@ytu.edu.cn
Effects of soybean isoflavones on the tissue structure and
antioxidant activity of liver and kidney in young mice
XU Wen-da,CHEN Ya-ru,SONG Ying-lin,CHI Jing-yi,ZHAO Zhen-jun,SHI Hui
(College of Life Science,Yantai University,Yantai 264005,Shandong,China)
Abstract:The 3-week-old C57BL/6 mice were treated with soybean isoflavones (SI).The morphology,antioxidant capacity and apoptosis of liver and kidney tissues were investigated,and the effects of SI on liver and kidney development in young mice were explored.The results showed that the percentage of body weight increasing in female mice is increased in a dose of SI dependent manner(Plt;0.05),while male mice is decreased(Plt;0.01).In female mice,SI treatment increases the antioxidant ability of liver and kidney(Plt;0.05),and reduces the tissue damage of liver and kidney.In male mice,SI treatments decrease the antioxidant ability of liver(Plt;0.01),but increase the antioxidant ability of kidney(Plt;0.05).There is pathological damage to the liver,and no tissue damage to the kidney.It is suggested that young males should be cautious taking SI.
Key words:soybean isoflavones;young mice;liver and kidney;organizational structure;antioxidant capacity
大豆异黄酮(soybean isoflavones,SI)是从豆科植物中提取出来的一种次生代谢产物,与雌二醇有类似的结构,具有雌激素活性[1],应用广泛.SI具有调节血糖血脂[2]、抗氧化应激[3]、保护神经[4]、有效预防和治疗多种癌症[5]、促进皮肤创面愈合[6]等生物学功能.近年来,SI的研究多侧重于其对生物体的有利方面[7],随着对SI认知的增加,高剂量SI的摄入是否会给机体,特别是幼年个体带来危害还无从得知[8].
本研究以3周龄C57BL/6小鼠为研究对象,分析SI处理后肝肾组织形态、抗氧化和凋亡情况,探讨SI对幼年小鼠肝、肾发育的影响.
1" 材料与方法
1.1" 主要试剂与药品
SI原料药(批号C12916812)和Bouins 固定液(批号20140210)购自上海麦克林生化科技有限公司;吐温-80(批号M25HS179460)购自上海源叶生物科技有限公司;苏木精-伊红染液(批号011623230614)和TUNEL细胞凋亡检测试剂盒(批号112822230321)购自碧云天公司;微量丙二醛(MDA)测定试剂盒(批号20220602)、超氧化物歧化酶(SOD)测定试剂盒(批号20220529)、总抗氧化能力(T-AOC)测定试剂盒(批号20220528)和微量还原型谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒(批号20220603)购自南京建成生物研究所.
1.2" 实验动物
30只C57BL/6品系小鼠(2周龄, 体重8~10 g, 雌雄各半)购自山东济南朋悦实验动物繁育有限公司(实验动物生产许可证编号SCXK(鲁)20230002,实验动物使用许可证编号YTU20210203-2).小鼠于动物房分笼饲养,自由进食和饮水.动物房温度16~25 ℃,相对湿度45%~60%,每日光照12 h,黑暗12 h.本研究动物实验经烟台大学动物伦理委员会审查批准.
1.3" 实验方法
1.3.1" 分组
小鼠适应性饲养7 d后,根据人体推荐量,按空白对照、2倍、20倍的原则[9]设计实验组为对照组(1%吐温-80水溶液)、低剂量SI组(10 mg·kg-1)和高剂量SI组(100 mg·kg-1).每组10只小鼠,雌雄各半.SI使用1%吐温-80水溶液配制.灌胃前进行小鼠称重并记录,灌胃溶液的体积为1%小鼠的体重,每日灌胃一次,持续2周.
1.3.2" 小鼠体重测定
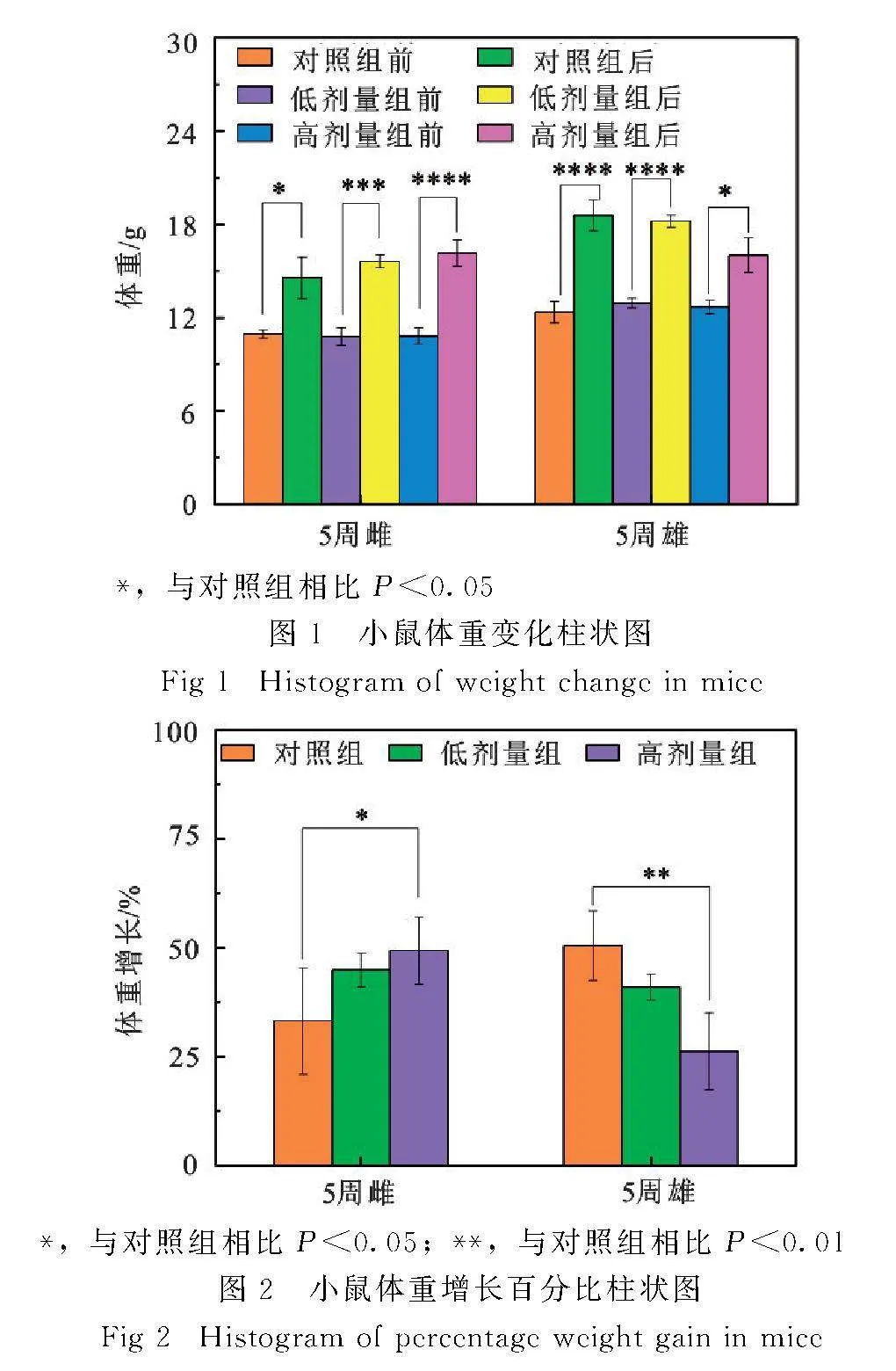
每日灌胃前和末次灌胃后称重并计算小鼠体重增长百分比.体重增长百分比=(末次灌胃后小鼠体重-首次灌胃前小鼠体重)/首次灌胃前小鼠体重×100%.
1.3.3" 小鼠脏器系数测定
将灌胃至5周龄的小鼠断颈处死,腹部消毒后取出肝脏和肾脏,剪去表面脂肪,经PBS清洗后用滤纸吸除表面水分,并称重.以小鼠解剖前最后一次称量的体重作为小鼠脏器体重数据,计算小鼠脏器系数.脏器系数=脏器重量/小鼠体重×100%.
1.3.4" 抗氧化能力测定
取适量肝脏和肾脏组织,与0.9%的NaCl溶液混合,制成10%组织匀浆,3 000 r·min-1离心10 min,保留上清液,使用相应试剂盒检测匀浆中MDA的含量以及SOD、GSH-Px和T-AOC的活性.
1.3.5" 病理学观察
取适量肝脏和肾脏组织,于Bouins 固定液中固定48 h,经冲洗、脱水、透明、浸蜡、包埋、切片、贴片、脱蜡、复水、HE染色后,光学显微镜下观察肝肾组织的病理学变化.在观察时选取至少6个视野对切片进行拍照.
1.3.6" 细胞凋亡检测
采用TUNEL法进行细胞凋亡检测.将石蜡切片进行脱蜡复水,滴加20 μg·mL-1不含DNA酶的蛋白酶K至完全覆盖切片,37 ℃下处理15 min,用PBS缓慢冲洗3次;然后向切片上滴加TUNEL检测液至完全覆盖切片,避光处理1 h,PBS冲洗3次;抗荧光淬灭剂封片后,用荧光显微镜观察.选取5个不同视野进行拍照,然后用LAS-X图像处理软件对图片进行分析,记录阳性细胞数量及细胞总量,计算细胞凋亡率.细胞凋亡率=(阳性细胞数/总细胞数)×100%.
1.3.7" 数据处理与分析
采用 SPSS 21 软件对实验数据进行统计分析,多组间比较采用单因素方差分析,两两比较采用LSD-t检验.
2" 结果
2.1" 小鼠体重
小鼠体重变化结果显示,雌雄体重都有增长的趋势(图1).雌性小鼠随着SI剂量的增加,其体重增长百分比显著增加(P<0.05);雄性小鼠随着SI剂量的增加,其体重增长百分比显著降低(P<0.01)(图2).
2.2" SI对肝脏发育的影响
2.2.1" 肝脏系数
与对照组相比,不同剂量SI组的雌、雄小鼠肝脏系数均无显著性差异(图3).
2.2.2" 肝脏抗氧化能力
与对照组相比,雌性小鼠高剂量SI组肝脏SOD活性显著降低(Plt;0.05),且低、高剂量SI组肝脏MDA含量显著减少(Plt;0.01).SI对雌性小鼠肝脏GSH-Px和T-AOC活性无显著影响(图4).
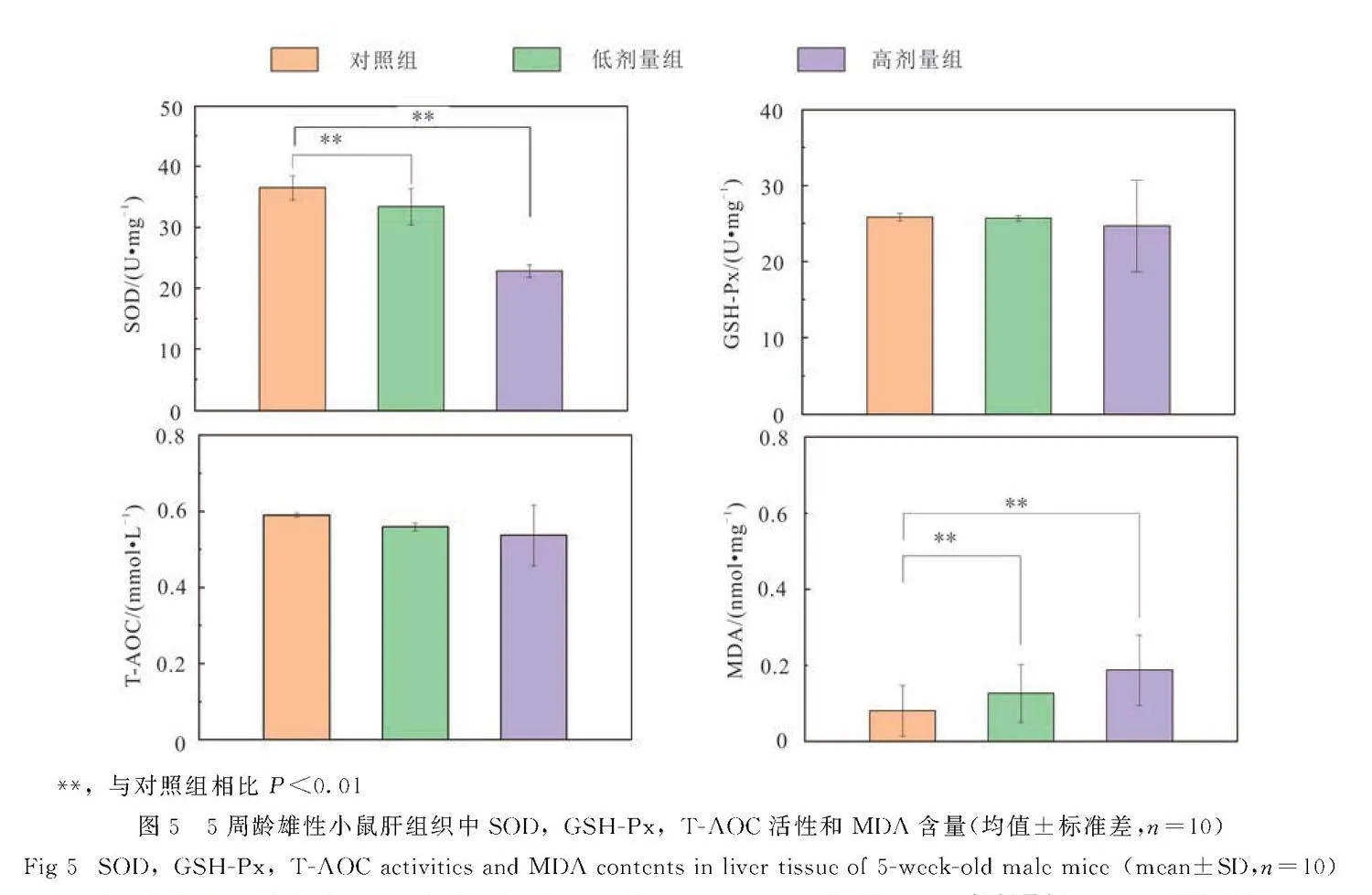
与对照组相比,雄性小鼠低、高剂量SI组肝脏SOD活性显著降低(Plt;0.05),且高剂量SI组肝脏MDA含量显著增加(Plt;0.05).SI对雄性小鼠肝脏GSH-Px和T-AOC活性无显著影响(图5).
2.2.3" 肝脏的病理学变化
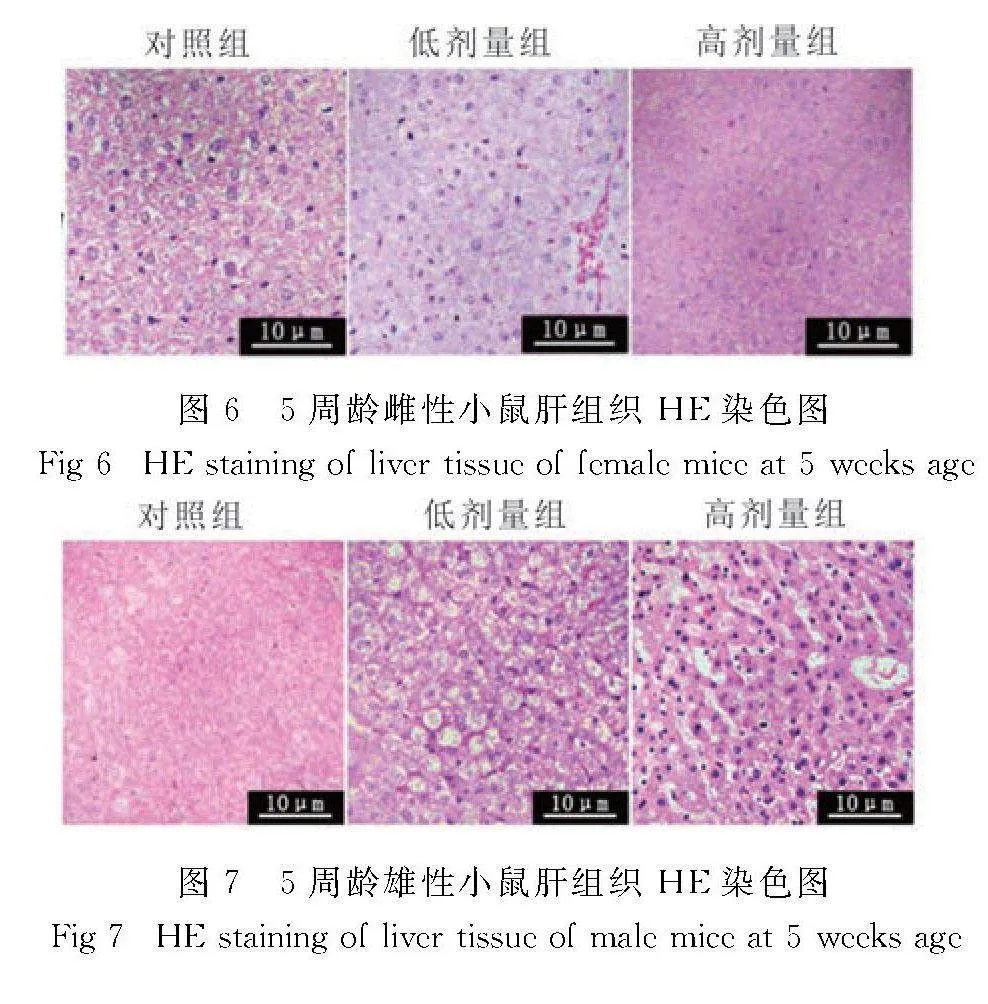
与对照组相比,SI处理组雌性小鼠肝脏无明显病理变化(图6).
与对照组相比,SI处理组雄性小鼠肝脏细胞索排列紊乱无序,存在炎性细胞浸润的现象;且高剂量SI组肝脏细胞出现空泡化、双核化、核固缩等现象(图7).
2.2.4" 肝脏组织细胞凋亡情况
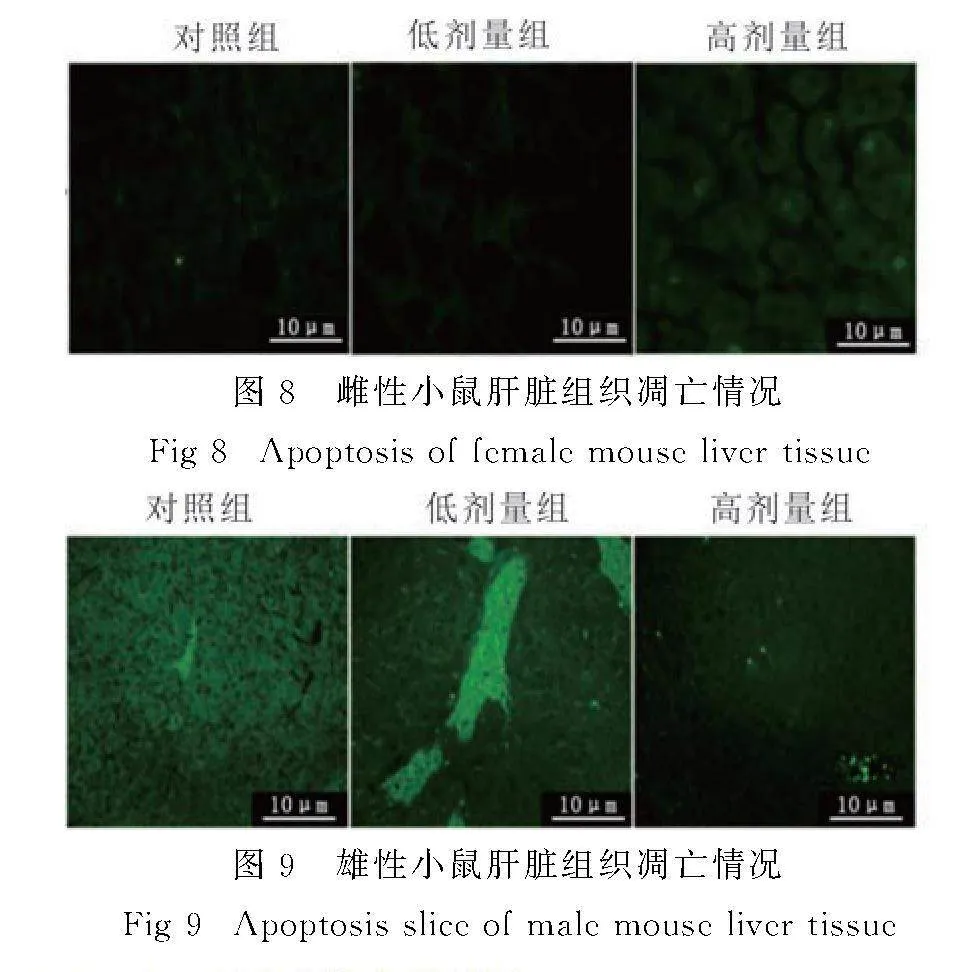
与对照组相比,SI处理组雌性小鼠肝脏无明显细胞凋亡(图8),SI处理组雄性小鼠肝脏出现少量凋亡细胞(图9).
2.3" SI对肾脏发育的影响
2.3.1" 肾脏系数" 与对照组相比,高剂量、低剂量SI组的雌、雄小鼠肾系数均无显著性差异(图10).
2.3.2" 肾脏抗氧化能力
与对照组相比,雌性小鼠低剂量、高SI剂量组的肾脏SOD活性显著下降(Plt;0.05),GSH-Px活性显著增加(Plt;0.05),高剂量SI组的MDA含量显著减少(Plt;0.05).SI对雌性小鼠肾脏T-AOC活性无显著影响(图11).
与对照组相比,雄性小鼠低、高SI剂量组的肾脏SOD活性显著下降(Plt;0.05),T-AOC活性显著增加(Plt;0.05),MDA含量显著减少(Plt;0.05).SI对雄性小鼠肾脏GSH-Px活性无显著影响(图12).
2.3.3" 肾脏的病理学变化
与对照组相比,雌雄小鼠低、高剂量SI组肾脏组织都没有显著的病变(图13,图14).
2.3.4" 肾脏组织细胞凋亡情况
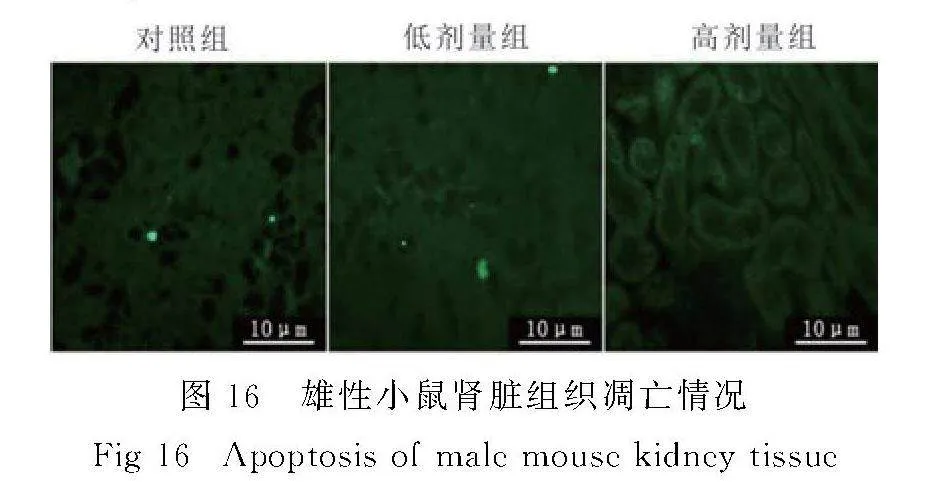
与对照组相比,雌雄SI处理组小鼠肾脏组织都未见或存在个别凋亡细胞(图15,图16).
3" 讨论
大豆的异黄酮含量约为1.28 mg·g-1,对于常
见的豆腐和豆乳产品来说,异黄酮含量分别为27.74和9.65 mg·100g-1[10].目前,亚洲国家的异黄酮摄入量异常高,中国、日本和韩国每天的大豆异黄酮摄入量为25~50 mg,而美国和欧洲国家的平均日摄入量低于2 mg[12-13].在中国,SI的摄入量因地理区域的不同也有很大的差异,且政府机构或卫生组织并没有官方的SI摄入量建议[14].幼年期是人类发育过程的重要阶段,SI的摄入是否会对幼年个体的发育产生影响引起了人们的关注.
赵文斌[15]发现,在猪生长和育肥期间,尤其是生长期,SI明显促进猪的增重.熊昕宜等[16]研究发现,对肥胖大鼠进行大豆异黄酮干预后,虽然血清中总胆固醇(TC)、低密度脂蛋白(LDL)含量明显降低,但体重仍在增加.SI可以通过调节与生长有关的激素水平、改善物质的代谢来改善生长性能,但其对生长性能的影响依赖剂量[17].本研究发现高剂量的SI有助于雌性小鼠体重的增长,但会抑制雄性小鼠体重的增长百分比.在叔丁醇对小鼠甲状腺影响的研究中,也提到损伤在雌雄小鼠间存在差异,结合本研究结果,提示性别差异在今后研究中也是一个不容忽视的问题[18].
刘思彤等[19]用SI对幼年小鼠进行灌胃,发现
SI处理组肝脏的SOD,GSH-Px,CAT活性上升,
而MDA含量降低,表明SI可通过清除自由基,剂量组
阻断自由基连锁反应,延缓肝脏的衰老.杨潇[20]
也发现,SI具有抗肿瘤作用,且SI 预防肝细胞癌变的作用机制与其抗氧化应激和清除氧自由基有关.陈苹等[21]研究证明,SI可以促进大鼠肝脏脂滴的清除,从而减少脂滴的形成,降低脂肪的沉积.本研究发现SI可以显著降低雌性小鼠肝脏的MDA含量,但是显著增加雄性小鼠肝脏的MDA含量.同时HE染色和细胞凋亡检测也显示SI处理组雌性小鼠肝脏损伤较轻,而雄性小鼠肝脏损伤严重,即SI对幼龄小鼠肝脏的抗氧化保护作用也存在性别差异.值得注意的是,SI处理降低了雌性小鼠肝脏的SOD活性,而对雌雄小鼠肝脏GSH-Px和T-AOC活性均无显著影响.提示SI对小鼠肝脏的抗氧化保护作用可能是通过调节其他抗氧化机制实现.
SI属于低毒性物质,如果摄入少量SI,机体可以自行排出,但SI具有蓄积毒性,所以如果长期摄入大量SI,将对人体各组织和器官产生危害[22].SI也可以用于治疗急性肾损伤、肾癌、肾病综合征等多种肾脏疾病[23].本研究发现适量SI摄入对幼龄雌雄小鼠肾脏均具有抗氧化损伤作用.
4" 结束语
SI对雌性小鼠肝脏和肾脏、雄性小鼠肾脏有抗氧化损伤作用,但会增加雄性小鼠肝脏的氧化损伤.本研究结果提示,幼年雄性个体摄入SI需谨慎.
参考文献:
[1]" XIE D,PAN Y,CHEN J,et al.Association of genetic variants in soy isoflavones metabolism-related genes with lung cancer risk[J].Gene,2024:927148732.
[2]" HAS M K,MARKIEWICZ M D,KOZIARSKA S D, et al.The influence of soy isoflavones and soy isoflavones with inulin on kidney morphology,fatty acids,and associated parameters in rats with and without induced diabetes type 2[J].Int J Mol Sci,2024,25(10):5418.
[3]" SHAO Y,XU J,WANG M,et al.Preliminary results on the effects of soybean isoflavones on growth performance and ruminal microbiota in fattening goats[J].Animals:An Open Access J From MDPI,2024,14(8):1188.
[4]" 张珍,韩领,夏晓洋,等.大豆异黄酮神经保护作用的研究进展[J].中国食物与营养,2019,25(1):53.
[5]" YAMAMOTO M,TANAKA Y,TAKEDA R,et al.Soy isoflavone genistein attenuates the efficacy of immune checkpoint therapy in C57BL/6 mice inoculated with B16F1 melanoma and a high PD-L1 expression level reflects tumor resistance[J].J Clin Biochem Nutrit,2024,74(1):57.
[6]" XIAOYONG P,YU Z,YUE W,et al.Genistein, a soybean isoflavone,promotes wound healing by enhancing endothelial progenitor cell mobilization in rats with hemorrhagic shock[J].Adv Biol,2023,7(4):e2200236.
[7]" ARIYANI W,KOIBUCHI N.The effect of soy isoflavones in brain development:The emerging role of multiple signaling pathways and future perspectives[J].Endocrine,2024,71:317.
[8]" SOUKUP S T,ENGELBERT A K,WATZL" B,et al.Microbial metabolism of the soy isoflavones daidzein and genistein in postmenopausal women:Human intervention study reveals new metabotypes[J].Nutrients,2023,15(10):2352.
[9]" 郭静,周凯,蔡冬青.大豆异黄酮对大鼠的体液免疫调节作用[J].中西医结合心血管病电子杂志,2020,8(29):84.
[10]" 贾宗平,袁静,俞诗源,等.山丹黄参多糖对四氯化碳致急性损伤小鼠肝组织Caspase-3和TNF-α表达的影响[J].西北师范大学学报(自然科学版),2016,52(3):96.
[11]" 白兴梁.不同品种大豆及发芽过程中异黄酮比较与抗氧化性研究[D].南京:南京财经大学,2012.
[12]" PABICH M,MATERSKA M.Biological effect of soy isoflavones in the prevention of civilization diseases[J].Nutrients,2019,11(7):1660.
[13]" 宛超,徐海滨,刘珊,等.中国大豆异黄酮保健食品的功能和安全性研究及分析[J]. 中国食品卫生杂志,2008,20(5):400.
[14]" MESSINA M,MESSINA V,NAGATA C.Perspective:Observational studies involving low soy intake populations have limited ability For providing insight into the health effects of soybean isoflavones[J].Adv Nutrit(Bethes Md),2024,15(4):100210.
[15]" 赵文斌.大豆异黄酮在猪禽养殖中的应用[J].吉林畜牧兽医,2023,44(1):113.
[16]" 熊昕宜,许泽玉,何念佳,等.大豆异黄酮干预肥胖大鼠肝氧化应激及炎症反应[J].浙江农业学报,2022,34(5):942.
[17]" XIANG L,RUIPING S,QUANWEI L,et al.Effects of dietary supplementation with dandelion tannins or soybean isoflavones on growth performance,antioxidant function,intestinal morphology,and microbiota composition in wenchang chickens[J].Front Vet Sci,2023,9:91073659.
[18]" 董思林,赵振军,石慧,等.叔丁醇暴露对HSPA1L敲除型雄性小鼠甲状腺的影响[J].西北师范大学学报(自然科学版),2024,60(3):48.
[19]" 刘思彤,刘亚辉,尹学哲,等.大豆异黄酮和维生素E提高衰老小鼠肝脏抗氧化能力比较[J].大豆科学,2020,39(5):797.
[20]" 杨潇,周晓,孔连宝.大豆异黄酮防治肝癌作用机制研究进展[J].医学综述,2020,26(17):3406.
[21]" 陈苹,李立科,陈晓林,等.大豆异黄酮对大鼠肝脏脂肪酸代谢的影响[J].四川农业大学学报,2018,36(2):267.
[22] "许文达,董思林,张晗,等.大豆异黄酮对幼年小鼠生殖发育的影响[J].中国药房,2024,35(6):678.
[23]" PENG Q,LI Y,SHANG J,et al.Effects of genistein on common kidney diseases[J].Nutrients,2022,14(18):3768.
(责任编辑" 陆泉芳)

