6种脱毒剂对9608香菇菌丝生长及LeV-HKB病毒相对表达量的影响



摘" " 要:为了解决9608香菇种植出现的种性退化问题,以PDA培养基为对照,研究6种脱毒剂处理对香菇菌丝生长速度、漆酶和羧甲基纤维素酶活性及LeV-HKB病毒含量的影响。结果表明,与对照相比,病毒唑、1.5片黄连素、1片黄连素、金银花、香菇多糖处理的香菇菌丝生长速度分别提高9.33%、1.80%、4.76%、2.44%、0.39%,而卡那霉素和氨苄青霉素处理的香菇菌丝生长速度分别降低了5.26%和14.62%;与对照相比,脱毒处理均提高了菌丝漆酶活性;病毒唑、1.5片黄连素、1片黄连素、金银花以及香菇多糖处理后的羧甲基纤维素酶活性比对照分别提高了39.19%、31.08%、11.49%、10.81%、2.70%,卡那霉素和氨苄青霉素处理后的羧甲基纤维素酶活性比对照分别降低了22.97%、0.68%。所有处理中,菌丝生长速度与羧甲基纤维素酶和漆酶活性,均为病毒唑处理提高幅度最大。不同培养基生长菌丝的RT-PCR与qRT-PCR检测结果表明,病毒唑处理基本不含LeV-HKB病毒。综上,病毒唑处理可显著提高香菇菌丝生长速度及羧甲基纤维素酶和漆酶活性,有效清除LeV-HKB病毒,该处理方式可为9608香菇优质生产提供科学支撑。
关键词:香菇;脱毒剂;酶活性;RT-PCR ;实时荧光定量PCR
中图分类号:S646.1+2 文献标志码:A 文章编号:1673-2871(2025)01-089-06
Effects of six detoxification agents on the growth of mycelium and relative expression level of LeV-HKB virus in 9608 shiitake mushroom
BAO Dandan1, LIU Ya’nan1, DUAN Nini1, 2, ZHANG Zhifeng1, 2, ZHANG Yingjun1, 2, LU Yunfeng1
(1. College of Life Sciences, Nanyang Normal University, Nanyang 473061, Henan, China; 2. Henan Engineering Technology Research Center for Mushroom-based Foods, Nanyang 473061, Henan, China)
Abstract: To address the issue of varietal degeneration in the cultivation of the 9608 strain of shiitake mushrooms, a study was conducted using PDA medium as a control to investigate the effects of six different detoxifying agents on the growth rate of mycelium, as well as the activity of laccase and carboxymethyl cellulase, and the content of the LeV-HKB virus. The results indicated that compared to the control, the growth rate of mycelium treated with viruszole, 1.5 tablets of berberine, 1 tablet of berberine, honeysuckle, and shiitake polysaccharides increased by 9.33%, 1.80%, 4.76%, 2.44%, and 0.39%, respectively. In contrast, treatments with kanamycin and ampicillin resulted in decreases in mycelial growth rate of 5.26% and 14.62%, respectively. Furthermore, the enzymatic activity of laccase in the mycelium increased following detoxification treatment compared to the control. The activity of carboxymethyl cellulase after treatment with viruszole, 1.5 tablets of berberine, 1 tablet of berberine, honeysuckle, and shiitake polysaccharides increased by 39.19%, 31.08%, 11.49%, 10.81%, and 2.70%, respectively, while treatments with kanamycin and ampicillin resulted in decreases of 22.97% and 0.68%, respectively. Among all treatments, the greatest enhancement in both mycelial growth rate and carboxymethyl cellulase and laccase activity were observed with viruszole treatment. RT-PCR and qRT-PCR analyses of mycelium grown on different media revealed that viruszole treatment essentially eliminated the LeV-HKB virus. In conclusion, viruszole treatment significantly enhances the growth rate of shiitake mycelium, increases the activity of carboxymethyl cellulase and laccase, and effectively eradicates the LeV-HKB virus, providing a scientific basis for the high-quality production of the 9608 strain of shiitake mushrooms.
Key words: Shiitake mushroom; Detoxification agents; Enzyme activities; RT-PCR; qRT-PCR
香菇富含营养物质和生物活性物质,如香菇多糖、多酚、功能氨基酸等,具有增强免疫力、抗肿瘤和其他健康益处的功能,具有重要的经济和药用价值,在亚洲国家,特别是中国、韩国和日本广泛种植[1-3]。
河南省西峡县是中国香菇的主要产地,年产香菇超30万t,9608品种自推广以来,因其适应性强、产量高、菇性好等优点,成为西峡县的主栽香菇品种[4-5]。随着香菇种植规模的逐年扩大,香菇病毒问题日益凸显[6-7],引发了重大经济损失,影响社会稳定[8]。中国香菇种质资源中最常见的病毒有Lentinula edodes partitivirus 1 (LePV1)和L. edodes mycovirus HKB (LeV-HKB)2种[9-10],LePV1和LeV-HKB能单一或复合感染香菇,且后者能显著促进前者基因的表达[11]。RT-PCR 是检测香菇病毒存在的常用技术[6,12],经检测9608香菇品种仅含有LeV-HKB[9]。
研究发现,脱毒处理后的香菇具有更高的菌丝生长速率、菌落密度、酶活性和生物量[6-7,12]。香菇常用的脱毒方法有原生质体再生脱毒法、单孢杂交法、菌丝体破裂法、断桥式脱毒法以及脱毒试剂法[6,12-13],相较其他方法,脱毒试剂法不需要复杂的仪器设备,制备脱毒菌株用时短,简便易行,效率高,优势明显。病毒唑(利巴韦林)对人和动物体内的多种病毒具有良好的治疗作用[14],已成功应用于香菇菌株(L856、L135和森源-1)脱毒[11]。黄连素抑制了细胞中HSV-1病毒的活性[15],金银花提取物在抗烟草花叶病毒方面具有良好防效[16],氨苄青霉素和卡那霉素 2 种抗生素能阻碍细菌细胞壁的合成[17],香菇多糖可以阻止细菌病毒在机体内复制[18]。因此,上述6种试剂有望用于香菇病毒的脱毒处理。
鉴于目前尚未有关于9608香菇脱毒的相关报道,试验以常规PDA培养基为对照,研究病毒唑、黄连素、金银花、香菇多糖、氨苄青霉素和卡那霉素等6种脱毒剂对9608香菇菌丝生长速度、漆酶和羧甲基纤维素酶活性及LeV-HKB病毒含量的影响,以期为食用菌菌株脱毒复壮提供借鉴和参考。
1 材料与方法
1.1 材料
试验于2024年1—6月在河南省南阳师范学院菌类食品工程研究中心进行。供试菌株为9608香菇,由河南省南阳市菌类食品工程研究中心提供。
1.2 试验设计
采用随机区组试验,共设置8个处理,每个处理3次重复。对照组为常规PDA培养基,pH 6~7。除特别说明外,试验组(脱毒培养基)按表1所示,在分装有250 mL PDA培养基的三角瓶中添加相应比例的脱毒剂,调节pH至6~7,高压灭菌,55 ℃时倒入脱毒铁盒中,室温冷却凝固。其中黄连素培养基(2个梯度):分别加入1.5片(150 mg)、1片(100 mg)的盐酸小檗碱片;金银花培养基:称取200 g土豆和50 g金银花,纱布包裹放入锅中煮沸20 min,后续步骤与配置常规PDA相同;病毒唑培养基:加入25 mg利巴韦林药片配置终质量浓度为100 μg·mL-1;香菇多糖培养基:加入25 g香菇多糖配置终浓度(φ)为10%;卡那霉素培养基与氨苄青霉素培养基:在常规PDA冷却至55 ℃时,分别加入质量浓度为100 μg·mL-1的卡那霉素和氨苄青霉素各2.5 mL,摇匀后倒入脱毒铁盒。
菌丝制备:挑取米粒大小的菌块接入普通平板中,在25 ℃下培养12 d,然后切取平皿中生长旺盛的菌丝尖端2 mm接入PDA培养基和脱毒培养基上,25 ℃恒温培养箱培养。将脱毒铁盒中菌丝块(直径6 mm)分别接入常规PDA培养基上培养12 d。
1.3 测定指标及方法
1.3.1 香菇菌丝生长速度测定 采用十字交叉法测量菌落半径,计算菌落半径(mm)与生长时间(d)的比值(菌丝生长速度)。
1.3.2 漆酶、羧甲基纤维素酶活性测定 粗酶液的制备:待香菇菌丝生长12 d后,取0.1 g菌丝研磨,然后加25 mL ddH2O,40 ℃水浴中浸提2 h,5000 r·min-1、4 ℃下离心10 min,上清液为菌丝粗酶液。采用 DNS 试剂法测定羧甲基纤维素酶活性,采用邻联甲苯胺溶液法测定漆酶活性,以沸水灭活的粗酶液作为对照[19]。酶活性单位定义为 1 min 能转化 1 μmol 底物的酶量,即 1 个酶活性单位(U)。
1.3.3 香菇病毒RT-PCR检测 将待检香菇菌株在PDA培养基上25 ℃ 暗培养15 d,用刮铲收集菌丝体,使用E.Z.N.A.® Plant RNA 提取试剂盒提取香菇菌丝体总RNA。设计引物(表2)对香菇病毒LeV-HKB的特异性区域进行扩增。根据Reverse Transcription Kit(with gDNase)反转录试剂盒说明书合成cDNA,反应条件:25 ℃ 10 min,55 ℃ 15 min,85 ℃ 5 min。
将反转录的样品通过RT-PCR检测病毒,反应总体系22 μL,包括0.9 μL cDNA,正反向引物各1 μL,11 μL enzyme Mix,8.1 μL DEPC处理水。香菇病毒定性分析的反应条件:95 ℃ 5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共30个循环。RT-PCR 反应产物经1.2%琼脂糖凝胶电泳,于凝胶成像系统检测RT-PCR结果[10]。
1.3.4 香菇病毒qRT-PCR定量检测 根据病毒基因组序列设计病毒特异性qRT-PCR检测引物(表3)。反应体系为10 μL:AceQTM qPCR SYBR Green Master Mix 5 μL、引物(0.25 μmol·L-1)各0.5 μL、cDNA 2 μL、ddH2O 2 μL。反应条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。每个qRT-PCR反应重复3次。经qRT-PCR反应所得循环阈值即Ct值,采用2-△△Ct的方法计算各组中病毒的相对表达量[20]。
1.4 数据处理
采用Excel 2010处理数据和作图,采用SPSS 19.0进行差异显著性分析。采用Norm Finder、 Graph Pad Prism 8.0分析香菇病毒定性和定量检测结果。
2 结果与分析
2.1 6种脱毒剂处理对香菇菌丝生长的影响
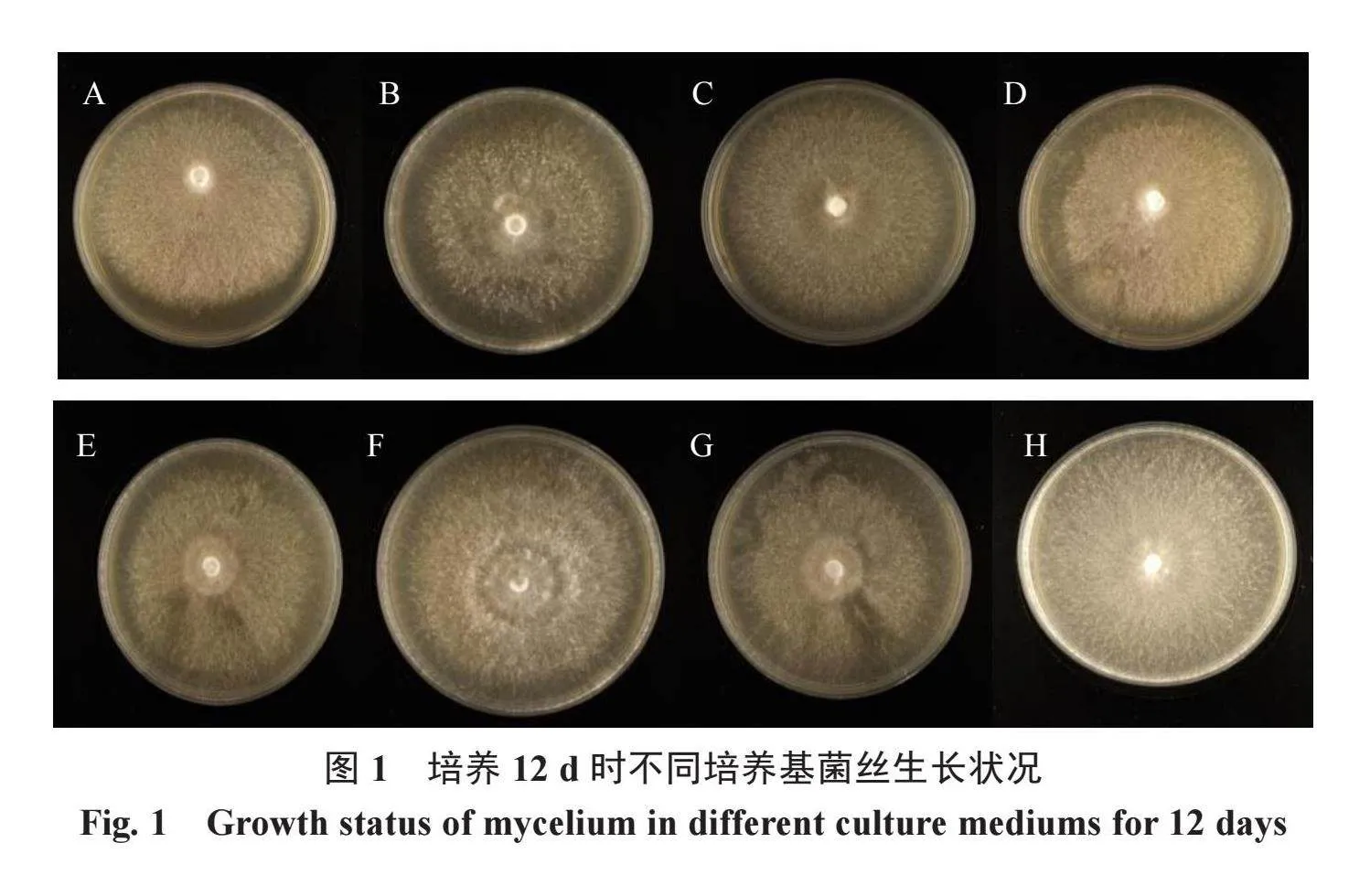
由图1可知,不同脱毒剂处理后,香菇菌丝均可生长,其中在病毒唑培养基上生长较快,第12 天菌丝已经基本长满平板且菌丝厚密。
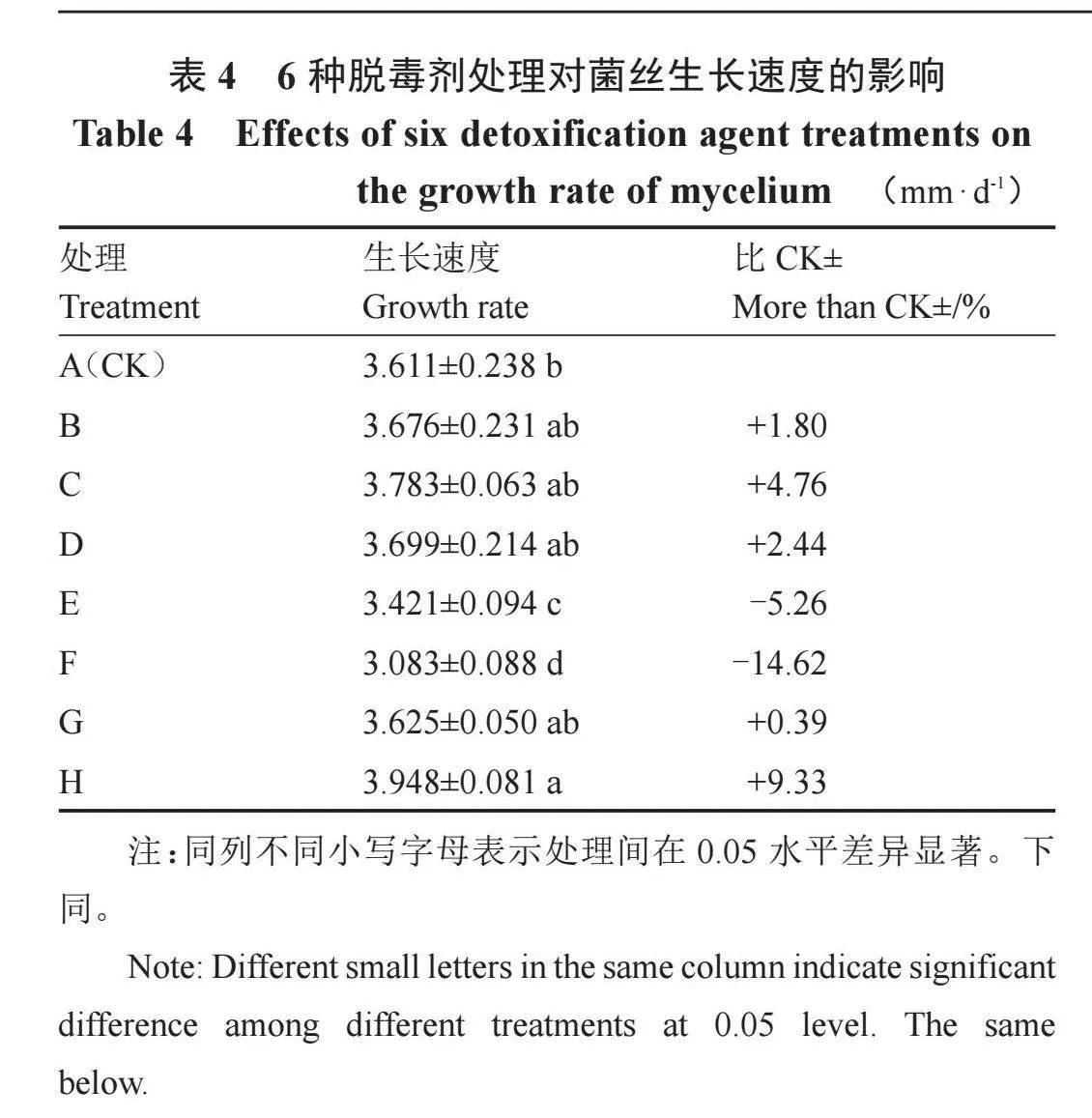
2.2 6种脱毒剂处理对香菇菌丝生长速度的影响
由表4可知,与对照相比,脱毒剂处理能显著影响香菇菌丝生长速度。病毒唑、1.5片黄连素、1片黄连素、金银花、香菇多糖处理的菌丝生长速度分别比常规PDA提高9.33%、1.80%、4.76%、2.44%和0.39%,其中病毒唑处理与对照呈显著差异;卡那霉素与氨苄青霉素处理的菌丝生长速度则比常规PDA分别显著降低5.26%和14.62%。以上结果表明,选择合适的脱毒试剂能有效提高香菇菌丝的生长速度。
2.3 6种脱毒剂处理对香菇菌丝酶活性的影响
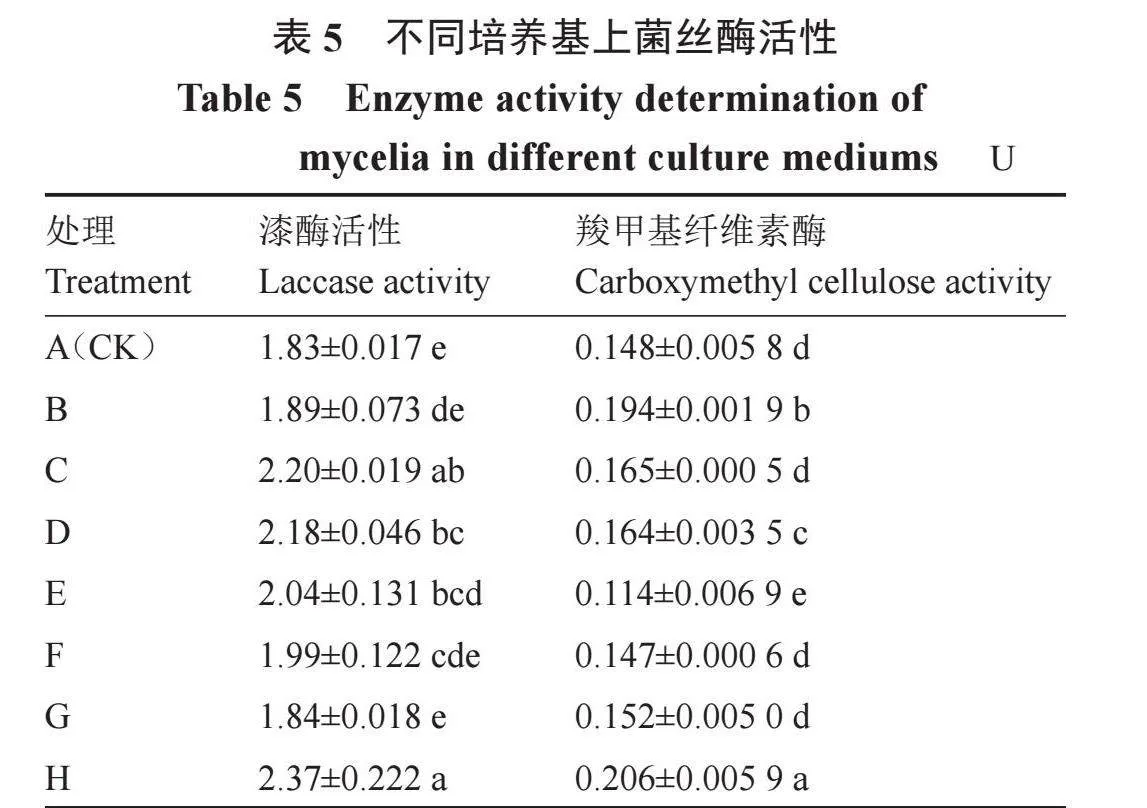
如表5所示,与常规PDA相比,不同脱毒剂处理的漆酶活性均有不同程度的提高,病毒唑、1.5片黄连素、1片黄连素、金银花、卡那霉素、氨苄青霉素和香菇多糖处理分别提高29.51%、3.28%、20.22%、19.12%、11.48%、8.74%和0.55%。与常规PDA相比,不同脱毒剂处理的羧甲基纤维酶活性有升有降,病毒唑、1.5片黄连素、1片黄连素、金银花和香菇多糖处理分别提高39.19%、31.08%、11.49%、10.81%、2.70%;卡那霉素和氨苄青霉素处理与常规PDA相比分别降低22.97%和0.68%。以上结果表明,合适的脱毒剂处理能显著提高香菇菌株的漆酶和羧甲基纤维素酶活性。
2.4 6种脱毒剂处理对香菇病毒相对表达量的影响
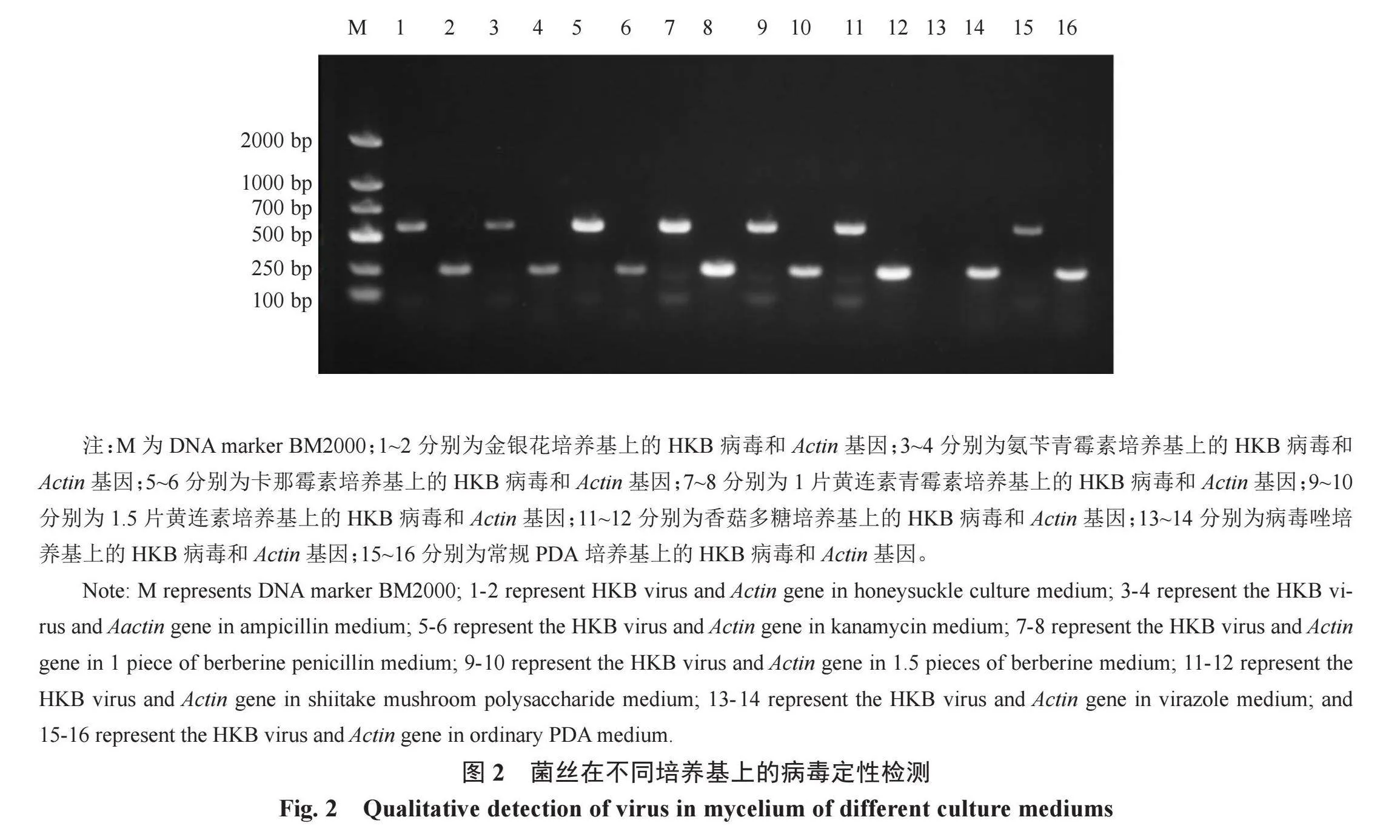
2.4.1 香菇HKB病毒定性检测分析 通过琼脂糖凝胶电泳检测香菇HKB病毒,如图2所示。扩增条带清晰唯一,扩增产物大小与目标条带一致,所有培养基上培养的菌丝均扩增出Actin基因(250 bp)。除病毒唑培养基外,其余培养基培养的菌丝均扩增出HKB病毒(589 bp),说明病毒唑处理能有效清除9608香菇的LeV-HKB病毒。
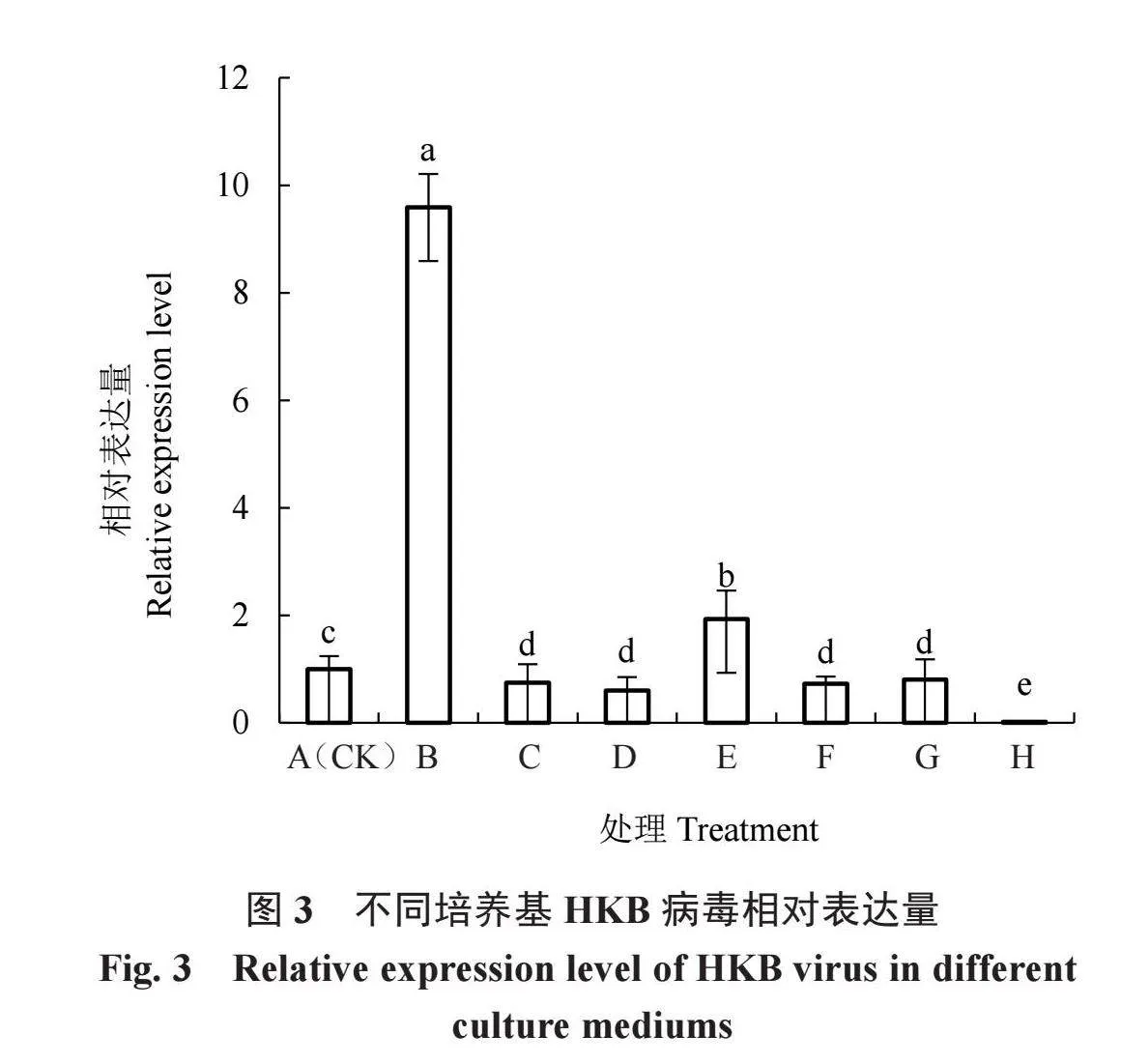
2.4.2 香菇HKB病毒定量检测分析 qRT-PCR检测结果如图3所示,8组处理之间存在显著差异。与常规PDA相比,黄连素1.5片和卡那青霉素处理显著提高了病毒相对表达量;香菇多糖、1片黄连素、氨苄青霉素和金银花处理后,病毒相对表达量显著降低;病毒唑处理后,病毒相对表达量基本为0,相比常规PDA,病毒相对表达量显著降低了98.00%。以上结果表明,病毒唑(利巴韦林)在6种脱毒剂中抑制病毒复制效果最佳。
3 讨论与结论
随着食用菌产业的发展,香菇栽培规模逐年扩大,香菇病毒问题日益凸显[2]。香菇通过脱毒之后的生长速度和酶活性高于未脱毒对照,可能与以下因素有关。香茹属于木腐类真菌,其菌丝体分解、腐蚀木材,将木质素、半纤维素、纤维素等转化成菌丝体的营养成分[22]。香菇能产生多酚氧化酶类,其中以漆酶最为重要,可把木材中不溶性的芳香类聚合物成分转化为水溶性含有苯环的简单化合物,苯环最后被破坏产生有机小分子化合物,被菌丝体加以吸收[23-25]。菌丝分解纤维素、木质素的能力也反映了菌丝的生长速度[26-28]。感染病毒的香菇菌丝活性衰弱,菌丝纤维素酶及木质素酶等酶活性明显下降,分解培养料中纤维素、半纤维素和木质素的能力不足[8]。因此,脱除病毒能有效提升菌丝活力和分解培养料的相应酶活性。本试验中,通过脱毒试剂法对 9608香菇菌种进行脱毒处理,RT-PCR与qRT-PCR检测结果表明,1片黄连素、金银花、氨苄青霉素处理后能显著降低香菇HKB病毒相对表达量;病毒唑处理能基本清除HKB病毒,这与Sun等[12]通过利巴韦林法消除LeV-HKB病毒的研究结果相同。
不同脱毒方法得到的脱毒效果可能相同。李京[22]研究表明,香菇经过原生质体再生脱毒后菌丝生长茂密,生长速度明显高于未脱毒对照,且能有效去除香菇dsRNA病毒。通过对脱毒菌株与带病毒菌株的研究,脱毒菌株的漆酶和羧甲基纤维素酶活性明显高于带病毒菌株,这与杨清香等[29]的结果相同。本试验结果表明,病毒唑、1.5片黄连素、1片黄连素、金银花、香菇多糖处理后,生长速度、漆酶和羧甲基纤维素酶活性均高于常规PDA,其中病毒唑处理的菌丝生长速度、漆酶和羧甲基纤维素酶活性均高于其他处理剂。病毒唑脱毒作为一种简单、方便、容易实施的脱毒方法,能够解决香菇菌株容易出现的菌种退化、香菇病毒病等问题。
综上所述,9608香菇经病毒唑、1.5片黄连素、1片黄连素、金银花、香菇多糖脱毒处理后,菌丝生长速度、漆酶和羧甲基纤维素酶活性都有不同程度的提高。相较于其他脱毒剂,病毒唑能显著提高香菇菌丝生长速度及羧甲基纤维素酶和漆酶活性,清除LeV-HKB病毒的能力最强。
参考文献
[1] DAI X S,STANILK J M,ROWE C A,et al.Consuming Lentinula edodes(Shiitake)mushrooms daily improves human immunity:A randomized dietary intervention in healthy young adults[J].Journal of the American College of Nutrition,2015,34(6):478-487.
[2] WU F,ZHOU L W,YANG Z L,et al.Resource diversity of Chinese macrofungi:Edible,medicinal and poisonous species[J].Fungal Diversity,2019,98(1):1-76.
[3] ARUNACHALAM K,SASIDHARAN S P,YANG X F.A concise review of mushrooms antiviral and immunomodulatory properties that may combat against COVID-19[J].Food Chemistry Advances,2022,1:100023.
[4] 谢清超,邹吉录.9608香菇菌株特性[J].中国食用菌,2002(1):25-26.
[5] 马玮超,刘文静,孙玉镯.外源细胞分裂素对香菇生长和品质的影响[J].北方园艺,2021(17):131-134.
[6] KIM J M,SONG H Y,CHOI H J,et al.Changes in the mycovirus(Lev)titer and viral effect on the vegetative growth of the edible mushroom Lentinula edodes[J].Virus Research,2015,197:8-12.
[7] 吴小平,王丽,谢宝贵,等.香菇菌株的脱毒研究[J].中国农学通报,2009,25(24):44-49.
[8] 应国华,吕明亮,薛振文,等.香菇病毒病综合防控技术[J].食药用菌,2012,20(2):114-116.
[9] 王锦杰,郭孟配,孙艺嘉,等.中国香菇种质资源中两种主要病毒的携带情况检测[J].菌物学报,2018,37(4):522-537.
[10] 孙艺嘉,郭孟配,王锦杰,等.中国香菇种质资源中主要真菌病毒的多重RT-PCR 检测技术[J].微生物学通报,2019,46(6):1381-1389.
[11] 郭孟配,边银丙,王锦杰,等.香菇dsRNA病毒的分离鉴定及致病性初步研究[C]//中国菌物学会2016年学术年会论文摘要集,2016.
[12] SUN Y J,GUO M P,WANG J J,et al.Curing two predominant viruses occurring in Lentinula edodes by chemotherapy and mycelial fragmentation methods[J].Journal of Virological Methods,2022,300:114370.
[13] 夏伟.平菇病毒dsRNA检测、脱毒及传播途径的研究[D].福州:福建农林大学,2011.
[14] 吕洁.基于酰基环丙烷和病毒唑的手性分子合成及其生物活性研究[D].贵阳:贵州大学,2023.
[15] 崔玉娟,胡丹东,杨颖丽,等.黄连素对HSV-1病毒感染HEp-2细胞的活性影响及分子机制[J].中国药理学通报,2022,38(3):387-393.
[16] 彭冠云.抗烟草花叶病毒物质筛选及作用机理初步研究[D].长沙:湖南农业大学,2006.
[17] 孙建春.苹果品种(系)脱毒原种苗获得的关键环节及流程[D].陕西杨凌:西北农林科技大学,2019.
[18] 曹旎,苏家恩,周彦夷,等.烟草番茄斑萎病防治药剂筛选[J].农业科学与技术(英文版),2023,24(4):47-52.
[19] 闵腾辉,杨中敏,玛依热·麦图隼,等.LED光质配比对香菇菌丝生长及转色期生理活性的影响[J].农业工程学报,2024,40(9):219-226.
[20] 胡延如,邵玉强,陈浩澜,等.糙皮侧耳热胁迫背景下RT-qPCR内参基因的筛选[J].菌物研究,2023,21(增刊1):200-206.
[21] 郭杰.香菇dsRNA病毒RT-PCR检测和传播途径的研究[D].福州:福建农林大学,2015.
[22] 李京.香菇dsRNA病毒脱毒研究[D].福州:福建农林大学,2013.
[23] 王丽.香菇病毒的检测与脱毒研究[D].福州:福建农林大学,2009.
[24] 张宇婷,宋明珠,王雪峰,等.侧耳木霉产漆酶酶活力测定和脱色方法[J].吉林农业大学学报,2021,43(3):317-323.
[25] 刘登辉,胡闽,赵小斌,等.一株高产纤维素酶菌株的分离及鉴定[J].武汉工程大学学报,2022,44(6):653-657.
[26] 邵坤.外源激素对茶树菇液体培养胞外酶活性影响的研究[D].重庆:西南大学,2008.
[27] 申慧彦.花脸蘑菌丝生物学特性及其胞外酶活性的研究[D].重庆:西南农业大学,2004.
[28] 牟艳红.我国主栽银耳配对香灰菌β-tubulin序列的遗传鉴定及生物学特性研究[D].四川雅安:四川农业大学,2012.
[29] 杨清香,王栋,陈建军,等.香菇病毒对香菇菌丝生长和漆酶活性的影响[J].西北农业学报,2008,17(2):243-246.

