成年雄性毛白杨组培幼化技术研究
摘 要:【目的】毛白杨以无性繁殖为主,而无性繁殖材料往往存在老化现象,严重影响苗木质量,研究繁殖材料的幼化技术对于改善苗木质量,促进无性林业发展有重要意义。【方法】以北京大兴区站上村的200年生雄性毛白杨为对象,取其根萌条为繁殖材料,探索2种灭菌试剂处理条件下,不同灭菌时间对外植体成活与生长的影响,同时在MS培养基中设置不同激素组合研究其增殖的最佳效果,筛选出适合其生长的最佳增殖培养基,通过继代培养研究此200年生成年雄性毛白杨的组培幼化技术。【结果】结果表明,0.1%氯化汞溶液的灭菌效果比10%次氯酸钠溶液效果好,最佳灭菌处理为0.1%氯化汞7 min,成活率为57%;最佳增殖培养基为MS+0.7 mg/L 6-BA+0.01 mg/L NAA,最高丛生芽分化系数为2.23,茎高生长量≥1 cm苗的数量比例为53.33%,显著高于其他处理;随着继代次数的增加,生长周期由63 d(1代)降至44 d(4代),继代培养增殖系数由0.93(1代)提升至4.85(4代),茎高生长量≥3 cm苗的数量比也从2.23%(1代)显著增至62.34%(4代)。【结论】此200年生毛白杨繁殖材料存在一定程度的老化现象,母株的年龄可能影响其根萌条的幼化程度,但随着继代次数的增加,生长势有了显著的提高,说明多次继代培养有较明显的幼化作用,且随着继代次数的增加,幼化效果也越好。
关键词:组织培养;成熟树木;生理衰弱;幼化;雄性毛白杨
中图分类号:S792.11 文献标志码:A 文章编号:1673-923X(2024)08-0009-07
基金项目:“十三五”国家重点研发计划项目课题(2016YFD0600403);林业和草原科技成果国家级推广项目(2023133111);北京市科技计划项目课题(Z231100003823026);北京园林绿化增彩延绿科技创新工程—品种研发及栽培技术推广项目(CEG-2015)。
Study on tissue culture juvenation technique of male Populus tomentosa Carr.
ZHANG Jin1,2, WANG Yongge2, PENG Yuxin2, LI Guolei1, WANG Maoliang2, ZHANG Hengyue2, CHANG Xiaochao1, LI Jinjin1, LIU Yong1
(1. School of Forestry, Key Laboratory for Silviculture and Conservation, Ministry of Education, Beijing Forestry University, Beijing 100083, China; 2. Institute of Landscape Architecture, Beijing 100102, China)
Abstract:【Objective】Regeneration of Populus tomentosa mainly rely on asexual reproduction, but the material of asexual propagation often has aging phenomenon.【Method】It is important to understand the aging pattern of reproductive material and the juvenation techniques. In this study, 200 year old mature trees of male P. tomentosa root sprouts were used as study materials. Two sterilization reagents and sterilization times were used to test the impact on the survival rate and growth of propagules. Different hormone combinations in MS medium were designed to select the best multiplication culture medium according to the effect of propagule proliferation. Juvenation technique of mature P. tomentosa were studied through successive sub-culture.【Result】The results showed that sterilization effect of 0.1% mercuric chloride solution was better than the 10% sodium hypochlorite solution. The best sterilization treatment was 0.1% mercuric chloride in 7 min, the highest survival rate was 57%. The best proliferation medium was MS+0.7 mg/L 6-BA+0.01 mg/L NAA, in which shoot multiplication coefficient was the highest of 2.23, the proportion of shoot number(shoot increment≥1 cm) was 53.33%, they were significantly higher than other mediums. After 4 generations of breeding the growth cycle decreased from 63 days to 44 days, the proliferation coefficient increased from 0.93 to 4.85, the percentage of plant number (shoot increment≥3 cm) significantly increased from 2.23% to 62.34%.【Conclusion】It was indicated that there was an aging phenomenon in this 200 years old P. tomentosa root sprout. The juvenation effect was much obvious after multiple sub-cultures.
Keywords: tissue culture; mature trees; physiological aging; juvenation; male; Populus tomentosa Carr.
采用无性繁殖方法育苗的树种,若以苗繁苗或使用大树枝条作为繁殖材料培育苗木,将会导致造林后树木生长过程中出现成熟效应,即斜长、老化、早衰等现象,严重影响了人工林的质量[1]。由于成年树木表现出更稳定的形态生理特性,在进行优树选择时,从成年树中选优比在幼苗或幼林中选优更有效。因此,当选出的优树是成年或老年树木时,了解成年树木繁殖材料作为外植体进行组织培养的幼化规律,对形成可能的幼化技术具有重要意义。
成年树木的繁殖材料往往具有成熟效应,使得其优良性状在无性繁殖中难以保持,组织培养外植体的器官发生同时受生长阶段变化和培养环境的影响,目前对这种生长阶段变化的研究较少,特别是从成熟阶段到幼年阶段的逆转变化[2-4]。体外诱导器官发生被证明是诱导再生的有效方法,也是外植体年幼阶段再生(离体培养幼化)的有效途径[5-6]。如巨杉Sequoiadendron giganteum Buchholz.就通过组培外植体器官发生的方式实现了幼化[7],这表明来自组培再生的植物可能具有幼年化的特征,比如更高的微体繁殖能力、生根能力等[8]。研究表明由成年树木组培获得的完全幼化的完整植株的数目并不多,组培幼化技术还有待证明[9]。完全幼化通常只能在配子形成、有性生殖和胚胎形成过程中获得,是否可以通过其他手段诱导真正稳定的幼化仍然存在争议[10-11]。如,1997年从橡胶树Hevea brasiliensis Müll. Arg.成熟外植体中诱导的体细胞胚重新获得了微体繁殖能力[8,12],2003年报道的可可树Theobroma cacao L.离体器官诱导的体细胞胚衍生无性系的能力曾引起科学界极大的关注[13]。目前,植物组培幼化技术已经广泛应用于许多不同植物物种,但乔木组织培养幼化技术只在少数的针叶树和阔叶树中被报道过[14-16]。
毛白杨Populus tomentosa Carr.是我国北方地区的乡土树种,在人工林建设和园林绿化中发挥着重要作用,其苗木培育多采用无性繁殖,生产上以大树枝条繁殖苗木的现象十分普遍,从而导致造林后树木的早衰。近年来,毛白杨的组织培养技术已经较为成熟,大量的研究表明,组培过程中合理搭配使用生长调节剂6-BA与NAA能获得较好的不定芽增殖和生长的效果[17-20]。本研究以成年雄性毛白杨根萌条为对象,使用2种灭菌试剂处理,采用2种植物生长调节剂配置增殖培养基,并进行多次继代培养,探索解决无菌再生体系中的关键技术问题,了解组培幼化的生长规律,为成年雄性毛白杨繁殖材料的幼化提供技术支持。
1 材料与方法
1.1 试验材料及试剂
1.1.1 试验材料
试验用组培外植体采自毛白杨古树的一年生根萌条,采集地点位于北京市大兴区安定镇,为散生优良雄性毛白杨单株,树龄为200 a以上,胸径为134 cm,树高为25.0 m。
1.1.2 试验试剂
基础培养基采用MS,产于Phyto Technology Laboratories(简称Phyto Tech)的MURASHIGE SKOOG(含维生素);凝固剂采用琼脂,产于MicroanalysisInc的Agar Powder;使用生长素类似物a-Naphthalene acetic acid(NAA),即a-萘乙酸;细胞分裂素使用6-Benzyil aminopurine(6-BA),即6-苄氨基嘌呤。
1.2 试验方法
1.2.1 启动培养灭菌试验
2016年5月,采集树干基部一年生根萌条。去顶芽和基部不饱满芽,取中段,将其分剪成带芽的茎段(具1~2个芽),用洗洁剂水浸泡10 min,用毛笔轻刷。将茎段清洗而后置于流水下冲洗1 h。将冲洗过的茎段转入超净工作台,用70%的乙醇浸泡并轻摇30 s,用无菌水清洗3次,再转入不同类型的灭菌剂中进行不同时间的灭菌处理,最后无菌水冲洗5~7次,待用。
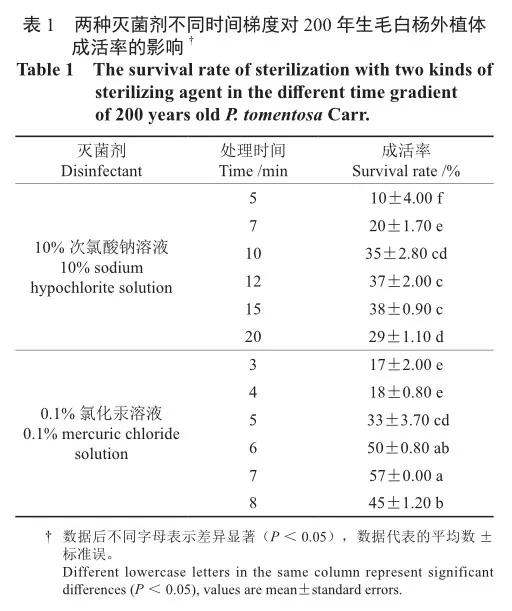
灭菌处理试验设计为2种灭菌试剂条件下,不同灭菌时间的双因素完全随机试验设计,具体为10%次氯酸钠溶液6个时间水平(5、7、10、12、15、20 min),0.1%氯化汞溶液6个时间水平(3、4、5、6、7、8 min),共12个处理,每个处理30个外植体,3次重复。最后进行外植体成活率的统计,对比次氯酸钠10%、氯化汞0.1%溶液对外植体成活率的影响。
用无菌解剖刀将灭过菌的外植体与灭菌液体直接接触的伤口部位斜剪掉一小段,留1.0~1.5 cm茎段,稍倾斜插入MS培养基(pH值=5.9,不添加任何激素),每瓶培养基接种3个芽,放置于温度为25±2 ℃,光照为12~14 h/d,光强为2 000~2 500 lx的培养室中培养,每隔3 d观察其成活与生长情况,记录最终成活率。两周后取未受污染的外植体进入后续阶段培养。
1.2.2 增殖培养基激素配比试验
选取生长良好的无菌苗,剪成1.0~1.5 cm长的带芽茎段,接种在增殖培养基上,增殖培养基分别是在MS培养基中添加不同浓度的细胞分裂素6-BA和生长素类似物NAA,6-BA浓度为0.7、0.5、0.3 mg/L,NAA浓度为0.05、0.03、0.01 mg/L,按照双因素完全随机试验设计,共9个处理,每个处理30个外植体,3次重复。无特殊说明,本试验全部培养基中含蔗糖30 g/L,琼脂8 g/L,pH值=5.9,培养室条件同上。每隔3 d观察1次,记录丛生芽分化的数量,丛生芽转入芽伸长培养基后,取大于1.0 cm的可接芽作为有效芽计算增殖系数[21]。
丛生芽分化系数=外植体分化出芽总数/外植体总数。
增殖系数=茎高生长量≥1.0 cm有效芽的个数/外植体总数。
1.2.3 继代培养试验
初代培养后,选取生长良好的无菌苗,剪成1.0~1.5 cm长的带芽茎段,接种到继代培养基上进行继代培养,继代培养基为试验选出的最佳增殖培养基,培养室条件同上。记录每一次继代无性系各项生长指标。具体测定方法如下:
1.2.3.1 记录每一次继代培养的培养周期
为保证芽培养有足够稳定的植株数量,每一代培养最大限度地给予其完整的培养周期,即通过观察与记录其生长指标,当生长速度降低时,视之为一个继代周期或培养周期。
1.2.3.2 记录每一代无性系组培苗增殖系数与茎高生长情况
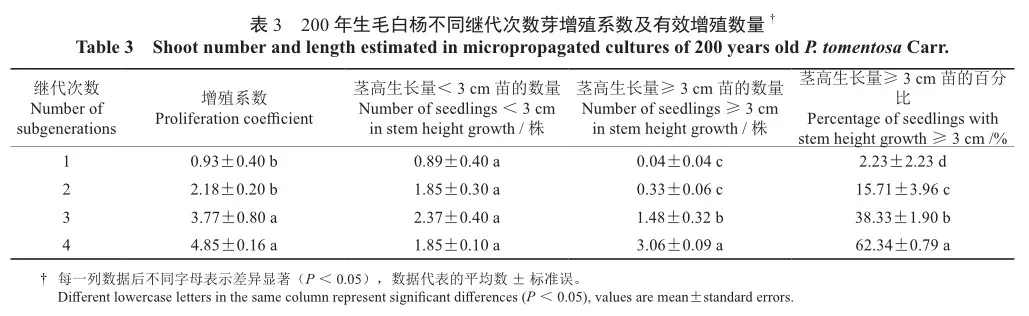
持续观察,当完成一个培养周期时,记录其增殖系数及茎高生长情况。并分别记录组培苗高度≥3 cm和<3 cm的数量,观察无性系每一代间茎高生长量的差异[22]。
1.3 数据分析
利用SPSS软件对成年雄性毛白杨无性系各项生长指标数据进行方差分析,对差异显著的指标采用Duncan方法进行多重比较(P<0.05)。
2 结果与分析
2.1 不同灭菌方法对成年雄性毛白杨外植体成活率的影响
通过灭菌处理试验发现,2种灭菌剂处理均表现出随着时间的延长,外植体成活率先升高后降低,其中10%次氯酸钠在灭菌15 min时效果最好,成活率为38%,0.1%氯化汞在灭菌7 min时成活率达最高,为57%,后者显著高于前者,因此最佳灭菌处理组合为0.1%氯化汞灭菌7 min(表1)。
2.2 成年雄性毛白杨增殖培养基的筛选
本研究根据预试验结果,选择6-BA、NAA作为增殖培养基的生长调节剂,结果发现(表2),不同浓度6-BA、NAA处理组合对其芽再生的增殖与生长影响显著。其中1号MS+0.7 mg/L 6-BA+ 0.01 mg/L NAA处理组合的茎高生长量≥1 cm苗的数量最高为0.53,所占比例为53%,显著高于其他处理(P<0.05),丛生芽分化系数也最高,平均为2.23,除与6号培养基差异不显著外,均高于其他处理;因此确定MS+0.7 mg/L 6-BA+0.01 mg/L NAA为最佳增殖培养基。
2.3 成年雄性毛白杨无性系继代培养周期的变化情况
观察芽分化率和茎高生长情况,当其生长稳定时,可视为一个继代周期。由图1可知,随着继代次数的增加,继代周期由第1代的63 d,逐渐缩短至第4代的44 d,说明其生长有加快的趋势。可见,根萌条虽然是一株树上发育最年轻的部位,但是由于其母株的年龄较高,也会表现出一定的成熟性,初期生长势较弱。随着继代次数的增加,生长周期缩短,表明通过组培多次继代能够起到一定的幼化作用。


2.4 成年雄性毛白杨无性系继代培养过程中的生长情况
从表3可看出,成年雄性毛白杨在继代过程中,随着继代次数增加,增殖系数由1代的0.93提升至4代的4.85,茎高生长量<3 cm苗的数量各代间差异不显著,但在茎高生长量≥3 cm苗的数量上,4代的3.06显著高于3代的1.48,而3代又显著高于1、2代,从茎高生长量≥3 cm苗的数量百分比上也可以看出4代的62.34%显著高于其他各代的生长量所占的百分数,说明多次继代能使成年雄性毛白杨在一定程度上发生幼化,且效果明显。
3 讨 论
3.1 植物灭菌剂对成年雄性毛白杨外植体灭菌成活率的影响
植物材料表面灭菌是组织培养过程中的关键环节,合适的灭菌剂可以在有效去除污染物的同时减少对植物细胞的破坏[23]。目前应用比较广泛且效果较好的灭菌剂主要有次氯酸钠、84消毒液、氯化汞[24-25]等。灭菌的成功与否,还取决于外植体类型,采集时间,材料木质化程度等,幼嫩的茎段可以适当缩短灭菌时间[26]。毛白杨茎段附有绒毛,灭菌较不易。研究表明,对于较难灭菌的植物采用0.1%~0.5%氯化汞灭菌效果较好[27]。本试验于5月采集成年雄性毛白杨根部萌条作为外植体,通过使用10%次氯酸钠和0.1%氯化汞2种灭菌剂,发现0.1%氯化汞溶液的灭菌效果较10%次氯酸钠溶液的好,同时还发现无论使用哪种灭菌剂,外植体的成活率均随着灭菌时间的增加而先升高后降低,由此表明灭菌时间太短可能达不到灭菌效果,而时间太长又容易伤害植物组织细胞,综上所述,本研究筛选出适合于此成年雄性毛白杨外植体的灭菌剂处理组合为0.1%氯化汞溶液灭菌7 min,灭菌效果优于其他处理,成活率也较高。
3.2 植物生长调节剂6-BA、NAA对成年雄性毛白杨无性系增殖与生长的影响
植物离体再生过程中,植物激素种类与浓度对外植体不定芽再生及生长起着重要的调节作用。目前多数研究表明,杨树组织培养过程中,合理搭配使用6-BA与NAA都能获得不错的效果[18,20],而植物基因型的不同,两者最适合的搭配组合也不同,因此合理选择6-BA和NAA的配合比例非常关键[28]。刘晓梅[29]研究表明毛白杨杂种茎段不定芽分化需要较低浓度的6-BA(<1.0 mg/L),而6-BA与低浓度的NAA(0.01 mg/L)配合使用能更好促进不定芽的生长。本试验同样表明仅使用这两种生长调节剂便可很好的促进毛白杨不定芽的增殖与生长,且一定浓度6-BA与低浓度NAA对无性系不定芽的增殖效果较好,各个处理组合间差异显著,使用MS+0.3 mg/L 6-BA+0.05 mg/L NAA组合处理的无性系各项生长指标均为最低,不定芽分化系数仅为0.93,高生长量≥1 cm苗的数量比例也仅为12.78%;使用MS+0.5 mg/L 6-BA+0.05 mg/L NAA组合处理的无性系不定芽分化系数较高为2.00,但高生长量≥1 cm苗的数量比例仅为23%,茎高生长不足;当使用MS+ 0.7 mg/L 6-BA+0.01 mg/L NAA处理组合时,丛生芽分化系数为最高2.23,茎高生长量≥1 cm苗的数量比例也为最高53.33%。因此认为,此成年雄性毛白杨古树组培繁育的最佳增殖培养基处理组合为MS+0.7 mg/L 6-BA+0.01 mg/L NAA。
3.3 组织培养多次继代对成年雄性毛白杨外植体的幼化作用

成熟效应(maturation)又被称为老化,包括遗传老化、个体发育老化及分生组织老化等,树木可以拥有不同成熟程度的组织器官[30-31]。成熟效应会导致相对稳定的发育改变,包括生长速率降低,生殖发育频率的增加以及形态特征的改变等[32,33]。幼化(rejuvenation),是指有性生殖和胚胎形成过程中成熟的逆转,或指通过修剪、连续继代、嫁接和应用植物生长抑制剂等方式处理下发生的逆转[34-35]。幼化苗木可消除成年大树的成熟效应、位置效应和年龄效应,使之恢复到幼年阶段[36]。树木胚后生长一般可分为三个发育阶段,即幼年营养生长阶段、成年营养生长阶段和成年生殖生长阶段。特定阶段都有自己特有的形态和生理生化特性[37-38]。通常,树木在幼年和青年阶段生长速度快,而成年阶段生长速度会降低[2,29]。Mc Gowran等[39]也曾研究发现,相比于年轻栎树Quercus robur L.繁育的组培无性系,300年生栎树的组培无性系生长势较弱,幼化性较低。本试验研究中,200年生毛白杨组培无性系在适宜的培养条件下,前期生长周期长达2个月、增殖系数低至0.93、茎高生长不足,整体状态表现为生长势弱,幼化性低,与前人的研究结果相一致。因此,当选择的优树是成年树或古树时(几十年生或几百年生大树),采用幼化繁殖材料及幼化繁育技术十分重要[40]。张世红等[41]研究表明20年生的毛白杨外植体随着继代的增加,组织成熟程度降低,幼化程度加深。孙立平等[42]对大叶杨实生苗嫩枝进行多次继代后,可使其茎条微扦插生根率提高至100%,林木由成年向幼年阶段转变常表现为生根能力的提升[43]。然而,尽管选用树木个体发育中幼化性高的根萌条作为外植体[44],此200年生雄性毛白杨组培无性系仍然受到母株年龄的影响,表现为前期生长慢,生长势弱。在前人研究中也发现随着母株年龄的增加,采穗插条的生根能力会逐渐减退[45]。本试验采用200年生毛白杨根萌条作为外植体,随着继代次数的增加,4代生长周期相比1代缩短了19 d,增殖系数增加了3.92,苗高生长量≥3 cm的苗数量百分比提高了40.11%,各代间差异不断增高,生长趋势明显加快,幼化效果显著。综上所述,无性繁殖材料往往受到母株年龄的影响,而多次组培继代可实现成年树木繁殖材料的幼化。
由于古树根萌条幼化繁殖材料数量有限,且年龄效应对根萌条存在影响,导致试验难度大,周期长,本试验只完成了4次继代,希望在以后的研究中能够继续深入探讨组培继代的幼化规律。
4 结 论
以200年生成年雄性毛白杨的根萌条为繁殖材料,组培最适灭菌处理为0.1%氯化汞溶液灭菌7 min,成活率为57%;最佳增殖培养基为MS+ 0.7 mg/L 6-BA+0.01 mg/L NAA,平均丛生芽分化系数为2.23,茎高生长量≥1 cm苗的比例占53.33%;此200年生成年雄性毛白杨的根萌条存在老化现象,多次继代培养对其有一定程度的幼化作用,增殖系数由最初1代的0.93增至4代的4.85,茎高生长量≥3 cm苗的数量比例也由最初1代的2.23%显著增至4代的62.34%,幼化效果显著。
参考文献:
[1] 潘春芳,刘斯文.当心,用苗不慎埋下千古恨[N].中国绿色时报,2015-02-15(003). PAN C F, LIU S W. Beware, bury eternal hatred carelessly with seedlings[N]. China Green Times,2015-02-15(003).
[2] GREENWOOD M S. Rejuvenation of forest trees[C]. Martinus Nijhoff,Dordrecht,1987,6:1-12.
[3] ADERKAS P, BONGA J. Influencing micropropagation and somatic embryogenesis in mature trees by manipulation of phase change, stress and culture environment[J]. Tree Physiology,2000,20: 921-928.
[4] HACKETT W P. Juvenility, maturation, and rejuvenation in woody plants[C]. Horticultural Revievs, Avi Rubiishing,1985,7: 110-147.
[5] PIERIK R L M. Rejuvenation and micropropagation[C]. Kluwer, Dordrecht,1990,91-101.
[6] BONGA J M, KLIMASZEWSKA K K, ADERKAS P. Recalcitrance in clonal propagation, in particular of conifers[J]. Plant Cell Tissue and Organ Culture,2010,100:241-254.
[7] MONTEUUIS O, BON M C. Rejuvenation of a 100 yr old giant sequoia (Sequoiadendron giganteum Buchholz) through in vitro meristem culture[J]. Annals of Forest Science,1989,46 (Supplement): 183-186.
[8] CARRON M P, ETIENNE H, LARDET L, et al. Somatic embryogenesis in rubber (Hevea brasiliensis Müll. Arg.)[C]. Kluwer, Dordrecht,1995,117-136
[9] HERNA′NDEZ I, CUENCA B, CARNEROS E, et al. Application of plant regeneration of selected cork oak trees by somatic embryogenesis to implement multivarietal forestry for cork production[J]. Tree and Forestry Science and Biotechnology, 2011,(Suppl.1):19-26.
[10] HACKETT W P. Juvenility and maturity[C]. Martinus Nijhoff, Dordrecht,1987:216-231.
[11] HARTMANN H T, KESTER D E, DAVIES J F T, et al. Plant propagation: principles and practices[M]. New Jersey: Prentice-Hall, 2017.
[12] PERRIN Y, DOUMAS P, LARDET L, et al. Endogenous cytokinins as biochemical markers of rubber-tree (Hevea brasiliensis) clone rejuvenation[J]. Plant Cell Tissue and Organ Culture,1997,47: 239-245.
[13] TRAORE A, MAXIMOVA S N, GUILTINAN M J. Micropropagation of Theobroma cacao L. using somatic embryoderived plants[J]. In Vitro Cellular Developmental Biology Plant, 2003,39:332-337.
[14] KLIMASZEWSKA K, OVERTON C, STEWART D, et al.Initiation of somatic embryos and regeneration of plants from primordial shoots of 10-year-old somatic white spruce and expression profiles of 11 genes followed during the tissue culture process[J]. Planta,2011,233:635-647
[15] HOANG T T, HA T M N, DO M C, et al. Somatic embryo as a tool for micropropagating of some plants[C]. Springer Nature Singapore,2022,6(4):129-162.
[16] 王杰,杨模华,郑力尉等.马尾松胚性细胞团诱导体系优化[J].中南林业科技大学学报,2020,40(11):73-84. WANG J, YANG M H, ZHANG L, et al. Establishment and optimization on initiation of embryogenic masses in Pinus massoniana[J]. Journal of Central South University of Forestry Technology,2020,40(11):73-84.
[17] 叶德柳.三倍体毛白杨组织培养技术体系研究[D].雅安:四川农业大学,2001. YE D L. Study on the technique system of tissue culture in triploid Populus tomentosa [D]. Ya’an: Sichuan Agricultural University, 2001.
[18] 张瑞娥.毛白杨不同优良无性系组培特性的比较研究[D].杨凌:西北农林科技大学,2003. ZHANG R E, A comparatively study on the tissue culture characteristics of Populus tomentosa. Carr. clones[D]. Yangling: Northwest A F University,2003.
[19] 张彦.白杨派种间杂种再生体系的建立[D].杨凌:西北农林科技大学,2010. ZHANG Y. Establishment of rejuvenation system of white poplar school intermediate hybrid[D]. Yangling: Northwest A F University,2010.
[20] 张瑞姿.三倍体毛白杨组培快繁[J].山西林业科技,2012, 41(4):40-41. ZHANG R Z. Tissue culture and rapid propagation of triploid Populus tomentosa[J]. Shanxi Forestry Science and Technology, 2012,41(4):40-41.
[21] 李春利,王孝敬,丁强强,等.毛白杨叶片再繁和遗传转化体系的优化[J].植物研究,2016,36(2):177-183. LI C L, WANG X J, DING Q Q, et al. Optimization of leaf repropagation and genetic transformation system of Populus tomentosa[J]. Plant Research,2016,36(2):177-183.
[22] MARTíNEZ T, VIDAL N, BALLESTER A, et al. Improved organogenic capacity of shoot cultures from mature pedunculate oak trees through somatic embryogenesis as rejuvenation technique[J]. Trees,2012,26(2):321-330.
[23] HUSAIN M K, ANIS M. Rapid in vitro multiplication of Melia azedarach L. (a multipurpose woody tree)[J]. Acta Physiologiae Plantarum,2009,31(4):765-772.
[24] TILKAT E, ONAY A, YILDIRIM H, et al. Direct plant regeneration from mature leaf explants of pistachio, Pistacia vera L[J]. Scientia Horticulturae,2009,121(3):361-365.
[25] 王沛琦,张平冬,李媛,等.‘北林雄株1号’和‘北林雄株2号’叶片再生体系的建立[J].中国农学通报,2014,30(7):11-16. WANG P Q, ZHANG P D, LI Y, et al. Establishment of leafexplant regeneration system in vitro of triploid hybrid of white poplar ‘Beilin Xiongzhu 1’ and ‘Beilin Xiongzhu 2’[J]. Chinese Agricultural Science Bulletin,2014,30(7):11-16.
[26] 曹孜义,刘国民.实用组织培养技术教程[M].兰州:甘肃科学技术出版社,1999:38-41. CAO Z Y, LIU G M. Practical tissue culture technology course[M]. Lanzhou: Gansu Science and Technology Press,1999: 38-41.
[27] 杜雪玲,张振霞,余如刚,等.植物组织培养中的污染成因及其预防[J].草业科学,2005,22(1):24-27. DU X L, ZHANG Z X, YU R G, et al. The cause of contamination and its prevention in plant tissue culture[J]. Pratacultural Science,2005,22(1):24-27.
[28] 周洲,李永丽,安世恒,等.欧美杨108高效组培再生系统[J].中南林业科技大学学报,2016,36(7):1-6. ZHOU Z, LI Y L, AN S H, et al. Effective tissue culture system for Populus euramericana ‘Guariento’ [J]. Journal of Central South University of Forestry and Technology,2016,36(7):1-6.
[29] 刘晓梅.白杨新杂种茎段组培技术的研究[D].杨凌:西北农林科技大学,2010. LIU X M. Study on the stem tissue culture of new hybrid poplar[D]. Yangling: Northwest A F University,2010.
[30] OLESEN P O. On cyclophysis and topophysis[J]. Silvae Genetica,1978,27(5):173-178.
[31] GREENWOOD M S. Juvenility and maturation in conifers: current concepts[J]. Tree Physiology,1995,15:433-438.
[32] ROBINSON W, WAREING P F. Experiments on the juvenileadult phase change in some woody species[J]. New Phytologist, 1969,68:67-78.
[33] GREENWOOD M S, HOPPER C A, HUTCHISON K W. Maturation in larch. I Effect of age on shoot growth, foliar characteristics and DNA methylation[J]. Plant Physiology,1989,90: 406-412.
[34] HAND P, BESFORD R T, RICHARDSON C M, et al. Antibodies to phase related proteins in juvenile and mature Prunus avium[J]. Plant Growth Regulation,1996,20:25-29.
[35] WENDLING I, TRUEMAN S J, XAVIER A. Maturation and related aspects in clonal forestry-Part I: concepts, regulation and consequences of phase change[J]. New Forests,2014,45:449-471.
[36] 朱之悌.树木无性繁殖和无性系育种[J].林业科学,1986,22(3): 209-219. ZHU Z T. Vegetative propagation and clonal breeding of forest trees[J]. Forestry Sciences,1986,22(3):209-219.
[37] CLEMENS J, HENRIOD R E, BAILEY D G, et al. Vegetative phase change in Metrosideros: shoot and root restriction[J]. Plant Growth Regulation,1999,28(3):207-214.
[38] ADERKAS P V, BONGA J M. Influencing micropropagation and somatic embryogenesis in mature trees by manipulation of phase change, stress and culture environment[J]. Tree Physiology, 2000,20(14):921.
[39] MC GOWRAN E, DOUGLAS G C, PARKINSON M. Morphological and physiological markers of juvenility and maturity in shoot cultures of oak (Quercus robur and Q. petraea)[J]. Tree Physiology,1998,18:251-257.
[40] 朱之悌,毛白杨多圃配套系列育苗新技术研究[J],北京林业大学学报,2002,24(增刊1):4-45. ZHU Z T. Research on new technology of Populus tomentoides seedling series[J]. Journal of Beijing Forestry University,2002,24(Suppl.1):4-45.
[41] 张世红,李坤霞,朱淑新,等.毛白杨成熟效应与组培幼化[J].西北林学院学报,2010,25(4):83-86. ZHANG S H, LI K X, ZHU S X, et al. Cyclophysis and rejuvenation of Populus tomentosa by tissue culture[J]. Journal of Northwest Forestry College,2010,25(4):83-86.
[42] 孙立平,章林,赵珊珊,等.大叶山杨幼化处理技术的研究[J].吉林林业科技,2009,38(5):18-20. SUN L P, ZHANG L, ZHAO S S, et al. Research on the rejuvenation technology of Populus davidiana var. macrophylla[J]. Jilin Forestry Science and Technology,2009,38(5):18-20.
[43] GREENWOOD M S, CUI X, XU F. Response to auxin changes during maturation-related loss of adventitious rooting competence in loblolly pine (Pinus taeda) stem cuttings[J]. Physiologia Plantarum,2001,111:373-380.
[44] 李新国,段安安,朱之悌.毛白杨无性系年龄效应及根萌条幼化效果的初步研究[J].西南林业大学学报,1998,18(2):61-67. LI X G, DUAN A A, ZHU Z T. Primary study on branch cyclophsis and sucker rejuvenation effect of Populus tomentosa[J]. Journal of Southwest Forestry University,1998,18(2): 61-67.
[45] 王明庥.论无性系林业—概念和应用[J].林业科技开发, 1992(1):2-4. WANG M X. Clonal forestry: concepts and practice[J]. Forestry Science and Technology Development,1992(1):2-4.
[本文编校:罗 列]

