辣木叶γ-氨基丁酸富集方法研究
摘" 要" 为了提高辣木叶的γ-氨基丁酸(γ-aminobutyric acid,GABA) 含量,通过辣木枝条的导管向叶片细胞补充外源L-谷氨酸(L-glutamic acid,L-Glu),以干叶的GABA含量为评价指标,从辣木叶谷氨酸脱羧酶(glutamate decarboxylase,GAD)的酶学特性、 L-Glu溶液pH和浓度、浸吸时间、转化反应时间、转化反应温度等方面对植物导管法富集辣木叶GABA的适宜条件进行研究。结果显示:辣木叶GAD的最适反应温度和pH分别为40 ℃和6.0,在4~30 ℃和pH 5.6~6.4相对较稳定;与破碎法(破碎叶片释放GAD转化外源L-Glu合成GABA)相比较,植物导管法(通过植物导管补充外源L-Glu)由于GAD存在细胞的保护而富集效果更佳,植物导管法富集的GABA含量是破碎法的1.71倍;当将鲜辣木枝条切口端插入pH 5.5、50 mmol/L"" L-Glu溶液于室温放置浸吸1 h,然后摘取辣木叶于35 ℃保温7 h,辣木叶GABA含量由初始(1.86±0.13)" mg/g增加至(5.97±0.36)mg/g,提高了2.21倍。植物导管法富集辣木叶GABA的工艺简单,在富GABA辣木叶产品开发方面具有很好的应用前景。
关键词" 辣木;γ-氨基丁酸;谷氨酸脱羧酶;植物导管;富集
doi:10.7606/j.issn.1004-1389.2024.08.019
https://doi.org/10.7606/j.issn.1004-1389.2024.08.019
收稿日期:2023-08-24" 修回日期:2023-11-06
基金项目:广东省重点建设学科科研能力提升项目(2022ZDJS079);广东省普通高校特色创新项目(2022KTSCX073);广东省自然科学基金(2022A1515010360);广东省本科高校教学质量与教学改革工程特色专业项目(2022KTSCX073)。
第一作者:杨胜远,男,博士,教授,研究方向为绿色生物制造。E-mail:yangsy1972@163.com
γ-氨基丁酸(γ-aminobutyric acid,GABA)具有降血压[1]、镇静[2]、改善睡眠[2-3]、增强免疫力[4]、预防心血管疾病[5]、调节新陈代谢[6]、改善氧化应激与甲状腺功能[7]、抑癌[8-9]等多种生理功能,是一种新型食品功能性因子。GABA合成主要有化学合成法和生物合成法,化学合成法由于化学原料具有毒性和腐蚀性,反应条件剧烈,副产物多,缺乏安全性,不适宜作为食品添加剂,而生物合成法是以生物内源酶催化合成GABA,反应条件温和、安全性高,以生物合成法生产食品或医药级GABA 是一条较理想途径[10]。生物合成法主要以微生物[11-12]和植物[13-21]及其内源酶合成GABA,其中利用植物内源酶转化反应富集GABA,无需提取GABA即可直接开发为富GABA食品,显著增加农副产品的附加值,已引起研究人员极大关注。一些研究表明,通过缺氧、高盐、热激、冷激、机械损伤等胁迫应激反应,可以增加植物的 GABA含量,已成功开发富GABA的茶叶[13]、发芽糙米[14]、发芽小米[15]、大豆[16]、蚕豆[17]、豌豆[18]、芸豆[19]、桑叶[20]、咖啡叶[21]等食材。然而,利用胁迫应激反应富集GABA的胁迫处理操作繁琐、时间长,容易对食材的结构和风味产生不利影响。因此,如何更简便而高效地利用植物内源酶富集食材中的GABA,对富GABA植物产品的开发仍具有重要意义。
辣木(Moringa" oleifera Lam.)为原分布于印度北部的亚喜马拉雅地区的抗旱速生树种[15],其嫩叶含有丰富的蛋白质、氨基酸、维生素、黄酮类、苯丙素类、多酚类、异硫氰酸酯类、甾体类、萜类、生物碱类以及多种矿物质[22-25],具有较好的营养价值以及抗氧化[26-27]、降血糖[27-28]、调血脂[28]、降尿酸[29]、降血压[30]、抗炎[31-32]、改善铅中毒的肝肾功能[33]、抗肿瘤[34-35]、润肠通便[36]等生理活性。中国卫生部《关于批准蛋白核小球藻等4种新资源食品的公告》(卫生部公告2012年第19号)已将辣木叶列为新资源食品。杨胜远等[25]研究表明辣木嫩叶含有(2.07±0.07) mg/g(以干质量计)天然GABA。因此,辣木叶也是补充GABA的新食材。Okada 等[37]采用口服GABA米胚芽食品进行研究表明,GABA的总摄入量为每人26.4 mg/d,GABA对妇女更年期综合症和老年初期精神障碍的总改善率为75%。按每人26.4 mg/d摄入量计,每人每天需要食用12.75 g干辣木叶,说明辣木叶天然GABA含量[25]仍偏低,不利于富GABA辣木叶产品的开发,亟待进一步通过富集技术提高辣木叶GABA含量。然而,目前关于利用辣木叶内源酶富集GABA的研究鲜见报道。
谷氨酸脱羧酶(glutamate decarboxylase,GAD,EC4.1.1.15)是生物体催化L-谷氨酸(L-glutamic acid,L-Glu)发生α-羧基脱羧作用生成GABA的唯一酶[38],而辣木叶同时存在L-Glu和GABA[25],由此推测辣木叶GABA的合成途径是通过内源GAD催化L-Glu脱羧作用而实现,即辣木叶存在GAD。本试验基于这一推断通过利用辣木枝条的导管作用向叶片细胞补充外源" L-Glu,结合辣木叶GAD酶学特性,从L-Glu溶液pH和浓度、浸吸时间、转化反应时间、转化反应温度等方面对辣木叶GABA的富集条件进行研究,构建辣木叶富集GABA的导管法。利用导管法制备的富GABA辣木叶的叶片完整、GABA含量高,在富GABA辣木茶的开发方面具有很好的应用前景,也可为其他叶类植物GABA富集技术开发提供参考。
1" 材料与方法
1.1" 材料与试剂
辣木鲜枝叶采自岭南师范学院校园自种辣木苗(lt;3 a龄)顶部枝叶,枝条长度约30~50 cm,均为3—7月新长嫩枝叶,叶片呈浅绿色。
异硫氰酸苯酯(Phenylisothiocyanate,PITC)和γ-氨基丁酸(含量≥99%),美国Sigma-Aldrich公司;乙腈、乙酸、三乙胺(均为色谱纯),美国TEDIA公司;其余试剂均为国产市售分析纯试剂或生化试剂。
1.2" 仪器与设备
P1201高效液相色谱仪,大连依利特分析仪器有限公司;AUW120电子分析天平,日本Shimadzu公司;TGL16M台式高速冷冻离心机,盐城市凯特实验仪器有限公司;VX-200涡旋混合仪,美国Labnet公司;FE28 pH计,上海梅特勒-托利多仪器有限公司;HH-2数显恒温水浴锅,常州荣华仪器制造有限公司。
1.3" 辣木叶GAD性质研究
1.3.1" 辣木叶GAD的提取" 称辣木叶180 g,于―20 ℃冷冻2 h,用研钵在冰浴上研磨至糜烂,加入石英砂60 g、4 ℃的pH 6.0、0.2 mol/L 磷酸盐缓冲液(Phosphate buffer solution,PBS,含0.1 mmol/L PLP和2 mmol/L巯基乙醇) 60 mL,继续充分研磨至浆状,静置浸提30 min,滤布压滤,收集滤液于4 ℃、8 500 r/min、离心15 min,取上清液,冰浴下加入(NH4)2SO4干粉至饱和度为90%,静置沉淀30 min,4" ℃、10 000 r/min离心15 min,取沉淀溶于 20 mL pH 6.0、0.2"" mol/L PBS缓冲液(含0.1 mmol/L PLP和" 2 mmol/L巯基乙醇),即为辣木叶GAD粗酶液, 4 ℃保藏备用。
1.3.2" 辣木叶GAD活力测定" 取辣木叶GAD粗酶液1 mL与0.20 mol/L L-Glu溶液(pH"" 6.0,溶于0.2 mol/L PBS缓冲液,含0.2"" mmol/L PLP) 1 mL混合,40 ℃水浴反应5 h,加入无水乙醇8 mL,混匀,8 500 r/min离心15 min,采用HPLC测定上清液GABA含量。将辣木叶GAD粗酶液1 mL、蒸馏水1 mL、无水乙醇8 mL混合,8 500 r/min离心15 min,采用HPLC测定上清液GABA,作为空白。GAD活力单位定义:在测定条件下1 h生成1 μmol GABA所需要的酶量为1个酶活单位(U)。以活力最高的实验组平均GAD活力为100%计算相对酶活(%)。
GAD活力=[(A×B-C×D)×5×2]/t
式中:A为试验组反应终止液GABA浓度,单位为μmol/mL;B为试验组反应终止液GABA测定稀释倍数;C为空白组反应终止液GABA浓度,单位为μmol/mL;D为空白组反应终止液GABA测定稀释倍数;5为无水乙醇终止反应产生的稀释倍数;2为反应液的总体积,单位为mL;t为反应时间,单位为h。
1.3.3" 温度对辣木叶GAD的影响" 温度对GAD反应活力的影响:按照GAD活力测定方法考察GAD分别在30、35、40、45、50、55、60、65 ℃的反应活力。温度对GAD稳定性的影响:先将GAD粗酶液分别于4、30、35、40、45、50、55 ℃保温3 h,然后再按照GAD活力测定方法测定各温度处理的GAD粗酶液在反应温度为40 ℃的残余活力。
1.3.4" pH对辣木叶GAD的影响" pH对GAD反应活力的影响:按照GAD活力测定方法考察GAD在反应pH分别为5.2、5.6、6.0、6.4、6.8、7.2的反应活力。pH对GAD稳定性的影响:先将GAD粗酶液通过超滤将溶剂换为生理盐水,然后取GAD酶液与pH分别为 5.2、5.6、6.0、" 6.4、6.8、7.2的0.05 mol/L的PBS缓冲液(含0.2 mmol/L PLP和2 mmol/L巯基乙醇)等体积混合,于40" ℃ 保温3 h,然后再按照GAD活力测定方法测定经不同pH下保温处理的GAD粗酶液在反应pH为6.0的残余活力。
1.4" 辣木叶GABA富集条件研究
1.4.1" 辣木叶GABA提取" 辣木叶于(103±2)℃烘干至恒量,粉碎过40目筛,称取辣木叶粉1 g于250 mL锥形瓶中,加蒸馏水40 mL,混匀,沸水浴浸提45 min,冷却后定容至250 mL,4 ℃、8 500 r/min离心20 min,上清液即为辣木叶GABA提取液。
1.4.2" GABA分析" 辣木叶提取液GABA含量分析参照文献[39],采用HPLC测定。辣木叶GABA含量(mg/g)均以干质量计。
1.4.3" 不同方法对辣木叶GABA富集的影响" 破碎法:称取鲜辣木叶10 g,用研钵在冰浴上研磨至糜烂,加入pH 6.0、50 mmol/L L-Glu溶液2 mL,混匀,40 ℃保温6 h,(103±2)℃烘干至恒量,提取并分析GABA含量。导管法:将鲜辣木枝条切口端插入pH 6.0、50 mmol/L L-Glu溶液液面10 cm以下,室温放置12 h,摘取辣木叶,将叶片于 40 ℃保温6 h,(103±2)℃烘干至恒量,提取并分析GABA含量。空白对照组:将未经富集处理而直接于(103±2)℃烘干至恒量的辣木叶作为空白对照。
1.4.4" L-Glu溶液pH对辣木叶GABA富集的影响" 将鲜辣木枝条切口端分别插入pH为"" 5.0、5.5、6.0、6.5、7.0的 50 mmol/L L-Glu溶液液面10 cm以下,室温放置12 h,摘取辣木叶,将叶片于 40 ℃保温6 h,(103±2)℃烘干至恒量,提取并分析GABA含量。将未经富集处理而直接于(103±2)℃烘干至恒量的辣木叶作为空白" 对照。
1.4.5" L-Glu浓度对辣木叶GABA富集的影响" 将鲜辣木枝条切口端分别插入pH 6.0的10、30、50、70、90 mmol/L L-Glu溶液液面10 cm以下,室温放置12 h,摘取辣木叶,将叶片于 40" ℃保温6 h,(103±2)℃烘干至恒量,提取并分析GABA含量。将未经富集处理而直接于(103±2)℃烘干至恒量的辣木叶作为空白对照。
1.4.6" 浸吸时间对辣木叶GABA富集的影响" 将鲜辣木枝条切口端插入pH 6.0、50 mmol/L L-Glu溶液液面10 cm以下,分别于室温放置1、2、3、4、5、12 h,摘取辣木叶,将叶片于 40 ℃保温6 h,(103±2) ℃烘干至恒量,提取并分析GABA含量。将未经富集处理而直接于(103±2)℃烘干至恒量的辣木叶作为空白对照。
1.4.7" 转化时间对辣木叶GABA富集的影响" 将鲜辣木枝条切口端插入pH 6.0、50 mmol/L L-Glu溶液液面10 cm以下,于室温放置1 h,摘取辣木叶,将叶片于 40 ℃分别保温0、2、4、6、" 8 h,(103±2) ℃烘干至恒量,提取并分析GABA含量。将未经富集处理而直接于(103±2)℃烘干至恒量的辣木叶作为空白对照。
1.4.8" 转化温度对辣木叶GABA富集的影响 "将鲜辣木枝条切口端插入pH 6.0、50 mmol/L L-Glu溶液液面10 cm以下,于室温放置1 h,摘取辣木叶,将叶片分别于30、35、40、45、50 ℃保温6 h,(103±2)℃烘干至恒量,提取并分析GABA含量。将未经富集处理而直接于(103±2) ℃烘干至恒量的辣木叶作为空白对照。
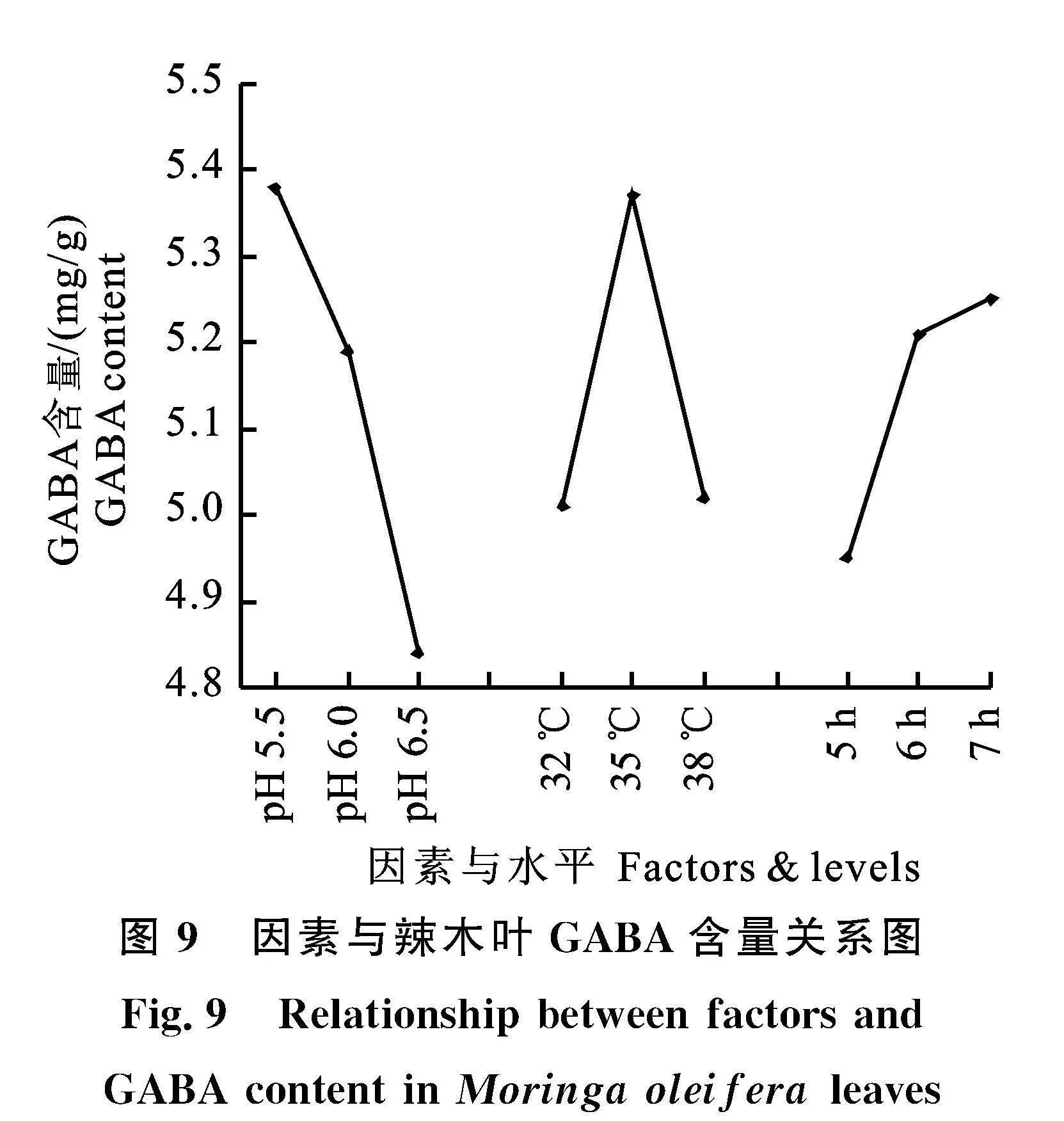
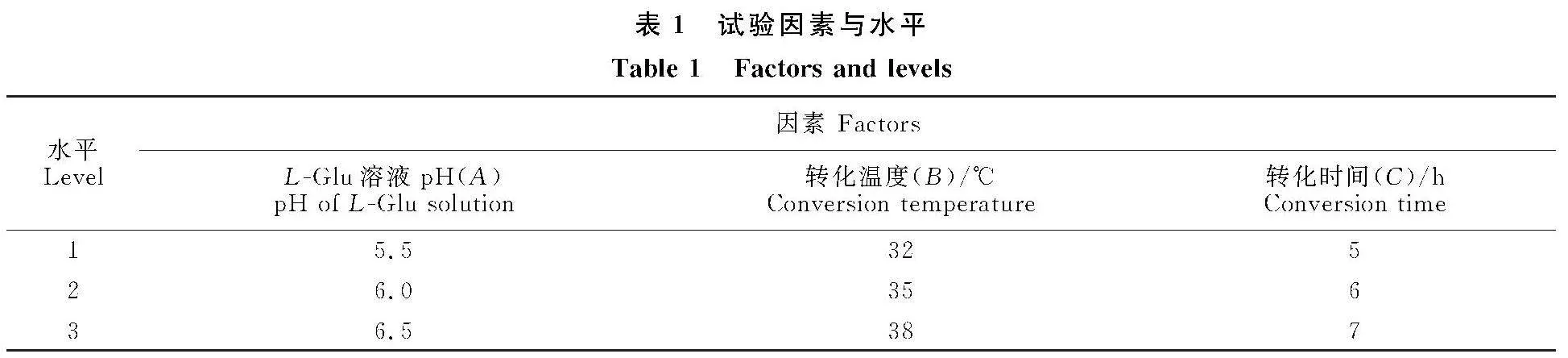
1.4.9" 正交试验" 根据单因素试验结果,选择L-Glu溶液pH、转化温度和转化时间进行正交试验。试验因素与水平见表1,L9 (34)正交试验设计表和结果见表2。按照表2的试验组合,将鲜辣木枝条切口端插入不同pH的50 mmol/L的L-Glu溶液液面10 cm以下,于室温放置1 h,摘取辣木叶,将叶片分别于不同温度下进行转化反应不同时间,置于(103±2)℃烘干至恒量,提取并分析GABA含量。
1.4.10" 验证试验" 将鲜辣木枝条切口端插入pH 5.5、50 mmol/L L-Glu溶液液面10 cm以下,于室温放置浸吸1 h,摘取辣木叶,将叶片于35 ℃保温7 h,(103±2)℃烘干至恒量,提取并分析GABA含量。以未经富集处理而直接于" (103±2)" ℃烘干至恒量的辣木叶作为空白对照。
1.5" 数据处理
试验结果以3次平行试验的“平均值±标准偏差”表示,通过IBM SPSS Statistics 19.0软件,运用单因素方差分析(ANOVA)的Duncan(D)法和独立样本t检验进行统计分析。采用Microsoft excel 2010软件绘图。图表中用相同英文字母代表两组间差异不显著(P>0.05),不同英文字母代表两组间差异显著(P<0.05)。
2" 结果与分析
2.1" 辣木叶GAD性质研究
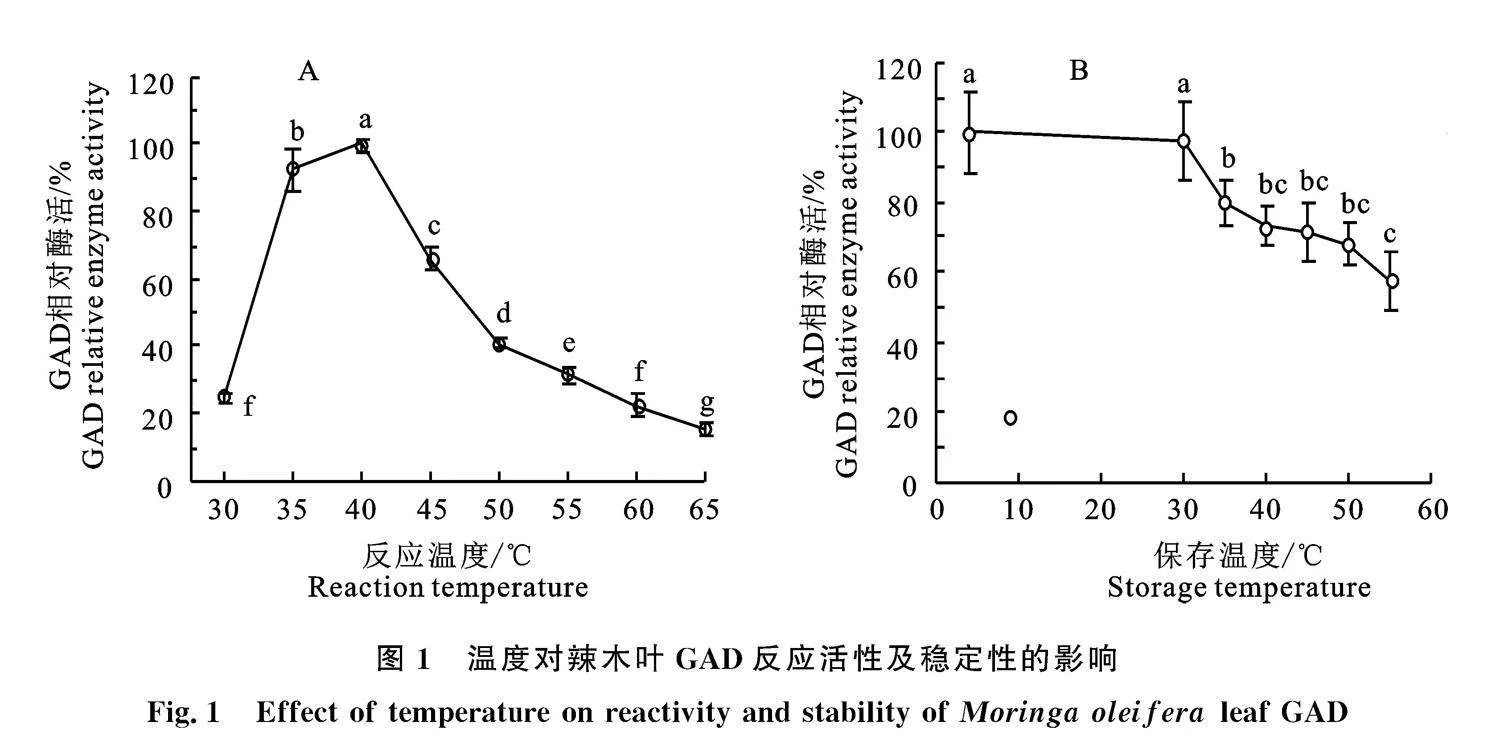
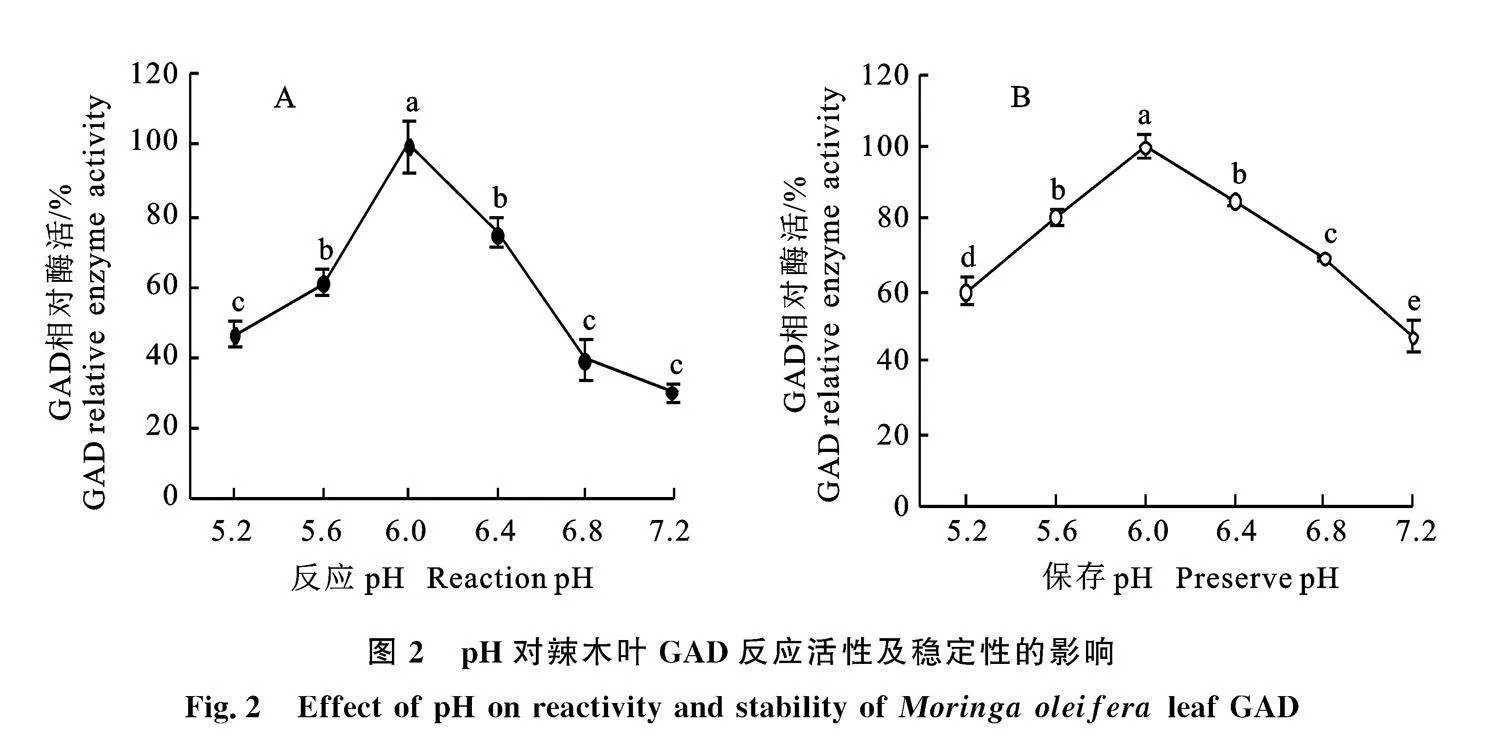
2.1.1" 温度对辣木叶GAD反应活性及稳定性的影响" 图1-A显示,辣木叶GAD活力在30~" 40 ℃随着温度升高而增加,超过40 ℃则GAD活力快速下降,最适反应温度为40 ℃。图1-B显示,当辣木叶GAD在pH 6.0、0.2 mol/L PBS缓冲液中于4~30 ℃保温3 h,活力无显著差异" (P>0.05),保存温度超过30 ℃则GAD逐渐失活,残余GAD活力随保存温度升高而下降,说明辣木叶GAD在4~30 ℃相对较稳定。结果表明,辣木叶GAD对温度依赖性较高,GAD的表观活力是温度对GAD的催化反应活力和稳定性综合影响的结果。在一定温度范围内,GAD活力随温度升高而增强,但温度升高则会造成GAD稳定性下降,这可能是温度超过40 ℃则GAD活力快速下降(图1-A)的原因。
2.1.2" pH对辣木叶GAD反应活性及稳定性的影响" 经对辣木叶GAD的pH依赖性进行分析,结果表明辣木叶GAD活力在pH 5.2~6.0随着pH升高而增加,超过pH 6.0则GAD活力快速下降,最适反应pH为6.0(图2-A);pH对辣木叶GAD 稳定性影响较大,当在不同pH条件下于" 40 ℃保温3 h,pH 6.0组的残余GAD活力最大,偏离pH 6.0则GAD失活较显著(P<0.05),当pH 小于5.6或pH 大于6.4时,残余GAD活力降低到pH 6.0组GAD活力的80%以下,说明辣木叶GAD稳定pH范围较窄,在pH 5.6~6.4相对较稳定(图1-B)。辣木叶GAD的最适反应pH(6.0)与GAD稳定pH(6.0)一致,结果也表明辣木叶GAD的稳定性是酶催化反应活力的基础。
2.2" 辣木叶GABA富集条件研究
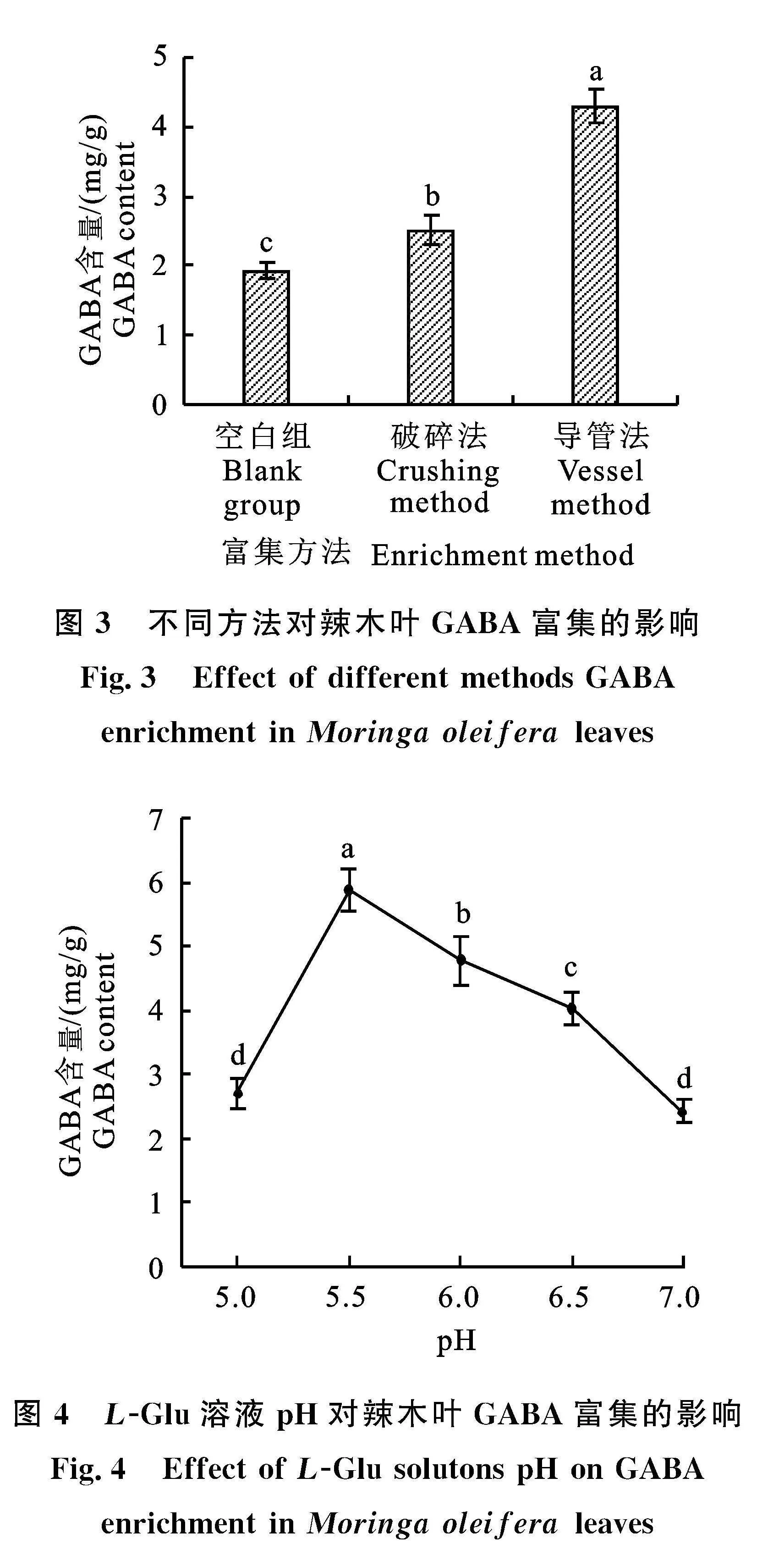
2.2.1" 不同方法对辣木叶GABA富集的影响" 图3表明,破碎法富集GABA并不够理想,GABA含量仅由(1.93±0.11) mg/g增加到了" (2.51±0.21) mg/g,只提高了30.05%。而通过导管法富集,辣木叶GABA的含量达到了" (4.28±0.24) mg/g,GABA含量是富集前的" 2.22倍、破碎法的1.71倍,有望通过条件优化进一步提升GABA含量。因此,选择导管法作为辣木叶GABA的富集方法。
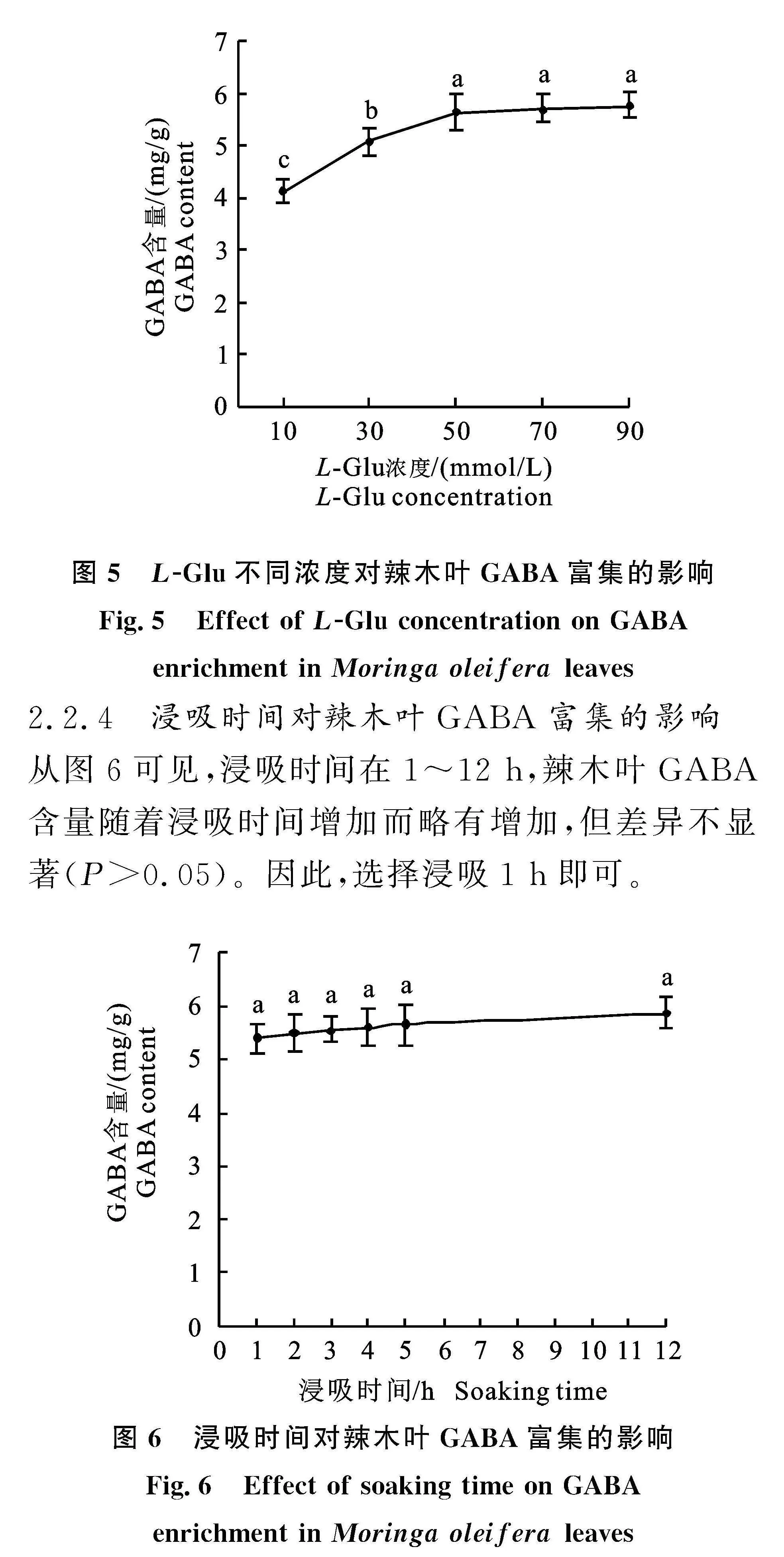
2.2.2" L-Glu溶液pH对辣木叶GABA富集的影响" 从图4可见,当L-Glu溶液pH为5.5时,辣木叶GABA含量最高,为(5.87±0.32) mg/g;当L-Glu溶液pH低于或高于5.5时,辣木叶GABA含量均呈显著下降(P<0.05)。因此,选择L-Glu溶液的pH为5.5。
2.2.3" L-Glu浓度对辣木叶GABA富集的影响" 图5表明随着L-Glu浓度增加,辣木叶GABA含量呈现先增加而逐步趋于平稳,当L-Glu浓度超过50 mmol/L时,辣木叶GABA含量增加不显著(P>0.05)。因此,选择L-Glu浓度为50 mmol/L较为适宜。
2.2.4" 浸吸时间对辣木叶GABA富集的影响" 从图6可见,浸吸时间在1~12 h,辣木叶GABA含量随着浸吸时间增加而略有增加,但差异不显著(P>0.05)。因此,选择浸吸1 h即可。
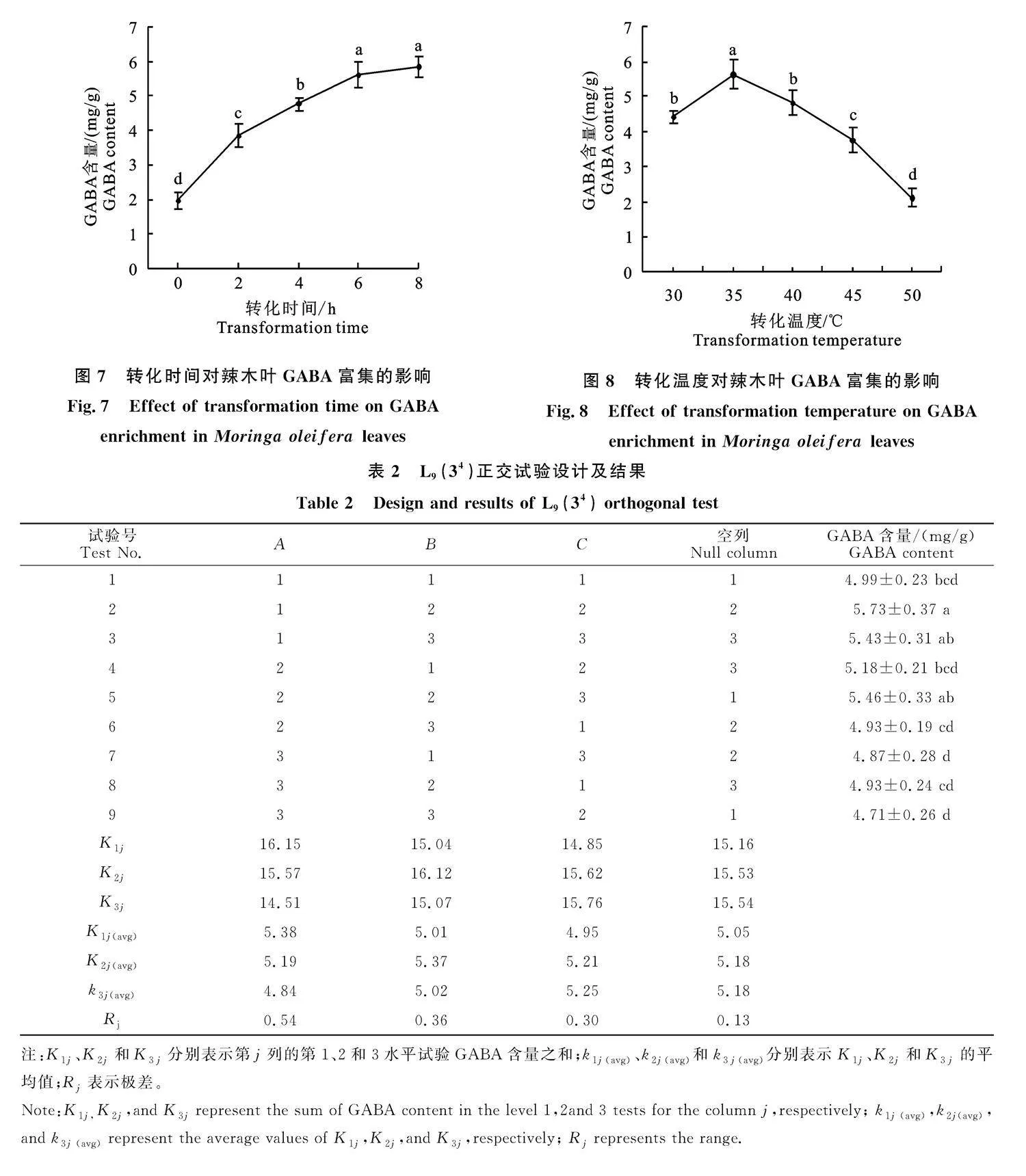
2.2.5" 转化时间对辣木叶GABA富集的影响" 图7显示,辣木叶GABA含量随着转化时间增加而增加,但转化反应6 h后,继续延长转化时间,辣木叶GABA含量增加不显著(P>0.05)。因此,从工艺成本角度考虑,选择转化时间为6 h。
2.2.6" 转化温度对辣木叶GABA富集的影响" 图8显示,当富集温度为35" ℃时,辣木叶GABA含量最高;超过35" ℃,辣木叶GABA含量则随温度升高而减少,各试验组GABA含量差异显著(P<0.05)。因此选择辣木叶富集GABA的温度为35 ℃较为适宜。
2.2.7" 正交试验" 正交试验结果如表2。极差分析表明各因素的R均大于空列R,说明各因素的水平效应存在差异,各试验因素的效应可靠,各因素与辣木叶GABA含量的关系如图9。表2表明影响辣木叶富集GABA的主次因素为Agt;" Bgt;C,最优水平为A1B2C3,即L-Glu溶液pH为5.5、转化温度为35" ℃、转化时间为7 h。
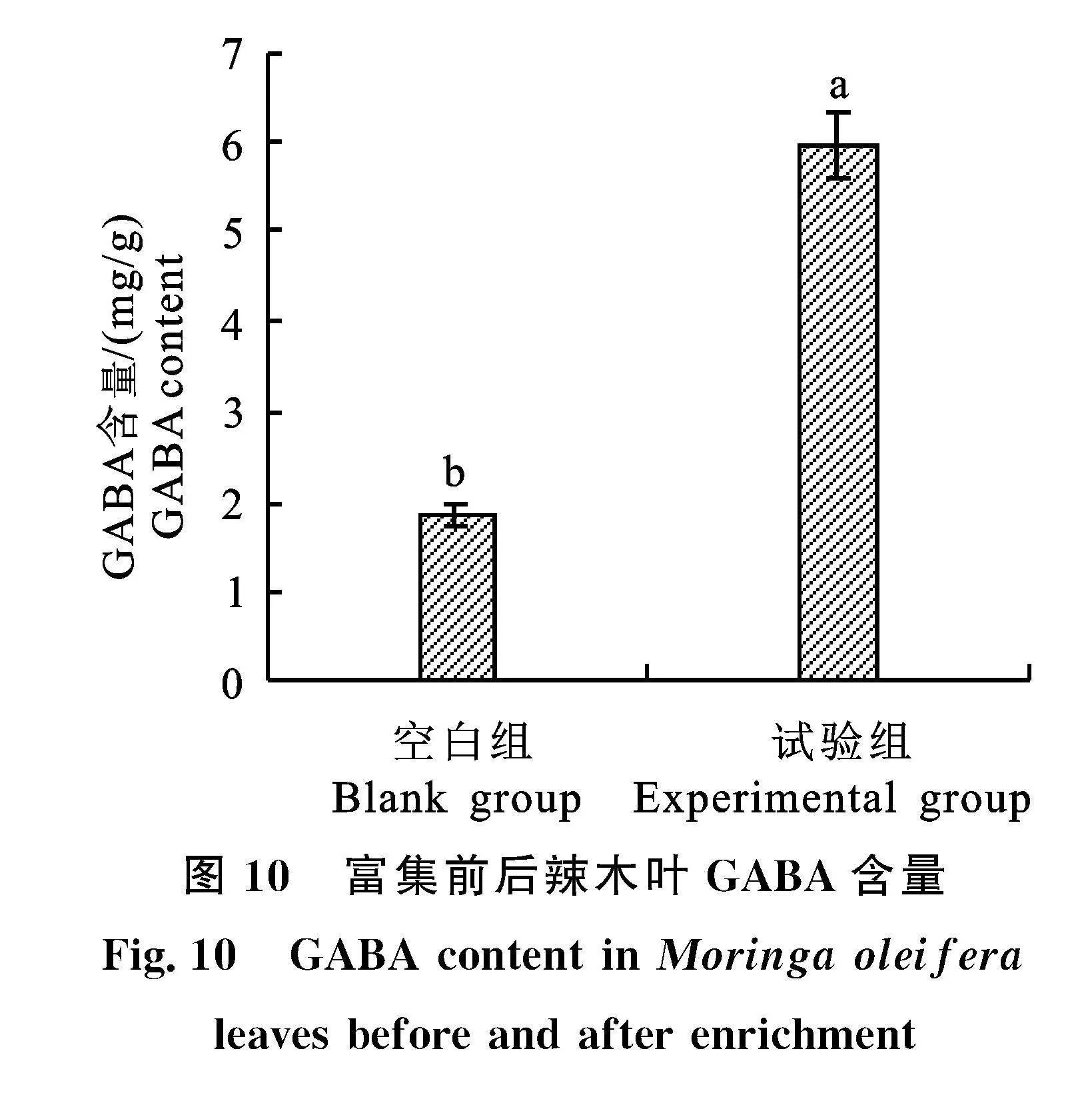
2.2.8" 验证试验" 按照单因素和正交试验的优化条件进行验证试验,结果表明:经过富集,辣木叶GABA含量由初始(1.86±0.13) mg/g增加至(5.97±0.36) mg/g,提高了2.21倍,差异显著(P<0.05)(图10)。以优化条件(即A1B2C3)富集的辣木叶GABA含量[(5.97±0.36) mg/g]略高于正交试验中GABA含量最高的试验组[试验号2,即A1B2C2(5.73±0.37) mg/g],但差异不显著(P>0.05)。图7显示,虽然转化反应6~8 h的辣木叶GABA含量差异不显著,但均值仍呈现缓慢增加的趋势,验证试验结果与图7相符。虽然转化反应6 h和7 h的GABA差异不显著,但GABA含量均值仍以7 h较高,为了保证富集产品GABA含量的稳定性,选择转化反应时间" 7 h较为适宜。由此确定辣木叶富集GABA的适宜条件为:L-Glu溶液pH为5.5,L-Glu浓度" 50 mmol/L,浸吸时间1 h,转化温度35 ℃,转化时间7 h。
3" 讨论与结论
可食植物富集GABA的根本目的是增加食材GABA含量,以利于开发富GABA食品,提升食品的功能性。辣木叶含有GAD,因此可以补充外源L-Glu,利用辣木叶内源GAD的催化作用实现GABA的富集。理论上,将辣木叶破碎(破碎法),可以释放细胞内的GAD,直接转化外源" L-Glu。然而,本研究表明破碎法富集GABA并不理想,GABA含量仅提高了30.05%(图3)。辣木叶破碎后,破坏了叶片组织的天然屏障,GAD更易与氧气、蛋白酶接触而受到破坏,而且组织的破坏也释放了下游代谢GABA的酶(如γ-氨基丁酸转氨酶),增加了GABA的代谢损失,这可能是GABA富集效果欠佳的主要原因,具体原因尚待进一步研究。
由于破碎法破坏了叶片结构,因此只适合开发富GABA的辣木叶粉或以辣木叶粉为基料的产品,在需保持原有食材的外貌特征、结构和风味类的产品(如辣木茶)开发方面存在较大局限。植物导管是植物体内木质部中主要输导水分和无机盐的管状结构[40]。辣木叶表皮气孔和维管束较发达,叶柄和茎导管种类繁多,具有强大的输导功能[41]。采用扦插方式可以通过枝条的导管将溶液中的L-Glu分布到辣木叶细胞中,实现外源L-Glu的无损补充,从而可以利用叶细胞的保护作用,充分发挥GAD催化作用,实现GABA富集。通过导管法进行富集,辣木叶GABA的含量得到大幅提升,富集效果优于破碎法(图3)。
由于L-Glu发生α-脱羧作用生成GABA会消耗H+,从而造成pH升高[42],进而降低GAD的转化活力。在GAD活力测定中可以使用PBS缓冲液进行pH内源控制,然而如在辣木叶中引入PBS缓冲液将因增加叶片磷酸盐含量而影响辣木叶的品质。由于缺乏缓冲体系,需要更低的初始pH抵消转化反应消耗的H+,才能保证GAD在高活力依赖的反应pH范围内发挥催化作用,因此辣木叶富集GABA的适宜初始pH(pH 5.5,图4)低于辣木叶GAD最适反应pH(pH 6.0,图2-A)。
除了酶的反应活性,酶的稳定性也是影响酶应用效率的关键因素。酶法合成效率是酶反应活力和酶稳定性综合效应作用的结果。由于富集转化时间相对较长,温度对GAD稳定性的影响将更为突出。图1-B显示当温度超过30 ℃则GAD逐渐失活,辣木叶富集GABA的最适转化温度(35 ℃,图8)低于辣木叶GAD最适反应温度" (40 ℃,图1-A),与温度对GAD稳定性的影响相关。
动物、植物和微生物均存在催化GABA代谢的γ-氨基丁酸转氨酶[43-45],植物γ-氨基丁酸转氨酶最适反应pH一般高于GAD[44],随着转化时间延长,消耗H+增加[42],叶片内环境pH升高,如pH达到γ-氨基丁酸转氨酶催化活力范围,将加快GABA的代谢。因此,γ-氨基丁酸转氨酶的酶学性质对植物GABA的富集也具有很好的参考价值,但目前尚鲜见关于辣木叶γ-氨基丁酸转氨酶酶学性质的研究报道。
本研究利用植物导管功能,可有效将外源L-Glu均匀分布到辣木叶细胞,并结合辣木叶内源GAD的酶学性质,在不破坏辣木叶原有形态和结构的条件下实现了辣木叶GABA无损富集。适宜富集方法为:将鲜辣木枝条切口端插入" pH 5.5、50 mmol/L L-Glu溶液液面10 cm以下,于室温放置浸吸1 h,摘取辣木叶,将叶片于35 ℃保温7 h。通过该法富集,辣木叶GABA含量由初始(1.86±0.13) mg/g增加至(5.97±" 0.36) mg/g,提高了2.21倍。本研究的富集方法操作简单,能耗和设备要求低,工艺条件容易满足,在富GABA辣木叶产品和其他茶品的开发方面具有很好的应用前景。该富集方法对其他富GABA叶茎类产品开发也具有很好的参考价值。
参考文献" Reference:
[1]" WANG W H,YAMAGUCHI S,KOYAMA M,et al. Evaluation of the antihypertensive activity of eggplant acetylcholine and γ-aminobutyric acid in spontaneously hypertensive rats [J/OL].Molecules,2023,28(6):2835.https://doi.org110.3390/molecules28062835.
[2]OKADA T,SUGISHITA T,MURAKAMI T,et al.Effect of the defatted rice germ enriched with GABA for sleeplessness depression,autonomic disorder by oral administration[J].Journal of the Japanese Society for Food Science and Technology-Nippon Shokuhin Kagaku Kogaku Kaishi,2000,47(8):596-603.
[3]YAMTSU A,YAMASHITA Y,PANDHARIPANDE T," et al.Effect of oral γ-aminobutyric acid (GABA) administration on sleep and its absorption in humans[J].Food Science and Biotechnology,2016,25(2):547-551.
[4]ABDOU A M,HIGASHIGUCHI S,HORIE K,et al.Relaxation and immunity enhancement effects of gamma-aminobutyric acid (GABA) administration in humans[J].Biofactors,2006,26:201-208.
[5]IMAM M U,ISHAKA A,OOI D J,et al.Germinated brown rice regulates hepatic cholesterol metabolism and cardiovascular disease risk in hypercholesterolaemic rats[J].Journal of Functional Foods,2014,8:193-203.
[6]MENG F,HAN Y,SRISAI D,et al.New inducible genetic method reveals critical roles of GABA in the control of feeding and metabolism [J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(13):3645-3650.
[7]XIE Z,XIA S,LE G W.Gamma-aminobutyric acid improves oxidative stress and function of the thyroid in high-fat diet fed mice[J].Journal of Functional Foods,2014,8:76-78.
[8]SONG L,DU A,XIONG Y,et al.γ-Aminobutyric acid inhibits the proliferation and increases oxaliplatin sensitivity in human colon cancer cells [J].Tumor Biology,2016, 37(11):14885-14894.
[9]SCHULLER H M,AL-WADEI H A,MAJIDI M.Gamma-aminobutyric acid,a potential tumor suppressor for small airway derived lung adenocarcinoma[J].Carcinogenesis,2008,29(10):1979-1985.
[10]" 周丽亚,牛玉杰,郑晓冰,等.谷氨酸脱羧酶的分子改造及酶学性质研究[J].中国生物工程杂志,2023,43(5):24-36.
ZHOU L Y,NIU Y J,ZHENG X B,et al.Molecular modification and enzymatic properties of glutamate decarboxylase[J]. China Biotechnology,2023,43(5):24-36.
[11]YANG S Y,LIU S M,JIANG M,et al.Enhancing effect of macroporous adsorption resin on gamma-aminobutyric acid production by Enterococcus faecium in whole-cell biotransformation system[J].Amino Acids,2020,52(5):771-780.
[12]LIM H S,CHA I T,ROH S W,et al.Enhanced production of gamma-aminobutyric acid by optimizing culture conditions of Lactobacillus brevis HYE1 isolated from Kimchi,a Korean fermented food[J].Journal of Microbiology and Biotechnology,2017,27(3):450-459.
[13]LIAO J R,WU X Y,ZHU X J,et al.Gamma-aminobutyric acid (GABA) accumulation in tea (Camellia sinensis L.) through the GABA shunt and polyamine degradation pathways under anoxia [J].Journal of Agricultural and Food Chemistry,2017,65(14):3013-3018.
[14]温翠娟,周" 敏,张露丹,等.高γ-氨基丁酸发芽糙米的循环加湿生产工艺研究[J].食品研究与开发,2022,43(9):132-137.
WEN C J,ZHOU M,ZHANG L D,et al.Cyclic humidification of germinated brown rice enriched with gamma-aminobutyric acid [J].Food Research and Development,2022,43(9):132-137.
[15]BAI Q Y,YANG R Q,ZHANG L X, et al.Salt stress induces accumulation of γ-aminobutyric acid in germinated foxtail millet (Setaria" italica L.) [J].Cereal Chemistry,2013,90(2):145-149.
[16]YANG R Q,HUI Q R,FENG X Y,et al.The mechanism of freeze-thawing induced accumulation of γ-aminobutyric acid in germinated soybean[J].Journal of the Science of Food and Agriculture,2020,100(3):1099-1105.
[17]杨润强,陈" 惠,顾振新.低氧联合NaCl胁迫下蚕豆发芽富集 γ-氨基丁酸培养条件优化[J].食品与发酵工业,2012,38(5):77-80.
YANG R Q,CHEN H,GU ZH X.The optimization of culture condition on γ-aminobutyric acid accumulation in fava bean (Vicia "faba L.) under hypoxia combined with NaCl[J].Food and Fermentation Industries,2012, 38(5):77-80.
[18]姜秀杰,张桂芳,张东杰.真空协同发芽富集豌豆 γ-氨基丁酸的工艺优化研究[J].食品科技,2020,45(5):58-63.
JIANG X J,ZHANG G F,ZHANG D J.Optimization of vacuum and germination treatment on γ-aminobutyric acid accumulation in pea [J].Food Science and Technology,2020,45(5):58-63.
[19]王中磊,马玉玲,王丽丽,等.湿热处理下富含γ-氨基丁酸芸豆品种的选择及筛选方法的建立[J].中国粮油学报,2021,36(6):36-44.
WANG ZH" L,MA Y L,WANG L L, et al.Cultivar selection and establishment of screening method for GABA-rich kidney beans under heat-moisture treatment[J].Journal of the Chinese Cereals and Oils Association,2021,36(6):36-44.
[20]JIN Y C,TU J,HAN X Y,et al.Characteristics of mulberry leaf powder enriched with γ-aminobutyric acid and its antioxidant capacity as a potential functional food ingredient [J].Frontiers in Nutrition,2022,9:900718.
[21]SUN Y,JI D Y,MA H L,et al.Ultrasound accelerated γ-aminobutyric acid accumulation in coffee leaves through influencing the microstructure,enzyme activity,and metabolites [J].Food Chemistry,2022,385:132646.
[22]PANDEY A,PRADHEEP K,GUPTA R,et al.‘Drumstick tree’ (Moringa oleifera Lam.):a multipurpose potential species in India [J].Genetic Resources and Crop"" Evolution,2011,58(3):453-460.
[23]崔一凡,陈香兰,张" 旭,等.辣木叶成分及其活性研究进展[J].沈阳药科大学学报,2022,39(9):1142-1150.
CUI Y F,CHEN X L,ZHANG" X,et al.Research progress on the constituents and activities of Moringa oleifera leaves[J].Journal of Shenyang Pharmaceutical University,2022,39(9):1142-1150.
[24]袁" 静,梁文仪,袁永兵,等.辣木叶化学成分和药理活性的研究进展[J].中草药,2021,52(14):4422-4432.
YUAN J,LIANG W Y,YUAN Y B,et al.Research progress on chemical constituents and pharmacological activities of Moringa oleifera leaves[J].Chinese Traditional and Herbal Drugs,2021,52(14):4422-4432.
[25]杨胜远,江 敏,胡小军,等.一种富含天然γ-氨基丁酸的新食材[J].食品研究与开发,2017,38(22):153-157.
YANG SH Y,JIANG M,HU X J,et al.A novel edible material with rich natural gamma-aminobutyric acid[J].Food Research and Development,2017,38(22):153-157.
[26]SHARIFF N F S M,SINGGAMPSLAM T,NG C H," et al.Antioxidant activity and zebrafish teratogenicity of hydroalcoholic Moringa oleifera L.leaf extracts [J].British Food Journal, 2020,122(10):3129-3137.
[27]BAMAGOUS G A,GHAMDI S" S" A,IBRAHIM I A A,et al.Antidiabetic and antioxidant activity of ethyl acetate extract fraction of Moringa oleifera leaves in streptozotocin-induced diabetes rats via inhibition of inflammatory mediators [J].Asian Pacific Journal of Tropical Biomedicine,2018,8(6):320-327.
[28]CHEN G L,XU Y B,WU J L,et al.Hypoglycemic and hypolipidemic effects of Moringa oleifera leaves and their functional chemical constituents [J].Food Chemistry,2020,333:127478.
[29]NURHAYATI A,KUSHARTO C M,MADANIJAH S," et al.Effect of feeding Moringa oleifera leaves capsule’s" on the uric acid in pre-elderly[J].Indian Journal of Public Health Research and Development,2019,10(12):1880.
[30]TIAN Y C,LIN L Z,ZHAO M M,et al.Xanthine oxidase inhibitory activity and antihyperuricemic effect of Moringa oleifera Lam.leaf hydrolysate rich in phenolics and peptides [J]. Journal of Ethnopharmacology, 2021,270:113808.
[31]WIDYANINGSIH T D,RACHMAWATI M,PRABAWATI E,et al.Anti-inflammatory effects of functional beverage from a mixture of moringa leaves,pandanus leaves,and red ginger in mice induced with monosodium urate crystal [J].IOP Conference Series:Earth and Environmental Science,2021,733(1):012129.
[32]DOS SANTOS A O,DO VAL D R,DA SILVEIRA F D,et al.Antinociceptive,anti-inflammatory and toxicological evaluation of semi-synthetic molecules obtained from a benzyl-isothiocyanate isolated from Moringa oleifera Lam.in a temporomandibular joint inflammatory hypernociception model in rats [J].Biomedicine amp; Pharmacotherapy,2018,98:609-618.
[33]ONAH C E,MELUDU S C,DIOKA C E,et al.Amelioratory effect of methanolic leaf extract of Moringa oleifera on some liver and kidney function and oxidative stress markers in lead-intoxicated rats [J].European Journal of Medicinal Plants,2016,12(4):1-12.
[34]罗凤仙,解" 静,钱颖艳,等.辣木生物碱抑制宫颈癌Hela细胞增殖和诱导其凋亡的作用 [J].现代食品科技,2020,36(2):18-24.
LUO F X ,XIE J ,QIAN Y Y ,et al.Inhibition of proliferation and apoptosis of cervical cancer hela cells by treating with Moringa oleifera Lam alkaloids [J].Modern Food Science and Technology,2020,36(2):18-24.
[35]LUETRAGOON T,SRANUJIT R P,NOYSANG C," et al.Anti-cancer effect of 3-hydroxy-β-ionone identified from Moringa oleifera Lam.leaf on human aquamous cell carcinoma 15 cell line [J].Molecules,2020,25(16):3563.
[36]党" 玥,田梦媛,王承潇,等.辣木叶提取物对便秘小鼠润肠通便的作用及机制研究[J].中草药,2021,52(14):4241-4247.
DANG Y,TIAN M Y,WANG CH X,et al. Effect and mechanism of Moringa oleifera leaves extract on moistening intestines and purgation in constipated mice [J].Chinese Traditional and Herbal Drugs,2021,52(14):4241-4247.
[37]OKADA T,SUGISHITA T,MURAKAMI T,et al.Effect of the defatted rice germ enriched with GABA for sleeplessness,depression,autonomic disorder by oral administration [J].Nippon Shokuhin Kagaku Kaishi, 2000, 47(8):596-603.
[38]TAKAHASHI C,SHIRAKAWA J,TSUCHIDATE T," et al. Robust production of gamma-aminobutyric acid"" using recombinant Corynebacterium glutamicum expressing glutamate decarboxylase from Escherichia coli [J].Enzyme amp; Microbial Technology,2012,51(3):171-176.
[39]杨胜远,林" 谦,赖丽萍,等.屎肠球菌纤维素结合域谷氨酸脱羧酶构建及其酶学性质[J].食品与发酵工业,2019,45(21):22-30.
YANG SH Y,LIN Q,LAI L P,et al.Construction and characteristics of recombinant cellulose-binding domain-glutamate decarboxylase of Enterococcus jaecium[J].Food and Fermentation Industries,2019,45(21):22-30.
[40]邹子瑜,谷利伟,张大维.东北地区李属(Prunes L.)植物导管分子形态结构研究[J].植物研究,2021,41(1):4-11.
ZOU Z Y,GU L W,ZHANG D W.Morphological structure of vessel elements of Prunes L.from northeast area of China [J].Bulletin of Botanical Research, 2021,41(1):4-11.
[41]刘长倩.辣木的显微鉴定及化学成分研究[D].合肥:安徽中医药大学,2016.
LIU CH Q.Study on the microscopic identification and chemical constituents of" Moringa oleifera Lam.[D].Hefei:Anhui University of Chinese Medicine,2016.
[42]DE BIASE D,TRAMONTI A,BOSSA F,et al.The response to stationary-phase stress conditions in Escherichia coli:role and regulation of the glutamic acid decarboxylase system [J].Molecular Microbiology,1999,32(6):1198-1211.
[43]WALLS A B,NILSEN L H,EYJOLFSSON E M,et al. GAD65 is essential for synthesis of GABA destined for tonic inhibition regulating epileptiform acticity [J]. Journal of Neurochemistry,2010,115(6):1398-1408.
[44]廖明星,陈志杰.原料鲜茶叶γ-氨基丁酸富集的关键技术[J].食品科技,2007(9):92-95.
LIAO M X,CHEN ZH" J.Key technology of gamma-aminobutyric acid enrichment in tea shoots [J].Food Science and Technology, 2007(9):92-95.
[45]朱" 莉,宋福平,张" 杰,等.苏云金芽胞杆菌γ-氨基丁酸代谢途径相关功能基因的克隆、表达及同源性分析[J].微生物学通报,2007,34(6):1031-1036.
ZHU L,SONG F P,ZHANG J,et al.Cloning expression and phylogenetic analysis of two GABA shunt-related proteins from Bacillus thuringiensis [J].Microbiology China,2007,34(6):1031-1036.
Enrichment Method for γ-Aminobutyric Acid in Moringa oleifera" Leaves
YANG Shengyuan,PENG Yuanhuai,ZHANG Shiqi,YANG Juan, JIANG Min and WANG Biaoshi
(College of Food Science and Engineering,Lingnan Normal University,Zhanjiang Guangdong" 524048,China)
Abstract" To increase the content of γ-aminobutyric acid (GABA) in Moringa oleifera" leaves,exogenous L-glutamic acid (L-Glu) was supplied to the leaf cells through the vessel of Moringa oleifera" branches.Using the GABA content in dried leaves as the evaluation indicator,the optimal conditions for the GABA enrichment in Moringa oleifera" leaves using plant vessel method were investigated,taking into account the enzyme characteristics of glutamate decarboxylase (GAD) of Moringa oleifera" leaf,pH and concentration of L-Glu solution,soaking time,conversion reaction time and temperature.The results indicated that the Moringa oleifera" leaf GAD exhibited the highest reactivity at 40 ℃ and pH 6.0,and remained relatively stable in the range of 4-30" ℃ and pH 5.6-6.4.Due to the protection provied by cell,the enrichment efficiency of the plant vessel method (supplementing exogenous L-Glu through the plant vessel) was better than that of the crushing method (crushing the leaves to release GAD for converting exogenous L-Glu to GABA).The GABA content in Moringa oleifera" leaves enriched by plant vessel method was 1.71 times higher than that obtained with the crushing method.When the cut ends of fresh branches were inserted into pH 5.5 L-Glu solution (50 mmol/L) at room temperature for 1 h,the Moringa oleifera" leaves were plucked and then incubated at 35 ℃ for 7 h,the GABA content of Moringa oleifera" leaves increased from the initial level of (1.86 ± 0.13) mg/g to (5.97 ± 0.36) mg/g,which was increased 2.21 times.Considering the simplicity of the GABA enrichment process through plant vessel method,it has a good application prospect in the development of GABA-rich Moringa oleifera" leaf products.
Key words" Moringa oleifera; Gamma-aminobutyric acid; Glutamate decarboxylase; Plant vessel; Enrichment
Received"" 2023-08-24""" Returned" 2023-11-06
Foundation item" Research Capacity Enhancement Project for Key Construction Discipline of Guangdong Province (No.2022ZDJS079); the Characteristic Innovation Project for Universities of Guangdong Province (No.2022KTSCX073); the Natural Science Foundation of Guangdong Province"" (No.2022A1515010360); Characteristic Specialty Project for Teaching Quality and Teaching Reform Engineering in Universities of Guangdong Province (No.2022KTSCX073).
First author" YANG Shengyuan,male,Ph.D,professor.Research area: green biological manufacturing.E-mail:yangsy1972@163.com
(责任编辑:史亚歌" Responsible editor:SHI Yage)

