不同海拔九寨沟林下人参土壤特性分析


摘" 要" 探究九寨沟不同海拔林下人参根际土壤养分、酶活性及微生物群落特性,筛选有利于林下人参生长的海拔高度,为九寨沟林下人参的科学种植提供技术参考。以同1 a生不同海拔高度的林下人参根际土壤为研究对象,检测土壤养分、土壤酶活性和土壤微生物,分析海拔对林下人参根际土壤营养因子、酶活性和微生物的影响,并分析土壤微生物群落与理化性质和酶活性的相关性。结果表明,林下人参根际土壤pH和蔗糖酶随着海拔升高而降低,土壤pH由7.70降至7.30,海拔每降低100 m,蔗糖酶降幅为50%;不同海拔林下人参根际土壤微生物多样性差异显著,细菌多样性指数随海拔增高而降低,海拔1 950 m处与2 150 m处细菌多样性指数差异显著,且细菌 OTU 数量大于真菌;九寨沟地区林下人参根际土壤微生物受pH和速效钾影响较大。海拔1 950 m的土壤环境更适宜九寨沟林下人参的生长。
关键词" 海拔;林下人参;土壤理化性质;土壤酶活性;土壤微生物
doi:10.7606/j.issn.1004-1389.2024.08.014
https://doi.org/10.7606/j.issn.1004-1389.2024.08.014
收稿日期:2023-11-27" 修回日期:2024-03-22
基金项目:四川省科技计划(2022YFQ0092);国家现代农业产业技术体系(CARS-21)。
第一作者:金梦真,女,硕士研究生,研究方向为药用植物栽培。E-mail:540167713@qq.com
通信作者:张亚玉,女,研究员,研究方向为中药材生产关键技术及质量评价。E-mail:zyy1966999@sina.com
人参(Panax" ginseng C.A.Mey.)作为“百草之王”,在中国已有四千多年的应用历史 [1]。随着时代的变迁,野生人参资源逐渐减少,且可种植人参的农田资源有限,发展人参新产区势在必行。而将人参种植在自然林下,不仅可以充分利用林地资源,还可以有效缓解种植业与林业之间的矛盾,并能够有效带动相关产业的发展[2]。
对植物生长发育而言,环境是重要影响因素之一,植物生长形态以及生理活动在不同环境下存在差异[3]。海拔通过影响气温、降水、光照等生态因子间接影响植物生长[4]。在长白山高海拔地区,人参总皂苷会随海拔升高而下降[5]。人参皂苷合成相关重要酶基因的表达与海拔高度存在明显正相关性[6]。土壤作为药用植物的养分来源,其理化性质、酶活性和微生物群落等多种因素相互作用,为药用植物提供养分。海拔作为环境因子的主导因素,会显著影响气温、光照等生态因子,进而导致土壤特性在空间上的非均一性分布[7-8]。作为维持土壤养分平衡的重要参与者,土壤微生物和酶活性对于药用植物生长发育有着突出作用[9-10],并且海拔高度对微生物群落结构和酶活性存在影响。刺梨根际土壤微生物组成及多样性随海拔高度变化而变化,且在不同海拔高度下其根际真菌功能存在明显差异[11]。此外,海拔高度也影响方竹林根际土壤酶活性,在不同海拔条件下其酶活性呈现出差异化的变化趋势[12]。通过对不同海拔的土壤环境差异进行分析,为合理利用山区林地资源提供参考依据,有着重要的研究价值和现实意义。
目前,林下人参种植区主要集中在东北地区,之前的研究大多集中在人参的品质、产量等方面,而对海拔、土壤微生物和酶活性方面的相关研究关注较少。林下人参生长过程中需要一定的低温环境才能满足人参生理后熟和形态后熟的特性。而九寨沟位于西南地区,气候条件与东北地区差异较大,因此选择适宜的海拔高度对林下人参生长发育至关重要。本文研究海拔对九寨沟林下人参根际土壤特性的影响,探讨不同海拔下林下人参根际土壤养分、土壤酶活性和微生物的差异,并揭示土壤营养因子和酶活性与微生物之间的相关性,以期从选土的角度筛选九寨沟地区有利于林下人参生长的海拔范围,为该地区林下人参种植提供科学指导,保障人参产业的可持续发展。
1" 材料与方法
1.1" 研究区概况和样品采集
2022年10月在四川省九寨沟县白十八坊林下人参基地(33°18′28″N,103°58′12″E)采集样品(表1),分别为海拔1 950 m(样品A)、2 050 m(样品B)和2 150 m(样品C)的林下人参根际土壤。林下人参为2014年移植的15 a生人参。在不同海拔高度下,通过随机取样法选取3~5个样点采集林下人参根际土壤。将采集的土壤分成两份,一份放在通风处自然阴干,风干土样分别过20目和100目筛,用于后续土壤理化性质测定;一份置于-80" ℃冰箱中保存,用于后续土壤细菌" 16S rRNA、真菌ITS序列测序和土壤酶活性检测。
1.2" 方法
1.2.1" 土壤养分测定" 土壤pH采用原位电位法测定[13];土壤速效磷(AP)、速效钾(AK)、碱解氮(AN)、全磷(TP)和全钾(TK)参照《土壤农化分析》进行相关指标测定[14];全氮(TN)和有机质(SOM)采用元素分析仪法测定[15]。
1.2.2" 土壤酶活性测定方法" 土壤中性磷酸酶(S_NP)活性采用磷酸苯二钠比色法测定[16];脲酶(S_UE)活性采用靛酚蓝比色法[16];土壤蔗糖酶(S_SC)活性采用3,5-二硝基水杨酸比色法测定[16];土壤过氧化氢酶(S_CAT)采用试剂盒(由上海生工生物工程公司提供)方法检测。
1.2.3" DNA提取" 使用磁珠法土壤和粪便基因组DNA提取试剂盒(TianGen)提取DNA,按照试剂盒说明进行操作。提取完成后,取适量的林下人参根际土壤DNA放入离心管中,稀释至" 1 ng/μL,并通过1%琼脂糖凝胶电泳检测DNA的纯度和浓度。
1.2.4" PCR产物获取" 16S V4区引物:515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACNVGGGTWTCTAAT-3′)。ITS1 区引物:ITS5- 1737FF(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2-2043R(5′-GCTGCGTTCTTCATCGATGC-3′)。所用引物由生工生物工程科技股份有限公司合成并提供。
以提取的基因组DNA为模板,配制反应体系:15 μL Phusion
?偵r" High-Fidelity PCR Master Mix ( New England Biolabs),上下游引物(10 μmol·L-1)各 0.2 μL,模板1 μL,3.6 μL 的 ddH2O。PCR反应程序为:98 ℃预变性1 min;98 ℃、" 10 s,50 ℃、30 s,72" ℃、30 s,进行 30 个循环;" 72" ℃、5 min。
1.2.5" 文库构建和测序" 使用NEB Next" UltraTM II FS DNA PCR-free Library Prep Kit建库试剂盒(New England Biolabs)进行文库构建,Qubit和Q-PCR定量合格后,使用Illumina NovaSeq 6000进行PE 250测序。
1.3" 数据统计与分析
采用诺禾致源平台提供的QIIME 2对微生物序列进行处理,运用R语言对微生物群落多样性进行Alpha分析、Bete分析和PCoA分析等,并绘制相关图表。使用Excel 2016和SPSS 26软件进行土壤酶活性及土壤理化性质数据处理。
2" 结果与分析
2.1" 海拔对林下人参根际土壤理化性质和酶活性的影响
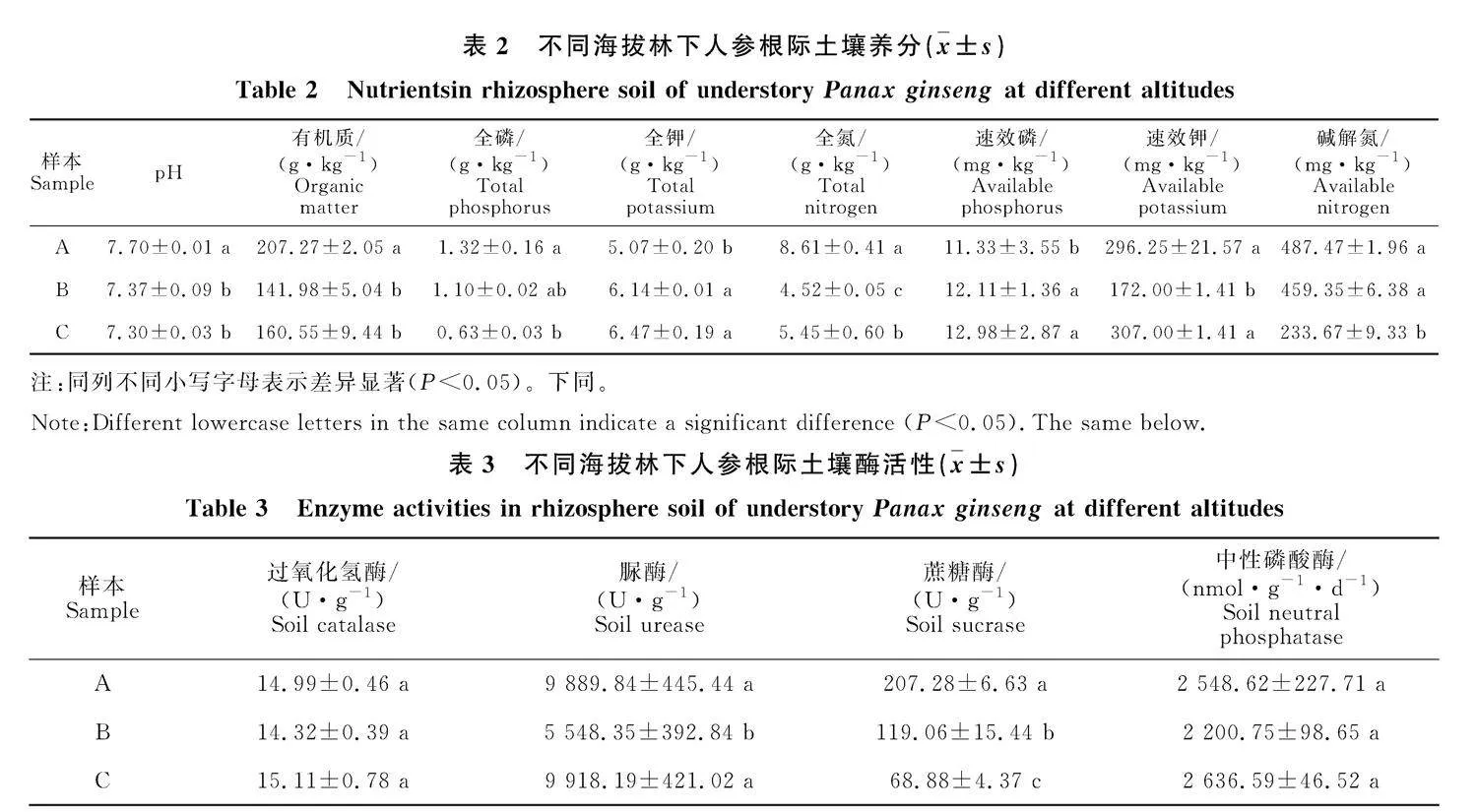
由表2可知,九寨沟林下人参根际土壤各养分指标在不同海拔间存在显著性差异。随着海拔增加,pH及全磷和碱解氮含量呈降低趋势,全氮、速效磷、有机质和速效钾含量则先减少后增加。全钾含量随着海拔升高而增加。
不同海拔间林下人参根际土壤酶活性存在差异(表3)。随着海拔增高,林下人参根际土壤中脲酶活性呈现先下降后上升的趋势,蔗糖酶活性则表现为下降趋势。结果表明,海拔1 950 m处4 种土壤酶活性均较高,2 050 m处偏低。海拔对过氧化氢酶和中性磷酸酶的影响不显著。
2.2" 不同海拔林下人参根际土壤微生物群落分析
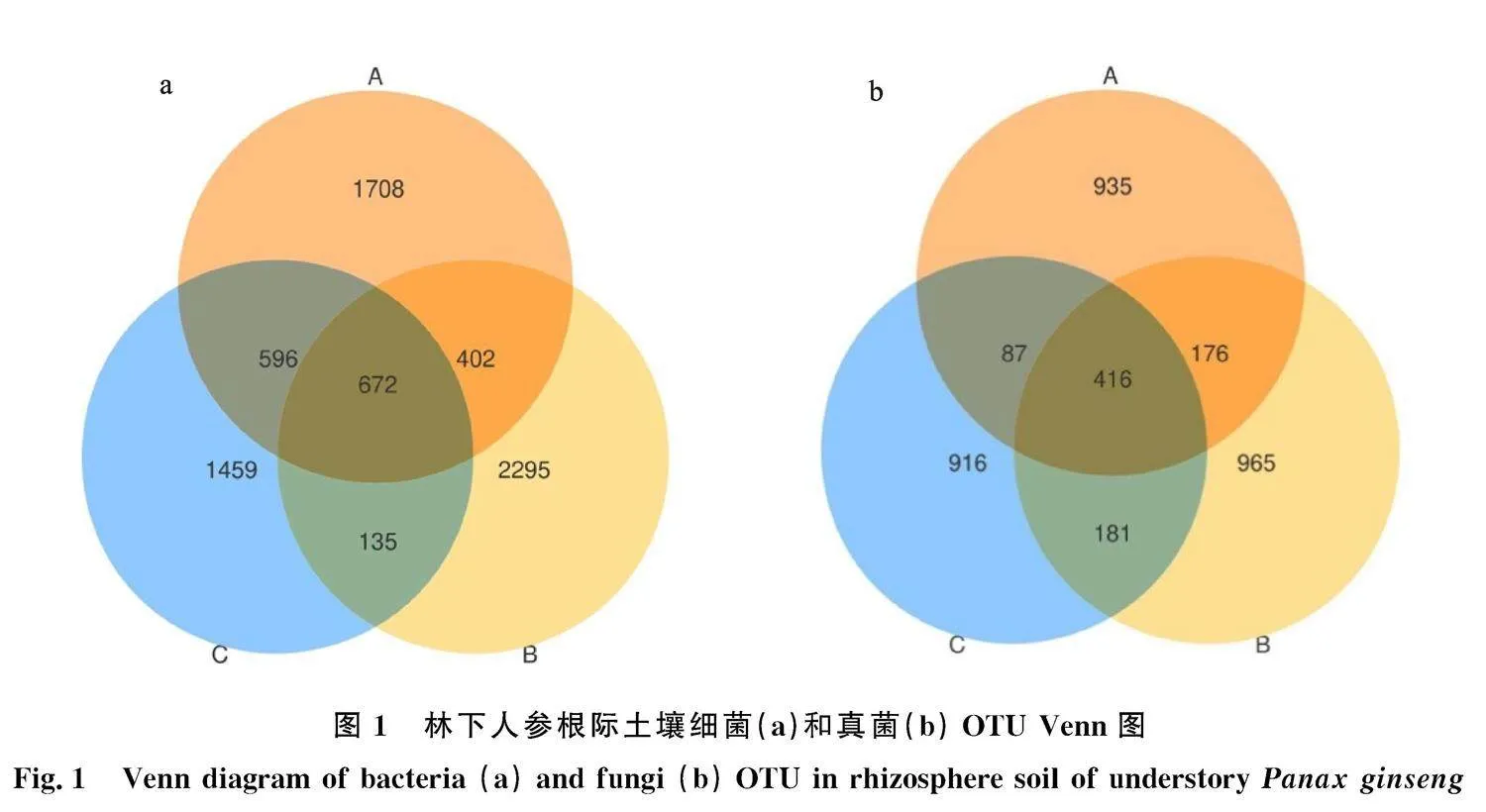
2.2.1" 林下人参根际土壤微生物群落OTU数量分析" 林下人参根际土壤细菌的OTU代表序列经过对比鉴定得到61门122纲26目374科 594属1 353种(图1和图2)。海拔2 050 m处特有细菌数最多,为2 295,海拔2 050 m处共3 504个OTU数,海拔2 150 m处特有细菌数最少,为1 559,共2 862个OTU数;林下人参根际土壤真菌的OTU代表序列经过对比鉴定得到14门57纲160目426科959属1 435种。不同海拔高度下优势菌群组成相似,真菌在海拔1 950 m、2 050 m和2 150 m无显著性差异。
2.2.2" 林下人参根际土壤微生物群落组成" 在门分类水平对九寨沟地区林下人参根际土壤细菌相对丰度进行比较,前10物种分别为:Proteobacteria(变形菌门)17.06%~29.39%,unidentified_Bacteria为14.12%~20.28%,Actinobacteria(放线菌门)为9.26%~14.23%,Acidobacteria(酸杆菌门)为4.83%~10.83%,Firmicutes(厚壁菌门)为2.42%~9.13%,Verrucomicrobiota(疣微菌门)为2.19%~8.89%,Crenarchaeota(泉古菌门)为0.53%~8.63%,Chloroflexi(绿弯菌门)为2.36%~3.08%,Bacteroidetes(拟杆菌门)为0.65%~1.65%,其他细菌群落为9.87%~11.23%(图2-a)。其中,Proteobacteria和Actinobacteria的相对丰度受海拔影响较为明显,呈现出先降低后升高的趋势,而unidentified_Bacteria和Actinobacteriota则呈相反趋势;属水平优势菌群为Bradyrhizobium(慢生根瘤菌属)、Mycobacterium(分枝杆菌属)、Bacillus(芽孢杆菌属)、RB14。其余种类的菌群占比都低于5%。Bradyrhizobium、Mycobacterium和Bacillus相对丰度随着海拔增加先降低后升高,RB14则相反,呈现先升高后降低的趋势。
不同海拔林下人参根际土壤的优势真菌群落(图2-b)显示,Ascomycota(子囊菌门)占比最高,为52.28%~76.77%,Basidiomycota(担子菌门)为6.67%~32.27%,Morierellomycota(被孢霉门)为4.63%~15.32%,Mucoromycota(毛霉菌门)为1.49%~7.65%,Rozellomycota(罗兹菌门)为0.20%~3.63%。其他真菌占比较低,均在1%以下。在Ascomycota方面,海拔2 050 m处的相对丰度显著高于其他组;在Basidiomycota方面,海拔2 150 m处的相对丰度最高,而Morierellomycota和Rozellomycota的相对丰度则低于其他海拔。在属水平上,优势真菌群落包括Penicillium(青霉菌属)、Geminibasidium(双担菌属)、Beauveria(白僵菌属)和Podila。不同海拔各菌属的相对丰度有所不同,其中海拔2 050 m处的Penicillium(29.20%)相对丰度高于" 1 950 m和2 150 m组,而Geminibasidium在海拔2 150 m处(26.86%)相对丰度最高。对于Beauveria和Podila,在海拔1 950 m处的相对丰度高于2 050 m和2 150 m。
2.3" 不同海拔林下人参根际土壤微生物多样性分析
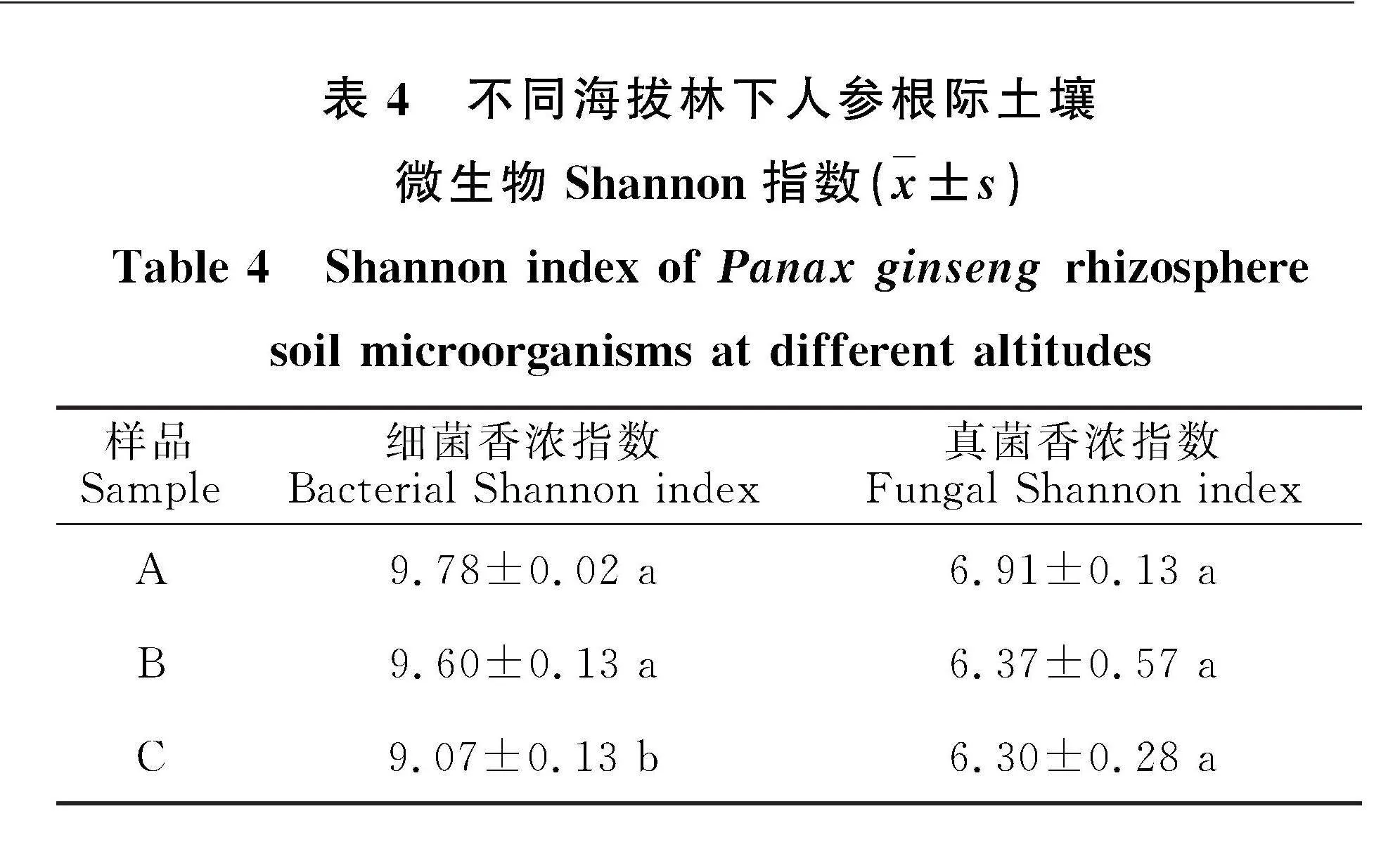
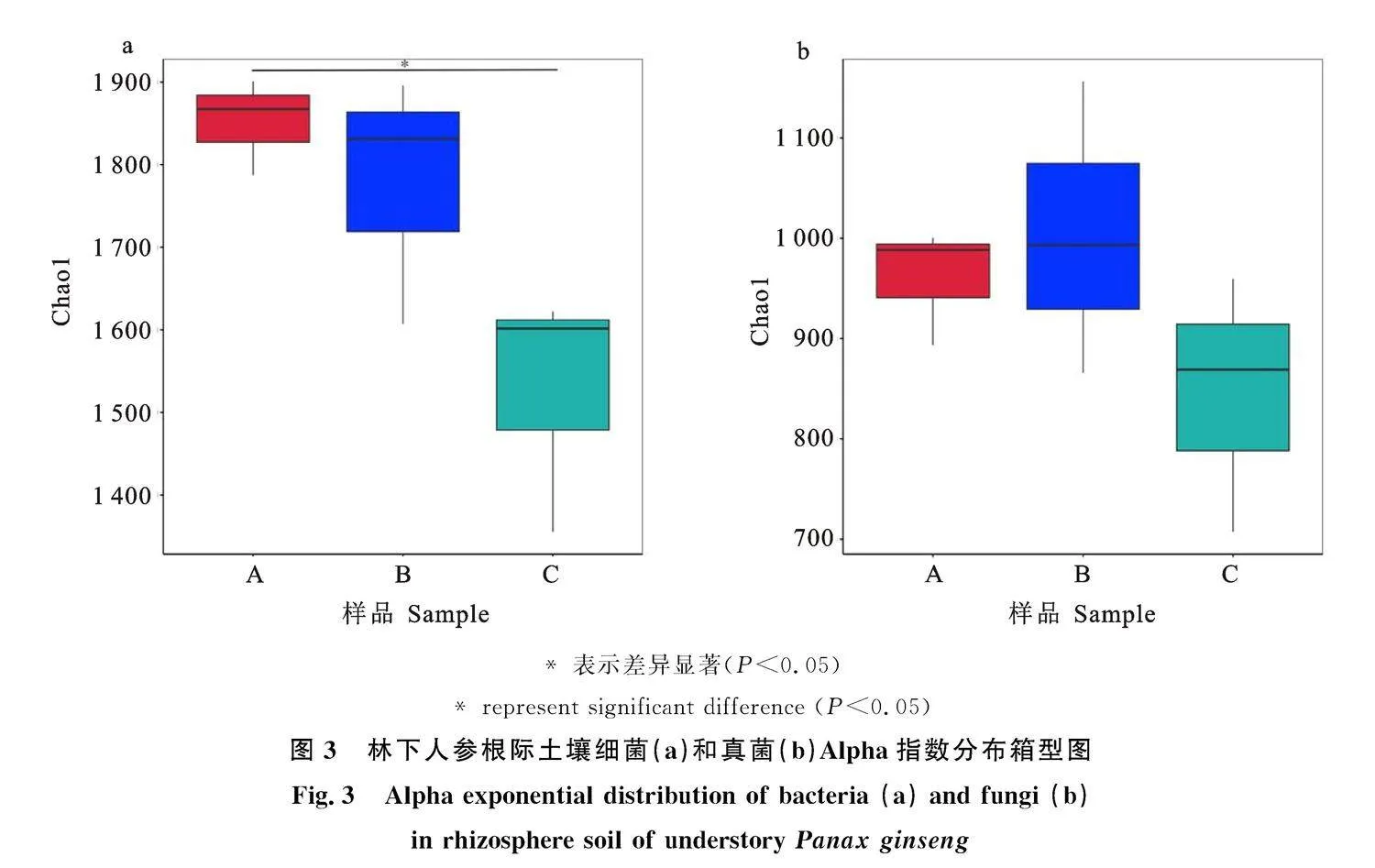
2.3.1" 土壤微生物Alpha多样性分析" 在宏基因组中,Chao1指数和Shannon指数用来反映微生物群落的丰富度和多样性,指数越大,表示样品中微生物群落物种数目越多,种类越丰富。Chao1分析结果(图3)表明,土壤细菌在海拔" 1 950 m与2 150 m间差异显著,与2 050 m无显著性差异,说明海拔高度的差异会引起细菌数目的变化,而根际土壤真菌数量在不同海拔间无显著性差异。Shannon指数分析结果(表4)表明,海拔越高,指数越低,细菌丰富度降低;而真菌在不同海拔间无显著性差异。综上所述,海拔对于林下人参根际土壤细菌群落结构影响较大,而对真菌群落影响较小。
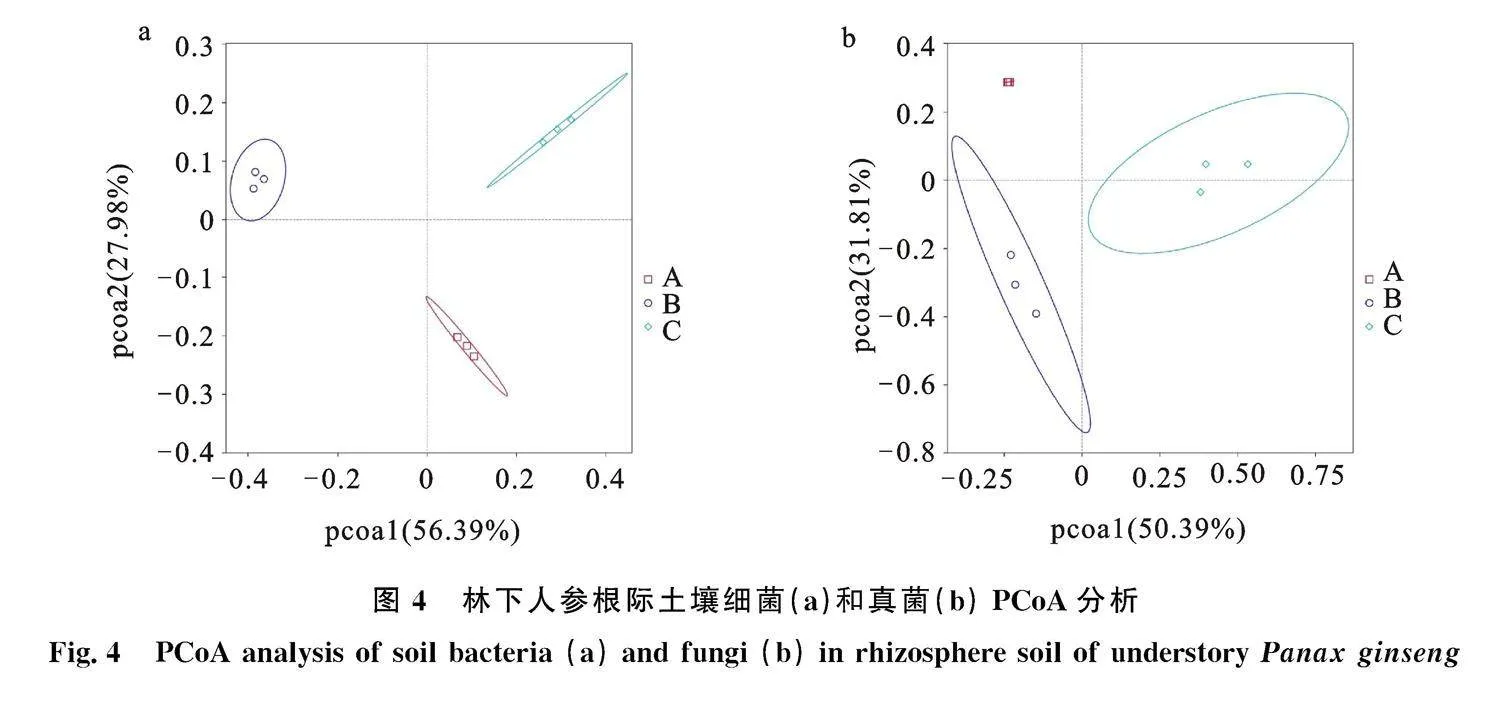
2.3.2" 土壤微生物Bete分析" PCoA分析用于研究微生物群组的相似性,距离越近,表明两个样品中微生物群组越相似,基于Bray-Curtis距离对九寨沟不同海拔林下人参根际土壤微生物进行PCoA分析。
不同海拔林下人参根际土壤微生物差异性较大(图4)。细菌Pcoa1和Pcoa2分别解释" 56.39%和27.98%的方差变异,二者累计贡献率为84.37%。Pc1可以将海拔2 050 m与1 950 m和2150m分开,Pcoa2可以将海拔1950m与
2 050 m和2 150 m分开,各个海拔土壤样品比较聚集,组内差异较小,组间差异较大;真菌Pc1和Pc2分别解释50.39%和31.81%的方差变异,二者累计贡献率为82.10%。Pcoa1可以将海拔" 2 150 m与1 950 m和2 050 m分开,Pcoa2可以将海拔1 950 m与2 050 m和2 150 m分开。
2.4" 不同海拔林下人参根际土壤微生物与土壤养分和酶活性相关性分析
分别筛选相对丰度排名前10的优势细菌和真菌,采用Spearman分析其菌属与土壤养分和酶活性之间的相关性。结果表明,有机质、pH、全氮、速效钾、脲酶、中性磷酸酶和过氧化氢酶与细菌群落分布有关(图5-a)。有机质和全氮与Proteobacteria、Actinobacteria和Bacteroidetes呈极显著正相关,与Crenarchaeota呈极显著负相关;速效钾、脲酶和中性磷酸酶与Actinobacteria和Firmicutes呈极显著负相关,与Verrucomicrobiota呈极显著正相关;而过氧化氢酶与上述菌群相关性呈相反趋势。
真菌群落主要受到土壤中碱解氮、全钾和全磷的影响。速效钾、中性磷酸酶和脲酶与Ascomycota、Chytridiomycota(壶菌门)和Fungi_phy_Incertae_sedis呈极显著负相关,与Mucoromycota和Zoopagomycota则呈极显著正相关;而过氧化氢酶与Mucoromycota和Zoopagomycota呈极显著负相关(图5-b)。
3" 讨" 论
3.1" 不同海拔林下人参根际土壤养分和酶活性分析
随着山区地势的不断上升,空气中降水量与相对湿度发生垂直变动,产生了气候差异,从而影响土壤养分状况[17]。在九寨沟地区,林下人参根际土壤pH和全磷含量随海拔增加而降低,全钾含量随海拔升高而增加,这与张可等[18]研究结果一致。土壤酶活性与土壤养分紧密相关,是土壤肥力的重要体现[19]。本研究中脲酶在海拔" 2 050 m处活性低于1 950 m和2 150 m,海拔" 2 050 m处全氮含量最低,结果表明不同海拔土壤脲酶活性与土壤全氮含量随海拔变化呈相同的趋势,脲酶活性与土壤全氮含量有关。脲酶能使土壤中的尿素迅速水解为氨,从而向植物供应大量氮源,是土壤中氮变化的重要指标,其活性与土壤细菌数量、有机质和氮肥浓度等有一定关联[20]。尽管不同产地环境存在差异,但土壤中全氮可能是影响土壤脲酶活性的重要因素。土壤中的蔗糖酶能够降解土壤中的蔗糖,为植物提供能量。研究显示,蔗糖酶活性随海拔增高而降低,与前人研究相符。随着海拔增加,树种多样性降低,植被类型发生变化,树叶凋零物减少,土壤有机质含量降低,导致土壤中蔗糖含量下降,进而影响土壤蔗糖酶的活性[21]。
3.2" 不同海拔林下人参根际土壤微生物群落多样性分析
九寨沟地区林下人参根际土壤微生物优势种群与东北地区相似[22],放线菌门、变形菌门和子囊菌门等为优势菌门。但是在九寨沟地区林下人参根际土壤中,优势细菌的相对丰度位于前十的泉古菌门和壶菌门,在东北地区林下人参根际土壤中相对丰度较低。可能由于南北地区气候条件和海拔的不同,影响了植物种类和数量,进而导致微生物优势种群产生差异,但这仍需进一步试验证明。
在门水平上,九寨沟林下人参根际土壤细菌中变形菌门和放线菌门为主要优势菌群,相对丰度都大于10%;真菌群落中子囊菌门、担子菌门和被孢霉门为真菌群落优势种群。微生物群落则受海拔高度影响,在不同海拔高度下呈明显差异。研究结果显示,在海拔1 950 m处变形菌门、放线菌门和被孢霉门相对丰度最高,变形菌和放线菌作为土壤中常见的细菌群落,可以防止植物根部受到病原菌的侵害[23],同时降解有机残骸为植物提供养分[24]。然而,先前的研究发现,随着温度升高,变形菌和放线菌的相对丰度会增加[25],与本研究结果不一致。由于海拔升高,温度降低,不同海拔高度下,树种存在差异性,不同种类植物根际分泌物有所差异,导致土壤微生物群落的分布不同[26];被孢霉菌能够促进土壤中养分的转化,有利于植物从土壤中汲取养分[27],海拔1 950 m处土壤养分含量相对较高,可能与被孢霉门菌群相对丰度较高有关。
在属水平上,Fusariella(镰刀菌属)是引起人参根腐病的致病菌属[28],在海拔2 050 m处,镰刀菌属相对丰度大于1%,显著高于1 950 m和2 150 m。可能由于土壤中放线菌门菌群占比较低所致,因为放线菌门可以直接与病原菌相互作用,从而减轻由镰刀菌属引起的病害[29]。白僵菌属作为防治人参地下害虫的有益真菌群落,在抗土传病害中起到良好的效果[29]。低海拔处温度适宜,土壤养分充足,有利于地下害虫生存,本研究中1 950 m处林下人参根际土壤中白僵菌属的相对丰度最高,能够有效减少地下虫造成的危害,促进林下人参健康生长。
前人研究表明,根际土壤微生物群落会根据不同海拔条件下的生态系统而建立,多样性呈现出较大变化[30]。本研究中,林下人参根际土壤细菌Chao1指数与Shannon指数随海拔增加而逐渐降低,其中Chao1指数在海拔1 950 m和2 050 m与2 150 m存在显著性差异,同时PCoA分析也显示不同海拔下细菌丰富度显著不同。高海拔地区温度较低,微生物缺乏体温调节机制,低温导致微生物细胞内酶活性下降,进而降低微生物代谢和物质合成能力,从而抑制微生物群落的繁殖和生长,这与Wang等[31]的研究结论一致。
3.3" 土壤微生物与土壤养分状况和酶活性的" 关系
土壤、气候和植被3种因素,是影响土壤微生物群落时空变化主要原因[32],不同海拔区间3种生态因子都存在显著差异。本研究结果表明,九寨沟地区林下人参根际土壤微生物的多样性主要受pH和速效钾影响,这与王岩等[33]研究结果相似。土壤pH作为微生物时空分布的重要影响因素[34-35],与细菌谱系多样性和群落结构呈显著相关[36],pH可以通过改变酶分子上活性基团的解离状态,影响酶与底物的结合能力。本研究显示,土壤微生物与酶活性之间存在极显著的相关性,微生物与土壤酶相互作用,微生物影响酶的种类和数量,酶活性受到微生物代谢产物的影响,加快土壤中养分的转化,为微生物群落提供所需的养分。海拔1 950 m处根际土壤微生物多样性和酶活性最高,表明土壤中微生物种类的多样性有利于提高土壤中酶的活性[37],且土壤酶活性较高有利于林下人参从土壤中汲取养分,促进林下人参的生长发育以及有效活性成分的累积。
4" 结" 论
九寨沟地区林下人参根际土壤变形菌门、放线菌门、子囊菌门、担子菌门和被孢霉门为优势菌群。
林下人参根际土壤微生物在不同海拔下呈显著性差异,细菌多样性随海拔增加而降低," 1 950 m处微生物多样性指数最高;土壤酶活性和土壤养分受海拔影响,位于海拔1 950 m都处于较高水平。
九寨沟林下人参根际土壤微生物的主要驱动因子为pH和速效钾,碱解氮、速效磷、全氮和全磷含量对微生物也存在影响。
在满足林下人参能够正常生长发育的低温条件下,九寨沟地区海拔1 950 m处有较好的土壤养分和较高的酶活性,微生物种群丰富,土壤环境适宜,因此在九寨沟地区林下人参适宜种植在海拔1 950 m处。
参考文献" Reference:
[1]" 孙星衍,孙冯翼.神农本草经[M].北京:人民卫生出版社,1963.
SUN X" Y,SUN F Y.Shennong’s Herbal[M].Beijing:People’s Medicinal Pharmacology House,1963.
[2]刘" 元.林下参培育关键影响因子研究综述[J].吉林林业科技,2019,48(3):35-37.
LIU Y.Review on key influencing factors of forest cultivated Panax ginseng[J].Journal of Jilin Forestry Science and Technology,2019,48(3):35-37.
[3]LI M" W,MUDGE K W,VERMEYLEN F.Effects of population,age and cultivation methods on ginsenoside content of wild American ginseng (Panax quinquefolium)[J].Journal of" Agriculturalamp;Food Chemistry,2005,53:8498.
[4]王引权,王" 艳,陈红刚,等.海拔梯度对药用植物品质形成影响的研究进展[J].中国现代中药,2012,14(5):41-44.
WANG Y Q,WANG Y,CHEN H G,et al.Advances in influences of altitudinal gradient on the distribution and quality formation of medicinal plants[J].Modern Chinese Medicine,2012,14(5):41-44.
[5]张秀丽,赵" 岩,张燕娣,等.不同海拔高度对人参总皂苷含量的影响[J].中国现代中药,2011,13(10):14-16,29.
ZHANG X" L,ZHAO Y,ZHANG Y D,et al.Effect of different altitude on the content of total ginsenosides in Panax ginseng[J].Modern Chinese Medicine,2011,13(10):14-16,29.
[6]林红梅.生态因子对人参皂苷含量及其生物合成关键酶基因表达的影响[D].长春:吉林农业大学,2016.
LIN H M.Effect ofecological factors on ginsenoside content of Panax ginseng and the expression of key biosynthesis enzymes genes[D].Changchun:Jilin Agricultural University,2016.
[7]马国飞,满苏尔·沙比提,张雪琪.托木尔峰自然保护区台兰河上游不同海拔灌木土壤理化性质研究[J].土壤通报,2017,48(6):1288-1295.
MA G" F,MANSUER SH,ZHANG X Q.Physicochemical properties of surface soil under different shrubs at various altitudes in upstream of Tailan River in Mount Tuomuer[J].Chinese Journal of Soil Science,2017,48(6):1288-1295.
[8]徐胜涛,何" 翔,杨佩文,等.不同海拔高度下香蕉园土壤理化性质及果实品质的变化[J].西南农业学报,2020,33(6):1215-1220.
XU SH T,HE X,YANG P W.Variation of soil physicochemical properties and fruit quality at different altitudes of banana plantation[J].Southwest China Journal of Agricultural Sciences,2020,33(6):1215-1220.
[9]PALANSOORIYA K" N,WONG J T F,HASHIMOTO Y,et al.Response of microbial communities to biochar-amended soils:a critical review[J].Biochar,2019,1(1):3-22.
[10]" FENG J" Y,JUE S T,ZHU Y J,et al.Crop-dependent root-microbe-soil interactions induce contrasting natural attenuation of organochlorine lindane in soils[J].Environmental Pollution,2020,257:113580.8
[11]李银凤,刘晓柱.海拔高度对刺梨根际土壤真菌与细菌多样性的影响[J].河南农业科学,2023,52(10):82-91.
LI Y F,LIU X ZH.Effects of altitude on the fungal and bacterial diversity in rhizosphere soil of Rosa roxburghii Tratt[J].Journal of Henan Agricultural Sciences,2023,52(10):82-91.
[12]张" 琳,王自荣,朱绍宇,等.不同海拔金佛山方竹林土壤酶活性与土壤理化性质的关系[J].西部林业科学,2022,51(4):125-133.
ZHANG" L,WANG Z R,ZHU SH Y,et al.Relationship between soil enzyme activities and soil physicochemical properties in Chimonobambusa utilis soil at different altitudes[J].Journal of West China Forestry Science,2022,51(4):125-133.
[13]生态环境部.HJ 962-2018.土壤pH的测定 电位法[S].北京:中国环境出版社,2018:1-4.
Ministry of Ecology and Environment.HJ 962-2018.Soil-Determination of pH-Potentiometry[S].Beijing:China Environmental Science Press,2018:1-4.
[14]鲍士旦,江荣风,杨超光,等.土壤农化分析[M].第三版.北京:中国农业出版社,2000:76-108.
BAO SH D,JIANG R F,YANG CH G,et al.Soil and Agriculture Chemistry Analysis[M].3rd ed.Beijing:China Agriculture Press,2000:76-108.
[15]王亚婷.元素分析仪同时测定土壤中的全氮和总碳[J].城市地质,2022,17(2):249-254.
WANG Y T.Concurrent determination by elemental analyzer of total nitrogen and total carbon in soil samples[J].Urban Geology,2022,17(2):249-254.
[16]关松荫.土壤酶及其研究方法[M].北京:中国农业出版社,1986.
GUAN S Y.Soil Enzymes and Their Research Methods[M].Beijing:China Agriculture Press,1986.
[17]尚" 斌,邹" 焱,徐宜民,等.贵州中部山区植烟土壤有机质含量与海拔和成土母质之间的关系[J].土壤,2014, 46(3):446-451.
SHANG B,ZOU Y,XU Y M,t al.Relationship between SOM contents of tobacco fields and elevation and parent materials in central region of Guizhou Province[J].Soils,2014,46(3):446-451.
[18]张" 可,赵" 岩,张连学.人参生长年限与海拔高度对栽培人参土壤中大量元素的影响[J].安徽农业科学,2012, 40(22):11238-11239,11335.
ZHANG K,ZHAO" Y,ZHANG"" L X.Impact of growth years and altitudes on the macro elements in ginseng-growing soils[J].Journal of Anhui Agricultural Sciences,2012,40(22):11238-11239,11335.
[19]樊" 军,郝明德.黄土高原旱地轮作与施肥长期定位试验研究Ⅱ.土壤酶活性与土壤肥力[J].植物营养与肥料学报,2003,9(2):146-150.
FAN "J,HAO M D.Study on long-term experiment of crop rotation and fertilization in the loess plateau Ⅱ.Relationship betweensoil enzyme activities and soil fertility[J].Journal of Plant Nutrition and Fertilizers,2003,9(2):146-l50.
[20]李" 茜,徐瑞蔓,陈" 迪,等.不同栽培年限人参根际土壤细菌群落与土壤理化性质和酶活性的相关性[J].植物营养与肥料学报,2022,28(2):313-324.
LI" Q,XU R M,CHEN D,et al.Correlation of bacterial community with soil physicochemical properties and enzyme activities in rhizosphere soil under different cultivation years of ginseng (Panax ginseng C.A.Mey.)[J].Journal of Plant Nutrition and Fertilizers,2022,28(2):313-324.
[21]YUAN Z" Q,FANG C,ZHANG R,et al.Topographic influences on soil properties and aboveground biomass in lucerne-rich vegetation in a semi-arid environment[J].Geoderma,2019,344:137-143.
[22]王" 勇,何" 舒,熊冰杰,等.不同栽培模式对人参根际土壤微生物多样性的影响研究[J].中草药,2021,52(17):5303-5310.
WANG" Y,HE SH,XIONG B J,et al.Studied on microbial diversity of rhizosphere soil from different cultivated Panax ginseng[J].Chinese Traditional and Herbal Drugs,2021,52(17):5303-5310.
[23]WANG Q F.Long-term fertilization changes bacterial diversity and bacterial communities in the maize rhizosphere of Chinese""" mollisols[J].Applied Soil Ecology,2018,125:88-96.
[24]ANANDHAMR,GANDHI P I,MADHAIYAN M,et al.Potential plant growth promoting traits and bioacidulation of rock phosphate by thiosulfate oxidizing bacteria isolated from crop plants[J].Journal of Basic Microbiology,2008,48(6):439-447.
[25]LI" H,YANG S,SEMENOV M V,et al.Temperature sensitivity of SOM decomposition is linked with a K-selected microbial community[J].Global Change Biology,2021,27(12):2763-2779.
[26]丛" 微,喻海茫,于晶晶,等.人参种植对林地土壤细菌群落结构和代谢功能的影响[J].生态学报,2021,41(1):162-171.
CONG" W,YU H M,YU J J,et al.Effects of Ginseng cultivation on soil microbial community structure and metabolic functions in forest land[J].Acta Ecologica Sinica,2021,41(1):162-171.
[27]宁" 琪,陈" 林,李" 芳,等.被孢霉对土壤养分有效性和秸秆降解的影响[J].土壤学报,2022,59(1):206-217.
NING" Q,CHEN L,LI F,et al.Effects of Mortierella on nutrient availability and straw decomposition in soil[J].Acta Pedologica Sinica,2022,59(1):206-217.
[28]邢佳丽,李可心,杜立财,等.不同地块人参根区土壤微生物群落组成及其多样性分析[J].中药材,2023,46(3):554-561.
XING J" L,LI K X,DU L C,et al.Composition and diversity of soil microbial communities in Panax ginseng root zone of different plots[J].Journal of Chinese Medicinal Materials,2023,46(3):554-561.
[29]崔增平,于文霞,袁" 华,等.人参生产中常用的几种微生物菌[J].特种经济动植物,2019,22 (1):34-36.
CUI Z P,YU W X,YUAN H,et al.Several microbial bacteria commonly used in ginseng production[J].Special"" Economic Animals and Plants,2019,22(1):34-36.
[30]郑雪芳,苏远科,刘" 波,等.不同海拔茶树根系土壤微生物群落多样性分析[J].中国生态农业学报,2010,18(4):866-871.
ZHENG X F,SU Y K,LIU B,et al.Microbial community diversity in tea root zone soils at different elevations[J].Chinese Journal of Eco-Agriculture,2010,18(4):866-871.
[31]WANG J T,ZHENG Y M,HU H W,et al.Soil pH determines the alpha diversity but not beta diversity of soil fungal community along altitude in a typical Tibetan forest"" ecosystem[J].Journal of Soils and Sediments,2015, 15(5):1224-1232.
[32]厉桂香,马克明.土壤微生物多样性海拔格局研究进展[J].生态学报,2018,38(5):1521-1529.
LI G X,MA K M.Progress in the study of elevational patterns of soil microbial diversity[J].Acta Ecologica Sinica,2018,38(5):1521-1529.
[33]王" 岩,王丽伟,赵洪颜,等.不同人参栽培土壤养分及微生物群落组成特征解析[J].中国农学通报,2022,38(5):60-68.
WANG Y,WANG L" W,ZHAO H Y,et al.Characteristics of nutrients and microbial community.composition of different Panax ginseng cultivation soil[J].Chinese Agricultural Science Bulletin,2022,38(5):60-68.
[34]ZABEL F,DELZEIT R,SCHNEIDER J M,et al.Global impacts of future cropland expansion and intensification on agricultural markets and" biodiversity[J].Nature Communications,2019,10(1):1-10.
[35]李" 巍,刘" 洋,罗" 钦,等.武夷山常绿阔叶林土壤微生物多样性的季节动态[J].热带亚热带植物学报,2017, 25(2):115-126.
LI W,LIU Y,LUO Q,et al.Seasonal dynamics in soil microorganisms diversity of Evergreen Broadleaved forest in Wuyi Mountains,southeastern china[J].Journal of Tropical and Subtropical Botany,2017,25(2):115-126.
[36]LAUBER C L,HAMADY M,KNIGHT R,et al.Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J].Applied and Environmental Microbiology,2009, 75(15):5111-5120.
[37]曹婷婷,郭" 振.土壤酶活性与土壤肥力关系的研究进展[J].农业科学,2019,9(6):444-448.
CAO T" T,GUO ZH.Research advance of the relationship between soil enzyme activity and soil fertility in forest land[J].Hans Journal of Agricultural Sciences,2019, 9(6):444-448.
Analysis of" Soil Characteristics of Understory Ginseng at Different Altitudes in Jiuzhai Valley
JIN" Mengzhen,WU Lingmei,YANG Kefang,LI Ruirong and ZHANG Yayu
(College of Food and Biological Engineering,Chengdu University,Chengdu" 610106,China)
Abstract" The aim of this study is to screen the altitude conducive to the growth of understory grown ginseng and to provide technical reference for the scientific cultivation of ginseng in Jiuzhai valley.The physical and chemical properties,enzyme activity and microbial community characteristics of ginseng rhizosphere soil in Jiuzhai valley at different altitudes were analyzed.These data include soil nutrients,soil enzyme activities and soil microorganisms ,and the effects of altitude on nutrient factors,enzyme activities and microorganisms in rhizosphere soil of understory ginseng.The results showed that rhizosphere soil pH and sucrase decreased with the increase of altitude.The soil pH value decreased from 7.70 to 7.30,and the sucrase decreased by 50% each time when the altitude decrease 100 m.The microbial diversity of ginseng rhizosphere soil at different altitudes was significantly different,and the bacterial diversity index decreased with the increase of altitude.There was a significant difference in bacterial diversity index between 1 950 m and 2 150 m.The number of microbial bacteria OTU in ginseng rhizosphere soil in forest was greater than that of fungi.The rhizosphere soil microorganisms of ginseng under forest in Jiuzhai area were greatly affected by pH and available potassium.The soil condition of Jiuzhai area at 1 950 m is much favorable to the understory ginseng growth.
Key words" Altitude; Understory ginseng; Soil physical and chemical properties; Soil enzyme activity; Soil microorganisms
Received"" 2023-11-27""" Returned" 2024-03-22
Foundation item" Sichuan Science and Technology Program(No.2022YFQ0092); China Agriculture Research System(No.CARS-21).
First author" JIN Mengzhen,female,master student.Research area:cultivation of medicinal plants." E-mail:540167713@qq.com
Corresponding"" author" ZHANG" Yayu,female,research fellow.Research area:the key technology of Chinese herbal medicine production and quality evaluation.E-mail:zyy1966999@sina.com
(责任编辑:顾玉兰" Responsible editor:GU Yulan)

