高温胁迫下二斑叶螨体内海藻糖、山梨醇、丙二醛和蛋白质含量的应激变化

摘" 要" 旨在明确二斑叶螨响应极端高温胁迫的生理机制。设置38" ℃、42" ℃、46" ℃和50" ℃ 4个温度梯度," 2 h、4 h 和6 h 3个胁迫时间,测定高温胁迫后其体内海藻糖、山梨醇、丙二醛和蛋白质含量的变化。结果表明,相同温度下,随着处理时间的延长,二斑叶螨雌成螨体内海藻糖含量升高,山梨醇(除38 ℃和42" ℃)、丙二醛(除38" ℃)和蛋白质(除38" ℃)含量降低;处理时间相同时,随着处理温度的升高,二斑叶螨雌成螨体内海藻糖、山梨醇、MDA和蛋白质含量呈现先增后减的趋势。其中,二斑叶螨雌成螨体内海藻糖含量最高为" 16.287 3 mg/g±0.716 2 mg/g,是对照的2.66倍;山梨醇含量最高为20.167 7 mg/g±0.374 1 mg/g,是对照的2.07倍;MDA含量最高为0.782 3 nmol/mg±0.075" nmol/mg,是对照的1.76倍;蛋白质含量最高为" 0.550 9 mg/g±0.014 7 mg/g,是对照的1.18倍。说明二斑叶螨可通过调整体内海藻糖、山梨醇、MDA和蛋白质含量来应对高温胁迫。
关键词" 极端高温;二斑叶螨;海藻糖;山梨醇;丙二醛
doi:10.7606/j.issn.1004-1389.2024.08.016
https://doi.org/10.7606/j.issn.1004-1389.2024.08.016
收稿日期:2023-03-23" 修回日期:2023-04-29
基金项目:甘肃农业大学国家级大学生科研创新训练项目(202110733020);甘肃农业大学农业昆虫与害虫防治重点团队建设项目(GSAU-XKJS-2023)。
第一作者:王" 彦,女,硕士研究生,研究方向为资源利用与植物保护。E-mail:812911561@qq.com
杨若兰(共同第一作者),女,在读本科生,研究方向为植物保护。E-mail:2321329502@qq.com
通信作者:尚素琴,女,教授,研究方向为有害生物综合治理。E-mail:shangsq@gsau.edu.cn
二斑叶螨(Tetranychus urticae Koch),属蛛形纲(Arachnida)、蜱螨亚纲(Acari)、真螨目(Acariformes)、叶螨科(Tetranychidae)、叶螨属(Tetranychus),是一种世界性的害螨[1]。其个体较小、繁殖力强、寄主范围广、防治困难,给经济作物造成巨大损失[2-3]。二斑叶螨对豆类、甜瓜、草莓等经济作物危害最为严重[4-5],主要以成、若和幼螨为害寄主,通过刺吸植物汁液,造成寄主出现失绿斑点等症状。甚至在寄主植物顶端叶片上吐丝结网,使叶片皱缩,最后造成全叶焦枯脱落[6-7]。目前化学防治仍然是二斑叶螨的主要防控措施,但由于农药的大量施用导致其田间种群对抗生素类、有机磷类、拟除虫菊酯类等常见化学药剂产生了抗药性[8-9],因此探索开发新型绿色综合防治措施尤为重要。
昆虫或螨作为变温动物,对温度变化敏感,高温对其影响更为显著。高温胁迫时体内会产生活性氧,对蛋白质、脂质、DNA等造成氧化损伤,导致细胞凋亡,超过生理上限时会造成它们的死亡。因此,热处理作为一种非化学杀虫措施已广泛应用于农作物采后处理。在受到极端因子胁迫时,螨可以通过增强免疫调节或提高抗逆物质含量来应对逆境胁迫[10-12]。其中,海藻糖(Trehalose)作为体内重要的血糖,可在高温、高渗透压等恶劣环境下在细胞表面形成独特的保护膜,保护蛋白质分子使之不变性[13]。研究发现西花蓟马受到" 45" ℃热激时其体内海藻糖含量明显降低,推测海藻糖在抵御极端高温中存在联系[14]。其次,山梨醇(Sorbitol)是一种六碳多元醇,具有良好的吸湿性,可以有效防止细胞水分流失。Hendrix等[15]与Wolfe等[16]研究发现,粉虱体内山梨醇含量的积累,能够稳定蛋白质的天然构象,调节生物体内渗透压,从而抵消干燥和极端温度的不利影响,提高其耐热性。另外,丙二醛(Malondialdehyde,MDA)是脂质过氧化过程的主要产物,加剧氧化损伤并导致氧化应激,破坏细胞结构功能,造成生物体死亡。其含量是判定脂质过氧化程度的重要指标。昆虫在抵御外界环境变化时,丙二醛的含量反映了昆虫体内损伤程度,并通过加速蛋白质氧化分解供能,增加海藻糖、山梨醇等物质含量来调节体内代谢途径,共同抵御环境胁迫[17-18]。
目前,二斑叶螨应对极端高温胁迫的研究主要集中在抗氧化酶和解毒酶等方面,体内抗逆物质在昆虫中的报道较多,而其体内抗逆物质含量的影响尚未见报道。为明确高温条件下,二斑叶螨体内海藻糖、山梨醇和蛋白质含量的应激变化,本研究设置高温胁迫环境,用不同高温与时长处理二斑叶螨,以探究高温胁迫下其体内海藻糖、山梨醇、MDA和蛋白质的变化,从生理水平阐明二斑叶螨对高温胁迫的适应机制,以期为利用热处理进行害螨新型绿色综合防控提供理论依据。
1" 材料与方法
1.1" 供试螨源
二斑叶螨种群采自甘肃省兰州新区草莓农业示范园区,将其置于盆栽1周左右的四季豆苗上,在人工气候箱内饲养繁殖,备用。饲养条件:T=(25±1) ℃,RH=(60±5)%,光周期L∶D=" 16 h∶8 h。期间不做其他温度处理且不接触任何杀虫剂。
1.2" 主要试剂及仪器
主要仪器:智能人工气候箱(HQH-H300,上海跃进医疗器械有限公司)、体式显微镜(ZEISS Stemi 305,卡尔蔡司(上海)管理有限公司)、全波长酶标仪(Epoch,美国伯腾仪器有限公司)、高速冷冻离心机(H1850R,湖南湘仪实验室仪器开发有限公司)、恒温水浴锅(SHHW21·420S,上海跃进医疗器械有限公司)、TGrinder第三代变速组织研磨器(天根生化科技(北京)有限公司)。
主要试剂:海藻糖检测试剂盒、山梨醇检测试剂盒、丙二醛含量试剂盒、BCA法蛋白含量试剂盒均购买于上海优选生物科技有限公司。
1.3" 方法
1.3.1" 高温胁迫处理" 以25" ℃为对照,设置4个高温:38" ℃、42" ℃、46" ℃、50" ℃,每个温度的胁迫时间为2 h、4 h、6 h。每个处理设置3个生物学重复和3个技术重复。将带有二斑叶螨种群的四季豆苗放入提前预热的智能人工气候箱内进行高温胁迫。胁迫完成后,挑取处理后雌成螨约150头于1.5 mL的离心管中,置于液氮迅速冷却,放入-80" ℃冰箱内保存,待用。
1.3.2" 海藻糖含量的测定" 参照海藻糖含量检测试剂盒说明书,将标准液用1 mL双蒸水稀释到10 mg/mL然后稀释为6个梯度浓度(0.1、" 0.08、0.06、0.04、0.02、0 mg/mL)。在1.5 mL离心管中加入0.25 mL梯度浓度标准液和和" 1 mL工作液,95" ℃水浴10 min,冷却后吸取300 μL至96孔酶标板中,最后利用全波长酶标仪测定620 nm处吸光值制作海藻糖标准曲线。
制备酶液:在样本离心管中加入1 mL提取液,用手提式研磨器充分研磨,室温静置45 min,用高速冷冻离心机离心(4 ℃,10 min,8 000"" r/min),取上清液约800 μL。然后将250 μL上清液和1 mL工作液移至新的1.5 mL离心管中,95" ℃水浴10 min,冷却后吸取300 μL至96孔酶标板中,用全波长酶标仪测定620 nm处吸光值。按照样本鲜质量计算海藻糖含量=y/w。(y为根据标准曲线所得样本中海藻糖含量,单位为(mg/mL);w为样本质量,单位为g)。
1.3.3" 山梨醇含量测定" 参照山梨醇含量检测试剂盒说明书制备酶液。在样本离心管中加入" 1 mL蒸馏水,用手提式研磨器充分研磨,95" ℃水浴10 min,高速冷冻离心机离心(4 ℃,10 min, 8 000 r/min),取上清液待测。
在待测管中依次加入150 μL试剂一、140 μL试剂二、1 000 μL样本。在空白管中依次加入150 μL试剂一、140 μL试剂二、1 000 μL蒸馏水。静置15 min,高速冷冻离心机离心(4 ℃,10 min,8 000 r/min),取300 μL上清液至96孔酶标板中,用全波长酶标仪测定655 nm处吸光值A。
按照样本鲜质量计算山梨醇含量=5.68 ×(ΔA+0.002)/w。(ΔA=测定管-空白管;w为样本质量,单位为g)。
1.3.4" 丙二醛(MDA)含量测定" 参照丙二醛含量检测试剂盒说明书制备酶液。在样本离心管中加入1 mL提取液,用手提式研磨器充分研磨,高速冷冻离心机离心(4 ℃,10 min,8 000 r/min),取上清液待测。
吸取300 μL试剂一于1.5 mL离心管中,再加入1 mL样本,混匀后95 ℃水浴10 min,冷却后高速冷冻离心机离心(4 ℃,10 min,8 000nbsp;" r/min)。吸取200 μL上清液至96孔酶标板中,用全波长酶标仪测定532 nm和600 nm处的吸光度,记为A532和A600,ΔA=A532-A600。MDA含量(nmol/g)=25.8×ΔA/Cpr。
1.3.5" 蛋白含量测定" 参照BCA法蛋白含量检测试剂盒说明书制备酶液。将试剂A和B按照50∶1比例混合制成工作液,工作液置于60" ℃水浴预热30 min。在样本离心管中加入1 mL蒸馏水,用手提式研磨器充分研磨,高速冷冻离心机离心(4 ℃,10 min,8 000 r/min)冰浴匀浆,取上清液待测。
测定管中加入4 μL待测液,200 μL工作液;空白管中加入4 μL蒸馏水,200 μL工作液;标准管中加入4 μL标准品,200 μL工作液。混匀后60" ℃保温30 min,置于96孔酶标板中,用全波长酶标仪测定562 nm处吸光值A,分别记为A测定管、A空白管、A标准管。蛋白含量(mg/g)=0.5 ×(A测定管-A空白管)/(A标准管-A空白管)。
1.4" 数据分析
所得数据均采用Excel 2016和SPSS 24.0进行统计分析,采用Duncan氏新复极差法比较不同处理之间的差异显著性(P<0.05)。采用单因素方差分析(ANOVA-ONE)不同处理时间和处理温度下海藻糖含量、山梨醇含量、丙二醛含量、蛋白质含量的差异显著性,事后进行Tukey HSD检验(Plt;0.05)。利用Origin 2018多因子功能分析绘图。
2" 结果与分析
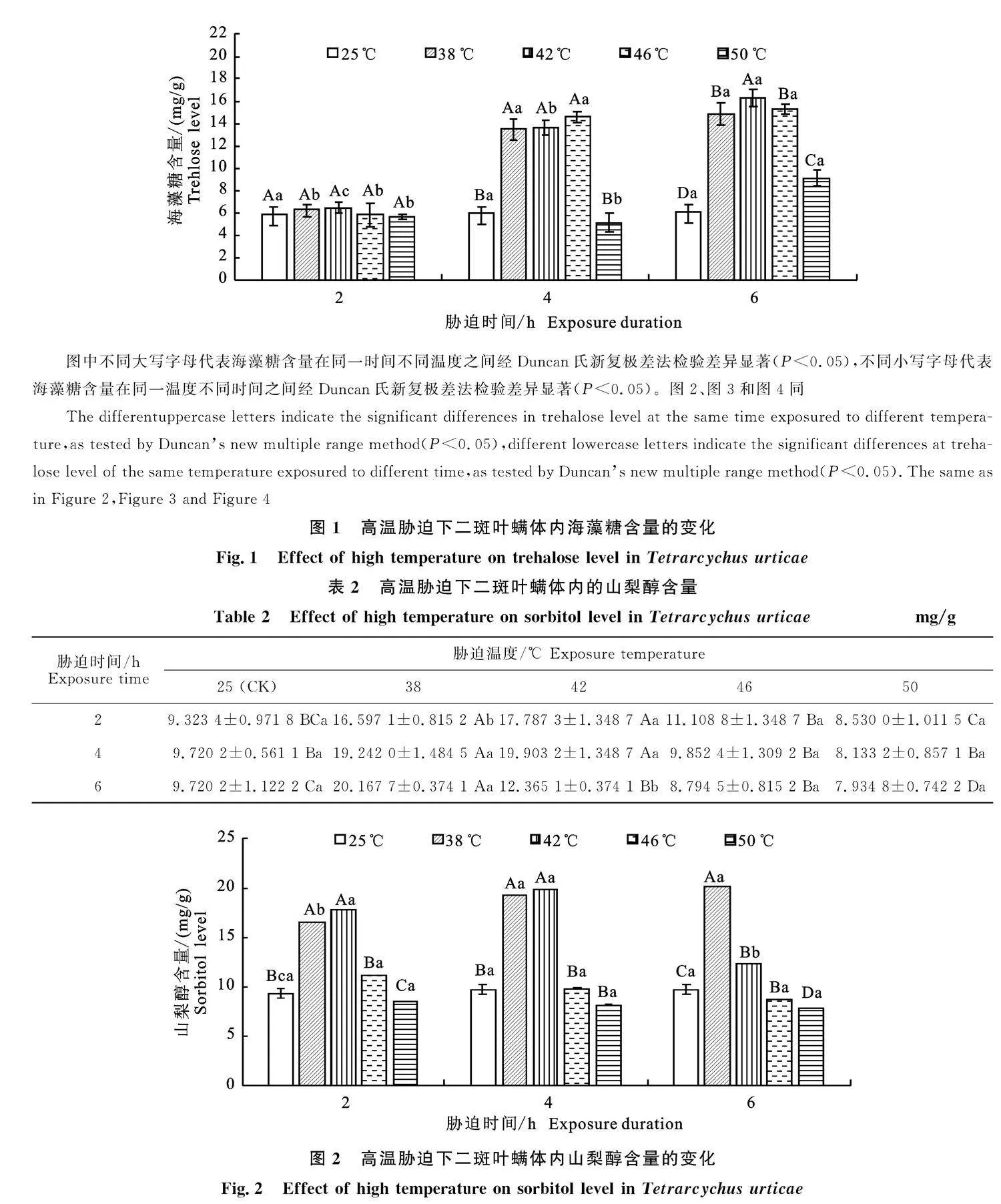
2.1" 高温胁迫对二斑叶螨体内海藻糖含量的影响
高温对二斑叶螨体内海藻糖含量的影响如表1与图1所示。经高温胁迫后,海藻糖含量呈现先上升后下降的趋势。在相同时间下,高温胁迫2 h后42" ℃处理的海藻糖含量最高,但在不同温度处理下海藻糖含量差异不显著;高温胁迫4 h后46" ℃处理的海藻糖含量最高,38" ℃、42" ℃、" 46" ℃处理的海藻糖含量差异不显著,但显著高于对照和50" ℃处理(P<0.05);高温胁迫6 h后" 42" ℃处理的海藻糖含量最高,显著高于其他温度处理(P<0.05),其他各温度处理的海藻糖含量差异显著(P<0.05)。在相同温度下,6 h海藻糖含量最高,均显著高于对照(P<0.05),但38" ℃和46" ℃处理6 h海藻糖含量与4 h海藻糖含量差异不显著。其中42" ℃胁迫6 h后可促进海藻糖含量的增加,最高达16.287 3 mg/g±0.716 2 mg/g(表1),是对照的2.66倍。
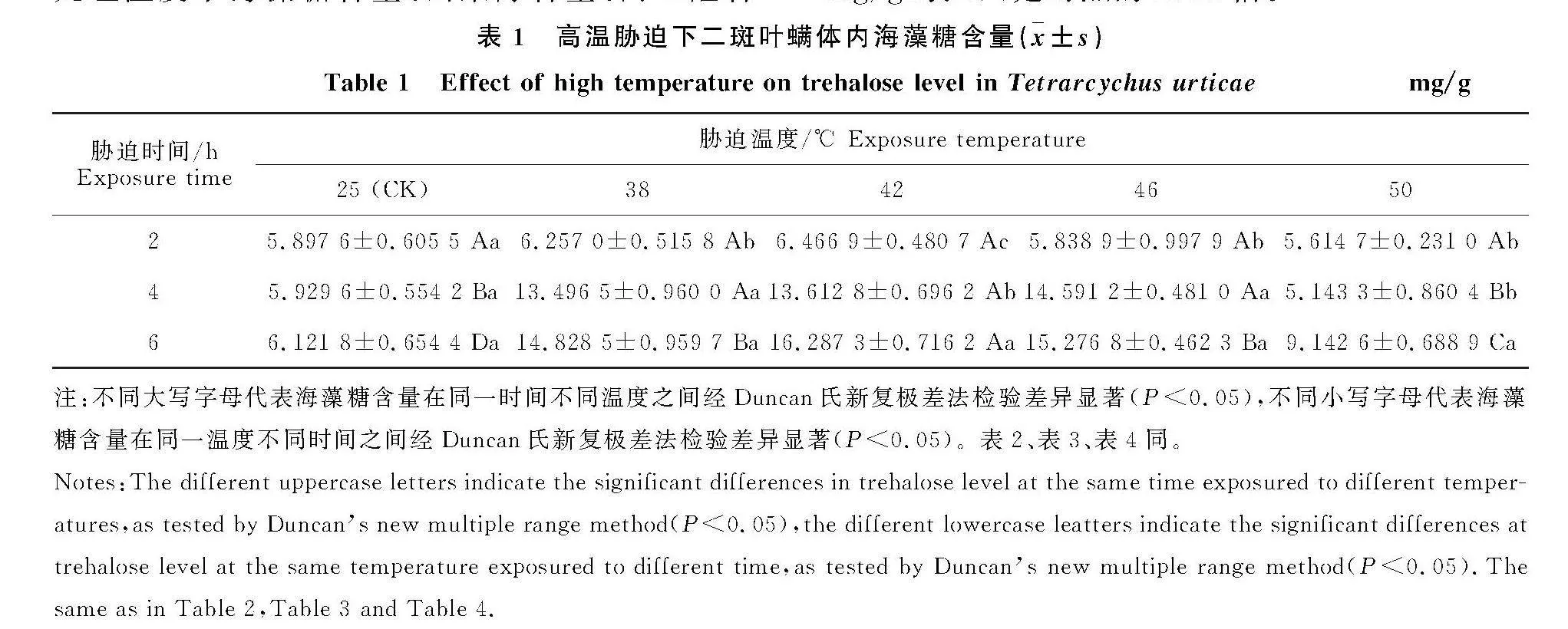
2.2" 高温胁迫对二斑叶螨体内山梨醇含量的" 影响
高温对二斑叶螨体内山梨醇含量的影响如表2与图2所示。经高温胁迫后,海藻糖含量呈现先上升后下降的趋势。在相同时间下,高温胁迫2 h后" 42" ℃处理的山梨醇含量最高,在38" ℃、42" ℃、" 50" ℃处理下山梨醇含量差异显著高于对照(P<" 0.05);高温胁迫4 h后42" ℃处理的山梨醇含量最高,38" ℃和42" ℃处理的山梨醇含量显著高于" 46" ℃、50" ℃和对照(P<0.05),但46" ℃、50" ℃和对照处理下差异不显著;高温6 h后38" ℃处理的山梨醇含量最高,显著高于其他温度处理(P<" 0.05)。在相同温度下,高温38" ℃处理时,6 h山梨醇含量最高,显著高于2 h(P<0.05),高温" 42" ℃处理时,4 h山梨醇含量最高,显著高于2 h(P<0.05),但38" ℃和42" ℃处理时6 h山梨醇含量与4 h山梨醇含量差异不显著。46" ℃、50" ℃处理时,2 h时山梨醇含量最高,但与其他处理时间下山梨醇含量差异不显著。其中38" ℃经6 h后可促进山梨醇含量的增加,山梨醇含量达到最高" 20.167 7" mg/g±0.374 1 mg/g,是对照的2.07倍," 50" ℃胁迫6 h后可抑制山梨醇含量的增长,山梨醇含量降至最低7.934 8" mg/g±0.742 2 mg/g(表2),与对照相比降低18.37% 。
2.3" 高温胁迫对二斑叶螨体内丙二醛含量的影响
高温对二斑叶螨体内丙二醛含量的影响如表3与图3所示。经高温胁迫后,丙二醛含量呈现先上升后下降的趋势。在相同时间下,高温2 h后42" ℃处理的丙二醛含量最高,在38" ℃、42" ℃、50" ℃处理下丙二醛含量差异显著高于对照(P<0.05);高温4 h后42" ℃处理的丙二醛含量最高,38" ℃和42" ℃处理的丙二醛含量显著高于46" ℃、50" ℃和对照(P<0.05),但46" ℃、50" ℃和对照处理下差异不显著;高温6 h后38" ℃处理的丙二醛含量最高,显著高于其他温度处理(P<0.05)。在相同温度下,高温38" ℃处理时,6 h丙二醛含量最高,显著高于2 h(P<0.05),高温42" ℃处理时,2 h丙二醛含量最高,显著高于4 h(P<" 0.05),但38" ℃和42" ℃处理下各自在6 h和4 h之间的丙二醛含量差异不显著。46" ℃、50" ℃处理2 h后丙二醛含量最高,但与其他处理时间下丙二醛含量差异不显著。其中38" ℃胁迫6 h后可促进丙二醛含量的增加,丙二醛含量达到最高0.782 3 nmol/mg±0.075 6 nmol/mg,是对照的1.76倍,50" ℃胁迫6 h后可抑制丙二醛含量的增长,丙二醛含量降至最低0.269 1 nmol/mg±" 0.085 7 nmol/mg(表3),与对照相比降低" 39.39%。
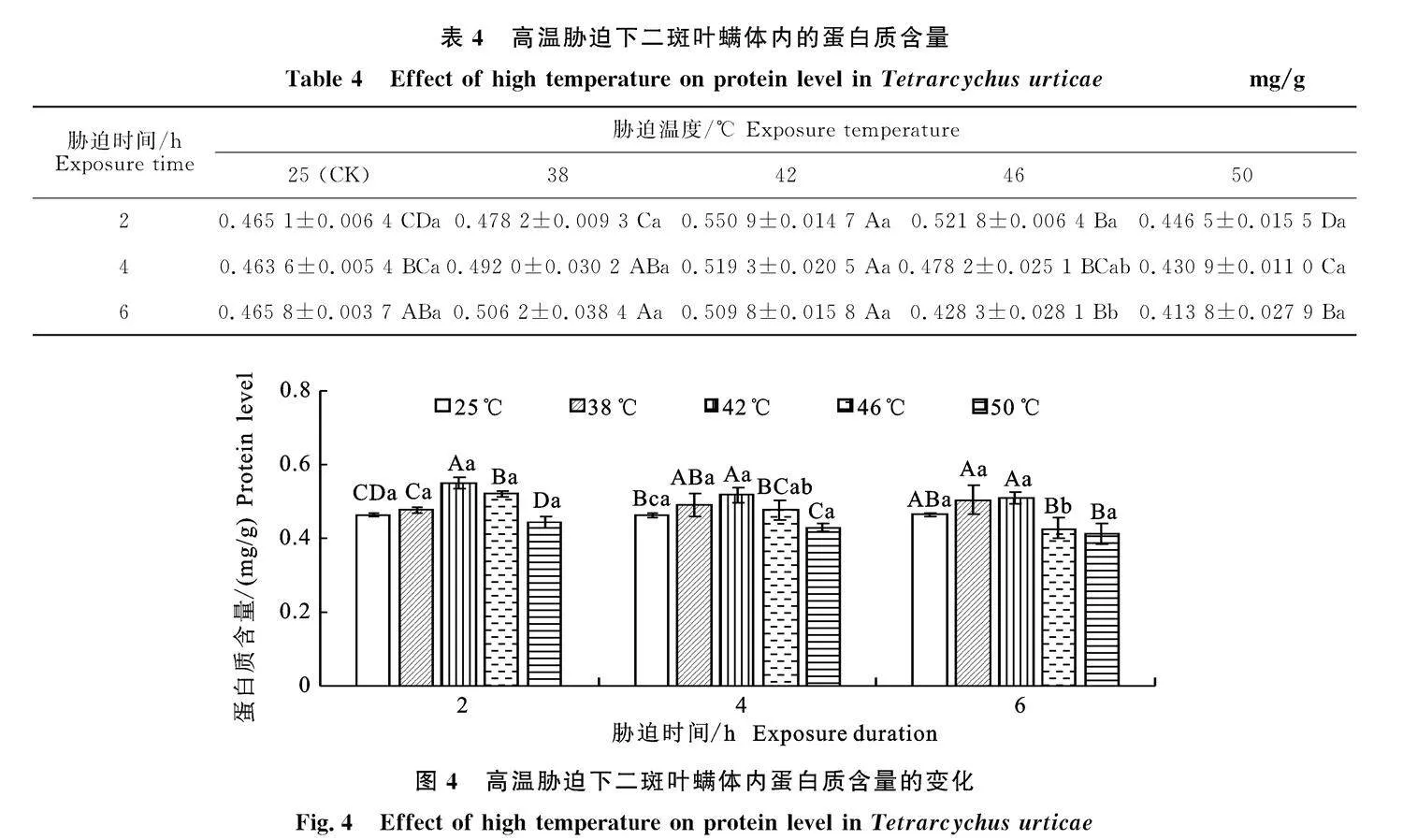
2.4" 高温胁迫对二斑叶螨体内蛋白质含量的" 影响
高温对二斑叶螨体内蛋白质含量的影响如表4与图4所示。经高温胁迫后,蛋白质含量呈现先上升后下降的趋势。在相同胁迫时间下,高温2 h后42" ℃处理的蛋白质含量最高,显著高于其他处理下蛋白质含量(P<0.05);高温4 h后" 42" ℃处理的蛋白质含量最高,显著高于其他(除38" ℃)处理下蛋白质含量(P<0.05);高温6 h后42" ℃处理的蛋白质含量最高,显著高于46" ℃和50" ℃处理下蛋白含量(P<0.05)。在相同温度下,高温" 38" ℃处理时6 h后蛋白质含量最高," 42" ℃、50" ℃处理时2 h后蛋白质含量最高,但是不同时间处理下蛋白质含量差异不显著;高温" 46" ℃处理时,2 h处理下蛋白质含量最高,显著高于6 h(P<" 0.05)。其中42" ℃胁迫2 h后可促进蛋白质含量的增加,蛋白质含量达到最高0.550 9 mg/g±0.014 7 mg/g,是对照的1.18倍,50" ℃胁迫6 h后可抑制蛋白质含量的增长,蛋白质含量降至最低0.413 8 mg/g±0.279 mg/g(表4),与对照相比降低11.16%。
3" 结论与讨论
昆虫或螨在长期进化过程中已形成包括形态、行为、生理生化代谢等不同机制以应对环境变化和各种胁迫[19-20]。温度是影响它们生长的最重要环境因素之一,温度升高有利于生长发育和繁殖,但超过45 ℃高温就会显著影响存活及种群增长[21-22]。Ristyadi等[23]研究发现,卢氏叶螨(Tetranychus ludeni)卵51" ℃处理3 h不能孵化,成螨" 51" ℃的处理12 h全部死亡。Gotoh等[24]发现,二斑叶螨成螨在47.5" ℃热水处理" 1 200 s或57" ℃处理9 s全部死亡。试验前期做了温度对二斑叶螨的致死率试验,50" ℃时二斑叶螨成螨致死率达到90%,因此50" ℃作为二斑叶螨的极端高温。本试验25" ℃~42" ℃条件下,二斑叶螨体内抗逆物质含量随温度上升而增加,42" ℃含量达到峰值;42" ℃~50" ℃极端高温胁迫二斑叶螨逐渐死亡,其抗逆物质含量显著低于42" ℃。因此在适宜温度范围内,二斑叶螨通过积累体内抗逆物质含量提高对高温耐受能力。
本试验发现,在25" ℃~42" ℃二斑叶螨体内海藻糖含量随温度升高而增加,这与双斑长跗萤叶甲(Monolepta hieroglyphica)26" ℃~41" ℃海藻糖含量增加[25],西伯利亚蝗(Gomphocerus sibiricus) 24" ℃~30" ℃和意大利蝗(Calliptamus italicus) 27" ℃~36" ℃海藻糖含量增加的结果一致[26-27]。其原因可能是高温胁迫条件下昆虫通过积累海藻糖来提高自身的耐热能力[25]。石中斌等[28]发现25" ℃~40" ℃舞毒蛾(Lymantira dispar)幼虫其体内海藻糖含量逐渐下降,这与本试验二斑叶螨在42" ℃~50" ℃其体内海藻糖含量逐渐下降的结果相同,这表明在极端高温的胁迫下,海藻糖在海藻糖酶的水解作用下转化成葡萄糖,参与能量代谢,抵御高温,并且在细胞表面形成特殊的保护膜,保护生物大分子结构不被破坏,导致海藻糖的含量下降[13,28-29]。
Wolfe等[16]发现当银叶粉虱(Bemisia argentifolii)暴露于42" ℃时,山梨醇含量显著增加。Salvucci等[30]证实银叶粉虱体内山梨醇含量呈昼夜波动,与环境温度成正比,这与本试验研究发现二斑叶螨体内山梨醇含量在25" ℃~42" ℃随着温度升高而增加的结果一致。说明在温度胁迫条件下,昆虫以食物中果糖作为底物,在 NADPH醛糖还原酶的作用下将其转变为山梨醇,并通过增加蛋白质的稳定性来抵御高温胁迫[31]。50" ℃胁迫6 h时二斑叶螨体内山梨醇含量显著低于对照。表明极端高温会破坏二斑叶螨体内环境平衡,水份失调渗透压升高,导致NADPH醛糖还原酶活力下降;同时破坏细胞的膜蛋白结构,使细胞膜的完整性和流动性降低或丧失,影响NADPH醛糖还原酶的转运速率[32-33]。
高温胁迫对二斑叶螨体内MDA含量的影响有所差异。38" ℃胁迫6 h时MDA含量达到最高,是对照组的1.76倍。这与胡瓜钝绥螨(Neoseiulus cucumeris)在25 ℃~44 ℃随温度升高MDA含量增加,柑桔全爪螨(Panonychus citri)在32 ℃时随着胁迫时间的增加MDA含量增高的结果相似[34-35]。其原因可能是38" ℃以上的高温会导致昆虫产生过量的活性氧(ROS),ROS会导致脂质过氧化,破坏细胞膜流动性,造成细胞凋亡,导致MDA含量增加[36]。当温度升高到" 46" ℃时,二斑叶螨MDA含量随温度升高和胁迫时间的延长逐渐下降,这与桔全爪螨MDA含量在38" ℃~41" ℃随温度升高和胁迫时间的增加而下降的试验结果相同[17]。说明昆虫会随着处理时间的增加而适应热应激,MDA的形成受阻[37-38]。此外,MDA含量降低的原因可能是抗氧化系统消除氧化应激,在大多数情况下,GST活性与MDA含量保持同步,GST消耗了H2O2以外的脂质过氧化产物[39-40]。
高温影响昆虫细胞内蛋白质的数量和种类组成,导致正常温度下的蛋白质合成系统关闭,随着温度持续升高,二斑叶螨体内热休克蛋白迅速合成[41-43]。分析结果发现25" ℃~50" ℃,二斑叶螨蛋白质含量呈现先上升后下降的趋势,42" ℃处理2 h时二斑叶螨体内蛋白质含量达到最高,是对照组的1.18倍,此后随着温度的升高和处理时间的延长,二斑叶螨体内蛋白质含量逐渐下降," 50" ℃时显著低于对照组。这与韭菜迟眼蕈蚊(Bradysia odoriphaga)[44]在25" ℃~37" ℃,意大利蝗(Calliptamus italicus)[27]在27" ℃~48" ℃体内蛋白质含量随温度升高呈现先增后减的结果一致。说明温度的升高对蛋白质含量有一定的促进作用,当达到极端温度时蛋白质会作为能量物质被消耗,导致昆虫体内蛋白质含量降低。
参考文献" Reference:
[1]" 李忠洲,周玉书,朴静子,等.二斑叶螨对螺螨酯的抗性选育及其解毒酶活性测定[J].应用昆虫学报,2013,50(2):454-459.
LI ZH" ZH,ZHOU Y" SH,PIAO J" Z,et al.Determination of selection for resistance to spirodiclofen and itseffect on detoxification enzymes in Tetranychus urticae[J].Chinese Journal of Applied Entomology,2013,50(2):454-459.
[2]蔡双虎,程立生.二斑叶螨的研究进展[J].热带农业科学,2003,23(2):68-74.
CAI SH H,CHENG L SH.Review of the researches on Tetranychus urticae Koch[J].Chinese Journal of Tropical Agriculture,2003,23(2):68-74.
[3]曹利军,周晓怡,宫亚军,等.我国12个地区草莓叶螨种类分子鉴定及遗传多样性[J].植物保护,2003,44(4):158-161.
CAO L J,ZHOU X Y,GONG Y J,et al.Molecular identification and genetic diversity of spider mites on strawberry from 12 regions of China[J].Plant Protection,2003, 44(4):158-161.
[4]DEMAUW W,WYBOUW N,ROMBAUTS S,et al.A link between host plant adaptation and pesticide resistance in the polyphagous spider mite Tetranychus urticae[J].Proceedings of the National Academy of Sciences,2013,110(2):113-122.
[5]王常清,韩永金,曹进刚,等.二斑叶螨雌成螨对高温胁迫的生理响应[J].环境昆虫学报,2021,43(1):181-190.
WANG CH Q,HAN" Y" J,CAO J G,et al.The response of physiological of Tetrarcychus urticae to heat stress[J].Journal of Environmental Entomology,2021,43(1):181-190.
[6]王富强 ,刘鲁江,傅常智,等.常见设施蔬菜二斑叶螨的综合防治[J].北方园艺,2017(15):61-65.
WANG F Q,LIU L J,FU CH ZH,et al.Integrated pest" management of Tetranychus urticae Koch for" common" greenhouse" vegetables[J].Northern Horticulture,2017(15):61-65.
[7]常" 芸,王常清,尚素琴.联苯肼酯亚致死质量浓度对二斑叶螨Tetranychus urticae解毒酶系的影响[J].植物保护学报,2020,47(5):1146-1154.
CHANG Y,WANG CH Q,SHANG S Q.Effects of sublethal concentration of bifenazate on the activities of detoxificationenzymes against red spider mite Tetranychus urticae[J].Journal of Plant Protection,2020,47(5):1146-1154.
[8]GORMAN K,HEWITT F,DENHOLM I,et al.New developments in insecticide resistance in the glasshouse whitefly (Trialeurodes vaporariorum) and the two-spotted spider mite (Tetranychus urticae) in the UK[J].Pest management science,2002,58(2):123-130.
[9]KWON D H,SEONG G M,KANG T J M,et al.Multiple resistance mechanisms to abamectin in the two-spotted spider mite [J].Journal of Asia-Pacific Entomologyv,2010,13(3):229-232.
[10]" MIRONIDIS G K,SAVOPOULOU-SOULTANI M.Effects of heat shock on survival and reproduction of Helicoverpa armigera(Lepidoptera:Noctuidae) adults[J].Journal of Thermal Biology,2010,35(2):59-69.
[11]JU R T,CHEN G B,WANG F,et al.Effects of heat shock,heat exposure pattern,and heat hardening on survival of the sycamore lace bug,Corythucha ciliate[J].Entomologia Experimentalis et Applicata,2011,141(2):168-177.
[12]杨丽红,黄" 海,王进军.高温胁迫对柑橘全爪螨存活及生殖的影响[J].中国农业科学,2014,47(4):693-701.
YANG L H,HUANG H,WANG J J.Effect of exposure to" heat" stress on" survival and fecundity of Panonychus citri[J].Scientia Agricultura Sinica,2014,47(4):693-701.
[13]朱江燕,黄健华,时" 敏,等.昆虫海藻糖代谢及其影响因素的研究进展[J].应用昆虫学报,2018,55(2):145-152.
ZHU J" Y,HUANG J" H,SHI M,et al.Advances in research on the trehalose metabolism in insects [J].Chinese Journal of Applied Entomology,2018,55(2):145-152 .
[14]姜" 姗,李" 帅,张" 彬,等.极端高温对西花蓟马存活、繁殖特性及体内海藻糖、山梨醇含量的影响[J].中国农业科学,2016,49(12):2310-2321.
JIANG SH,LI SH,ZHANG B,et al.Effects of extreme high temperature on survival rate,reproduction,trehalose and sorbitol of Frankliniella occidentalis[J].Scientia Agricultura Sinica,2016,49(12):2310-2321.
[15]HENDRIX D,S ALVUCCI M.Polyol metabolism in homopterans at high temperatures:accumulation of mannitol in aphids (Aphididae:Homoptera) and sorbitol in whiteflies (Aleyrodidae:Homoptera)[J].Comparative Biochemistry and Physiology Part A:Molecular amp; Integrative Physiology,1998,120(3)487-494.
[16]WOLFE" G R,SALVUCCI M E,HENDRI D L.A thermoprotective role for sorbitol in the silverleaf whitey,Bemisia argentifolii [J].Journal of Thermal Biology,1998,44(7-8)597-603.
[17]YANG L" H,HUANG H,WANG J J.Antioxidant responses of citrus red mite,Panonychus citri" (McGregor) (Acari:Tetranychidae),exposed to thermal stress[J].Journal of Insect Physiology,2010,56(12):1871-1876.
[18]CUI Y D,DU Y Z,LU M X,et al.Antioxidant responses of Chilo suppressalis (Lepidoptera:Pyralidae) larvae exposed to thermal stress[J].Journal of Thermal Biology,2011,36(5):292-297.
[19]NETHERER S,SCHOPF A.Potential effects of climate change on insect herbivores in European forests—General aspects and the pine processionary moth as specific example[J].Forest Ecology and Management,2010,259(4):831-838.
[20]李" 宁,张世泽,刘同先.二氧化碳浓度和温度升高对烟粉虱主要保护酶和解毒酶活性的影响[J].植物保护学报,2016,43(1):99-104.
LI N,ZHANG SH Z,LIU T X.Effects of elevated CO2 concentration and temperature on protective enzymesand detoxification enzymes of Bemisia tabaci (Hemiptera:Aleyrodidae)[J].Journal of Plant Protection,2016,43(1):99-104.
[21]MOURIER H,POULSEN K P.Control of insects and mites in grain using a high temperature short time (HTST) technique[J].Journal of Stored Products Research,2000,36(3):309-318.
[22]JAGDALE G B,GREWAL P S.Acclimation of entomopathogenic nematodes to novel temperatures:trehalose accumulation and the acquisition of thermotolerance[J].International Journal for Parasitology,2003,33(2):145-152.
[23]RISTYADI D,HE X" Z,WANG Q.Thermotolerance in a spider mite:implications in disinfestation treatment[J].Systematic amp; Applied Acarology,2022,27(3):473-481.
[24]GOTOH T,KITASHIMA Y,SATO T.Effect of hot-water treatment on the two-spotted spider mite,Tetranychus urticae,and its predator,Neoseiulus californicus (Acari:Tetranychidae,Phytoseiidae)[J].International Journal of Acarology,2013,39(7):533-537.
[25]马晓江,张志虎,王" 中,等.短时高温胁迫对双斑长跗萤叶甲雌虫游离氨基酸、海藻糖和可溶性糖的影响[J].植物保护,2018,44(2):111-115.
MA X" J,ZHANG ZH H,WANG ZH,et al.Effects of brief exposure to high temperature on free amino acids,total sugar and trehalose of female adult Monoleptahierogl yphica(Motschulsky)[J].Plant Protection,2018,44(2):111-115.
[26]李" 娟,李" 爽,王冬梅,等.高温胁迫下西伯利亚蝗体内抗逆物质含量变化[J].昆虫学报,2014,57(10):1155-1161.
LI J,LI SH,WANG D" M,et al.Changes in the contents of stress resistant substances in Gomphocerus sibiricus(Orthoptera:Acrididae) under high temperature stress[J].Acta Entomologica Sinica,2014,57(10):1155-1161.
[27]李" 爽,王冬梅,李" 娟,等.雌雄意大利蝗耐高温差异及其生理生化响应对策[J].应用昆虫学报,2015,52(4):960-967.
LI SH,WANG D" M,LI J,et al.Differences in heat tolerance and physio-biochemical mechanisms between adult female and male Calliptamus italicus(Orthopera:Acrididae)[J].Chinese Journal of Applied Entomology,2015,52(4):960-967.
[28]石中斌,曾健勇,国嘉兴,等.温度胁迫对舞毒蛾营养成分和总抗氧化力的影响[J].应用昆虫学报,2019,56(3):557-562.
SHI ZH B,ZENG J Y,GUO J X,et al.Effects of temperature stress on the nutrient content and total antioxidant capacity of the gypsy moth[J].Chinese Journal of Applied Entomology,2019,56(3):557-562.
[29]CROWE J,CROWE L,CHAPMAN D.Preservation of membranes in anhydrobiotic organisms:The role of trehalose[J].Science,1984,223(4637):701-703.
[30]SALVUCCI M E,WOLFE G R,HENDRIX D L.Purification and properties of an unusual NADPH-dependent ketose reductase fromthe silverleaf whitey[J].Insect Biochemistry and Molecular Biology,1998,28(5-6):357-363.
[31]SALVUCCI M E,HENDRIX D L,WOLFE G R.Effect of high temperature on the metabolic processes affecting sorbitol synthesis in the silverleaf whitefly,Bemisia argentifolii[J].Journal of Insect Physiology,1999,45(1):21-27.
[32]FIELDS P G.The control of stored-product insects and mites with extreme temperatures[J].Journal of Stored Products Research,1992,28(2):89-118.
[33]SALIN C,VERNON P,VANNIER G.Effects of temperature and humidity on transpiration in adults of the lesser mealworm,Alphitobius diaperinus( Coleoptera:Tenebrionidae)[J].Journal of Insect Physiology,1999,45(10):907-914.
[34]YANG L H,HUANG H,WANG J J.Antioxidant responses of citrus red mite,Panonychus citri (McGregor) (Acari:Tetranychidae),exposed to thermal stress[J].Journal of Insect Physiology,2010,56(12):1871-1876.
[35]ZHANG G H,LIU" H,WANG J J,et al.Effects of thermal stress on lipid peroxidation and antioxidant enzyme activities of the predatory mite,Neoseiulus cucumeris(Acari:Phytoseiidae)[J].Experimental and Applied Acarology,2014,64(1):73-85.
[36]LOPEZ-MARTINEZ G,ELNITSKY M A,BENOIT J B,et al.High resistance to oxidative damage in the Antarctic midge Belgica antarctica ,and developmentally linked expression of genes encoding superoxide dismutase,catalase and heat shock proteins[J].Insect Biochemistry and Molecular Biology,2008,38(8):796-804.
[37]MENG J Y,ZHANG CY,ZHU F,et al.Ultraviolet light-induced oxidative stress:Effects on antioxidant response of Helicoverpa armigera adults[J].Journal of Insect Physiology,2009,55(6):588-598.
[38]PARK M S,JO P G,CHOI Y K,et al.Characterization and mRNA expression of Mn-SOD and physiological responses to stresses in the Pacific oyster Crassostrea gigas[J].Marine Biology Research,2009,5(5):451-461.
[39]AN M I,CHO" C Y.Activity of antioxidant enzymes and physiological responses in ark shell,Scapharca broughtonii,exposed to thermal and osmotic stress:effects on hemolymph and biochemical parameters[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2010,155(1):34-42.
[40]JOANISSE D,STOREY K.Oxidative stress and antioxidants in overwintering larvae of cold-hardy goldenrod gall insects[J].The Journal of Experimental Biology,1996,199(7):1483-1491.
[41]李冰祥,蔡惠罗,陈永林.昆虫的热休克反应和热休克蛋白[J].昆虫学报,1997,40(4):417-427.
LI B X,CAI H L,CHEN Y L.Insect heat shock response and heat shock proteins[J].Acta Ecologica Sinica,1997,40(4):417-427.
[42]FEDER M E,HOFMANN G" E.Heat-shock proteins,molecular chaperones,and the stress response:evolutionary and ecological physiology[J].Annual Review of Physiology,1999,61(1):243-282.
[43]杜" 尧,马春森,赵清华,等.高温对昆虫影响的生理生化作用机理研究进展[J].生态学报,2007,27(4):1565-1572.
DU Y,MA CH S,ZHAO Q H,et al.Effects of heat stress on physiological and biochemical mechanisms of insects a litera ture" review[J].Acta Ecologica Sinica,2007,27(4):1565-1572.
[44]郭苏帆.高温对韭菜迟眼蕈蚊和异迟眼蕈蚊生长发育及生理代谢的影响[D].兰州:甘肃农业大学,2018.
GUO S F.Effects of high temperature on the growth,development and" physiological" metabolism of Bradysia odoriphaga Yang et Zhang and Bradysia difformis Frey[D].Lanzhou:Gansu Agricultural University,2018.
Physiological"" Response Mechanisms of Changes in Trehalose,Sorbitol,MDA
and" Protein Contents in Body of Tetranychus urticae to Heat Stress
WANG Yan,YANG Ruolan,YUAN Shao,BAI Xin,WANG Feifei and" SHANG Suqin
(College of Plant Protection,Gansu Agricultural University,Lanzhou" 730070,China)
Abstract" To" elucidate the physiological responses of two-spotted spider mite Tetrarcychus urticae to heat stress in a greenhouse environment,changes in trehalose,sorbitol,MDA and protein contents were measured under stress treatments with four temperatures (38" ℃,42" ℃,46" ℃ and 50" ℃),and three treatment duration (2 h,4 h and 6 h).The results showed that the levels of trehalose,sorbitol (except at 38" ℃ and 42" ℃),MDA (except at 38" ℃) and protein (except at 38" ℃) in adult female mite increased with longer treatment durations at the same temperature,while the levels of these compounds in adult mites increased first and then decreased with higher treatment temperature at the same duration.The maximum value were 16.287 3 mg/g±0.716 2 mg/g for trehalose (2.66 times higher than the control),20.167 7 mg/g±0.374 1 mg/g for sorbitol (2.07 times higher than the control),and 0.782 3 nmol/mg±0.075 6 nmol/mg prot for MDA (1.76 times higher than the control),respectively.The protein content reached 0.550 9 mg/g±0.014 7 mg/g,1.18 times higher than the control.Moreover,a significant interaction relationship was observed between heat stress and treatment time (Plt;0.05).TSSM could cope with heat stress by adjusting the contents of trehalose,sorbitol,MDA and protein in the body,providing a theoretical basis and practical guidance for the prevention and control of Tetranychus tetranychus by heat stress.
Key words" Extreme high temperature; Tetrarcychus urticae; Trehalose; Sorbitol; Malondialdehyde
Received"" 2023-03-23""" Returned" 2023-04-29
Foundation item" Key National Scientific Research Innovation Training Project for College Students of Gansu Agricultural University(No.202110733020);" Disciplinary Key Team Construction for Agricultural Insect and Pest Control of College of Plant Protection,Gansu Agricultural University" (No.GSAU-XKJS-2023).
First author" WANG" Yan,female,master" student.Research area:resource utilization and plant protection.E-mail:812911561@qq.com
YANG Ruolan(co-first author),female,undergraduate.Research area:plant protection.E-mail:2321329502@qq.com
Corresponding"" author" SHANG Suqin,female,professor.Research" area:agricultural entomology and pest control." E-mail:shangsq@gsau.edu.cn
(责任编辑:郭柏寿" Responsible editor:GUO Baishou)

