辣椒籽分离蛋白超滤提取工艺优化及特性表征






摘要:辣椒籽作为辣椒加工过程中的主要副产物,富含蛋白等营养物质,却未能得到有效利用。基于此,该研究以益都红辣椒籽为原料,采用超滤辅助碱溶酸沉法提取辣椒籽分离蛋白,并与传统碱溶酸沉法提取的辣椒籽分离蛋白的综合提取率、物料投入以及理化和功能特性进行对比。传统碱溶酸沉工艺提取辣椒籽分离蛋白的最佳工艺参数为料液比1∶40、提取温度40 ℃、提取时间180 min、浸提次数1次、碱溶pH 10。为提高蛋白提取量,减少调节pH的酸碱用量,改善分离蛋白的理化特性,采用5 kDa和10 kDa的双级膜超滤技术辅助碱溶酸沉法获得3个超滤组分,包括gt;10 kDa蛋白、5~10 kDa蛋白和lt;5 kDa蛋白,蛋白提取量较传统碱溶酸沉法提高5.28%,盐酸用量较传统碱溶酸沉法减少19.48%。相比于传统碱溶酸沉法提取的蛋白,gt;10 kDa蛋白的溶解度、持水力、乳化稳定性分别显著提高了9.88%、78.66%、22.69%,说明超滤辅助碱溶酸沉法能够获得理化特性更佳的辣椒籽分离蛋白,是一种具有应用前景的辣椒籽分离蛋白提取手段。
关键词:辣椒籽分离蛋白;碱溶酸沉法;超滤;工艺优化;理化和功能特性
中图分类号:TS255.2 """""文献标志码:A """"文章编号:1000-9973(2024)09-0001-08
Optimization of Ultrafiltration Extraction Process of Capsicum Seed
Protein Isolate and Characterization of Its Characteristics
DENG Zi-meng1, HOU Peng-jie1, LIU Si-di1, CUI Jun-liang2, LIU Zhi-yong2,
YIN Xue-dong3, LENG Hong-wei3, LIAO Xiao-jun1, ZHAO Liang1*
(1.Beijing Key Laboratory for Food Non-thermal Processing, Key Laboratory of Fruit and Vegetable
Processing, Ministry of Agriculture, National Engineering Technology Research Center for Fruit
and Vegetable Processing, College of Food Science and Nutritional Engineering,
China Agricultural University, Beijing 100083, China; 2.Xinfeida (Shandong)
Food Co., Ltd., Dezhou 253600, China; 3.Guizhou Guisanhong
Food Co., Ltd., Zunyi 563000, China)
Abstract: As the main by-product of Capsicum processing, Capsicum seed is rich in protein and other nutrients, but it has not been effectively used. Based on this, in this study, with Yidu red Capsicum seed as the raw material, ultrafiltration assisted alkali-solution and acid-precipitation method is used to extract Capsicum seed protein isolate, and the comprehensive extraction rate, material input, physicochemical and functional characteristics of Capsicum seed protein isolate extracted by ultrafiltration assisted alkali-solution and acid-precipitation method are compared with those extracted by traditional alkali-solution and acid-precipitation method. The optimal process parameters of Capsicum seed protein isolate by traditional alkali-solution and acid-precipitation method are solid-liquid ratio of 1∶40, extraction temperature of 40 ℃, extraction time of 180 min, extraction frequency of 1 time and alkali
收稿日期:2024-03-24
基金项目:国家自然科学基金面上项目(32272247);国家重点研发计划专项(2021YFD1600100);中国农业大学2115人才工程资助;黔科合支撑[2021]一般277
作者简介:邓梓萌(2001—),女,硕士研究生,研究方向:果蔬加工。
*通信作者:赵靓(1987—),女,教授,博士,研究方向:果蔬加工。
solution pH of 10. In order to increase the extraction amount of protein, reduce the dosage of acid and alkali to regulate pH, and improve the physicochemical characteristics of protein isolate, 5 kDa and 10 kDa dual-stage membrane ultrafiltration technology assisted alkali-solution and acid-precipitation method is used to obtain three ultrafiltration components, including gt;10 kDa protein, 5~10 kDa protein and lt;5 kDa protein. Compared with traditional alkali-solution and acid-precipitation method, the extraction amount of protein increases by 5.28% and the dosage of hydrochloric acid decreases by 19.48%. The solubility, water holding capacity and emulsification stability of gt;10 kDa protein significantly increase by 9.88%, 78.66%, 22.69% respectively compared with those extracted by traditional alkali-solution and acid-precipitation method. The results indicate that Capsicum seed protein isolate with better physicochemical characteristics could be obtained by ultrafiltration assisted alkali-solution and acid-precipitation method, which is a promising method for extracting" Capsicum seed protein isolate.
Key words: Capsicum seed protein isolate; alkali-solution and acid-precipitation method; ultrafiltration; process optimization; physicochemical and functional characteristics
辣椒是一种重要的调味品和蔬菜,我国辣椒年产量超过1 700万吨,占世界总产量的41.48%,居世界首位[1]。辣椒籽占辣椒干重的30%~60%,富含蛋白质、膳食纤维、脂肪、矿物质、辣椒碱等营养物质,具有较高的开发利用价值[2]。然而,辣椒籽作为辣椒加工业的主要副产物,主要用于饲料、肥料和制粉,未被高值化利用,造成资源浪费和环境污染[3]。因此,如何高效利用辣椒籽、提高附加值、延长产业链是辣椒加工业亟待解决的问题。
传统的蛋白质供应模式以动物蛋白为主,但随着人口增长、环境压力等问题的出现,开发并利用新的蛋白资源是目前研究的热点之一。植物蛋白易被消化吸收,功能特性良好,有降低胆固醇、抗氧化和降血压等功效,具有广阔的开发前景[4]。辣椒籽中蛋白含量在7%~25%左右,氨基酸种类齐全,富含鲜味氨基酸和必需氨基酸,是一种理想的优质蛋白[3]。辣椒籽分离蛋白有潜力成为膳食中蛋白质的良好来源。
目前,植物蛋白的主要提取方法包括碱溶酸沉法[5]、溶剂法[6]、盐溶法[7]等。碱溶酸沉法是传统的蛋白提取方法,尤其在籽类蛋白质提取方面应用广泛,具有操作简便、成本较低的优点,但提取率较低,调节pH所消耗的酸碱用量较大[2]。因此,国内外研究人员采用其他方法辅助碱溶酸沉法提取辣椒籽分离蛋白,能有效提升提取工艺的效率,获得具有良好理化和功能特性的辣椒籽分离蛋白。植物蛋白常用的辅助提取方法有酶解辅助提取法、微波辅助提取法、超滤辅助提取法和超声辅助提取法等[1]。其中,超滤技术操作条件温和、操作简单、能耗低,通过去除小分子颗粒可以纯化蛋白质,降低工艺成本,并改善蛋白的理化和功能特性。唐子箫等[8]利用超滤辅助碱溶酸沉法提取藜麦蛋白,蛋白提取率较碱溶酸沉法增加了23.99%;Liang等[9]利用超滤辅助碱溶酸沉法提取茶籽蛋白,获得了理化和功能特性更优的茶籽蛋白。因此,超滤辅助碱溶酸沉法有潜力成为提取辣椒籽分离蛋白的可行方法,但尚未见相关研究报道。
本团队分别采用马燕等[10]的超高压法及李茉等[11]
的超声辅助碱溶酸沉法提取辣椒籽分离蛋白,所得蛋白的提取率、纯度、理化特性均得到了较好的提高。基于此,本试验采用超滤辅助碱溶酸沉法提取辣椒籽分离蛋白并同步制备功能肽,优化了料液比、提取温度、提取时间、浸提次数、碱溶pH 5个工艺参数,为辣椒籽分离蛋白的提取提供了新的可行性工艺,根据各超滤组分的不同特性为其后续在食品加工中的应用提供了理论基础。
1 材料与方法
1.1 材料与试剂
辣椒籽:由新飞达(山东)食品有限公司提供,团队前期研究表明,益都红辣椒籽蛋白含量较高。
1.2 试剂
正己烷(分析纯):天津市永大化学试剂有限公司;氢氧化钠、盐酸、十二烷基硫酸钠(均为分析纯):上海阿拉丁生化科技股份有限公司;5×考马斯亮蓝G-250(分析纯):北京索莱宝科技有限公司;硼酸(分析纯):上海麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH,分析纯):梯希爱(上海)化成工业发展有限公司;甲醇(分析纯):福晨(天津)化学试剂有限公司。
1.3 主要仪器与设备
XY-400A多功能粉碎机 永康市小宝电器有限公司;RX-2高速冷冻离心机 日本日立公司;Gamma 1-16 LSC Plus冷冻干燥机 德国Christ公司;V1800紫外可见分光光度计 尤尼柯(上海)仪器有限公司;KN580凯氏定氮仪、SPH/SPM系列消解仪 济南阿尔瓦仪器有限公司;Spark 10M微孔板检测系统 瑞士帝肯公司。
1.4 方法
1.4.1 碱溶酸沉法提取辣椒籽分离蛋白工艺流程
辣椒籽→挑选、除杂→粉碎→过筛→脱脂→碱溶→离心→等电点沉降→水洗→中和→透析→冷冻干燥→辣椒籽分离蛋白。
1.4.2 碱溶酸沉法提取辣椒籽分离蛋白单因素试验设计
以辣椒籽分离蛋白提取率为指标,分别对料液比、提取温度、提取时间、浸提次数、碱溶pH 5个因素进行单因素试验。设定料液比为1∶10、1∶20、1∶30、1∶40、1∶50;提取温度为25,30,40,50,60 ℃;提取时间为30,60,90,120,150,180 min;浸提次数为1,2,3,4次;碱溶pH为7,8,9,10,11。对提取工艺进行初步优化,确定较佳因素试验参数范围,每个处理重复3次,结果取平均值。
1.4.3 碱溶酸沉法提取辣椒籽分离蛋白工艺优化
根据单因素试验结果设计正交试验,以提取时间、浸提次数、料液比为自变量,辣椒籽分离蛋白提取率为指标,设计L9(33)正交试验表(见表1),进行提取工艺优化。
1.4.4 超滤辅助碱溶酸沉法提取辣椒籽分离蛋白工艺流程
辣椒籽→挑选、除杂→粉碎→过筛→脱脂→碱溶→离心→一级超滤→二级超滤→等电点沉降→水洗→中和→透析→冷冻干燥→辣椒籽分离蛋白。
一级超滤:采用错流超滤设备,有效膜面积为28.26 cm2,选用截留分子量为10 kDa的聚醚砜膜。在温度45 ℃、操作压力0.40 MPa的条件下对脱脂辣椒籽粕碱提液进行超滤操作。超滤4 h后,停止超滤。
二级超滤:采用错流超滤设备,有效膜面积为28.26 cm2,选用截留分子量为5 kDa的聚醚砜膜。在温度45 ℃、操作压力0.40 MPa的条件下对一级超滤透过液进行超滤操作。超滤1 h后,停止超滤。
1.4.5 辣椒籽分离蛋白的提取率
辣椒籽分离蛋白的提取率(%)=脱脂辣椒籽粕碱提液蛋白含量(mg/mL)脱脂辣椒籽粕总蛋白含量(mg/mL)×100%。
1.4.6 膜通量测定
参照高盼等[12]的方法测定超滤膜膜通量,膜通量的计算公式如下:
R=MA×T。
式中:R为膜通量(kg·m-2·h-1);M为透过液质量(kg);A为膜面积(m2);T为超滤时间(h)。
1.4.7 截留率测定
参照高盼等[12]的方法并略作修改,测定超滤膜截留率,截留率的计算公式如下:
P=1-c′c×100%。
式中:P为蛋白质截留率(%);c′为透过液的蛋白质浓度(mg/mL);c为初始溶液的蛋白质浓度(mg/mL)。
1.4.8 辣椒籽分离蛋白含量测定
采用Bradford[13]的方法对蛋白含量进行测定。取500 μL稀释样品,加入5 mL 1×G250 染色液混匀,反应3 min后使用分光光度计在595 nm处测定吸光值。
标准曲线的绘制:取100 μL牛血清蛋白标准品,加入PBS缓冲液2.4 mL,稀释至终浓度为0.2 mg/mL,配制一系列梯度浓度的牛血清蛋白溶液,梯度稀释范围为0~0.2 mg/mL,加入5 mL 1×G250 染色液混匀,反应3 min后使用分光光度计在595 nm处测定吸光值。以牛血清蛋白溶液浓度为横坐标,吸光值为纵坐标绘制标准曲线:y=3.645x+0.062 8,R2=0.992 5。
1.4.9 辣椒籽总蛋白含量测定
采用凯氏定氮法,参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的方法进行测定。
1.4.10 溶解度测定
参照Bradford[13]的方法进行测定。称取0.100 0 g样品溶解于10 mL蒸馏水中,在12 000 r/min、10 ℃的条件下离心10 min后取上清液测定蛋白含量,利用凯氏定氮法测定样品中总蛋白含量。蛋白的溶解度用氮溶解度指数(NSI)表示,氮溶解指数(NSI)的计算公式如下:
NSI(%)= 上清液中蛋白质含量(mg/mL)样品中总蛋白质含量(mg/mL)×100%。
1.4.11 持水力测定
参照Mepba等[14]的方法并略作修改。称取0.100 0 g样品于10 mL烧杯中,加入5 mL蒸馏水,常温下磁力搅拌24 h后,在3 500 r/min、10 ℃的条件下离心10 min,弃去上清液,称取样品湿质量。持水力的计算公式如下:
持水力(g/g)=m1-m0m0。
式中:m1为样品湿质量(g);m0为样品干质量(g)。
1.4.12 持油力测定
参照梅钰琪等[15]的方法并略作修改。称取0.100 0 g样品于10 mL烧杯中,加入5 mL大豆油,常温下磁力搅拌24 h后,在3 500 r/min、10 ℃的条件下离心10 min,弃去上清液,称取样品湿质量。持油力的计算公式如下:
持油力(g/g)=m1-m0m0。
式中:m1为样品湿质量(g);m0为样品干质量(g)。
1.4.13 乳化活力和乳化稳定性测定
参考Zou等[16]的方法并略作修改。取3 mL 0.1%辣椒籽分离蛋白溶液于10 mL离心管中,加入1 mL辣椒籽油,在12 000 r/min的条件下均质2 min,迅速从离心管底部取50 μL乳液,稀释于5 mL 0.1% SDS溶液中,以0.1% SDS溶液作为空白对照,在500 nm处测定吸光值,记为A0。静置10 min后,重复上述步骤,在500 nm处测定吸光值,记为A10。以乳化活力(EAI,m2/g)和乳化稳定性(ES,%)评价乳化性。乳化活力(EAI)和乳化稳定性(ES)的计算公式如下:
EAI(m2/g)=2T× A0×DC×φ×10 000。
ES(%)=A10A0×100%。
式中:T为常数,2.303;D为稀释倍数;C为蛋白浓度(g/mL);φ为油的体积分数(%)。
1.4.14 起泡性和泡沫稳定性测定
参考Ge等[17]的方法并略作修改。取4 mL 10 mg/mL 的辣椒籽分离蛋白溶液于10 mL烧杯中,在30 000 r/min的条件下均质2 min,量取泡沫体积为V0。静置30 min后,量取泡沫体积为V1,辣椒籽分离蛋白溶液的起泡性(FC)和泡沫稳定性(FS)的计算公式如下:
FC(%)=V04×100%。
FS(%)=V1V0×100%。
式中:4为进行均质操作的蛋白溶液体积(mL)。
1.4.15 抗氧化性测定
DPPH自由基清除率测定:参照Brand等[18]的方法并略作修改。DPPH溶液配制:称取0.100 1 g DPPH,用甲醇定容至50 mL,取7 mL用甲醇定容至250 mL。
样品测定:取100 μL样液于10 mL离心管中,加入4 mL DPPH溶液,常温下避光反应45 min,在517 nm处测定吸光值A。DPPH自由基清除率的计算公式如下:
DPPH自由基清除率(%)=1-A-A0A1×100%。
式中:A为样品和DPPH溶液的吸光值;A0为样品溶液的吸光值;A1为DPPH溶液的吸光值。
1.5 数据处理
采用Excel 2016软件进行方差检验,SPSS 23.0软件进行显著性分析,Origin 9.2软件进行图表绘制。
2 结果与分析
2.1 碱溶酸沉法提取辣椒籽分离蛋白单因素试验结果
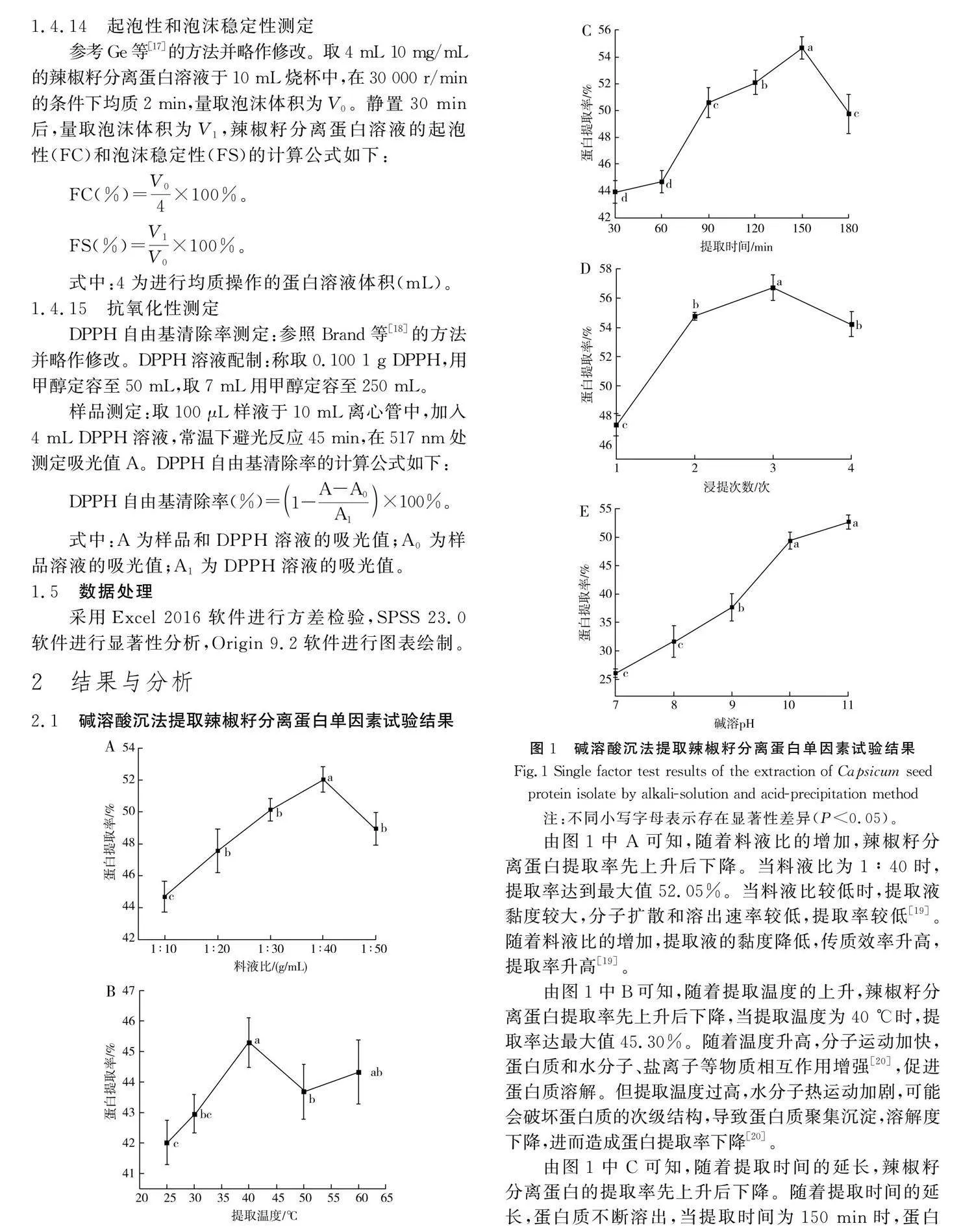
由图1中A可知,随着料液比的增加,辣椒籽分离蛋白提取率先上升后下降。当料液比为1∶40时,提取率达到最大值52.05%。当料液比较低时,提取液黏度较大,分子扩散和溶出速率较低,提取率较低[19]。随着料液比的增加,提取液的黏度降低,传质效率升高,提取率升高[19]。
由图1中B可知,随着提取温度的上升,辣椒籽分离蛋白提取率先上升后下降,当提取温度为40 ℃时,提取率达最大值45.30%。随着温度升高,分子运动加快,蛋白质和水分子、盐离子等物质相互作用增强[20],促进蛋白质溶解。但提取温度过高,水分子热运动加剧,可能会破坏蛋白质的次级结构,导致蛋白质聚集沉淀,溶解度下降,进而造成蛋白提取率下降[20]。
由图1中C可知,随着提取时间的延长,辣椒籽分离蛋白的提取率先上升后下降。随着提取时间的延长,蛋白质不断溶出,当提取时间为150 min时,蛋白提取率达到最大值。继续延长提取时间,可能会使溶出的蛋白相互作用,形成絮凝沉淀[21]。
由图1中D可知,随着浸提次数的增加,辣椒籽分离蛋白提取率先上升后下降。当浸提次数为3次时,辣椒籽分离蛋白提取率达最大值56.72%。增加浸提次数会增加能耗、成本、废水排放量,延长生产周期。
由图1中E可知,随着碱溶pH的升高,辣椒籽分离蛋白提取率先上升后下降。当碱溶pH为11时,提取率达最大值52.68%。这是因为碱性条件使得蛋白质带负电,蛋白质分子间相互排斥,对蛋白质有增溶效果。但pH过高会破坏蛋白质的生物活性,影响蛋白质的理化和功能特性[22]。
2.2 碱溶酸沉法提取辣椒籽分离蛋白工艺的正交试验优化
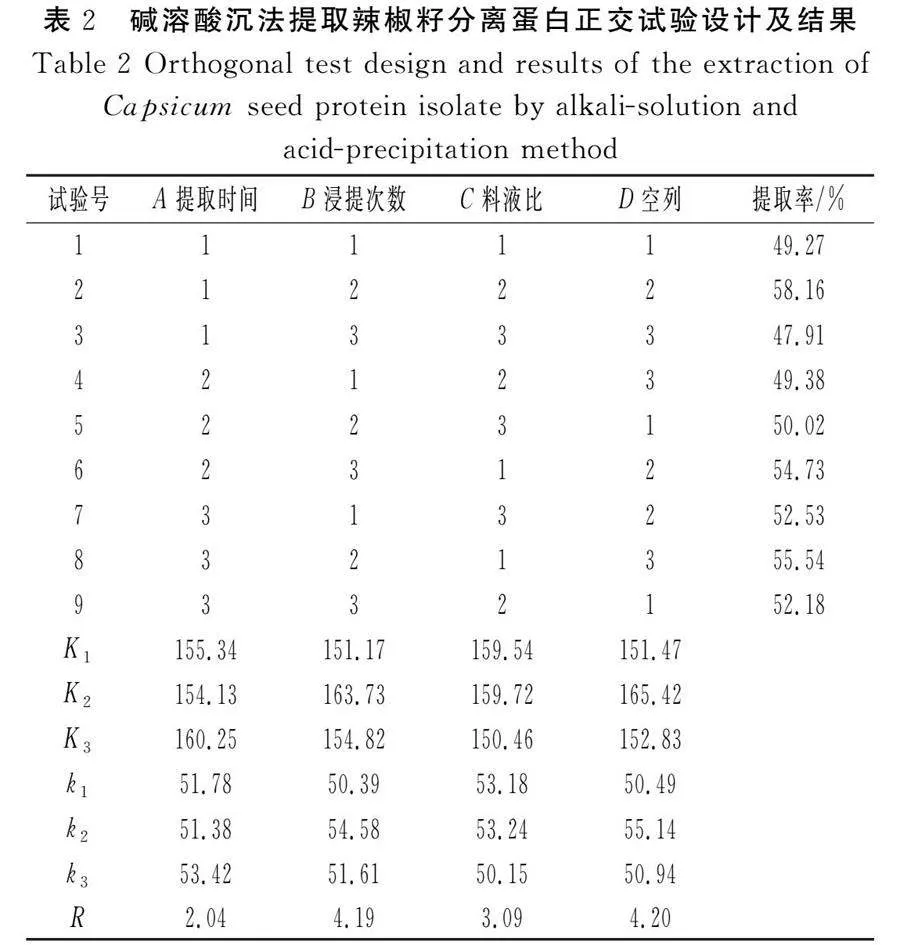
在单因素试验的基础上,设计L9(33)正交试验,以辣椒籽分离蛋白提取率为评价指标,优化碱溶酸沉法提取辣椒籽分离蛋白的最佳工艺参数,正交试验设计及结果见表2,正交试验方差分析结果见表3。
由表2可知,各因素对辣椒籽分离蛋白提取率的影响程度为Bgt;Cgt;A,即浸提次数gt;料液比gt;提取时间。极差分析和方差分析均表明,A3B2C2为最佳提取条件。由表3可知,因素A、B、C的P值均gt;0.05,即提取时间、浸提次数、料液比在正交设计三水平内对辣椒籽分离蛋白提取率均无显著影响,可以根据实际情况进行选择。综合提取率和能耗、成本、废水排放量,确定提取辣椒籽分离蛋白的工艺参数为料液比1∶40、提取温度40 ℃、提取时间180 min、碱溶pH 10、浸提次数1次。在此条件下,辣椒籽分离蛋白提取率和提取量分别为56.20%、11.94 g/100 g脱脂辣椒籽粕,纯度为77.04%,盐酸用量为23.1 mL/100 g脱脂辣椒籽粕。
2.3 超滤膜的膜通量和截留率变化
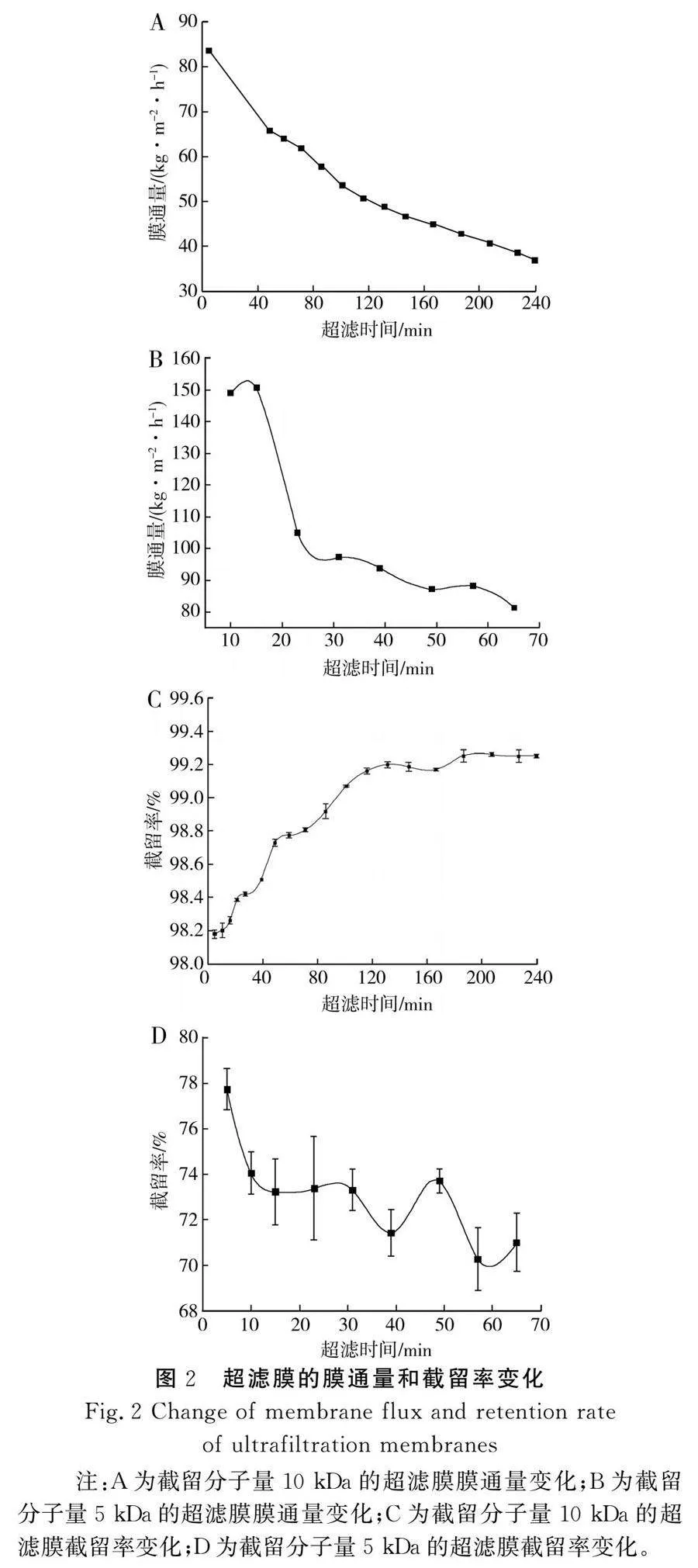
由图2可知,随着超滤时间的延长,截留分子量为10,5 kDa的超滤膜膜通量均先下降后趋于平稳,这是因为超滤初期,蛋白质迅速在超滤膜表面形成吸附层,表现出膜通量迅速衰减,随后蛋白质在超滤膜表面逐渐形成凝胶层,膜通量趋于平衡[21],这与唐子箫等[8]、Migdalia等[23]的研究结果一致。利用截留分子量为10 kDa的超滤膜对脱脂辣椒籽粕碱提液进行一级超滤,浓缩倍数为2.67,膜通量大于37.05 kg·m-2·h-1,截留率大于98.18%,截留效果良好;利用截留分子量为5 kDa的聚醚砜膜对一级超滤透过液进行二级超滤,截留率大于70.25%,浓缩倍数为2.30。gt;10 kDa蛋白的提取量为12.57 g/100 g脱脂辣椒籽粕,较传统碱溶酸沉法提高了5.28%;盐酸用量为18.6 mL/100 g脱脂辣椒籽粕,较传统碱溶酸沉法减少了19.48%,说明超滤辅助碱溶酸沉法提高了辣椒籽分离蛋白的提取量、减少了盐酸的用量。
2.4 辣椒籽分离蛋白及超滤组分的溶解度
由图3可知,传统碱溶酸沉法提取的蛋白、gt;10 kDa蛋白、5~10 kDa、lt;5 kDa蛋白的氮溶解指数分别为60.13%、70.01%、92.95%、92.71%。其中,gt;10 kDa蛋白的氮溶解指数较传统碱溶酸沉法提取的蛋白显著提高了9.88%(Plt;0.05),表明超滤辅助处理改善了辣椒籽分离蛋白的溶解性,其原因可能为超滤辅助处理去除了大部分低分子量的非蛋白质成分和少量非水溶性蛋白质,导致其水溶性蛋白质含量较高,这与对红扁豆、绿扁豆[24]、马豆[25]、豌豆[26]分离蛋白的研究结果一致。
2.5 辣椒籽分离蛋白及超滤组分的持水力和持油力
由图4可知,传统碱溶酸沉法提取的蛋白和gt;10 kDa蛋白的持水力分别为4.17,7.45 g/g,gt;10 kDa蛋白的持水力较传统碱溶酸沉法制得的蛋白显著提高了78.66%(Plt;0.05),说明超滤辅助处理有助于辣椒籽分离蛋白持水力的提高,这可能是由于膜分离处理导致蛋白链的展开,促进了蛋白质的持水能力,这与对大豆[27]、扁豆[28]分离蛋白的研究结果一致。gt;10 kDa蛋白的持油力为1.70 g/g,低于传统碱溶酸沉法提取的蛋白的3.57 g/g,这可能是因为传统碱溶酸沉法提取的蛋白中蛋白含量较高,与油相的相互作用增强[29],这与对鹰嘴豆[24]分离蛋白的研究结果一致。
2.6 辣椒籽分离蛋白及超滤组分的乳化性和乳化稳定性
由图5可知,传统碱溶酸沉法提取的蛋白、gt;10 kDa蛋白、5~10 kDa蛋白、lt;5 kDa蛋白的乳化活力分别为6.01,5.94,13.55,9.62 m2/g,其中,5~10 kDa蛋白、lt;5 kDa蛋白的乳化活力较高,这可能是由于超滤辅助处理导致疏水基团暴露,促进其与油相相互作用形成乳液[9]。传统碱溶酸沉法提取的蛋白、gt;10 kDa蛋白、5~10 kDa蛋白、lt;5 kDa蛋白的乳化稳定性分别为54.08%、66.35%、52.97%、52.97%,其中,gt;10 kDa蛋白的乳化稳定性较传统碱溶酸沉法提取的蛋白显著提高了12.27%(Plt;0.05),这可能是由于gt;10 kDa蛋白的分子量较大,降低了其在乳液中的扩散速率或增强了其立体效应,进而提高了乳液的稳定性,这与对茶籽[7]分离蛋白的研究结果一致。
2.7 辣椒籽分离蛋白及超滤组分的起泡性和泡沫稳定性
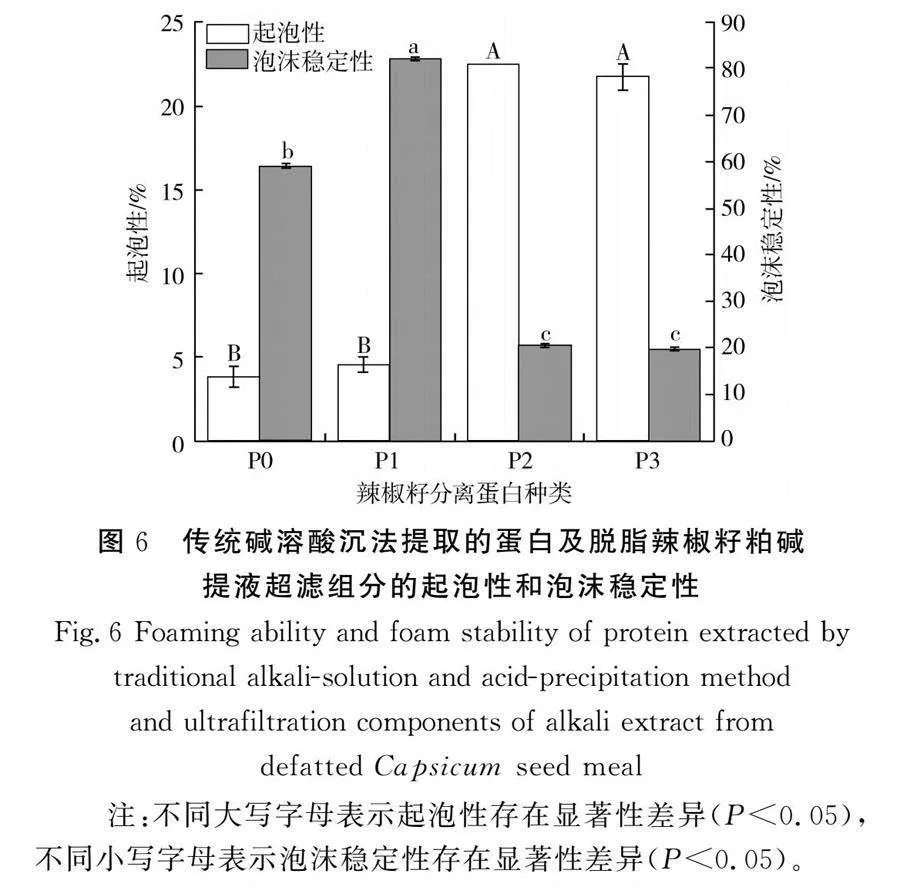
由图6可知,传统碱溶酸沉法提取的蛋白、gt;10 kDa蛋白、5~10 kDa蛋白、lt;5 kDa蛋白的起泡性分别为3.83%、4.58%、22.50%、21.75%。5~10 kDa蛋白、lt;5 kDa蛋白的起泡性较高,这是由于蛋白分子溶解度的增加促进了蛋白在水-空气界面的扩散和伸展,从而降低了表面张力[30]。传统碱溶酸沉法提取的蛋白、gt;10 kDa蛋白、5~10 kDa蛋白、lt;5 kDa蛋白的泡沫稳定性分别为59.03%、82.11%、20.56%、19.74%。与传统碱溶酸沉法提取的蛋白相比,gt;10 kDa蛋白的泡沫稳定性显著提高了39.10%(Plt;0.05),这可能是由于gt;10 kDa蛋白的聚集特性有助于形成稳定的界面膜,促进蛋白分离物的聚集,减少泡沫排出,形成了稳定的泡沫[29]。
2.8 辣椒籽分离蛋白及超滤组分的抗氧化性
在细胞代谢过程中产生的自由基是癌症和心血管疾病等发展的主要因素。氧化应激时自由基含量升高,导致氧化损伤,富含抗氧化活性成分的食品可以保护人体免受氧化损伤,从而预防相关疾病。自由基清除率决定其抗氧化性,其值越大表明抗氧化性越强[31]。
由图7可知,传统碱溶酸沉法提取的蛋白、gt;10 kDa蛋白、5~10 kDa蛋白、lt;5 kDa蛋白的DPPH自由基清除率分别为7.12%、7.60%、19.76%、18.49%。与传统碱溶酸沉法提取的蛋白相比,5~10 kDa蛋白、lt;5 kDa蛋白的抗氧化性分别显著提高了177.53%、158.71%(Plt;0.05),表明超滤辅助碱溶酸沉法能够提高辣椒籽分离蛋白的抗氧化性。
3 结论
优化传统碱溶酸沉法提取辣椒籽分离蛋白的工艺参数为料液比1∶40、提取温度40 ℃、提取时间180 min、浸提次数1次、碱溶pH 10。采用超滤辅助碱溶酸沉法提取辣椒籽分离蛋白的提取量较传统碱溶酸沉法提高5.28%,盐酸用量较传统碱溶酸沉法减少19.48%。超滤处理改善了辣椒籽分离蛋白的溶解度、持水力、乳化稳定性,gt;10 kDa蛋白较传统碱溶酸沉法提取的蛋白分别显著提高了9.88%、78.66%、22.69%。该法同步制备出溶解性、抗氧化性、乳化性、起泡性较好的5~10 kDa、lt;5 kDa的小分子蛋白,可用于功能肽的制备,以期作为天然抗氧化活性成分添加到功能食品中减少氧化应激损伤。该法提取的辣椒籽分离蛋白可以应用于肉制品中,增加产品的嫩度和多汁性,也可以作为天然乳化剂应用于色拉、蛋黄酱、焙烤食品、乳饮料、冰激凌中,以期为辣椒籽分离蛋白深加工产品的开发提供前期制备工艺。
参考文献:
[1]WANG F Z, MA Y, WANG Y T, et al. Physicochemical properties of seed protein isolates extracted from pepper meal by pressure-assisted and conventional solvent defatting[J].Food and Function,2021,12(21):11033-11045.
[2]曹悦,马燕,赵靓,等.辣椒籽及其高值化利用研究进展[J].食品工业科技,2018,39(21):320-327.
[3]宁娜.辣椒籽的油脂和蛋白质研究[D].重庆:西南大学,2011.
[4]肖彤,苏晓琳,周航,等.植物蛋白肉中挥发性不良风味物质的研究进展[J].食品工业科技,2022,43(18):1-11.
[5]赵婧,宋弋,刘攀航,等.植物基替代蛋白的利用进展[J].食品工业科技,2021,42(18):1-8.
[6]吴雅茹,陈贵茹,雷建都,等.桑叶蛋白超声提取联合超滤纯化工艺优化及其营养评价[J].食品工业科技,2023,44(16):236-245.
[7]曾婧,白雪媛,王悦,等.铁皮石斛蛋白提取工艺优化、活性成分筛选及结构研究[J].食品工业科技,2022,43(19):228-237.
[8]唐子箫,李俊华,朱晓军,等.藜麦蛋白的提取与超滤分离[J].食品与发酵工业,2021,47(15):129-136.
[9]LIANG L, XIAO Y L, ZHANG J X, et al.Physicochemical, functional, and digestive characteristics of tea seed cake protein obtained by ultrafiltration[J].Journal of Food Science,2022,87(10):4522-4537.
[10]马燕,孟伊娜,邹淑萍,等.高压脱脂辣椒籽分离蛋白提取工艺优化及其功能特性研究[J].中国调味品,2020,45(8):54-60.
[11]李茉,倪元颖,彭郁,等.超声辅助提取辣椒籽蛋白工艺优化[J].农业工程学报,2016,32(24):309-314.
[12]高盼,张慧慧,王澍,等.酶法辅助制备核桃蛋白的工艺优化及超滤回收核桃蛋白[J].中国油脂,2022,47(10):11-17.
[13]BRADFORD M M. A rapid and sensitive method for quantitation of microgram quantities of protein utilizing principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[14]MEPBA H, EBOH L, BANIGO D. Effects of processing treatments on the nutritive composition and consumer acceptance of some Nigerian edible leafy vegetables[J].African Journal of Food, Agriculture, Nutrition and Development,2007,7(1):1-18.
[15]梅钰琪,郑键欣,杨韵仪,等.盐溶超滤制备菜籽蛋白及其功能特性研究[J].中国食品添加剂,2023,34(1):1-9.
[16]ZOU H N, ZHAO N, SUN S, et al. High-intensity ultrasonication treatment improved physicochemical and functional properties of mussel sarcoplasmic proteins and enhanced the stability of oil-in-water emulsion[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects,2020,589:124463.
[17]GE J, SUN C X, SUN M M, et al. Introducing panda bean (Vigna umbellata (Thunb.) Ohwi et Ohashi) protein isolate as an alternative source of legume protein: physicochemical,functional and nutritional characteristics[J].Food Chemistry,2022,388:133016.
[18]BRAND W W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30.
[19]张英蕾,姚鑫淼,卢淑雯,等.碱溶酸沉法提取黑豆蛋白工艺优化[J].中国食品添加剂,2019,30(1):60-68.
[20]陈翔宇,邹怡然,蒋天宁,等.响应面法优化碱溶酸沉法提取黄秋葵蛋白工艺条件研究[J].海南师范大学学报(自然科学版),2019,32(3):288-294.
[21]林栋,张爱民,王绍校,等.赤小豆蛋白的提取工艺优化及其功能性质[J].中国食品添加剂,2022,33(1):75-82.
[22]郝文来.基于碱溶酸沉法的亚麻籽油蛋白分离工艺优化[J].当代化工,2019,48(10):2285-2287.
[23]MIGDALIA A, NESTOR J, NELSON C, et al. Development of a scalable procedure by a discontinuous crossflow DF/UF to obtain a concentrate of chenopodin from a dead-end centrifugal UF at bench scale[J].Food Chemistry,2020,313:126154.
[24]BOYE J I, AKSAY S, ROUFIK S, et al. Comparison of the functional properties of pea, chickpea and lentil protein concentrates processed using ultrafiltration and isoelectric precipitation techniques[J].Food Research International,2010,43(2):537-546.
[25]VOSE J R. Production and functionality of starches and protein isolates from legume seeds (field pea and horsebeans)[J].Cereal Chemistry,1980,57(6):406-410.
[26]TIMMERMANNS Y. In Proceedings: Technofunctional Properties of Proteins and Hydrocollids in Food Production[M].Neumunster:Marz,1993:18-19.
[27]JOHN H, SINHA L K. Quality characteristics and functional properties of soy protein isolate prepared using ultrafiltration[J].Journal of Agricultural Engineering,2019,56(1):16-28.
[28]ALONSO-MIRAVALLES L, JESKE S, BEZ J, et al. Membrane filtration and isoelectric precipitation technological approaches for the preparation of novel, functional and sustainable protein isolate from lentils[J].European Food Research and Technology,2019,245(9):1855-1869.
[29]MALOMO S A, ALUKO R E. Conversion of a low protein hemp seed meal into a functional protein concentrate through enzymatic digestion of fibre coupled with membrane ultrafiltration[J].Innovative Food Science and Emerging Technologies,2015,31:151-159.
[30]HE Z Y, LI W W, GUO F X, et al. Foaming characteristics of commercial soy protein isolate as influenced by heat-induced aggregation[J].International Journal of Food Properties,2015,18(8):1817-1828.
[31]LYU R Z, DONG Y F, BAO Z J, et al. Advances in the activity evaluation and cellular regulation pathways of food-derived antioxidant peptides[J].Trends in Food Science and Technology,2022,122:171-186.

