香菇多糖提取、结构特征及生物活性研究进展

摘要:香菇属于担子菌纲,是世界上种植最广泛的蘑菇之一,以其食品和药物的双重用途而闻名。香菇富含多糖、维生素、微量元素等营养成分,具有很高的营养和药用价值,深受消费者喜爱。从优质香菇的子实体中提取的多糖是在其生理作用中起主要作用的活性成分。大量研究表明,香菇多糖具有抗炎、抗氧化和抗癌等多种生物活性。香菇多糖具有良好的亲水性、环保性、无毒性、无害性、原料易得等特点,在食品和医药领域得到了广泛的应用。研究香菇多糖的提取、结构特征和生物活性,预测研发趋势,对于相关食品和医药产品的研发及其实际技术应用至关重要。
关键词:香菇;多糖;提取工艺;结构特征;生物活性
中图分类号:TS201.1""""" 文献标志码:A"""" 文章编号:1000-9973(2024)09-0208-07
Research Progress on Extraction, Structural Characteristics and
Bioactivity of Lentinula edodes Polysaccharides
LI Jun-sheng, GUAN Li, LI Jia-hui, XIA Zhi, TAN Chong, ZUO Jin-long*
(College of Food Engineering, Harbin University of Commerce, Harbin 150028, China)
Abstract: Lentinula edodes belongs to Basidiomycetes. It is one of the most widely cultivated mushrooms in the world, and it is famous for its dual use of food and medicine. Lentinula edodes is rich in polysaccharides, vitamins, trace elements and other nutrients. It has high nutritional and medicinal value and is deeply loved by consumers. Polysaccharides extracted from the fruit bodies of high-quality Lentinula edodes are active components that play a main role in their physiological functions. A large number of studies have shown that Lentinula edodes polysaccharides have many bioactivities such as anti-inflammation, antioxidation and anti-cancer. Lentinula edodes polysaccharides have been widely used in the field of food and medicine due to their good hydrophilicity, environmental protection, non-toxicity, harmlessness and easy availability of raw materials. Studying the extraction, structural characteristics and bioactivity of Lentinula edodes polysaccharides and predicting the research and development trends are very important for the research and development of related food and pharmaceutical products and their practical technical application.
Key words: Lentinula edodes; polysaccharides; extraction technology; structural characteristics; bioactivity
收稿日期:2024-02-08
基金项目:黑龙江省自然科学基金联合引导项目(LH2022E090)
作者简介:李俊生(1973—),男,教授,硕士,研究方向:农产品废弃物资源化利用。
*通信作者:左金龙(1970—),男,教授,博士,研究方向:农产品废弃物资源化利用。
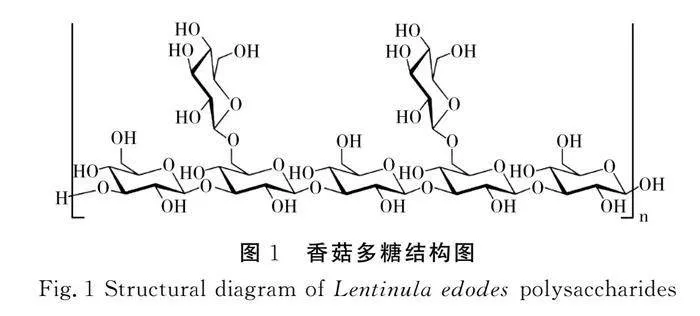
香菇,又名“香菌”,是中国最早种植的菌种之一,在我国福建、贵州等地均有种植。香菇富含蛋白质、维生素、微量元素等成分[1],具有较高的营养价值,因此被称为“菇中皇后”。在其成分中,香菇多糖(lentinan,LNT;Lentinula edodes polysaccharides,LEP)是从优质香菇的子实体中分离出来的生物活性物质。这些是由β-1,3-葡聚糖为主链、β-1,6-糖苷链为支链形成的高分子量多糖[2],是香菇的主要活性成分,香菇多糖结构见图1[3]。已有研究表明,香菇多糖具有多种生物活性,包括抗癌、抗肿瘤、调节免疫力、治疗糖尿病等[4-6]。LEP作为食品级多糖,具有良好的亲水性、胶凝性和表面活性剂性能,在食品、医药和化妆品等领域得到了广泛的应用,香菇多糖的高效低成本利用已成为各行业的研究热点。
本文阐述了香菇多糖提取背景下的酶解法、超声波萃取法、表面活性剂萃取法的作用机理和提取效果。同时,本文还讨论了香菇多糖结构特征和生物活性的研究进展,并展望了提取技术的未来发展趋势。本研究旨在为多糖提取技术的发展、工业化生产和实际应用提供理论依据。
1 香菇多糖提取方法
通过不同提取方法从食用菌子实体或菌丝体中得到多糖,传统获取多糖的方法通常利用水或有机溶剂进行,然而植物细胞壁的复杂结构导致香菇多糖提取操作较复杂,可能会妨碍提取多糖的活性,同时存在耗时长、提取率低、需要多次提取、容易得到酸性多糖、提取多糖后产生的废液会对环境造成污染等缺点。研究者为解决传统多糖提取存在的诸多问题,采用超声波提取法、酶解法、表面活性剂提取法等技术,显著提高了多糖的提取效率,降低了溶剂的使用量,提高了提取物的产量,降低了对产物的破坏性。香菇多糖提取纯化示意图见图2。
1.1 酶解法
酶解法利用生物酶的专一性水解或降解细胞壁,使胞内活性物质释放。酶解技术反应条件温和、成本低,是适合多糖提取的方法[7],但生物酶对反应条件要求严格,不适宜的条件会导致酶蛋白失活且酶解法所需成本相对较高,利用该方法时要考虑反应条件对酶活性的影响。
赵茹等[8]在纤维素酶添加量0.4%、提取温度60 ℃、提取时间2 h、液固比20∶1(mL/g)的工艺条件下提取香菇多糖,其含量达到5.73%。由于香菇细胞壁多糖含量较高且具有一定厚度,导致多糖难以从细胞内向细胞外扩散,然而在复合酶的作用下,细胞壁被破坏,促使多糖从植物细胞中溶出。在温度为45 ℃、pH为4.5、液固比为20∶1(mL/g)、纤维素酶、木瓜蛋白酶和果胶酶复合酶作用条件下,香菇多糖提取率达(18.16±0.10)%,提取率明显提高[9]。
由于单酶法在实际生产过程中会受到规模化应用酶来源、酶对底物的专一性等条件的限制,多数研究者在提取植物多糖时更倾向于使用由果胶酶、纤维素酶和蛋白酶等组成的复合酶。植物细胞壁在复合酶作用下被破坏,纤维素酶将纤维素分解成葡萄糖、寡糖和高级葡萄糖聚合物等糖类化合物,果胶类化合物通过果胶酶分解为半乳糖醛酸,最后多糖从胞内释放。
1.2 超声波萃取法
超声波萃取法主要利用超声波的空化和机械作用,当液体中微小气泡(空化核)在超声场作用下的振动频率与超声波频率相等时,空化气泡发生剧烈溃灭并产生强毛细管波和高速微射流(gt;100 m/s),颗粒尺寸减小,细胞壁与细胞膜结构被破坏,细胞内容物的穿透能力增强,加速了有效成分的释放,空化效应可使水分子解离产生自由基,破坏细胞结构,提高提取率,常用于食品原料或加工副产物中多糖的提取[10-11]。
Wang等[12]从废弃香菇基质中提取香菇多糖,在提取温度50 ℃、液固比30∶1(mL/g)、超声功率120 W的条件下,总多糖含量可达(37.05±0.31) mg/g。张弘弛等[13]在最佳提取条件(料液比1∶40(g/mL)、浸提时间0.5 h、超声温度60 ℃、超声时间20 min)下获得香菇多糖提取率为15.86%。与酶解法相比,超声波萃取法明显增强了多糖的提取效果,且所需时间更短[8-9]。
超声波功率增加导致形成的空化气泡数量增加,气泡对细胞的破坏能力及传质速率增强,多糖提取效率提高,但超声波功率过高、提取时间过长会使多糖发生水解,收率降低。因此,利用超声波辅助萃取多糖时要考虑超声功率和提取时间对目标物提取的影响。
1.3 表面活性剂协同超声萃取法
表面活性剂协同超声提取的技术要点在于超声非热加工特性与表面活性剂润湿、增溶作用相结合,从而达到表面活性剂水溶液取代高浓度醇溶液,以减少有机溶剂的使用,同时可以达到安全环保、降低成本、优化有效成分等效果,更有利于活性成分的溶出[14],该方法可在工业中应用来提取多糖。
张琴等[15]通过表面活性剂协同超声波提取香菇多糖,在表面活性剂添加量2%、料液比1∶20(g/mL)的条件下超声处理40 min,香菇多糖含量为7.05%。在表面活性剂基础上加入双频超声波辅助可以避免因单频超声声场不均匀、空化效应不完全而影响提取效率的问题,在料液比1∶40(g/mL)、表面活性剂用量2.5%、(25+40) kHz超声波条件下超声提取25 min,香菇多糖提取率为14.16%,提取效果显著增强[16]。
随着表面活性剂添加量的增加,多糖产率也随之增加,但当表面活性剂添加量达到一定值时多糖产量下降,这是因为多糖提取液中表面活性剂浓度高于其临界胶束浓度,游离状态下的活性剂数量变少且形成胶束,多糖产量降低[17]。
2 分离纯化与结构分析
2.1 分离纯化
经过各种提取技术所获得的多糖是含有色素、蛋白质、脂肪以及其他物质的粗多糖提取物,需要对其进行透析、沉淀并冷冻干燥去除杂质以获得粗香菇多糖。杂质影响多糖结构和生物活性,因此需要对香菇粗多糖进行分离、纯化以获得均一性多糖组分。
通常情况下,利用Sevag法、三氟三氯乙烷法、三氯乙酸法(trichloroacetic acid,TCA)、酶解法等去除多糖中的蛋白质。鹿士峰[18]运用正交试验法以多糖保留率和蛋白质脱除率为标准比较盐酸法、三氯乙酸法、Sevag法脱蛋白质能力,同时考虑几种方法对多糖活性的影响。结果表明,盐酸法蛋白去除率最高达70.61%,香菇多糖保存率为50.39%,综合评分为60.50分,该方法处理后的多糖活性显著增强,即盐酸法脱蛋白效果最佳。此外,H2O2氧化法与活性炭吸附法也是去除色素常用的方法,H2O2电离出的氢氧根离子与色素发生氧化反应达到脱色目的;活性炭直接吸附分子质量在500~1 000 Da以内的色素物质,对溶液进行纯化[19]。鹿士峰[18]比较H2O2、壳聚糖与活性炭3种脱色剂对香菇多糖的除色效果,研究发现活性炭法脱色率和多糖保留率最高,对多糖活性的损伤较小,该法为所研究方法中最优的脱色方法。
在除尽蛋白质与色素后仍需对多糖进一步分离纯化才能获得均一性多糖。在分离蛋白质和色素的基础上,进一步分离纯化多糖的方法主要有乙醇沉淀法、离子交换色谱法、凝胶过滤层析法、透析法[20]。乙醇分级沉淀是指在提取液中加入乙醇、甲醇等溶剂改变溶液极性,溶质的溶解度改变,大分子量物质从混合溶液中析出[21]。Morales等[22]利用乙醇沉淀法得到不溶性粗多糖,再利用NaOH和冷冻干燥技术得到3种不同葡聚糖,分别为(1→6)-β-D-葡聚糖、(1→3)-α-D-葡萄糖、(1→3),(1→6)-β-D-葡萄糖,该方法操作简单,适用于大量处理样品,但由于存在乙醇等有机溶剂,可能会影响多糖活性和结构。凝胶层析是利用不同分子量的多糖在凝胶柱中洗脱时间存在差异这一特点对其进行分离,常用凝胶填料Sephadex-G、Sepharose,凝胶层析法具有纯化效果好、操作简单、应用范围广等优点,但存在分离量低、只适用于实验室研究的缺点。离子交换色谱法主要利用样品与填料间的离子交换作用,釆用水和盐溶液对中性和酸性多糖进行分离[21]。Udchumpisai等[23]将乙醇沉淀法与凝胶层析结合来纯化LNT,先将95%冷乙醇加入粗多糖溶液中进行连续沉淀,再用DEAE-EF离子交换层析柱与Sepharose G-100柱分馏、沉淀得到多糖馏分LVP,最常用香菇多糖的分离纯化方法为DEAE、DEAE-Sephadex A-25离子交换层析柱、Sephadex G-100柱层析技术[24]。
2.2 结构分析
天然香菇多糖是从优质真菌香菇子实体中分离得到的活性物质[25],其结构复杂多样。多糖在生物体内发挥生理学功能和应用价值的关键在于单糖连接方式、结构、相对分子质量、官能团、分支等[26]。为了更全面地了解香菇多糖,研究者对LNT的单糖组成、分子量、糖苷键类型进行了研究。
多糖是由至少10个单糖分子通过脱水、缩合作用形成的高分子有机化合物[27],LNT经分离纯化后获得单一多糖,利用GC、HPGPC、HPLC确定酸水解衍生物单糖组成及比例[28]。利用GC对亚临界水萃取协同低共熔溶剂所得香菇多糖进行成分分析,发现两种多糖组成相似,但分子质量比存在差异[29];复合酶解法得到的LNT由葡萄糖单糖构成[25];水提醇沉法得到的LNT中存在甘露糖(mannose,Man)、鼠李糖(rhamnose,Rha)、阿拉伯糖(arabinose,Ara)、木糖(xylose,Xyl)等单糖[30]。Wang等[31]利用HPLC对超声辅助提取的粗多糖以及乙醇分离纯化后的均一性多糖进行单糖组成分析,结果表明粗多糖和均一性多糖均由L-鼠李糖(L-rhamnose,L-Rha)、D-葡萄糖醛酸(D-glucuronic acid,D-GluA)、D-半乳糖醛酸(D-galacturonic acid,D-GalA)、D-葡萄糖(D-glucose,D-Glu)和D-木糖(D-xylose,D-Xyl)组成。Morales等[22]采用水热提取LNT,GC-MS分析结果显示该多糖主要由葡萄糖(glucose,Glu)、甘露糖、半乳糖(galactose,Gal)组成,其中Glu占总单糖组分的91.4%,这与Li等[32]利用HPLC分析单糖组成的研究结果相同,从上述单糖组成研究结果可以发现多糖的单糖组成受提取方法的影响[28],葡萄糖为LNT的主要单糖成分。
香菇多糖生物活性的发挥会受到分子量大小差异的限制,低分子量多糖分子量通常在1 000 Da以下更容易被人体吸收,可以更好地发挥生物活性,较低分子量的多糖存在大量还原性羟基末端残基,可以更好地清除自由基而发挥抗氧化活性。通常利用凝胶渗透色谱-多角度激光散射联用技术、HPLC、HPGPC、GPC来分析香菇多糖的分子量[33]。Zhang等[29]分别利用3种不同提取方法得到LEPH、LEPS、LEPD 3种多糖,GPC分析结果显示3种多糖的分子量分别为6.3×104,6.6×104,6.4×104 Da,所使用的3种方法对多糖分子量无显著影响。Li等[32]分别利用热水提取法、超声提取法、高压灭菌辅助超声联合提取香菇多糖,利用高压凝胶渗透色谱-多角度激光散射和折射率分析多糖分子量,分析结果显示3种多糖平均分子量均在103 kDa。Chikari等[34]通过亚临界多频超声辅助双水相技术得到DFu-AATPE和TFu-AATPE两种多糖及无超声处理组多糖。HPGPC分析三者分子量存在差异,对照组平均分子量最小,为83.62 Da,双频与三频处理多糖分子量几乎相同,分别为2.384,2.387 kDa。与其他方法[25,29-30,35]相比,超声法所得多糖分子量较小,这可能是由于酸性介质破坏多糖糖苷键使多糖分子量降低,随后超声空化产生剪切力再次破坏糖苷键,进一步增加了多糖分子量的降解。
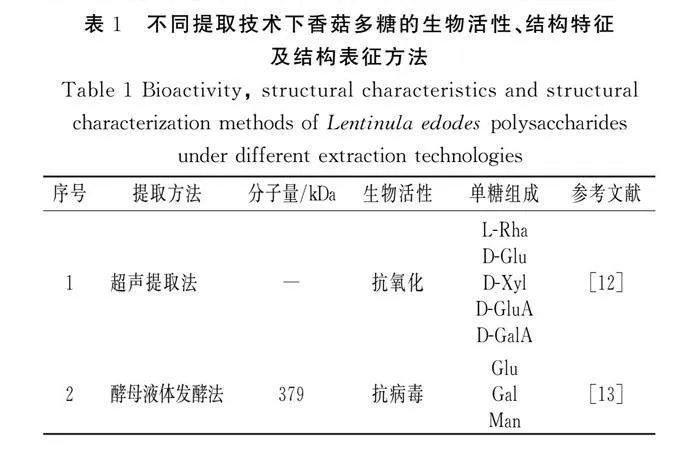
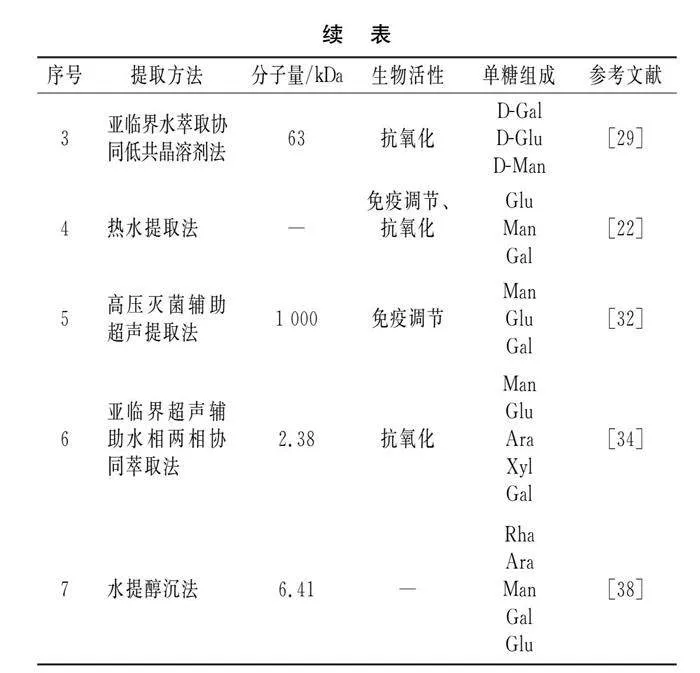
除单糖组成、分子量外,糖苷键的存在同样影响LNT的生物活性,LNT的β-(1,3)-葡聚糖结构是其发挥抗癌活性的关键[36]。Morales等[22]对LNT分离纯化获得β-(1→6)、β-(1→3),(1→6)、α-(1→3)3种不同糖苷键的D-葡聚糖并进行体外降胆固醇、抗氧化活性实验。研究结果表明,3种葡聚糖均具有降胆固醇功能,但只有β-(1→6)和β-(1→3),(1→6)葡聚糖具有清除DPPH的能力。Kaleta 等[37]从香菇中得到的Se-Le-30馏分是α-1,4-葡聚糖和β-(1,3)、β-(1,6)-D-葡聚糖的混合物,该馏分通过控制CD3抗原刺激来抑制PBMCs的增殖,该结果表明Se-Le-30馏分通过选择性免疫抑制发挥抗癌活性。不同提取技术下香菇多糖的生物活性、结构特征及结构表征方法见表1。
3 生物活性
作为世界第二大食用菌,人们对香菇进行了大量研究。香菇富含人体所需营养素、各类维生素(如维生素B1、B2、B6、B12、烟酸)以及多种活性物质(多糖、膳食纤维等),对人体健康有益。其中活性成分如多糖可以用于消炎、抗癌、抗肿瘤等药物的研发,具有极高的药用价值且多糖属于天然物质,不会对人体健康产生危害。
3.1 抗炎与免疫调节
机体发炎表现为发热,是机体免疫系统对病原微生物等外来刺激产生的正常生理反应,受多种炎症因子调控,轻度炎症有助于人体提高自身免疫力、抑制细菌、病毒等微生物繁殖,但机体发生剧烈免疫刺激会导致大量炎症因子沉积,引起器官发炎甚至造成器官衰竭。
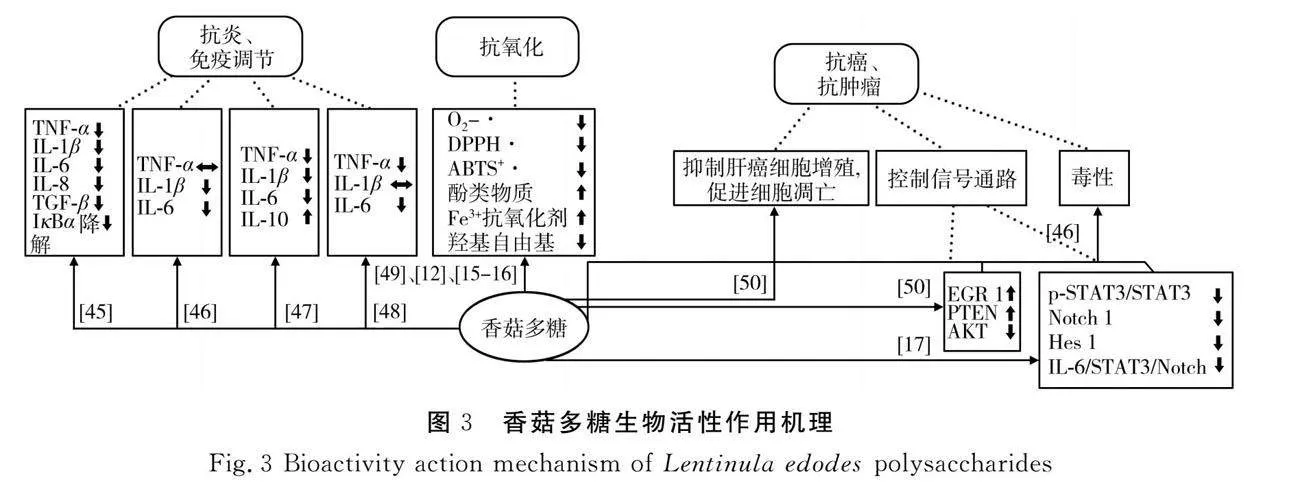
核转录因子(NF-κB)信号通路在调控非特异性免疫中起着核心作用,NF-κB抑制剂(IκB)降解诱发促炎症细胞因子(TNF-α和IL1β)的表达,导致机体发炎[39],同样TGF-β表达水平的提高可能会加重肠道炎症反应。Ren等[40]通过脂多糖诱导哲罗鱼幼鱼肠道发炎来研究LNT的抗炎效果,饲喂LNT后幼鱼肠道内炎症因子TNF-α、IL-1β、IL-6和IL-8与TGF-β的表达水平明显下降,IκBα的降解减少,LNT的抗炎效果明显,该实验中也通过降低巨噬细胞中促炎细胞因子TNF-α(持平)、IL-1β和IL-6表达水平表现香菇多糖的抗炎作用[22]。LNT通过改变炎症因子与TGF-β表达、改善肠道菌群来抑制肠道发炎,张晓晓[41]通过水提醇沉获得LNT,通过灌胃方式将药物以及LNT送入小鼠体内,结果表明LNT通过维持肠道内有益菌群数目、抑制有害菌繁殖、修复肠道机械屏障、增强肠屏障的完整性以及增强免疫力达到减轻肠道炎症的目的。机体长期摄入抗生素会破坏肠道菌群平衡,产生抗性病原微生物,导致肠道炎症。小鼠服用的LNT通过降低NF-κB信号通路表达和降低抗炎因子表达水平来降低肠道炎症,同时LNT提高肠道微生物多样性,保护肠道[42]。
3.2 抗癌与抗肿瘤
肿瘤的发生是由于细胞异常分化和发育,生长不受机体控制,而常规的手术治疗和放射性治疗会对人体造成损伤,因此,天然抗肿瘤活性物质逐渐成为研究的新方向。
LNT是以β-1,3-糖苷键为主链、β-1,6-糖苷键为支链聚合形成的β-(1,3)-葡聚糖高分子化合物,通过抑制癌细胞增殖、加速细胞凋亡转移、控制信号通道抑制癌症进一步发展,在中国和日本已被临床用作抗肿瘤药物[36]。You等[4]通过小鼠体内与体外实验发现LNT对肝癌的抑制作用表现在3个方面:第一,LNT抑制肝癌细胞增殖并促进其凋亡;第二,LNT提高小鼠肝癌细胞(Hepa16)中EGR 1的表达,EGR 1进一步激活肿瘤抑制因子PTEN的表达,从而抑制AKT信号通路激活;第三,LNT通过EGR 1/PTEN/AKT轴诱导细胞凋亡来抑制小鼠肝癌进一步发展,这为肝癌药物开发和临床应用提供了科学依据。LNT通过影响IL-6/STAT3/Notch信号通路,抑制胰腺癌细胞(Capan-1)增殖进行抗癌[43]。除了通过促进细胞凋亡、抑制癌细胞增殖和抑制信号通路外,还可通过葡聚糖毒性作用来干扰癌细胞生长。Morales等[22]分离出的G-1、G-2、G-3葡聚糖对癌细胞表现出显著的细胞毒性作用,G-2(250 μg/mL)和G-3(250 μg/mL)样品处理乳腺肿瘤24 h同时表现出细胞毒性,处理时间延长至48 h,G-3仍表现出显著的细胞毒性作用,通过细胞毒性作用降低肿瘤乳腺细胞活性达到抗癌目的。
3.3 抗氧化
人体细胞通过生物氧化反应获得能量以维持机体正常生理功能,同时细胞内形成的自由基会对其结构、功能造成损害,引起心脏病、癌症、糖尿病、免疫系统紊乱等多种疾病。
香菇多糖抗氧化能力的强弱表现为对DPPH·、·OH、ABTS+·等多种自由基的清除效果。在多糖研究中发现外源物质的添加会影响多糖的活性,Xiang等[44]进行的多糖抗氧化实验也证实了该结论,Fe2+的加入刺激香菇菌丝胞内多糖、胞外多糖产生,比对照组(无Fe2+)高2.98倍和1.79倍;经过Fe2+处理的样品表现出良好的羟基自由基清除能力,且Fe2+的浓度影响LNT的抗氧化效果。Wang等[12]利用不同浓度乙醇溶液对蘑菇废基质多糖(Spent L. edodes substrate polysaccharide,SP)分级纯化得到SP40、SP60和SP80 3种多糖,抗氧化活性强弱为SPgt;SP80gt;SP60gt;SP40。SP对DPPH·和ABTS+·的清除率最高,分别为82.07%和76.77%,所表现出的较强氧化能力归因于粗多糖中含有其他抗氧化物质(酚类化合物和多糖-酚复合物),这有助于提高多糖清除自由基的能力[29];FRAP测定结果与自由基清除实验结果类似,SP的FRAP值最高,其次为SP80、SP60、SP40,乙醇浓度增加,氢离子发生变化,Fe3+表现出极好的抗氧化效果。Chikari等[34]利用LNT分别进行DPPH自由基、羟基自由基和ABTS+自由基清除实验以检测其抗氧化能力强弱,超声处理后的多糖对自由基的清除能力更强,这是因为多频超声辐射强,有力地破坏了植物细胞壁,加速了具有清除自由基能力相关化合物的释放,同时超声处理有效地降低了多糖分子量,从而进一步提高LNT的抗氧化性能。香菇多糖生物活性作用机制见图3。
4 结论与展望
随着人们生活质量的提高,对健康的关注越来越多。香菇多糖是一种存在于香菇中的多糖,无毒,具有抗炎、抗氧化、抗癌和抗肿瘤的特性,是维持各种生物体生命活动的重要大分子。以香菇多糖为原料制成的保健食品已逐渐成为人们日常消费中必不可少的一部分。香菇多糖在医疗药品、功能性食品、化妆品等领域具有非常广阔的应用前景。虽然香菇多糖在各个领域的发展前景良好,但是仍存在一些需要关注的问题。
4.1 靶向香菇多糖提取技术与绿色分离纯化方法开发
目前的生产工艺通常利用热水提取、酸碱提取和微波辅助提取技术提取香菇多糖。然而,使用不同提取技术从同一材料中获得的多糖虽然分子量相似,但是在提取率、质量和香菇多糖含量方面存在差异,因此难以控制提取物质的质量和成本。为了提高香菇多糖的提取效果、含量和性质,有必要在现有方法的基础上开发更有效、更有针对性的提取技术。同时,从现有的香菇多糖提取技术中获得的提取物通常含有蛋白质、色素等,因此需要对香菇多糖进行后续加工,然而,在提取、分离、纯化过程中添加的试剂有毒有害,因此寻找绿色加工技术是香菇多糖研究中需要解决的问题。
4.2 拓展香菇多糖应用范围
目前香菇多糖与其他多糖相比应用范围较窄,如开发出多糖压片糖果[50],利用其抗氧化性改善食物储藏品质等[38],其中将生物活性用于临床研究[41]最为突出。
4.3 深入研究香菇多糖的结构
单糖分子通过糖苷键相互连接,单糖分子量庞大,种类繁多,糖苷键连接方式复杂。香菇多糖种类丰富,内部结构复杂。加强香菇多糖的结构分析可以更好地理解和应用香菇多糖的功能和性质。
4.4 进行体外研究
鉴于香菇多糖结构的复杂性和特异性,现有技术很难准确分析香菇多糖在体内的消化、吸收和代谢情况。因此,有必要对香菇多糖进行体外研究和开发,以便更好地了解香菇多糖发挥作用的内在机制,更有效地促进其在工业生产中的应用。
参考文献:
[1]韩维,张林婷,许兴华,等.香菇脆片的研制及干燥方式对产品品质的影响[J].中国调味品,2022,47(12):37-45.
[2]ZHANG M, ZHANG Y R, ZHANG L J, et al. Mushroom polysaccharide lentinan for treating different types of cancers: a review of 12 years clinical studies in China[J].Progress in Molecular Biology and Translational Science,2019,163:297-328.
[3]LEONG Y K, YANG F C, CHANG J S. Extraction of polysaccharides from edible mushrooms: emerging technologies and recent advances[J].Carbohydrate Polymers,2021,251:117006.
[4]YOU J P, WU Q C, LI Y B, et al. Lentinan induces apoptosis of mouse hepatocellular carcinoma cells through the EGR1/PTEN/AKT signaling axis[J].Oncology Reports,2023,50(1):1-12.
[5]LIANG J J, ZHANG M N, LI X H, et al. Structure and immunomodulatory activity of Lentinus edodes polysaccharides modified by probiotic fermentation[J].Food Science and Human Wellness,2024,13(1):1-25.
[6]WU T J, CAI Z, NIU F D, et al. Lentinan confers protection against type 1 diabetes by inducing regulatory T cell in spontaneous non-obese diabetic mice[J].Nutrition amp; Diabetes,2023,13(1):4.
[7]孙靖轩,王延锋,王金贺,等.食用菌多糖提取技术研究概况[J].中国食用菌,2012,31(3):6-9.
[8]赵茹,康明丽,张琴,等.酶解辅助提取香菇多糖工艺优化及其抗氧化活性[J].食品研究与开发,2023,44(12):116-121.
[9]GU H, LIANG L, PENG Z X, et al. Optimization of enzymatic extraction, characterization and bioactivities of Se-polysaccharides from Se-enriched Lentinus edodes[J].Food Bioscience,2023,51(17):102346.
[10]FARID C, MARYLINE A V, ANNE S T, et al. A review of sustainable and intensified techniques for extraction of food and natural products[J].Green Chemistry,2020,22(8):1148-1183.
[11]MOHAMMAD K M, BATOUL C, GHASSAN N, et al. Optimization of polysaccharides extraction from a wild species of Ornithogalum combining ultrasound and maceration and their anti-oxidant properties[J].International Journal of Biological Macromolecules,2020,161:958-968.
[12]WANG K, GUO J, CHENG J, et al. Ultrasound-assisted extraction of polysaccharide from spent Lentinus edodes substrate: process optimization, precipitation, structural characterization and antioxidant activity[J].International Journal of Biological Macromolecules,2021,191:1038-1045.
[13]张弘弛,刘瑞,焦乐乐,等.基于二次回归旋转正交法优化香菇多糖的提取工艺[J].中国调味品,2021,46(11):88-93.
[14]苏学军,郑琳,钱明月.表面活性剂协同超声提取陈皮中总黄酮的工艺研究[J].中国调味品,2015,40(5):18-21.
[15]张琴,康明丽,赵茹,等.表面活性剂协同超声提取香菇多糖[J].食品工业,2023,44(2):23-28.
[16]谢鹏,高愿军,秦令祥,等.表面活性剂协同双频超声波辅助提取香菇多糖工艺及抗氧化活性研究[J].食品研究与开发,2021,42(21):56-61.
[17]杨静娟.表面活性剂协助提取及乳液法分离玉竹多糖化合物的研究[D].长沙:中南大学,2011.
[18]鹿士峰.香菇活性物质的提取分离纯化及抗氧化活性研究[D].聊城:聊城大学,2019.
[19]李洙锐.水金钗石斛活性多糖的分离纯化、结构鉴定及其抗病毒活性的研究[D].贵阳:贵州大学,2020.
[20]孙小雯,杜新颖,付先军,等.桔梗多糖的制备工艺及生物活性研究进展[J].现代食品科技,2024,40(2):338-345.
[21]马冰清.香菇菌糠多糖的提取分离及抗炎活性研究[D].上海:华东理工大学,2021.
[22]MORALES D, RUTCKEVISKI R, VILLALVA M, et al. Isolation and comparison of α-and β-D-glucans from shiitake mushrooms (Lentinula edodes) with different biological activities[J].Carbohydrate Polymers,2020,229:115521.
[23]UDCHUMPISAI W, BANGYEEKHUN E. Purification, structural characterization, and biological activity of polysaccharides from Lentinus velutinus[J].Mycobiology,2020,48(1):51-57.
[24]WANG W L, TAN J Q, NIMA L M, et al. Polysaccharides from fungi: a review on their extraction, purification, structural features, and biological activities[J].Food Chemistry-X,2022,15:100414.
[25]CHIHARA G, HAMURO J, MAEDA Y Y, et al. Fractionation and purification of the polysaccharides with marked antitumor activity, especially lentinan, from Lentinus edodes(Berk.) Sing. (an edible mushroom)[J].Cancer Research,1970,30(11):2776-2781.
[26]FERREIRA S S, PASSOS C P, MADUREIRA P, et al. Structure-function relationships of immunostimulatory polysaccharides:a review[J].Carbohydrate Polymers,2015,132:378-396.
[27]张龄予,侯苏芯,张文尉,等.蓝靛果的化学成分及其提取分离研究进展[J].应用化学,2022,39(11):1629-1640.
[28]LIU D, TANG W, YIN J Y, et al. Monosaccharide composition analysis of polysaccharides from natural sources:hydrolysis condition and detection method development[J].Food Hydrocolloids,2021,116:106641.
[29]ZHANG J X, YE Z Q, LIU G Y, et al. Subcritical water enhanced with deep eutectic solvent for extracting polysaccharides from Lentinus edodes and their antioxidant activities[J].Molecules,2022,27(11):3612.
[30]XIE J H, JIN M L, MORRIS G A, et al. Advances on bioactive polysaccharides from medicinal plants[J].Critical Reviews in Food Science and Nutrition,2016,56:60-84.
[31]WANG X M, MAJZOOBI M, FARAHNAKY A. Ultrasound-assisted modification of functional properties and biological activity of biopolymers:a review[J].Ultrason Sonochem,2020,65:105057.
[32]LI J H, ZHU Y Y, GU F T, et al. Efficient isolation of immunostimulatory polysaccharides from Lentinula edodes by autoclaving-ultrasonication extraction and fractional precipitation[J].International Journal of Biological Macromolecules,2023,237:124216.
[33]MAITY G N, MAITY P, KHATUA S, et al. Structural features and antioxidant activity of a new galactoglucan from edible mushroom Pleurotus djamor[J].International Journal of Biological Macromolecules,2021,168:743-749.
[34]CHIKARI F, HAN J, WANG Y, et al. Synergized subcritical-ultrasound-assisted aqueous two-phase extraction, purification, and characterization of Lentinus edodes polysaccharides[J].Process Biochemistry,2020,95:297-306.
[35]REN G, XU L, LU T, et al. Structural characterization and antiviral activity of lentinan from Lentinus edodes mycelia against infectious hematopoietic necrosis virus[J].International Journal of Biological Macromolecules,2018,115:1202-1210.
[36]SIVANESAN I, MUTHU M, GOPAL J, et al. Mushroom polysaccharide-assisted anticarcinogenic mycotherapy: reviewing its clinical trials[J].Molecules,2022,27(13):4090.
[37]KALETA B, ROSZCZYK A, ZYCH M, et al. Selective biological effects of selenium-enriched polysaccharide (Se-Le-30) isolated from Lentinula edodes mycelium on human immune cells[J].Biomolecules,2021,11(12):1777.
[38]GUO Y X, CHEN X F, GONG P, et al. Effect of shiitake mushrooms polysaccharide and chitosan coating on softening and browning of shiitake mushrooms (Lentinus edodes) during postharvest storage[J].International Journal of Biological Macromolecules,2022,218:816-827.
[39]SEIFRIED H E, ANDERSON D E, FISHER E I, et al. A review of the interaction among dietary antioxidants and reactive oxygen species[J].Journal of Nutritional Biochemistry,2007,18(9):567-579.
[40]REN G M, XU L M, LU T Y, et al. Protective effects of lentinan on lipopolysaccharide induced inflammatory response in intestine of juvenile taimen (Hucho taimen Pallas)[J].International Journal of Biological Macromolecules,2019,121:317-325.
[41]张晓晓.香菇多糖对小鼠肠道黏膜炎的干预及作用机制[D].大连:大连医科大学,2022.
[42]JI X Y, SU L, ZHANG P, et al. Lentinan improves intestinal inflammation and gut dysbiosis in antibiotics-induced mice[J].Scientific Reports,2022,12(1):19609.
[43]张冬,邓同兴,王丰刚,等.香菇多糖通过IL-6/STAT3/Notch信号通路调控胰腺癌细胞增殖、迁移及化疗敏感性[J].食品工业科技,2023,44(24):334-340.
[44]XIANG Q J, ZHANG H J, CHEN X Q, et al. Enhanced effects of iron on mycelial growth, metabolism and in vitro antioxidant activity of polysaccharides from Lentinula edodes[J].Bioengineering,2022,9(10):581.
[45]GUO L N, KONG N, ZHANG X Y, et al. Multimode ultrasonic extraction of polysaccharides from maca (Lepidium meyenii): optimization, purification, and in vitro immunoregulatory activity[J].Ultrasonics Sonochemistry,2022,88:106062.
[46]朱丽芳,陈露.山茱萸多糖的提取和多糖降解研究进展[J].现代盐化工,2022,49(5):7-9.
[47]邓霞,喻随,陈思颖,等.响应面法优化超声波辅助提取英山云雾茶多糖的研究[J].中国食品添加剂,2020,31(8):102-107.
[48]徐娟,付晓娜,周海,等.黄精多糖提取、单糖组成及抗氧化活性分析[J].粮食与油脂,2022,35(7):141-146.
[49]MIAO J, REGENSTEIN J M, QIU J, et al. Isolation, structural characterization and bioactivities of polysaccharides and its derivatives from Auricularia—a review[J].International Journal of Biological Macromolecules,2020,150:102-113.
[50]单维婷,王英臣,高倩倩.香菇多糖制备工艺的优化及其产品生产[J].粮食与油脂,2022,35(9):122-126.
[51]YOU X W, WANG S L, LIU F M, et al. Ultrasound-assisted surfactant-enhanced emulsification microextraction based on the solidification of a floating organic droplet used for the simultaneous determination of six fungicide residues in juices and red wine[J].Journal of Chromatography A,2013,1300:64-69.

